目次
NIPT(非侵襲的出生前検査)を扱っている施設はたくさんあります.しかし,説明がなされず,検査についてきちんと理解せずに検査を受ける方も大勢います。大事な赤ちゃんの検査,きちんと理解してから受けませんか?遺伝の専門ミネルバクリニックがNIPTで検査できる染色体の数の異常(異数性)による疾患ついてご説明します.染色体の数の異常がなぜ起こるのか?についてはこちらのページをご覧ください。今回は、GeneReviewJapanにないので、専門家向けのダウン症候群(21トリソミー)のページを翻訳して作ってみたいと思います。https://www.ncbi.nlm.nih.gov/books/NBK526016/
Faisal Akhtar; Syed Rizwan A. Bokhari.
最新情報:2019年4月10日
序文
ダウン症候群(21トリソミー)は1866年に英国の医師John Langdon Downによって最初に記述されたが、その21番染色体との関連はパリのJerome Lejeune博士によってほぼ100年後に確立された。ヒトで最もよくみられる染色体異常であるダウン症候群(21トリソミー)を引き起こす21番染色体の3番目のコピーの全部または一部の存在である[1]。また、最も高頻度に出生する生存出生異数性は、この症候群を引き起こす21トリソミーであることがわかっている[2]。
病因
ダウン症候群(21トリソミー)患者の大多数は21番染色体の余分なコピーを有する。ダウン症候群(21トリソミー)の遺伝的基礎と、異なる遺伝子型と表現型との関連には、異なる仮説がある。その中には、Hsa21の用量あるいは遺伝子数の増加があり、その結果、遺伝子拡大が増加する遺伝子投与量の不均衡がある[3]。さらに、異なる遺伝子とダウン症候群(21トリソミー)の異なる表現型との関連の可能性も含まれる。もう一つの一般的な仮説は、増幅発生不安定性仮説であり、それによれば、多数の三染色体遺伝子によって作り出され、多くの遺伝子の発現と規制により大きな影響をもたらす遺伝的不均衡が生じている[3]。
このリストでは臨界領域仮説もよく知られている。ダウン症候群(21トリソミー)重要領域(DSCR)は、Has21の部分的トリソミーと関連する染色体領域が少ない。21q21.22のDSCRはダウン症候群(21トリソミー)の多くの臨床的特徴の原因である[3][4]異なる解析の徹底的な研究の後、1つの重要領域遺伝子が21トリソミーに関連するすべての表現型の特徴を引き起こすことはできないことが明らかとなり、むしろ、複数の重要領域または重要遺伝子がこの現象に果たす役割を有することがより明白になった[5]。
疫学
ダウン症候群(21トリソミー)の発生率は母親の年齢と共に増加し、それは異なる集団(1000の生存出生中1/319~1)で変動し[6][7]、ダウン症候群(21トリソミー)胎児の発生率は受胎時にかなり高いが、これらの胎児の約50%~75%が出産前に失われることも知られている。他の常染色体トリソミーの発生は21よりもはるかに多いが、出生後の生存はダウン症候群(21トリソミー)と比較して非常に不良である。この21トリソミー患者の生存率の高さは、Hsa21と呼ばれる21番染色体上の少数の遺伝子の機能であると考えられており、これは常染色体の中で最も小さく、かつ最も密度が低い[8]。
病態生理
21番染色体の余分なコピーはダウン症候群(21トリソミー)と関連しており、これは配偶子形成の間に21番染色体が分離できず、全身の細胞に余分な染色体が生じるために起こる。ロバートソン転座と等染色体または環状染色体は、21トリソミーの他の2つの考えられる原因である。アイソクロモソームは、ロバートソン転座時に長腕と短腕の代わりに2本の長腕が一緒に分離する状態である。これは患者の2%~4%に起こる。21番染色体の長腕は別の染色体、ほとんどが14番染色体に結合している。モザイク現象では、受精後の分裂の誤りのために2つの異なる細胞株が存在する[6]。
病歴と身体
臨床的特徴
ダウン症候群(21トリソミー)は、異なるシステムが影響を受けるため、様々な臨床状態が関連している。これらの患者は、知的・発達障害や神経学的特徴、先天性心臓欠損、消化管(GI)異常、特徴的な顔貌、異常など幅広い徴候・症状を有している[9]。
先天性心臓欠損症(CHD)
先天性心臓欠損症は、ダウン症候群(21トリソミー)患者の罹患率および死亡率と関連する原因としては、特に生後2年間では圧倒的に多く、主要なものである。21トリソミーにおける先天性心臓欠損の異なるタイプの発生における地理的ならびに季節的変動については異なる示唆がなされているが、これまでのところ、いずれの結果も決定的なものではない[10]。
ダウン症候群(21トリソミー)で生まれた赤ちゃんにおけるCHDの発生率は50%までです。ダウン症候群(21トリソミー)に伴う最も一般的な心臓欠損は房室中隔欠損(AVSD)であり、この欠損はダウン症候群(21トリソミー)における先天性心臓欠損の最大40%を占める[6]。非Hsa21 CRELD1遺伝子[6][11]ダウン症候群(21トリソミー)における第2の共通心臓欠損は、心室中隔欠損(VSD)であり、これは、ダウン症候群(21トリソミー)を有する患者の約32%において見られる。AVSDとともに、これらはダウン症候群(21トリソミー)患者の先天性心臓欠損症の50%以上を占める[6][11]。
21トリソミーに関連する他の心臓欠損は、二次性心房欠損(10%)、ファロー四徴症(6%)、孤立性PDA (4%)であるが、患者の約30%は複数の心臓欠損を有する。ダウン症候群(21トリソミー)における心臓欠損の有病率には地理的変動があり、アジアではVSDが最も多く、ラテンアメリカではsecundum型ASDが多い。このように地域によって異なるタイプのCHDの有病率に違いがある理由はいまだ不明であり、地域的近接性など多くの要因が寄与していることがわかっている[6]。
ダウン症候群(21トリソミー)患者ではCHDの有病率がこのように高いため、全ての患者が生後数週間以内に心エコー検査を受けることが推奨されている。
消化管(GI)の異常
21トリソミー患者は、消化管に関連する多くの構造的および機能的障害を有する。構造的欠陥は口から肛門までのどこにでも生じうるものであり、十二指腸や小腸の閉鎖や狭窄、輪状膵、無孔肛門、ヒルシュスプルング病などの特定の欠陥が、これらの患者では一般集団と比較して多く発生することがわかっている[1]。
ダウン症候群(21トリソミー)患者の約2%はヒルシュスプルング病であるが、ヒルシュスプルング病患者の12%はダウン症候群(21トリソミー)である[1][6]。ヒルシュスプルング病は機能性下部腸閉塞の一形態であり、神経細胞が直腸の遠位部に移動できず、正常な蠕動を示さない無神経節を生じ、正常な排便反射の障害を引き起こして機能的閉塞を引き起こす[12]。乳児は通常、腸閉塞に関連する徴候および症状を呈する。十二指腸閉鎖および鎖肛は通常、新生児期に存在する。
ダウン症候群(21トリソミー)の構造的欠陥患者とは別に、患者は胃食道逆流(GERD)、慢性便秘、間欠性下痢、およびセリアック病のような多くの他の消化器疾患に罹りやすい。これらの患者の約5%には、セリアック病とダウン症候群(21トリソミー)との強い関連性が存在するため、セリアック病の年1回のスクリーニングを行うことが推奨される。いったん診断されると、これらの患者は残りの一生グルテン除去食を続けなければならない[13]。
血液疾患
ダウン症候群(21トリソミー)に関連する血液疾患はいくつかある。ダウン症候群(21トリソミー)(HANDS)の新生児における血液学的異常は好中球増加症、血小板減少症、赤血球増加症を構成し、ダウン症候群(21トリソミー)児のそれぞれ80%、66%、34%にみられる[14][15][16]。手指症は通常軽症で、生後3週以内に消失する[14][15][16]
ダウン症候群(21トリソミー)にきわめて特異的な他の疾患は、一過性の骨髄増殖性疾患であり、ダウン症候群(21トリソミー)の生後3カ月未満の乳児における芽球細胞の検出と定義される。巨核球のクローン性増殖を特徴とし、生後1週間に検出され、生後3ヵ月までに消失する。また、一過性の異常骨髄造血または一過性白血病としても知られており、ダウン症候群(21トリソミー)患者の約10%に存在することが知られている。これが胎児に起こると、自然流産を引き起こす可能性がある[17][18]。
ダウン症候群(21トリソミー)患者は白血病を発症するリスクが10倍高く[19]、小児急性リンパ芽球性白血病全体の約2%、小児急性骨髄性白血病全体の10%を占める。急性リンパ芽球性白血病のダウン症候群(21トリソミー)患者の30%はヤヌスキナーゼ2遺伝子の機能変異と関連がある[20]。
慢性骨髄性白血病(TML)患者の約10%は、4歳以前に急性巨核芽球性白血病(AMKL)の白血病形成を発症する。AMKLは、未成熟巨核球の制御不能な増殖につながるX連鎖転写因子であるGATA1遺伝子と関連している[21]。
神経疾患
Hsa21のトリソミーは脳容積の減少、特に海馬や小脳と関連している[22]。 低緊張症はダウン症候群(21トリソミー)の乳児の特徴であり、ほとんどすべての乳児にみられる。受動的筋伸張に対する抵抗性の低下と定義され、これらの患者では運動発達の遅延の原因となる[23]。筋緊張低下症のため、ダウン症候群(21トリソミー)患者は歩行の安定性が低下し、身体的労作に対するエネルギー必要量が増加する関節弛緩を有する[24]。これらの患者は、身体活動レベルが低いため骨量が減少し、骨折のリスクが増大しやすい一方で[25]、靭帯弛緩によりこれらの患者は環軸椎亜脱臼を起こしやすくなる[26]。
ダウン症候群(21トリソミー)の子供の5~13%にけいれん発作がみられます[27]。そのうち40%は生後1日以前にけいれんを起こすことになります。このような場合のけいれん発作は通常は乳児けいれんです[28]。乳児痙攣を伴うダウン症候群(21トリソミー)児は、抗てんかん薬に対しても同様の他の小児と比較して良好な反応を示すため、早期介入や治療により発達転帰が改善する[27]。
Lennox-Gestaut症候群は、ダウン症候群(21トリソミー)の小児においても、発症した場合、遅発性である場合、脳波異常率の増加とともに反射発作を伴う場合に多くみられることがわかっている[29]。
ダウン症候群(21トリソミー)患者の40%は、最初の30年間に強直間代発作またはミオクローヌス発作を発症する[28]。認知症は45歳以上のダウン症候群(21トリソミー)患者に好発し[30]、約84%が発作を起こしやすい[31]。これらの患者の発作は、認知機能の急速な低下に関連している[32]。
ダウン症候群(21トリソミー)患者では60歳までに50~70%の患者が認知症を発症する場合、早発型アルツハイマー病を発症するリスクが有意に高い[33]。アルツハイマー病のリスク増加と関連することが知られているアミロイド前駆体タンパク(APP)はHsa21上にコードされていることがわかっており、このタンパクのトリソミーがダウン症候群(21トリソミー)患者における認知症の頻度増加の原因である可能性が高い。最近の研究では、APPの三重複が正常集団においても早発型アルツハイマー病のリスク上昇と関連していることが示されている[34]。
ダウン症候群(21トリソミー)患者のほぼ全員が軽度から中等度の学習障害を有している。DYRK1A、シナプトジャニン1、single-minded homolog 2(SIM2)など複数の遺伝子のトリソミーがマウスに学習・記憶障害を引き起こすことが明らかにされており、これらの遺伝子の過剰発現がダウン症候群(21トリソミー)の人の学習障害を引き起こしている可能性が示唆されている[35]。
内分泌疾患
甲状腺機能不全はダウン症候群(21トリソミー)と最もよく関連している。甲状腺機能低下症は先天性のこともあれば、生涯のあらゆる時期に獲得されることもある[25]。ニューヨークの新生児スクリーニングプログラムでは、ダウン症候群(21トリソミー)児の先天性甲状腺機能低下症の発症率が他と比較して高いことが報告されている[36]。抗甲状腺自己抗体は、後天性甲状腺機能低下症を有するダウン症候群(21トリソミー)患者の13~34%に認められ、これらの抗体の濃度は生後8年以降に上昇した[25]。ダウン症候群(21トリソミー)患者の約半数は、TSHの上昇とチロキシン値の正常化を伴う無症候性甲状腺機能低下症であることが示されている[37]。甲状腺機能亢進症は、一般小児集団における甲状腺機能亢進症の発症率をまだ上回っているものの、ダウン症候群(21トリソミー)患者では甲状腺機能低下症と比較してはるかに頻度が低い[38]。
性的発達の異常もまた、男女とも思春期遅延に伴って有意であることが注目されている。女児では、原発性性腺機能低下症は初潮または副腎皮質弓の遅延として現れるが、男児では停留精巣、性器不明瞭、小陰茎、小精巣、精子数の減少、腋毛および陰毛のわずかな成長として現れることがある[25]。
また、インスリン様成長因子はダウン症候群(21トリソミー)患者の骨格成熟遅延や低身長の原因ともいわれている[25]。
筋骨格系疾患
ダウン症候群(21トリソミー)の小児では、筋緊張低下により靭帯の弛緩が亢進し、肉眼的運動技能の遅延を引き起こし、関節脱臼を来す可能性があるため、筋量が減少するリスクが高い[39]。また、これらの患者は、日光への不十分な曝露、ビタミンDの不十分な摂取、セリアック病に続発する吸収不良、抗痙攣療法による分解の増加などのいくつかの因子によるビタミンD欠乏症を有している。これらの因子は、ダウン症候群(21トリソミー)の小児の骨量減少のリスクを高め、再発骨折の素因となる[40]。
屈折異常と視覚異常
ダウン症候群(21トリソミー)の小児では、眼および眼窩の奇形がよくみられる。これらには、眼瞼炎(2~7%)、円錐角膜(5~8%)、白内障(25~85%)、網膜異常(0~38%)、斜視(23~44%)、弱視(10~26%)、眼振(5~30%)、屈折異常(18~58%)、緑内障(1%未満)、虹彩異常(38~90%)および視神経異常(非常に少数例)が含まれる。
眼の異常は、放置しておくと、これらの患者の生命に重大な影響を及ぼす可能性がある。したがって、ダウン症候群(21トリソミー)の患者は全員、生後6カ月間は眼の診察を受け、その後は毎年行うべきである[41]。
耳鼻咽喉科(ENT)障害
耳、鼻、のどの問題も、ダウン症候群(21トリソミー)の患者さんでは非常によくみられます。ダウン症候群(21トリソミー)患者の耳の解剖学的構造は、聴覚障害の素因となる。難聴は通常、耳垢の嵌入および小耳管による慢性中耳滲出液、急性中耳炎、鼓膜穿孔などの中耳の病態のため伝音性である。これらの患者は通常、治療のために等圧チューブを必要とする。
また、感音難聴は狭い内耳道などの内耳に構造的な異常があるため、ダウン症候群(21トリソミー)との関連も指摘されています[42]。
評価
ダウン症候群(21トリソミー)の出生前診断には様々な方法が用いられている。妊娠14~24週の超音波は、項部ひだ厚の増大、鼻骨の小さいまたは全くない、および大きな心室のような軟らかいマーカーに基づく診断のためのツールとして使用できる[43]。診断には羊水穿刺や絨毛サンプリングが広く用いられてきたが、流産のリスクは0.5~1%と少ない[44]。
他にもいくつかの方法が開発されており、胎生期および出生後の両方で21トリソミーの迅速な検出に使用されている。最も一般的に用いられるのは、Hsa21特異的プローブを用いるか、Hsa21の全体を用いるかのいずれかによる間期核のFISHである[45]。現在用いられている別の方法はQF-PCR法であり、DNA多型マーカーを用いることにより3つの異なる対立遺伝子の存在が決定される[46]。この方法の成功は、有益なマーカーとDNAの存在に依存する。STRマーカー法を用いることにより、ダウン症候群(21トリソミー)の症例の最大86.67%が同定できることがわかっている[47]。
パラローグ配列定量(PSQ)と呼ばれる比較的新しい方法は、Hsa21コピー数上のパラローグ配列を使用する。パラローグ遺伝子を用いて、パラローグ配列定量として知られる標的染色体数異常を検出するPCR方法である[48]。
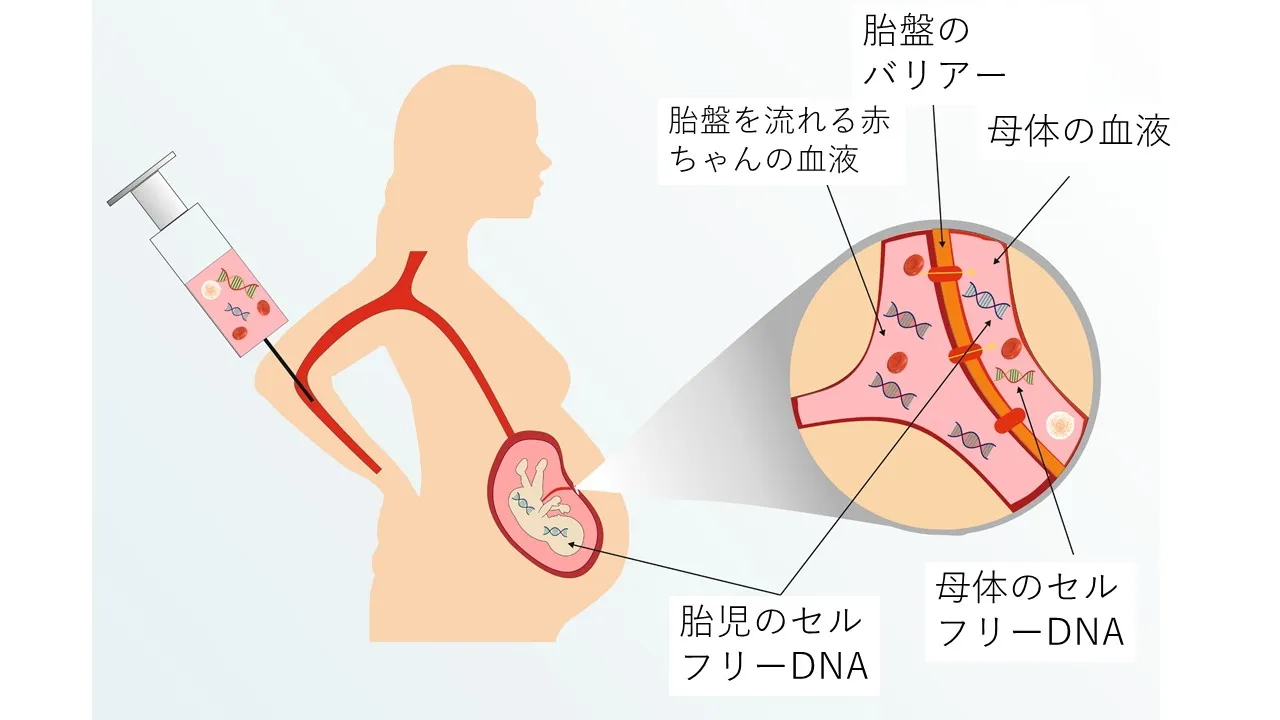
出生前にダウン症候群(21トリソミー)の診断に用いるために研究されている非侵襲的な出生前診断法がある。これらは、母体血液中の胎児細胞の存在および母体血清中の無細胞胎児DNAの存在に基づいている。[49]
セルフリー胎児DNAは母体血漿の5~10%を占め、妊娠中に増加し、出産後には消失する。この方法は、Rh(-)女性の胎児Rh状態[50]、X染色体連関疾患における性別[51]、父系遺伝の常染色体劣性および優性形質の検出に用いられているが[52]、染色体異数性、特にトリソミーの検出に用いることは未だ課題である。
ダウン症候群(21トリソミー)の診断のために、デジタルPCRや次世代シークエンシング(NGS)のような最近の他の方法もほとんど開発されていない[53]。
治療・管理
ダウン症候群(21トリソミー)患者の管理は集学的である。ダウン症候群(21トリソミー)が疑われる新生児では、診断を確定するために核型検査を実施すべきである。両親の遺伝子検査およびカウンセリングのために、家族を臨床遺伝医に紹介する必要がある。
親の教育は、ダウン症候群(21トリソミー)の管理に関して最も重要な側面の1つである。なぜなら、両親は、適切に診断各治療できるように、ダウン症候群(21トリソミー)に関連する様々な可能性のある状態を認識する必要があるからである。治療は基本的に対症療法であり、完全な回復は不可能である。
これらの患者は、聴力および視力を評価されるべきであり、白内障を発症しやすいため、タイムリーな手術が必要である。甲状腺機能検査は年1回実施すべきであり、もし障害があればそれに応じて管理すべきである。
心臓手術後は摂食の問題が改善されますが、最適な成長と体重増加のためには、バランスのとれた食事、定期的な運動、理学療法が必要です。
心臓紹介は、先天性心疾患の臨床的徴候にかかわらず、全ての患者に送られるべきであり、先天性心疾患がある場合は、児の最適な成長と発達を確実にするために生後6ヶ月以内に修正すべきである。
その他にも、発達小児科医、小児呼吸器科医、消化器科医、神経内科医、脳神経外科医、整形外科専門医、小児精神科医、理学療法士・作業療法士、言語療法士、聴覚士などが関わっています。
予後
近年の医療の進歩に伴い、先天性障害の是正のための手術手技の開発や一般的なケアの向上に伴い、ダウン症候群(21トリソミー)患者の乳幼児の生存率や平均余命が大幅に増加している。ほぼ60年前に行われたBirmingham (英国)の研究では、乳児の45%が生後1年生存し、5年生存率は40%に過ぎないことが示されている[54]。約50年後に実施された後の研究では、ダウン症候群(21トリソミー)に先天性心欠損症を合併した患者の78%が1年間生存した一方で、異常のない患者では96%まで生存したことが示されている[55]。これらの患者の平均余命のこの増加は、医学の発展のために、著しく増加し続けるはずである。医療施設は、これらの患者に適正かつタイムリーな管理を提供し、患者が充実した生産的な生活を送れるよう援助することを目的としている[56]。
医療チームのアウトカムの強化
ダウン症候群(21トリソミー)患者の管理は、専門家間の努力である。ダウン症候群(21トリソミー)が疑われる新生児では、診断を確定するために核型検査を実施すべきである。両親の遺伝子検査およびカウンセリングのために、家族を臨床遺伝医に紹介する必要がある。
ほとんどすべての臓器系が関与しているため、小児は眼科医、整形外科医、心臓専門医、皮膚科医、消化器専門医、理学療法士、メンタルヘルスナース、ENT外科医および行動専門医による診察を受ける必要がある。
親の教育は、ダウン症候群(21トリソミー)の管理に関して最も重要な側面の1つである。なぜなら、両親は、適切に診断各治療できるように、ダウン症候群(21トリソミー)に関連する様々な可能性のある状態を認識する必要があるからである。治療は基本的に対症療法であり、完全な回復は不可能である。
過去30年間にわたって寿命が延びている一方で、健常者と比較して平均寿命が依然として短い。
引用文献
- 1.
-
Holmes G. Gastrointestinal disorders in Down syndrome. Gastroenterol Hepatol Bed Bench. 2014 Winter;7(1):6-8. [PMC free article] [PubMed]
- 2.
-
Gardiner K, Herault Y, Lott IT, Antonarakis SE, Reeves RH, Dierssen M. Down syndrome: from understanding the neurobiology to therapy. J. Neurosci. 2010 Nov 10;30(45):14943-5. [PMC free article] [PubMed]
- 3.
-
Antonarakis SE, Lyle R, Dermitzakis ET, Reymond A, Deutsch S. Chromosome 21 and down syndrome: from genomics to pathophysiology. Nat. Rev. Genet. 2004 Oct;5(10):725-38. [PubMed]
- 4.
-
Pritchard MA, Kola I. The “gene dosage effect” hypothesis versus the “amplified developmental instability” hypothesis in Down syndrome. J. Neural Transm. Suppl. 1999;57:293-303. [PubMed]
- 5.
-
Holland AJ, Hon J, Huppert FA, Stevens F. Incidence and course of dementia in people with Down’s syndrome: findings from a population-based study. J Intellect Disabil Res. 2000 Apr;44 ( Pt 2):138-46. [PubMed]
- 6.
-
Asim A, Kumar A, Muthuswamy S, Jain S, Agarwal S. “Down syndrome: an insight of the disease”. J. Biomed. Sci. 2015 Jun 11;22:41. [PMC free article] [PubMed]
- 7.
-
Bittles AH, Glasson EJ. Clinical, social, and ethical implications of changing life expectancy in Down syndrome. Dev Med Child Neurol. 2004 Apr;46(4):282-6. [PubMed]
- 8.
-
Roper RJ, Reeves RH. Understanding the basis for Down syndrome phenotypes. PLoS Genet. 2006 Mar;2(3):e50. [PMC free article] [PubMed]
- 9.
-
Choi JK. Hematopoietic disorders in Down syndrome. Int J Clin Exp Pathol. 2008 Jan 01;1(5):387-95. [PMC free article] [PubMed]
- 10.
-
Benhaourech S, Drighil A, Hammiri AE. Congenital heart disease and Down syndrome: various aspects of a confirmed association. Cardiovasc J Afr. 2016 Sep/Oct;27(5):287-290. [PMC free article] [PubMed]
- 11.
-
Wiseman FK, Alford KA, Tybulewicz VL, Fisher EM. Down syndrome–recent progress and future prospects. Hum. Mol. Genet. 2009 Apr 15;18(R1):R75-83. [PMC free article] [PubMed]
- 12.
-
Amiel J, Sproat-Emison E, Garcia-Barcelo M, Lantieri F, Burzynski G, Borrego S, Pelet A, Arnold S, Miao X, Griseri P, Brooks AS, Antinolo G, de Pontual L, Clement-Ziza M, Munnich A, Kashuk C, West K, Wong KK, Lyonnet S, Chakravarti A, Tam PK, Ceccherini I, Hofstra RM, Fernandez R., Hirschsprung Disease Consortium. Hirschsprung disease, associated syndromes and genetics: a review. J. Med. Genet. 2008 Jan;45(1):1-14. [PubMed]
- 13.
-
Wallace RA. Clinical audit of gastrointestinal conditions occurring among adults with Down syndrome attending a specialist clinic. J Intellect Dev Disabil. 2007 Mar;32(1):45-50. [PubMed]
- 14.
-
Henry E, Walker D, Wiedmeier SE, Christensen RD. Hematological abnormalities during the first week of life among neonates with Down syndrome: data from a multihospital healthcare system. Am. J. Med. Genet. A. 2007 Jan 01;143A(1):42-50. [PubMed]
- 15.
-
Hord JD, Gay JC, Whitlock JA. Thrombocytopenia in neonates with trisomy 21. Arch Pediatr Adolesc Med. 1995 Jul;149(7):824-5. [PubMed]
- 16.
-
Miller M, Cosgriff JM. Hematological abnormalities in newborn infants with Down syndrome. Am. J. Med. Genet. 1983 Oct;16(2):173-7. [PubMed]
- 17.
-
Zipursky A, Brown E, Christensen H, Sutherland R, Doyle J. Leukemia and/or myeloproliferative syndrome in neonates with Down syndrome. Semin. Perinatol. 1997 Feb;21(1):97-101. [PubMed]
- 18.
-
Zipursky A, Brown EJ, Christensen H, Doyle J. Transient myeloproliferative disorder (transient leukemia) and hematologic manifestations of Down syndrome. Clin. Lab. Med. 1999 Mar;19(1):157-67, vii. [PubMed]
- 19.
-
Hasle H, Clemmensen IH, Mikkelsen M. Risks of leukaemia and solid tumours in individuals with Down’s syndrome. Lancet. 2000 Jan 15;355(9199):165-9. [PubMed]
- 20.
-
Kearney L, Gonzalez De Castro D, Yeung J, Procter J, Horsley SW, Eguchi-Ishimae M, Bateman CM, Anderson K, Chaplin T, Young BD, Harrison CJ, Kempski H, So CW, Ford AM, Greaves M. Specific JAK2 mutation (JAK2R683) and multiple gene deletions in Down syndrome acute lymphoblastic leukemia. Blood. 2009 Jan 15;113(3):646-8. [PubMed]
- 21.
-
Wechsler J, Greene M, McDevitt MA, Anastasi J, Karp JE, Le Beau MM, Crispino JD. Acquired mutations in GATA1 in the megakaryoblastic leukemia of Down syndrome. Nat. Genet. 2002 Sep;32(1):148-52. [PubMed]
- 22.
-
Pearlson GD, Breiter SN, Aylward EH, Warren AC, Grygorcewicz M, Frangou S, Barta PE, Pulsifer MB. MRI brain changes in subjects with Down syndrome with and without dementia. Dev Med Child Neurol. 1998 May;40(5):326-34. [PubMed]
- 23.
-
Lott IT. Neurological phenotypes for Down syndrome across the life span. Prog. Brain Res. 2012;197:101-21. [PMC free article] [PubMed]
- 24.
-
Agiovlasitis S, McCubbin JA, Yun J, Pavol MJ, Widrick JJ. Economy and preferred speed of walking in adults with and without Down syndrome. Adapt Phys Activ Q. 2009 Apr;26(2):118-30. [PubMed]
- 25.
-
Hawli Y, Nasrallah M, El-Hajj Fuleihan G. Endocrine and musculoskeletal abnormalities in patients with Down syndrome. Nat Rev Endocrinol. 2009 Jun;5(6):327-34. [PubMed]
- 26.
-
Merrick J, Ezra E, Josef B, Hendel D, Steinberg DM, Wientroub S. Musculoskeletal problems in Down Syndrome European Paediatric Orthopaedic Society Survey: the Israeli sample. J Pediatr Orthop B. 2000 Jun;9(3):185-92. [PubMed]
- 27.
-
Arya R, Kabra M, Gulati S. Epilepsy in children with Down syndrome. Epileptic Disord. 2011 Mar;13(1):1-7. [PubMed]
- 28.
-
Pueschel SM, Louis S, McKnight P. Seizure disorders in Down syndrome. Arch. Neurol. 1991 Mar;48(3):318-20. [PubMed]
- 29.
-
Ferlazzo E, Adjien CK, Guerrini R, Calarese T, Crespel A, Elia M, Striano P, Gelisse P, Bramanti P, di Bella P, Genton P. Lennox-Gastaut syndrome with late-onset and prominent reflex seizures in trisomy 21 patients. Epilepsia. 2009 Jun;50(6):1587-95. [PubMed]
- 30.
-
Menéndez M. Down syndrome, Alzheimer’s disease and seizures. Brain Dev. 2005 Jun;27(4):246-52. [PubMed]
- 31.
-
De Simone R, Puig XS, Gélisse P, Crespel A, Genton P. Senile myoclonic epilepsy: delineation of a common condition associated with Alzheimer’s disease in Down syndrome. Seizure. 2010 Sep;19(7):383-9. [PubMed]
- 32.
-
Lott IT, Doran E, Nguyen VQ, Tournay A, Movsesyan N, Gillen DL. Down syndrome and dementia: seizures and cognitive decline. J. Alzheimers Dis. 2012;29(1):177-85. [PMC free article] [PubMed]
- 33.
-
Janicki MP, Dalton AJ. Prevalence of dementia and impact on intellectual disability services. Ment Retard. 2000 Jun;38(3):276-88. [PubMed]
- 34.
-
Hunter CL, Bachman D, Granholm AC. Minocycline prevents cholinergic loss in a mouse model of Down’s syndrome. Ann. Neurol. 2004 Nov;56(5):675-88. [PubMed]
- 35.
-
Voronov SV, Frere SG, Giovedi S, Pollina EA, Borel C, Zhang H, Schmidt C, Akeson EC, Wenk MR, Cimasoni L, Arancio O, Davisson MT, Antonarakis SE, Gardiner K, De Camilli P, Di Paolo G. Synaptojanin 1-linked phosphoinositide dyshomeostasis and cognitive deficits in mouse models of Down’s syndrome. Proc. Natl. Acad. Sci. U.S.A. 2008 Jul 08;105(27):9415-20. [PMC free article] [PubMed]
- 36.
-
Haddow JE, Palomaki GE, Allan WC, Williams JR, Knight GJ, Gagnon J, O’Heir CE, Mitchell ML, Hermos RJ, Waisbren SE, Faix JD, Klein RZ. Maternal thyroid deficiency during pregnancy and subsequent neuropsychological development of the child. N. Engl. J. Med. 1999 Aug 19;341(8):549-55. [PubMed]
- 37.
-
Tüysüz B, Beker DB. Thyroid dysfunction in children with Down’s syndrome. Acta Paediatr. 2001 Dec;90(12):1389-93. [PubMed]
- 38.
-
Lavard L, Ranløv I, Perrild H, Andersen O, Jacobsen BB. Incidence of juvenile thyrotoxicosis in Denmark, 1982-1988. A nationwide study. Eur. J. Endocrinol. 1994 Jun;130(6):565-8. [PubMed]
- 39.
-
Morris AF, Vaughan SE, Vaccaro P. Measurements of neuromuscular tone and strength in Down’s syndrome children. J Ment Defic Res. 1982 Mar;26(Pt 1):41-6. [PubMed]
- 40.
-
Cabana MD, Capone G, Fritz A, Berkovitz G. Nutritional rickets in a child with Down syndrome. Clin Pediatr (Phila). 1997 Apr;36(4):235-7. [PubMed]
- 41.
-
Merrick J, Koslowe K. Refractive errors and visual anomalies in Down syndrome. Downs Syndr Res Pract. 2001 Jul;6(3):131-3. [PubMed]
- 42.
-
Shott SR. Down syndrome: common otolaryngologic manifestations. Am J Med Genet C Semin Med Genet. 2006 Aug 15;142C(3):131-40. [PubMed]
- 43.
-
Agathokleous M, Chaveeva P, Poon LC, Kosinski P, Nicolaides KH. Meta-analysis of second-trimester markers for trisomy 21. Ultrasound Obstet Gynecol. 2013 Mar;41(3):247-61. [PubMed]
- 44.
-
Renna MD, Pisani P, Conversano F, Perrone E, Casciaro E, Renzo GC, Paola MD, Perrone A, Casciaro S. Sonographic markers for early diagnosis of fetal malformations. World J Radiol. 2013 Oct 28;5(10):356-71. [PMC free article] [PubMed]
- 45.
-
Kuo WL, Tenjin H, Segraves R, Pinkel D, Golbus MS, Gray J. Detection of aneuploidy involving chromosomes 13, 18, or 21, by fluorescence in situ hybridization (FISH) to interphase and metaphase amniocytes. Am. J. Hum. Genet. 1991 Jul;49(1):112-9. [PMC free article] [PubMed]
- 46.
-
Jain S, Agarwal S, Panigrahi I, Tamhankar P, Phadke S. Diagnosis of Down syndrome and detection of origin of nondisjunction by short tandem repeat analysis. Genet Test Mol Biomarkers. 2010 Aug;14(4):489-91. [PubMed]
- 47.
-
Jain S, Panigrahi I, Gupta R, Phadke SR, Agarwal S. Multiplex quantitative fluorescent polymerase chain reaction for detection of aneuploidies. Genet Test Mol Biomarkers. 2012 Jun;16(6):624-7. [PubMed]
- 48.
-
Deutsch S, Choudhury U, Merla G, Howald C, Sylvan A, Antonarakis SE. Detection of aneuploidies by paralogous sequence quantification. J. Med. Genet. 2004 Dec;41(12):908-15. [PMC free article] [PubMed]
- 49.
-
Walknowska J, Conte FA, Grumbach MM. Practical and theoretical implications of fetal-maternal lymphocyte transfer. Lancet. 1969 Jun 07;1(7606):1119-22. [PubMed]
- 50.
-
Daniels G, Finning K, Martin P, Massey E. Noninvasive prenatal diagnosis of fetal blood group phenotypes: current practice and future prospects. Prenat. Diagn. 2009 Feb;29(2):101-7. [PubMed]
- 51.
-
Lo YM, Corbetta N, Chamberlain PF, Rai V, Sargent IL, Redman CW, Wainscoat JS. Presence of fetal DNA in maternal plasma and serum. Lancet. 1997 Aug 16;350(9076):485-7. [PubMed]
- 52.
-
Wright CF, Burton H. The use of cell-free fetal nucleic acids in maternal blood for non-invasive prenatal diagnosis. Hum. Reprod. Update. 2009 Jan-Feb;15(1):139-51. [PubMed]
- 53.
-
Voelkerding KV, Dames SA, Durtschi JD. Next-generation sequencing: from basic research to diagnostics. Clin. Chem. 2009 Apr;55(4):641-58. [PubMed]
- 54.
-
RECORD RG, SMITH A. Incidence, mortality, and dex distribution of mongoloid defectives. Br J Prev Soc Med. 1955 Jan;9(1):10-5. [PMC free article] [PubMed]
- 55.
-
Bell R, Rankin J, Donaldson LJ., Northern Congenital Abnormality Survey Steering Group. Down’s syndrome: occurrence and outcome in the north of England, 1985-99. Paediatr Perinat Epidemiol. 2003 Jan;17(1):33-9. [PubMed]
- 56.
-
Skotko BG, Davidson EJ, Weintraub GS. Contributions of a specialty clinic for children and adolescents with Down syndrome. Am. J. Med. Genet. A. 2013 Mar;161A(3):430-7. [PubMed]