目次
リキッドバイオプシーは、現在、進行性転移性非小細胞肺がん(NSCLC)の貴重な診断ツールと考えられています。非小細胞肺がんNSCLCでは、循環腫瘍DNA(ctDNA:Circulating tumor DNA)分析は、標的となる突然変異の存在を特定できる可能性を高めることが示され、標的となる変異を同定する可能性を高めることが知られており、臨床的には組織生検よりも安全な代替手段であると考えられています。そのリスクの低さから多くの臨床場面で利用されるようになってきました。
循環腫瘍DNA(ctDNA)を連続的に検査すること(モニタリング)は、治療効果の評価や再発のモニタリング(早期発見)にも役立つと考えられています。
術後に血漿中の循環腫瘍DNActDNAが検出可能であれば、腫瘍が残存している可能性が高いため、早期に切除された非小細胞肺がんNSCLCの微小残存病変(MRD)を評価するために、血漿中のctDNAを定量化する研究も行われています。
この記事では非小細胞肺がんの診断・治療、術後の再発のモニタリングとリキッドバイオプシーの関係に焦点を当てたいと思います。
循環セルフリーDNA(cfDNA)とは?
腫瘍に由来する末梢血中の循環無細胞DNA(cfDNA)は、ヌクレオソーム(80-200bp)に結合しているか、細胞外小胞に封入されており、循環腫瘍DNA(ctDNA:Circulating tumor DNA)と呼ばれています。循環腫瘍DNActDNAは、腫瘍細胞のアポトーシスやネクローシスが起こることで壊れた細胞から吸収されて血液の中を循環するようになります。
癌患者の循環腫瘍DNA(ctDNA)レベルの上昇は、腫瘍への免疫細胞の限定的に浸潤して腫瘍を生体から排除しようとして戦う事でも起こります。
循環セルフリーDNA(cfDNA)のリキッドバイオプシーの利点とは
腫瘍内は非常に不均一な環境にあるため、腫瘍組織を生検してもたとえば壊死組織しか取れなくて病理診断ができないなどという事もありますが、リキッドバイオプシーでctDNAを検出することは、そうした腫瘍組織のバイオプシー(組織生検)と比較して利点がいくつかあります。
- 循環腫瘍DNA(ctDNA)は、腫瘍内に存在する遺伝子変異の代表的な情報を提供してくれる。
- 循環腫瘍DNA(ctDNA)は典型的なセルフリーDNA自体の半減期が非常に短い(16分~2.5時間)ことから「現時点」の「リアルタイム」な腫瘍の遺伝子の異常を評価している。
- 非侵襲的に循環腫瘍DNA(ctDNA)を得ることができるため、連続的に計測してたとえば肺がんの再発を早期発見するなどのモニタリングには有利である。
- 従来の組織生検と比較して、費用対効果にも優れている。
- 循環腫瘍DNA(ctDNA)の分子特性は、実際の全身の腫瘍負荷をより正確に把握することができる。
- 循環腫瘍DNA(ctDNA)は単一部位の生検のみではカバーできない、所定の腫瘍標本内の不均一性や、転移の腫瘍生物学をより正確に反映する。
たとえば原発部位から転移する際にはたくさんの変異を積み重ねて、腫瘍組織から周囲の組織(マトリックス)に移動する能力、血管を破って進入する能力、血流にのって流されてまた血管壁に取り付いて破って血管外に出る能力、新しい組織に侵入する能力、などを得て可能となるため、原発巣と転移巣では腫瘍の遺伝子変異は異なります。全身の腫瘍の遺伝子変異の情報を幅広く得ることができ、何度でも繰り返し行えて、侵襲も採血だけと少ないのがリキッドバイオプシーの魅力です。
循環セルフリーDNA(cfDNA)のリキッドバイオプシーの欠点とは
一般的に、循環セルフリーDNA(cfDNA)全体に含まれる循環腫瘍DNA(ctDNA)の割合は非常に低く、がんの種類やステージによっても異なるため、高感度の検出技術が必要となることがその欠点です。
循環腫瘍DNA(ctDNA)を肺がん治療の日常臨床現場でどう使っていくか?
循環腫瘍DNA(ctDNA)、チロシンキナーゼ阻害剤(TKI)、免疫療法は、NSCLCの診断から標的療法までの理解と治療の両方に革命をもたらしました。ctDNAの定量化は、臨床的な意思決定に利便性と正確性をもたらし、さらに、TKIを用いた標的治療や免疫療法の実施により、NSCLC患者のQOLが大幅に向上ました。
国際肺癌学会(IASLC)は、リキッドバイオプシーは患者の治療を向上させる大きな可能性を秘めており、非小細胞肺がんNSCLCに関連するいくつかの治療環境で、臨床にすぐに導入することが正当化されると述べています。
以下、リキッドバイオプシーによる非小細胞肺がんの循環腫瘍DNA(CtDNA)を測定することで治療方針などが変わる場合を述べていきたいと思います。
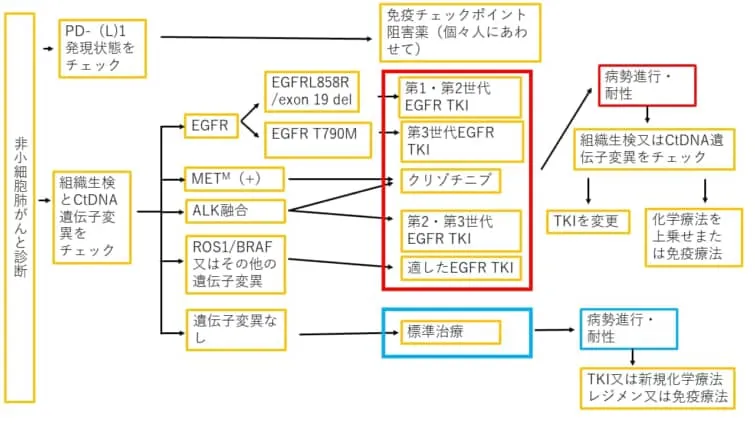
新たに進行性や転移性肺がんと診断された場合
1.標的となる変異があるとそれに対して特異的に効果がある分子標的治療薬を特定して効果的な治療を行える
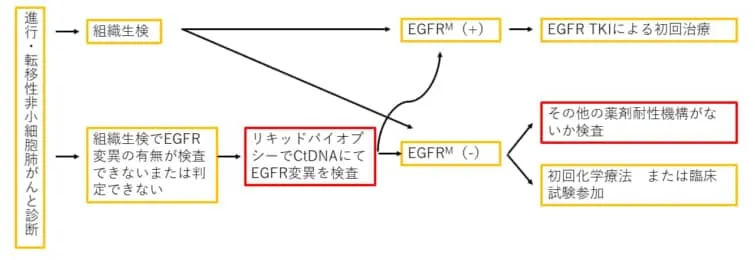
臨床において循環腫瘍DNA(ctDNA)を利用したリキッドバイオプシーが検討される最も一般的な場面は、新しく診断された進行性転移性NSCLCの場合です。ctDNAを利用することで、EGFR変異、ALK融合、ROS1融合、BRAF V600E変異、ERBB2(HER2)変異、RET融合、MET増幅、METエクソン14スキップバリアントなどの標的となる変異を同定できる可能性が高まることが報告されています。
第1世代EGFR-TKI:ゲフィチニブ,エルロチニブ
第2世代EGFR-TKI:アファチニブ
第3世代EGFR-TKI:オシメルチニブ
2.ファーストライン(初回治療)の免疫療法に適した非小細胞肺がん患者さんを見分ける
現在まで、ファーストライン(初回治療)の免疫療法に適しているのはどういう患者さんなのか、ということを判断するために定期的に検査される検査項目(腫瘍のバイオマーカー)はPD-L1というたった1つしかありません。
それがPD-L1ですが、世界中の多くの病理検査室で日常的に検査されていますが、以下のような生物学的または技術的な制約のため、評価が困難な場合もあります。
- ・PD-L1の発現は、悪性腫瘍だけでなく通常の免疫細胞にも見られるため、PD-L1の状態を慎重に評価するには複雑さがある。
- ・PD-L1の発現は腫瘍内にかなりの不均一性(発現が高いところ低いところと同じ腫瘍の組織の中で差がある)がある。
- ・小規模な生検組織では腫瘍全体のPD-L1の発現状態を反映または代表していない可能性がある。
特に、ニボルマブやイピリムマブなどの免疫チェックポイント阻害剤による治療の対象となる非小細胞肺がんNSCLC患者を特定するための新たなバイオマーカーとして、がん組織の生検におけるTumor mutational burden(TMB)が注目されていますが、現状ではTMB分析のための横断的な検査室の技術基準や検証はまだ不足しており、TMBを日常の臨床現場に導入することは困難です。
組織生検からのPD-L1免疫組織化学に基づく治療効果の予測、すなわちTMB評価は、生検標本中の腫瘍組織の量が非常に少ない、またはがん細胞の割合が少なかったりするため常に可能というわけではありません。TMBが比較的高く、PD-L1の発現が高い患者であっても免疫組織学的検査では偽陰性になる可能性があります。
そこで、リキッドバイオプシーは新たな診断ツールであり、一部の専門治療施設ではすでに肺がん患者の臨床現場で日常的に使用されています。もともとリキッドバイオプシーという用語は、循環腫瘍細胞(CTC)を意味していましたが、今日では循環無細胞腫瘍DNA(cfDNA)やエクソソームも含まれています。リキッドバイオプシーは、肺がんの診断方法として、または治療効果のモニタリングや治癒手術後の微小残存病変の検出ツールとして利用されているのです。
それまでの治療薬が効かなくなった非小細胞肺がん患者さんの新たで最適な治療薬を見分ける
リキッドバイオプシーは、時間の経過とともに発生する薬剤耐性のメカニズムを解明するのに適しています。「侵襲性が低い検査方法である(採血のみ)」ことと「対象となるがんの一般的な性質を反映している(病理組織検査はたまたま採取された小部分しか反映されない)」ことから、「繰り返し検査可能」であるためです。
リキッドバイオプシーは、米国病理学会(CAP)/国際肺癌学会(IASLC)/分子病理学会(AMP)の新しいガイドラインで、NSCLC患者の分子検査として推奨されています。
注意すべき点は、リキッドバイオプシーは疾患の最初の診断用組織生検の代わりにはならないということです。
組織生検で組織が得られない稀なケースに限って、リキッドバイオプシーは組織診断を得るためのツールとなり得ます。
場合によっては、組織生検の材料が小さく、病理医が必要な分子検査をすべて行うことができないため、さらなる分析を行うために新たな組織の入手が緊急に必要となる。このような場合にも、リキッドバイオプシーは選択肢の一つとなるでしょう。
非小細胞肺がんで治療を受けている患者の病気が進行した時
1.チロシンキナーゼ阻害剤(TKI)治療を受けている患者の病気が進行した時
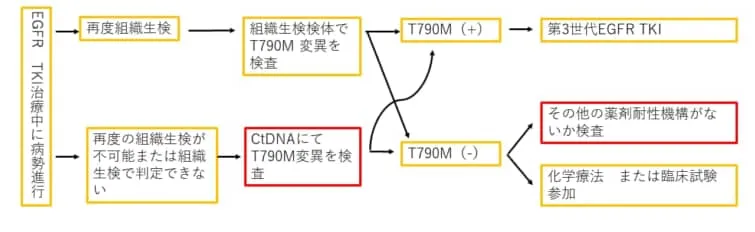
循環腫瘍DNA(ctDNA)検査が利用されるもう一つの一般的な場面は、チロシンキナーゼ阻害剤(TKI)治療を受けている患者の病気が進行した時でしょう。ctDNAは、このようなシナリオにおいて耐性のメカニズムを特定するのに役立ち、いくつかの二次的な分子変化は、さらに別のTKIに適応する可能性があります。
日本で保険承認されている薬剤では、標的変異と分子標的治療薬の関係
- ・ALK融合遺伝子
- 非小細胞肺がんにおいてアレクチニブ塩酸塩(アレセンサカプセル)、クリゾチニブ(ザーコリカプセル)、セリチニブ(ジカディア錠)が有効。
- ・ROS1融合遺伝子
- 非小細胞肺がんでエヌトレクチニブ(ロズリートレクカプセル)が有効。
- ・NTRK融合遺伝子
- 固形がん一般でエヌトレクチニブ(ロズリートレクカプセル)の投与が有効。
- ・活性型EGFR遺伝子変異
- 非小細胞肺がんでアファチニブマレイン酸塩(ジオトリフ錠)、エルロチニブ塩酸塩(タルセバ錠)、ゲフィチニブ(イレッサ錠)、オシメルチニブメシル酸塩(タグリッソ錠)が有効
- ・EGFRエクソン20 T790M変異
- 非小細胞肺がんでオシメルチニブメシル酸塩(タグリッソ錠)が有効
- ・METex14遺伝子(MET遺伝子エクソン14スキッピング変異)
- 非小細胞肺がんでカプマチニブ塩酸塩水和物(タブレクタ錠)が有効
第1世代EGFR-TKI:ゲフィチニブ,エルロチニブ
第2世代EGFR-TKI:アファチニブ
第3世代EGFR-TKI:オシメルチニブ
非小細胞肺がんにおけるリキッドバイオプシー(循環腫瘍DNACtDNA)のこれから
現在、非小細胞肺がんNSCLCにおけるリキッドバイオプシー検査の用途はますます広がっています。CfDNA検査(セルフリーDNA検査)は、主に早期の治癒可能な疾患の患者に実施されます。
治癒を意図した治療後に循環する腫瘍cfDNAの存在は、最小または分子レベルの残存病変と強く相関することがわかっています。
非小細胞肺がんの再発はcfDNAの存在によって予測され、転帰(疾患経過)は悪化します。
最近の研究では、治癒目的で化学放射線療法を受けた局所進行NSCLC患者における地固め免疫療法の有用性が評価されました。地固め療法は、cfDNAによる微小残存病変陽性の患者の転帰を改善しましたが、cfDNA評価で微小残存病変を認めなかった患者では、地固め免疫療法の有用性は認められませんでした。これにより、最小残存病変の指標としてのcfDNAの状態は、治癒目的の治療レジメン(薬の組み合わせ)が終了した後の補助療法に関する意思決定の指針となる可能性があります。
また、早期で治癒可能なNSCLCの約40~50%は、NGSベースのcfDNAスクリーニング技術を用いて検出できる可能性があるとされています。肺がんを早期で発見すること自体が難しいので、循環腫瘍DNA(CtDNA)のリキッドバイオプシーで肺がんを早期発見する時代が来るかもしれません。
肺がんの分子異常と治療選択
肺がんの分子異常については、過去10年間で知識が増え、分子特性に基づいて疾患のサブセット(小分類)が定義されています。
数年前から、疾患の特定の分子特性に応じてカスタマイズされた治療法を提供することが、日常的な臨床診療の標準となっています。しかし、疾患の経過に伴い、標的治療に対する耐性が獲得されることはよくあることです。腫瘍の遺伝子情報は、上皮成長因子チロシンキナーゼ阻害剤(EGFR TKI)などの特定の標的治療薬の治療効果を予測するために使用されています。
上皮成長因子チロシンキナーゼ阻害剤(EGFR TKI)
第一世代のEGFR TKIが承認され、その後、EGFRの特定の変異型に対して特異的な作用を持つオシメルチニブのような第二、第三世代のTKIが開発されました。一般的なEGFR活性化変異に特異的かつ効果的に対処できること、T790M変異を有するEGFRタンパク質の阻害が可能であること(この変異は、第1世代または第2世代のEGFR TKIの治療失敗の原因となっている)、野生型(WT)EGFRに対する影響が比較的少ないことから、治療の毒性や副作用が軽減されることなど、この新しい治療薬群にはいくつかの利点があります。
未分化リンパ腫キナーゼ(ALK;Anaplastic lymphoma kinase)TKI
未分化リンパ腫キナーゼ(ALK;Anaplastic lymphoma kinase)を標的とした薬剤群も拡大を続け、第一世代のALK TKIであるクリゾチニブに耐性を獲得した患者群で有効な治療手段を提供しています。
これらの次世代ALK TKI(アレクチニブ、セリチニブ、ブリガチニブ、アンサルチニブ、ロルラチニブ)は、変異型ALKに結合して阻害する可能性を有しています。注目すべきは、これらの新規ALK TKIはすべて、特定の耐性変異に応じて異なる結合親和性を持っていることです。したがって、各個人に合わせた治療法を見つける方法としては、これらの耐性変異を正確に特定することが非常に重要となってきます。
非小細胞肺がんの疾患の経過に伴う腫瘍の進化により遺伝子変異が変化し、新たな治療法の選択肢が増える可能性があるため、繰り返し組織生検を行うことが提唱されていますが、患者にとってかなりの侵襲を伴い、ADLや身体の状態(パフォーマンスステータスPS)が低い場合は行うことができません。
例えば、コンピュータ断層撮影(CT)ガイド下の肺生検では、主要な合併症の発生率は5%となっていますが、リキッドバイオプシーでは血液を採取するだけなので侵襲性がありません。
循環腫瘍DNA(ctDNA)を解析するための方法
臨床現場では、ctDNAの存在と質を分析するために、複数の技術が開発されています。
対立遺伝子特異的PCR
対立遺伝子特異的PCRは、特定のよく知られたがん関連変異の信頼できる増幅を可能にしますが、特に早期の肺がんでは感度が非常に低くなります。限られた数の一般的で明確な変異が検査可能であるため、既知の一般的なドライバー変異を持つ患者にしか適用できません。
デジタルPCR
デジタルPCRでは、サンプルが複数の小さな反応に分割されるため、感度が大幅に向上します。限られた数の一般的で明確な変異が検査可能であるため、既知の一般的なドライバー変異を持つ患者にしか適用できません。
次世代シーケンシングNGS
次世代シーケンシングNGSは、少数のホットスポット領域のみを強化するように設計された多重PCRアッセイの組み合わせを利用して、遺伝子変異をスクリーニングし、変異した対立遺伝子の割合を定量化することで、ctDNA検査の適用範囲を拡大しました。この技術の限界は、少数の遺伝子のみが調査され、ブレイクポイント配列が以前に特性化されていない場合は、コピー数の変化や構造的変異を検出できないことです。
ハイブリッドキャプチャーとそれに続くNGSを組み合わせた手法
ハイブリッドキャプチャーとそれに続くNGSを組み合わせた手法では、極めて高い感度を維持しながら、より多くの種類の遺伝子異常を定量化することができます。
ディープシーケンシング
エクソーム全体またはゲノムのディープシーケンシングにより、包括的なctDNAプロファイリングを行うことが可能ですが、ディープシーケンシング技術は、サンプルあたりのコストがかなり高く、感度がかなり低いため、進行した悪性疾患の患者にのみ使用されています。
EGFR遺伝子変異の検査
EGFR遺伝子変異は、喫煙歴のない被験者の肺腺がんの43%、および喫煙者の肺腺がんの11%に発生します。EGFR遺伝子変異の割合が最も高いのはアジア民族です。複数の無作為化試験により、EGFR変異を有する転移性非小細胞性肺がんmetastatic NSCLCの場合、EGFR TKIであるエルロチニブ、ゲフィチニブ、アファチニブによる治療が化学療法と比較して無増悪生存期間(PFS)を改善することが確認されています。
EGFR変異の検査は、NSCLCの分子解析における重要な要素の1つであり、各患者に最適でカスタマイズされた治療を提供するためにEGFR遺伝子変異の有無の情報が必要となります。
組織分析はEGFR変異のスクリーニングにおけるゴールドスタンダードであることに変わりはありませんが、分子検査のための組織サンプルが十分でない場合や、生検のリスクが高すぎる場合には、リキッドバイオプシーが唯一の選択肢となることが多くなります。
cobas EGFR Mutation Test v2は、リアルタイムPCRベースの検査法で、当初はホルマリン固定パラフィン包埋腫瘍標本に適用されていたのですが、ファーストラインのエルロチニブ投与とゲムシタビンとシスプラチンの併用療法を比較したENSURE試験では、血漿サンプルへの適用が検証されました。
循環腫瘍DNA(ctDNA)検査によるEGFR変異の検査の感度
ctDNA検査によるEGFR変異の検査の感度は、血流中のctDNAの総量に依存しており、これは患者ごとに異なるだけでなく、1人の同じ患者でも異なる時点で変化する可能性があります。また、ctDNAの半減期は2時間未満であることが示されています。腫瘍の負荷もctDNAの濃度を当然左右すると想定できますが、腫瘍が大きい患者ほどctDNAの濃度が高くなる傾向があると報告されています。
これまでのデータによると、胸腔外病変(M1b)は、胸腔内病変(M1aまたはM0)と比較して、リキッドバイオプシーによるEGFR遺伝子変異が検出される可能性が高くなることが報告されています。
注目すべきは、現在利用可能なEGFRのctDNA検査は、感度よりも特異度を優先していることです。
EGFR変異をスクリーニングするデジタルPCRまたはNGSベースのアプローチは、従来のPCRと比較して低い検出限界を達成し、その結果、より良い感度を提供することができるため、NSCLCにおける複数の一般的なドライバー変異を検査するプラットフォームは、EGFR変異の陰性結果を解釈するのに最も適しています。




