目次
大腸がんは結腸がんと直腸がんを合わせたものをいいます。大腸がん(CRC)は、米国で3番目に多いがん死亡原因であり、毎年、約15万人の新規症例が診断され、そのうち2/3が結腸がん、1/3が直腸がんです。
日本では2018年に新たに大腸がんと診断された人が男性は約9万人、女性は約7万人、合計約16万人となっています。日本の人口約1億2千万が米国約3億3千万と米国の4割にも満たないことを考えると、日本では大腸がんが非常に多いと言ってよいでしょう。臓器別にみると、大腸がんは日本では男性3番目に、女性2番目に多いがんです。
この記事ではそんな大腸がんの根治的または治癒を目指した積極的切除術の術後管理のエビデンスをお伝えします。
大腸がんでは外科的切除が約8割の患者さんで行われる
外科的切除は、非転移性疾患を呈する大腸がんCRCの80%に対する主要な治療法です。
大腸がんのステージ分類に関しては別ページをご用意しておりますのでそちらをご覧ください。
大腸がんの予後(疾患経過)を評価するための最も強力なツールとなるのが、大腸がんの手術切除標本の病理学的分析です。
治癒の可能性のある手術や最新の補助化学療法を行っても、II期またはIII期の患者の40%以上が一次治療後に再発します。
術後のサーベイランスプログラム(観察)は、無症候性(症状がない)の再発を早期に発見することで、根治療法を受けられる可能性のある患者の割合が増えることを目指して行われます。こうしたアプローチによる生存率の向上は、エビデンスもメタアナリシスという最高レベルで示されています。定期的に画像診断を行うことで、切除可能な再発を早期に発見することができるのです。
ステージIIまたはIIIの大腸癌(CRC)の治癒目的の手術を含む積極的な治療の、術後の集中的なフォローアップを推奨
治療後のサーベイランスの効果を検討した研究の大部分は、ステージIIまたはIIIの疾患を切除した患者を対象にしています。
切除されたステージIIまたはIIIの大腸癌(CRC)では、術後の集中的な観察が推奨されます。
大腸がん術後最初の3年間で推奨されるフォローアップ
最初の3年間は3-6カ月ごと、4-5年目は6カ月ごとにフォローアップ診察を行います。
大腸がん術後最初の3年間で推奨されるフォローアップは以下の通りとなっています。
- 毎回の血清CEA(腫瘍マーカー)
- 年1回の胸部、腹部、骨盤のCT撮影
- 1年後に大腸内視鏡検査
大腸内視鏡検査は1年後に正常であれば、前回の大腸内視鏡検査の結果に応じて、その後3~5年の間隔でフォローアップを行います。
低位前方切除を受けた直腸癌で、骨盤内放射線治療を受けていない患者には、6ヶ月に1回、3~5年間、軟性直腸鏡検査を行うことが推奨されます。
大腸がん術後集中的サーベイランスのエビデンス
結腸・直腸癌の術後や術後化学療法の最終治療後のサーベイランスの目的は、二次原発癌やポリープをスクリーニングすることで、さらなる早期の外科的介入により治癒する可能性のある患者さんを見つけることです。再発癌を早期に診断することで、より良好な転帰が得られるという見解を支持するデータが増えています。
無症状の再発を早期に発見することで、根治療法を受けられる可能性のある患者の割合が増えることを期待して、術後の集中的な監視プログラムが正当化されてきた歴史があります。しかし、実は、個々の無作為化試験では生存率の向上は証明されていませんが、それらを総合したメタアナリシスでは、結腸・直腸がんCRC切除後の集中的なフォローアッププログラムによって、わずかですが有意な生存率の向上が示唆されています。
再発病の早期発見は生存率を高めるか?
原発性CRC治療後の適切なサーベイランスに関する議論を検討する際に生じる重要な臨床的疑問は、再発病変の早期発見が生存率を向上させるかどうかということである。再切除により、限局性再発の患者の一部は治癒します。
特に肝臓や肺に転移があり、かつ転移部位が限られている一部の患者に対しては、手術により治癒の可能性があります。限定的な肝転移に対して肝部分切除術を受けた患者の5年生存率は40%に近いことが報告されています。
孤立性肺転移は肝転移に比べて件数自体は少ないのですが、慎重に選択された肺転移患者の治療にも転移切除術が用いられており、5年生存率は35~45%と良好です。
症状のある再発よりも無症状の再発の方が、治癒の可能性のある切除(根治的切除)の対象となる可能性が高く、根治切除後では無増悪生存率と全生存率が有意に良好であることが示されています。
このことは、集中的なフォローアップ(病歴と身体検査に血清検査、放射線検査、内視鏡検査を加えたもの、集中群)と最小/無フォローアップ(対照群)を比較した11の試験に登録された、ステージI、II、IIIのCRCを切除した患者約4000人を対象としたメタアナリシスで明らかにされています。集中的な追跡調査は、無症状の疾患再発を検出する確率(RR 2.59、95%CI 1.66-4.06)、再発時に治癒目的の手術を行う確率(RR 1.98、95%CI 1.51-2.60)、および腫瘍再発後の全死因(がんに関係ないものもすべて含む)に関する生存率(RR 2.13、95%CI 1.24-3.69)が有意に高いことと関連していました。
しかし、症状のある再発の場合であっても必ずしも根治治療ができないというわけではありません。再発結腸癌に関するレビューでは、最終的に切除可能な再発の25%が、来院時に症状を呈しています。
根治切除後の大腸がんに対して集中的サーベイランス戦略と非集中的サーベイランス戦略のどちらが良いのか?
American Society of Clinical Oncology(ASCO)、Cancer Care Ontario、European Society for Medical Oncology(ESMO)、National Comprehensive Cancer Network(NCCN)など、ほとんどの専門家グループから発表されている治療後のサーベイランスに関する最新のガイドラインにおいて、根治切除されたステージIIまたはIIIの大腸がんCRCで、治癒目的の手術の候補と考えられるほとんどの患者に、術後の集中的サーベイランスが推奨されています。
治療後のサーベイランス戦略をより集中的に行う場合とそうでない場合の利点については、引き続き議論されている。全体として、13件の無作為化試験のうち6件が、治癒の可能性があるCRCの切除後に治療後の監視を徹底することで、わずかではあるが有意な全生存率の向上を認めています。
根治切除後の大腸がんに対するサーベイランスの強弱は?
複数のメタアナリシスが、CRC切除後のサーベイランスの強さと弱さの役割を論じており、集中的なサーベイランスの方が頻度が高いことがわかったのですが(リスク比1.98、95%CI 1.53-2.56)、生存率の向上につながってはいません。
しかし、集中的サーベイランスの定義自体が一定ではない。例えば、年1回の大腸内視鏡検査を5年間実施することは集中的、切除後1年と4年の大腸内視鏡検査は非集中的、CEAの測定は、3年間は2か月ごとでその後2年間は3か月ごとに行うのが集中的、3年間は3~6か月ごとその後2年間は12か月ごとに行うのは非集中的という具合です。画像診断と手術手技の進歩、および術後化学療法変遷を考慮して、検討し続ける必要があると考えられています。
治癒切除後の大腸がんに対する具体的なフォローアップとは?
最適なフォローアップとは何か?いつどんな検査をすべきなのか、は無作為化試験におけるフォローアッププログラムに大きなばらつきがあることもあって、確立されていません。
現在のガイドラインでは、切除後3~5年間は、CEAの連続測定と定期的なCT検査を行うことが推奨されています。
適切なサーベイランス戦略は、再発病変の時間的パターンと場所を考慮する必要があります。
腫瘍再発の圧倒的多数は最初の5年以内に発生し、そのほとんどは手術後最初の2〜3年以内に発生します。
一般的には大腸がんの遠隔転移は肝転移が多いのですがが、直腸遠位部の静脈やリンパの流れは肝臓を迂回しているため、直腸遠位部癌の患者では肺転移がより一般的に起こります。
臨床検査
血清CEA
根治手術後の大腸がんのサーベイランスで定期的に推奨される唯一の臨床検査は、血清CEAです。CEA値が5ng/mLを超えても、1年以上の追跡調査で画像診断やその他の診断方法で疾患の再発を示す証拠がない場合、またはCEA上昇の後に少なくとも2回の連続測定で自然に正常化した場合は偽陽性と考えられます。
全体としては、フォローアップ中の患者の約半数が少なくとも1回の偽陽性のCEA上昇が見られ、約半数にに真陽性のCEA上昇が見られますが、真陽性の1割程度は大腸がん以外の新たながんと関連していました。
CEAの偽陽性の9割は5~10ng/mLでした。偽陽性の場合著く高くなる(たとえば20を超える)ことはありません。
CEA値が誤って上昇する原因として、FUベースのレジメンによるアジュバント(術後化学)療法が考えられるが、これは治療に伴う肝機能の変化が原因である可能性があるため、アジュバント治療が終了してからCEAサーベイランスを開始します。
また、喫煙者ではCEA値が有意に高く、10ng/mLまでの正常値が見られることがあります。
CEAが徐々に上昇し、再検査で確認される場合は、転移/再発部位を特定するためにさらなる評価が必要となります。検査としては、腹部・骨盤CT、胸部CT、ポジトロン断層撮影(PET)、場合によっては大腸内視鏡検査などを考えます。
その他の腫瘍マーカー
その他の腫瘍マーカーの有用性は不明です。
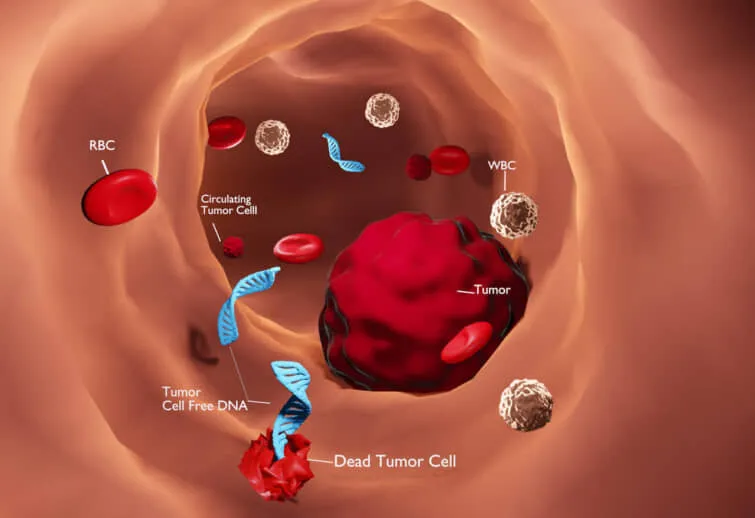
循環腫瘍DNA
循環腫瘍DNA(ctDNA)とは、患者のがんに由来する循環DNAの割合のことです。大腸がんCRCは血液中にDNAを排出しますが、ctDNAを検出・定量する技術の向上に伴い、再発リスクの高感度な指標としてctDNAを使用することへの関心が高まっています。
循環腫瘍DNAを大腸がん術後に測定した研究報告1
大腸がんCRCの外科的治療を受けた患者27人の報告の結果を以下に示します。
- ・14人の再発患者全員に術後のctDNAが検出されたが、非再発患者には検出されませんでした。
- ・限局性疾患に対する治療を受けた21名の患者のうち、術後3ヶ月以内にctDNAが検出された6名全員が再発したのに対し、術後3ヶ月の時点でctDNAが検出されなかった残りの15名の患者では再発は4名のみでした。
- ・循環腫瘍DNA(ctDNA)が検出されなかったのに検出されるようになった6名は、ctDNAが検出されなかった6名に比べて、無再発生存期間および全生存期間が有意に短かった。
- ・平均して、ctDNAでは8.2カ月後、CEAでは12.3カ月後、CTでは16.9カ月後に再発が発見され、循環腫瘍DNA(ctDNA)は画像所見で再発が発見される8か月以上前に再発をキャッチしています。
循環腫瘍DNAを大腸がん術後に測定した研究報告2
別の研究では、I期、II期、III期の大腸がんCRCを切除した患者58名を対象に、末梢循環中の腫瘍の変異を低頻度で検出できる極めて感度の高い変異検出法を用いて、術後1カ月、その後3~6カ月の間隔でctDNAの検査を行ったところ以下の結果を得ました。
- ・ctDNAが陽性であった患者の再発率は77%(13人中10人)であり、ctDNAが陽性であった場合、X線による検査で発見される再発よりも中央値で4ヵ月(範囲2~31)先行していました。
- ・ctDNAが検出されなかった45名の患者のうち、追跡期間中央値49ヵ月の時点で再発した患者はいなかった。
循環腫瘍DNAを大腸がん術後に測定した研究報告3
この研究では、ステージI、II、IIIの大腸がんCRC患者125名を対象に、16の変異を標的としたポリメラーゼ連鎖反応(PCR)ベースのマルチプレックス次世代シーケンサーによるctDNA評価を行いました。この次世代シーケンサーは、各患者の腫瘍とマッチした生殖細胞系DNAの全エクソーム・シーケンサーに基づいて各患者ごとにカスタマイズされ、評価は手術前、術後1カ月、3カ月ごとに最長3年間行われました。
- ・最終治療後、循環腫瘍DNA(ctDNA)が陽性の患者は、再発が40倍以上と高く(ハザード比HR43.5、95%CI 9.8-193.5)、すべての多変量解析において、既知の臨床病理学的危険因子を調整した後もなお、ctDNAの状態は再発と独立して関連していた。
- ・アジュバント(術後)化学療法後に血液サンプルを採取した58名の患者のうち、ctDNA陽性の7名全員が再発したのに対し、ctDNA陰性の51名のうち7名が再発した(100%対14%)。
これらの研究では、再発の早期発見により、再発時に治癒可能な治療を受ける機会が有意に増加したかどうかは明らかではありません。
X線画像診断
コンピュータ断層撮影
II期またはIII期の結腸癌または直腸癌を切除した患者に対しては、治癒目的の手術を含む積極的な治療を受けることが可能な場合、少なくとも3年間は年1回の胸部および腹部の監視用CTスキャンを行うことが推奨されています。また、直腸がんの場合、骨盤内放射線治療を行っていない場合は、年1回の骨盤内CT検査が推奨されています。
胸部のサーベイランスに関するエビデンスは肝臓の画像診断に比べて少ないですが、CTで肺の再発が検出され、治癒の可能性のある切除を受けた7人の患者全員が、CEA値が正常で無症候性であり、そうでなければ検出されなかったであろう患者でした。CT検出群は、症状のある群と比較して、再発時からの生存期間中央値が有意に長かったが(26.4ヵ月対12.6ヵ月)、CEA検出群ではそうではなかった(19.2ヵ月)ので、再発を無症状のうちに発見することは意義があると考えられます。
再発が最も多く見つかったのは腹部CTスキャンでしたが、切除可能な再発が最も多かったのは胸部CTスキャンでした。
重要な点は、治療後のサーベイランス戦略を計画する際に、放射線被曝や二次悪性腫瘍のリスクを考慮して、特に若年層では不要なCTスキャンの回数を制限するように注意すべきであるということです。
陽電子放出断層撮影-PET検査
PETは、日常的なサーベイランスには意義が乏しず、ASCOやNCCNなどの専門家グループのガイドラインでは、その使用は特に推奨されていません。
治癒可能な手術後の再発の検出におけるPETの役割は不明です。一部の患者では早期再発(および予期せぬ第二原発腫瘍)が発見されるかもしれないのですが、これらの利点は偽陽性および偽陰性の結果によって相殺され、術後の監視戦略にPETを加えることによる生存率への影響は不確実となっています。
血清CEAの上昇が持続し、従来の診断法では明らかにならなかった患者に対しては、PET検査によって隠れた転移性疾患が明らかになり、患者の管理が変わる可能性があります。
二次がんやポリープの診断
内視鏡検査は、管腔内の CRC を直接観察できる唯一の手段であり、二次がんやポリープを診断するためのサーベイランスの柱となっています。
周術期の大腸内視鏡検査
同期性大腸癌は、正常な腸管で隔てられた2つ以上の異なる原発腫瘍で、直接の進展や転移によるものではないと定義され、大腸がんCRC患者の2~5%に発生します。
原発性CRCの治療を受けたすべての患者は、同期性悪性腫瘍と非悪性ポリープを除外するために大腸内視鏡検査を受けるべきです。
閉塞性腫瘍のある患者には、CTコログラフィーや二重造影バリウム浣腸を術前に行うことができます。例えば、閉塞性癌で大腸内視鏡検査を術前に実施できない場合には、術後に回復してから通常、術後6ヵ月以内に大腸内視鏡検査を実施すべきです。
術後の内視鏡サーベイランス
生存率向上の問題は未解決ですが、治療後の定期的な内視鏡サーベイランスは、ASCO、ESMO、Cancer Care Ontario、NCCN、ACS、およびACS/United States Multisociety Task Force on Colorectal Cancer合同委員会などの主要グループによって支持されています。
サーベイランス大腸内視鏡検査の目的は、多クローン性大腸がんおよびポリープ(初回診断から6カ月以上経過した非吻合性の新腫瘍)の検出と、治癒治療が可能な段階にある初回原発癌の吻合部再発の検出の2つがあります。
異時性病変は1.5~3%の患者に発生し、その多くは術後36ヶ月以内に発生します(1年あたり0.35~0.5%)が、一部の患者では10年までリスクが高くなります。これらの「異時性」病変の2分の1以上は、最初の切除から24ヵ月以内に発生し、最初に見落とされた同期がんである可能性があり、その他は早期の吻合部再発です。
1年後のサーベイランス大腸内視鏡検査で大腸がんCRCの発生率が高いことが、ASCO や米国大腸癌マルチソサエティタスクフォースを含むほとんどの専門家ガイドラインが、切除後1年後の大腸内視鏡検査を推奨している理由となっています。
吻合部再発は、結腸癌患者の 2~4%に発生し、直腸癌患者、特に直腸間膜全摘出術や骨盤内放射線治療を受けていない患者では、その割合が高くなります。吻合部再発の約90%は最初の切除後3年以内に発見されます。
術後の大腸内視鏡検査の利点と最適な頻度については議論されています。大腸がんCRC切除後に大腸内視鏡サーベイランスを受けた患者は、疾患特異的な死亡率ではなく、全体的な死亡率が低いことが示されています。さらに、年1回またはそれ以下の間隔で大腸内視鏡検査を行った場合に、それ以下の間隔(3年または5年)で行った場合と比較して、生存率が向上することは示されていません。
吻合部再発の早期発見による疾患特異的な生存利益を検出できないのは、内視鏡的に吻合部再発が検出された患者の圧倒的多数が治癒不能であるという事実に関連しているのかもしれない。直腸癌の局所再発率は一般的に結腸癌よりも高く、早期発見が再治療の成功につながる可能性があるため、硬性または軟性の直腸鏡S状結腸鏡による直腸の定期的な検査を実施する根拠があります。
一方、定期的な大腸内視鏡検査は、手術で治癒可能な段階にある異時性の癌を発見するだけでなく、腺腫性ポリープを発見・除去することで異時性の癌を予防することにも明らかな利点があります。
まとめ
大腸がんの根治切除(治癒切除)の術後フォローアップについて検査内容をお伝えしました。循環腫瘍DNA(CtDNA)を測定するリキッドバイオプシーは、まだ技術的に新しく、観察期間が十分ではないのですが、X線画像所見や腫瘍マーカーよりも半年以上早期に再発をキャッチできることについては、再発をなるべく早期に発見するという事につながるのではという期待が高まります。
また、ご覧いただいたように、「生存期間の延長」をアウトカムとしてみた場合、効果がはっきりしない内容でもたくさんの専門家集団から推奨されている検査内容もあり、実際の個々の患者がどういう検査やフォローアップを選ぶのかについては、ご本人もよく知り納得の上でなさるべきだと感じています。
わが国でもリキッドバイオプシーは保険収載されましたが、全経過中に一度しか適応されない、使用している抗腫瘍薬が効果がなくなったときしか使えない、などの難点があります。
こうした点を、セルフカバーできるのが自由診療のよい点だと感じています。
ミネルバクリニックでは大腸がんの患者さんに対するセレクトされた循環腫瘍DNA(CtDNA)を測定するリキッドバイオプシーを取り扱っております。術前にどういう異常があったかを知ることで、根治術後に残存病変があるのか、効果がある抗腫瘍薬は何なのか、薬剤の効果が乏しくなった時など、自費診療で何度でも検査が可能です。ご自身の治療の戦略をしっかりと立てるためにも、是非ご検討下さい。がんと遺伝子の両方の専門医を持つ院長が真摯に対応いたします。

ミネルバクリニックでは、がんに罹患していないか、または、術後に再発していないか、治療効果はどうか、というモニタリングを可能な遺伝子検査を提供しています。検体は血液ですが、オンライン診療で当院を受診していただき、全国の協力施設で採血をした頂く形で検査を受けることが可能です。是非ご検討ください。
関連記事:
●がんに罹患していないか、術後に再発していないか、治療効果はあるか、のモニタリング|リキッドバイオプシー
●総合がん遺伝子検査(がんになりやすいのかを検査)