目次
細胞のプログラムされた死、アポトーシスは生物学の中でも重要な現象です。健康な生体の維持から疾病の治療に至るまで、この自己破壊のメカニズムは生命の根幹に関わるプロセスとして、多岐にわたる研究分野で注目されています。この記事では、アポトーシスの基本的な概念を解説し、生物学的な役割やネクローシスとの違い、そして最新の研究動向や治療への応用について明らかにしていきます。自己免疫疾患やがんなどの病態との関連から、新しい治療法の開発に至るまで、アポトーシスが持つ潜在的な可能性を探ります。
アポトーシスとは
アポトーシスの定義
アポトーシスは、プログラムされた細胞死の一形態で、生物の正常な成長や発達、維持に不可欠な過程です。このプロセスは、特定のシグナルに応答して細胞が自らを破壊することによって行われ、細胞の構成成分は小さな膜で包まれた断片(アポトーシス体)に分割され、その後、隣接する細胞やマクロファージ(免疫細胞の一種)によって取り込まれ、分解されます。
アポトーシスは細胞が遺伝子の指示に従って自己破壊するため、「自殺」とも形容されますが、これは生物全体の健康や恒常性を維持するために行われる自然で秩序あるプロセスです。このプロセスは、以下のような多くの生理的および病理的状況で重要な役割を果たします:
・発達中の組織の形成:手足の指の間の細胞がアポトーシスを経ることで、指が個別に分離します。
・免疫系の調節:古くなったり、機能しなくなった免疫細胞は、アポトーシスによって除去されます。
・がんの防止:DNA損傷や異常な増殖シグナルを受けた細胞は、アポトーシスを通じて排除されることで、がん化を防ぎます。
・疾患の進行:一部の病理的状態では、過剰なアポトーシスが組織損傷や疾患の進行に寄与することがあります。
アポトーシスは、カスパーゼと呼ばれる一群のプロテアーゼ酵素の活性化によって特徴づけられ、これにより細胞の構造と機能に必要なタンパク質が系統的に分解されます。また、細胞の核が縮小し、DNAが断片化されることもアポトーシスの典型的な特徴です。アポトーシスの正確な調節は生物の健康維持に不可欠であり、その失調は多くの疾患の原因となり得ます。
アポトーシスのメカニズム
アポトーシスは、細胞がプログラムされた方法で死ぬ過程であり、そのメカニズムは主に二つのシグナル伝達経路を介して進行します:外因性経路と内因性経路です。これらの経路は、特定の細胞死シグナルに応答して活性化され、最終的にはカスパーゼと呼ばれる一群のプロテアーゼ酵素のカスケード活性化を引き起こします。カスパーゼはアポトーシスの実行において中心的な役割を果たし、細胞の解体とアポトーシス体の形成を担います。
### 外因性経路(死の受容体経路)
外因性経路は、細胞の外部からのシグナルによって引き起こされます。この経路は、FasリガンドやTNF(腫瘍壊死因子)のような特定のリガンドが細胞表面の死の受容体(例:Fas受容体やTNF関連受容体)に結合することで開始されます。この結合により、受容体がトリメリゼ(3つに集まる)し、アダプタータンパク質と結合します。この複合体は、プロカスパーゼ-8を活性化します。プロカスパーゼ-8はカスパーゼ-8に変換され、これがさらに実行カスパーゼ(例:カスパーゼ-3)を活性化し、細胞の解体プロセスが開始されます。
### 内因性経路(ミトコンドリア経路)
内因性経路は、細胞内部のストレスやDNA損傷などのシグナルによって引き起こされます。この経路の中心には、ミトコンドリアの外膜の透過性が変化し、サイトクロムcが細胞質に放出されることがあります。サイトクロムcは、Apaf-1やプロカスパーゼ-9と結合してアポトソームを形成し、プロカスパーゼ-9をカスパーゼ-9に変換します。カスパーゼ-9はさらに実行カスパーゼを活性化し、細胞の解体を進行させます。
### カスパーゼの役割
カスパーゼは、アポトーシス中に細胞内の特定のターゲットタンパク質を選択的に分解することで、細胞の構造を解体し、最終的に細胞死を実行します。この過程では、核の断片化、細胞質の縮小、細胞膜の変化など、アポトーシスの特徴的な形態学的変化が生じます。
アポトーシスの精密な制御は、発生、組織恒常性の維持、異常細胞の除去に不可欠であり、この過程の失敗はがん、自己免疫疾患、神経変性疾患など、多くの病気の原因となり得ます。
アポトーシスでおこる目に見える変化とは?
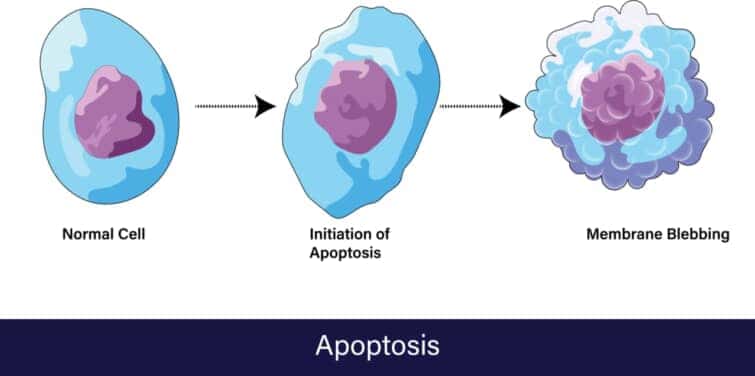
顕微鏡下でのアポトーシス細胞は特徴的な変化を示します。正常な細胞核が一つの丸い楕円形をしているのに対し、アポトーシスを起こす細胞の核は縮小し、凝縮して最終的には断片化します。また、細胞自体が収縮し、細胞膜が変化して細胞表面から突起物が出る(blebbing)現象も観察されます。これらの変化はアポトーシスが進行していることを示しています。
アポトーシスはどのように開始されるのか?
1.様々な生理ストレス信号が異なるアポトーシス促進タンパクを介してBcl-2タンパクファミリーを阻害
細胞は様々な生理的ストレスにさらされ、これらは異なるアポトーシス促進タンパクを介してアポトーシスを阻害するBcl-2タンパクと拮抗します。Bcl-2様タンパクが多く存在すると、アポトーシスを促進する主要なタンパクであるBaxがミトコンドリアの膜からチトクロームcを放出させる働きを無力化されることができなくなります。
2.ミトコンドリア外膜からチトクロムcが放出
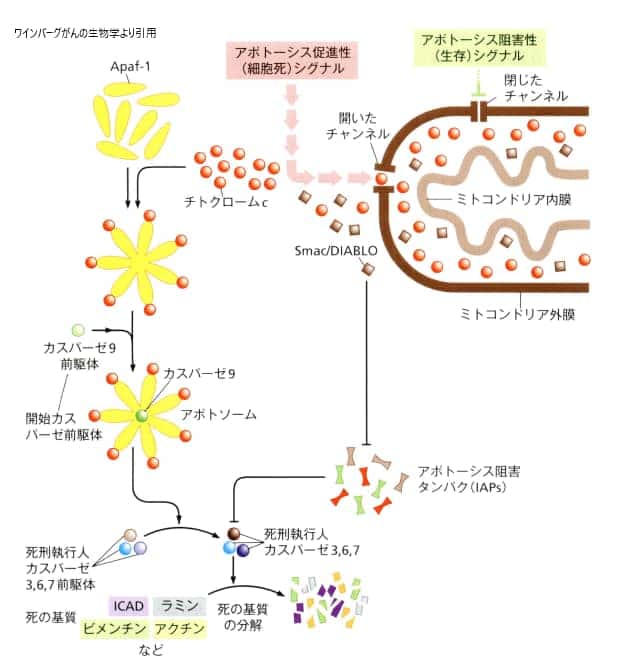
チトクロムは、酸化還元反応に関わる酵素で、ヘムに結合している鉄イオンがFe3+からFe2+に変化することにより、電子を運ぶ役割を担っています。ミトコンドリアは、グルコースと酸素を使ってATPを生成する重要な細胞内小器官で、生物学の授業で学んでいるかと思います。ミトコンドリアがチトクロムを細胞内に放出すると、その行動がアポトーシス(細胞のプログラムされた死)の連鎖反応の引き金になります。
ミトコンドリアの外膜は、細胞が生存するか死ぬかを決める上で重要な役割を果たしています。様々なアポトーシスを防ぐシグナルは、ミトコンドリア外膜上のチャンネルを閉じた状態に保つことで作用します。一方で、アポトーシスによる細胞死を促すシグナルは、これらのチャンネルを開放することで作用します。
ミトコンドリアの外膜から細胞質に放出される分子にはさまざまなものがありますが、中でもチトクロームc(赤い丸で示される)とSmac/DIABLO(褐色の四角形で示される)の分子は特に重要な役割を果たします。チトクロームcは、Apaf-1分子と結合して、7つのスポークを持つアポトソームを形成します。これは、アポトーシス(細胞のプログラムされた死)の過程において重要なステップの一つです。
Smac/DIABLOは、アポトーシスの過程において重要な役割を果たします。この分子はプロカスパーゼ9を引き寄せ、活性化させることで、活性化したカスパーゼ9(緑の丸で示される)を生成します。活性化したカスパーゼ9は次に、カスパーゼ3の前駆体(オレンジの丸で示される)を活性化します。これにより生じた活性化したカスパーゼ3は、一連の他のカスパーゼ前駆体(死刑執行人カスパーゼ)を活性化させ、アポトーシスの連鎖反応を引き起こします。いったん活性化されると、さまざまな「死のサブストラート」が分解され、その結果、細胞にアポトーシスの特徴的な表現型(この場合は、blebbingという現象)が現れます。通常、多くのアポトーシス阻害タンパク質がカスパーゼに結合し、それを不活化することによって、アポトーシスの進行を防いでいます。
3.アポソームの形成
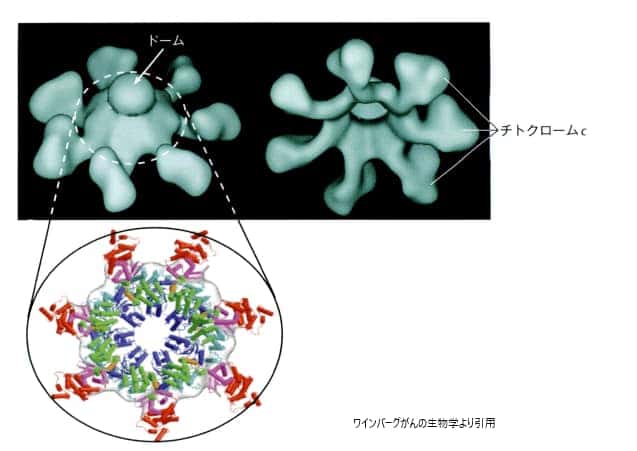
ミトコンドリアから細胞質に放出されたチトクロームc分子は、Apaf-1タンパク質と結合し、アポトソーム(apoptosome)を形成します。アポトソームは「死の車輪」とも呼ばれ、7本のスポークを持つ車輪のような構造をしています。この構造において、Apaf-1がスポークを形成し、チトクロームc分子がスポークの先端に位置します。アポトソームの組み立てが完了すると、カスパーゼ9の前駆体が車輪の中心(「ドーム」)に引き寄せられ、その場で活性化されたカスパーゼ9に変換されます。この過程は、細胞のアポトーシス、すなわちプログラムされた細胞死を引き起こす重要なステップの一つです。
カスパーゼ9は、システイン・アスパラギン酸特異的タンパク分解酵素cysteine aspartyl-specific proteaseのファミリーの一員で、ヒトゲノムにはこのファミリーに属するタンパク分解酵素をコードする遺伝子が11個マップされています。
4.p53によるアポトーシスの活性化
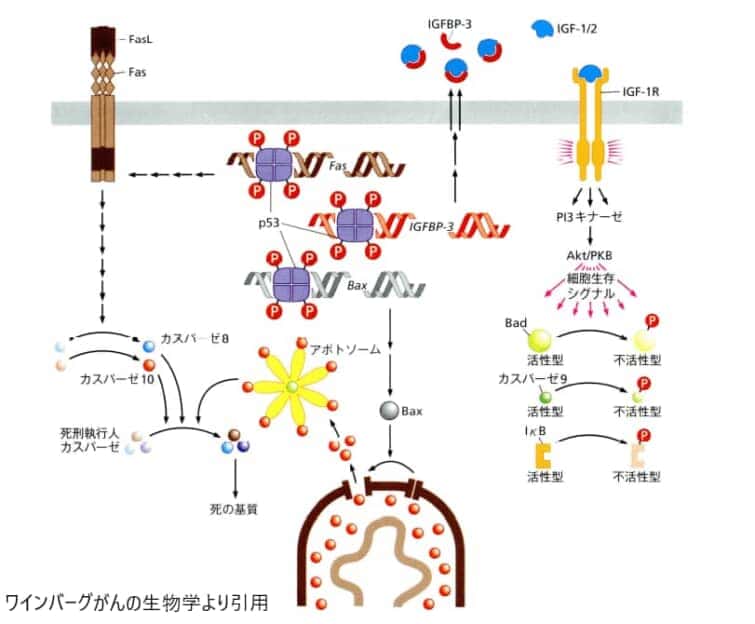
p53(タンパクの名前です)は、複数のシグナル伝達経路を通じてアポトーシス(細胞の自己破壊プログラム)を活性化します。図示されているように、p53は4つのサブユニットからなる四量体として機能し、リン酸化されることで活性化されます。
1.p53は、Fas受容体をコードする遺伝子の発現を促すことにより、その転写を活性化します。これにより、p53は細胞表面でのこの細胞死受容体の発現を増加させ、その結果、細胞は細胞外間隙に存在するあらゆるFasリガンド(FasL)に対して感受性を持つようになります。
2.p53はIGF結合タンパク3(IGFBP-3)の発現を促すことにより、このタンパクを細胞外間隙に放出させます。IGF結合タンパク3は、生存を促進しアポトーシス(細胞の自己破壊)を防ぐ作用を持つリガンドであるIGF-1やIGF-2と結合します。これにより、IGF-1やIGF-2がその受容体、すなわちIGF-1受容体(IGF-1R)に結合するのを阻害します。IGF結合タンパク3がない場合、IGF-1やIGF-2が受容体に結合してアポトーシスを抑制し、細胞死を防ぐことになります。
3.p53は、アポトーシス(細胞自己破壊)を促進するBcl-2関連タンパク質であるBaxの発現を促します。これにより、ミトコンドリアの外膜からチトクロムcが放出されるプロセスが促進されます。
4.p53は、Smac/DIABLOなどのアポトーシスを阻害するいくつかのタンパク質を不活化することで、アポトーシスを促進します。
発達過程におけるアポトーシス
●組織の形成: 生物が発達する過程で、アポトーシスは特定の細胞の除去を通じて正しい組織形態を形成するのに役立ちます。例えば、人間の手足の指の間の組織は、アポトーシスによって取り除かれ、個々の指が形成されます。
●神経系の発達: 脳の発達中には、適切な神経回路の形成のためにアポトーシスが使われます。不要な神経細胞がプログラムされた細胞死を通じて除去され、効率的な神経ネットワークが構築されます。
●免疫系の発達: 免疫系では、自己反応性のリンパ球(自分自身の体を攻撃する可能性がある細胞)がアポトーシスによって排除されます。これにより、自己に対する免疫反応のリスクが低減されます。
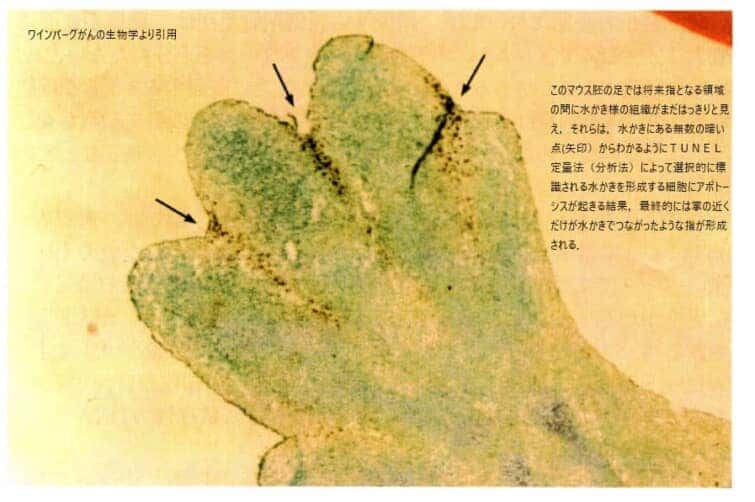
これはカエルの胚の手の発達過程についての説明です。手が形成される際、最初は指と指の間に細胞が存在し、その後これらの細胞がアポトーシス(計画的な細胞死)を経て死亡し、水かきを残しながら指が分離して形成されます。ヒトの胚発生においても同様の過程が見られ、このアポトーシスの過程が正常に行われない場合、指がくっついた状態で生まれることがあります。この現象は、指の形成におけるアポトーシスの重要性を示しています。
細胞の恒常性維持におけるアポトーシス
●異常細胞の除去: DNA損傷や発がん性変異を持つ細胞は、アポトーシスによって積極的に取り除かれます。これにより、がんの発生リスクが減少します。
●組織の更新: 皮膚細胞や腸の上皮細胞のように、定期的に更新が必要な組織では、古い細胞がアポトーシスを通じて定期的に除去され、新しい細胞に置き換えられます。
●病気の防御: ウイルスに感染した細胞は、しばしばアポトーシスを引き起こし、感染の拡大を防ぐことがあります。この自己犠牲により、感染の拡散を制限し、他の細胞への感染を防ぎます。
アポトーシスは、生物の健康と正常な機能を維持するために必要な、精密でバランスの取れたプロセスです。このプロセスの障害は、過剰な細胞死や不十分な細胞死につながり、それぞれ自己免疫疾患やがんなどの病気の原因となることがあります。
病気とアポトーシス
自己免疫疾患とがんにおけるアポトーシスについてもっと説明します。
### 自己免疫疾患でのアポトーシス
自己免疫疾患では、体の免疫系が正常な細胞や組織を異物と認識し攻撃します。この過程では、アポトーシスが異常に活性化されることがあります。正常には、アポトーシスは老化した細胞や損傷を受けた細胞を除去する健康なプロセスです。しかし、自己免疫疾患においては、このプロセスが過剰になり、必要な細胞までもが破壊されることがあります。例えば、関節リウマチでは、関節を構成する細胞がアポトーシスを起こし、炎症と組織の損傷を引き起こします。
### がんでのアポトーシス
がん細胞は、アポトーシスを避けることで無制限に増殖する能力を獲得します。正常な細胞の場合、DNAが損傷したり、細胞周期が異常であったりすると、アポトーシスが誘発され、細胞は自らを死滅させます。これは、損傷した細胞ががん化するのを防ぐための体の自然な防御機構です。しかし、がん細胞はこのメカニズムを回避する変異を獲得することがあり、その結果、死滅することなく成長し続けることができます。がん細胞がアポトーシスを回避するメカニズムには、特定の遺伝子の活性化や抑制、細胞死を制御するたんぱく質のバランスの変化などが含まれます。たとえば、p53遺伝子は細胞のDNA損傷を感知し、修復が不可能な場合にはアポトーシスを誘導する役割を担います。がん細胞では、このp53遺伝子がしばしば変異または失活しており、結果として細胞はアポトーシスに進まず、増殖し続けます。
このように、アポトーシスは生体内での細胞の生死を決定する重要なプロセスであり、自己免疫疾患やがんなどの疾患の発症と進行において中心的な役割を果たしています。これらの疾患におけるアポトーシスの異常は、新たな治療標的の開発につながる可能性があります。
アポトーシスとネクローシスの違い
細胞の死のメカニズム比較
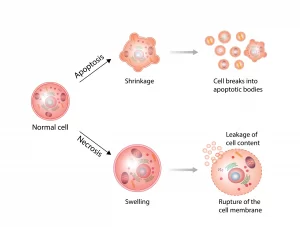
アポトーシスとネクローシスは、細胞の死に至る二つの主要なメカニズムであり、それぞれが異なる特徴と生物学的な役割を持っています。以下に、これらのメカニズムの比較を紹介します。
### アポトーシス:プログラムされた細胞死
– 定義と特徴: アポトーシスは、細胞が特定のシグナルに応答して自らを死滅させる、遺伝子によってプログラムされた過程です。このプロセスは、細胞の成長と発達の正常な部分であり、損傷した細胞や不要になった細胞を取り除くために必要です。
– メカニズム: アポトーシスでは、細胞は収縮し、核が凝縮され、細胞膜は intact(無傷) ですが、細胞表面に「食べる信号」とも呼ばれる特定の分子が現れ、免疫系の細胞による迅速な除去が促されます。
– 生物学的な役割: アポトーシスは、組織の形成、不要な細胞の除去、DNA損傷が修復不可能な細胞の除去など、健康な組織の維持に不可欠です。
### ネクローシス:偶発的細胞死
– 定義と特徴: ネクローシスは、細胞が外的な損傷やストレス、例えば毒素、感染、物理的損傷によって死に至る過程です。この過程は、細胞の破壊と炎症の引き金となります。
– メカニズム: ネクローシスでは、細胞膜が破裂し、細胞内容物が周囲の組織に放出されます。これにより、炎症反応が引き起こされ、時には周囲の健康な組織にも損傷を与えることがあります。
– 生物学的な役割: ネクローシスは主に損傷や病気の結果として起こりますが、特定の生物学的プロセス、例えば一部の免疫反応においても役割を果たすことがあります。
### 比較
– 制御性: アポトーシスは高度に制御されたプロセスであり、細胞のプログラムに基づいています。対照的に、ネクローシスは主に偶発的なイベントとして起こり、外的な損傷によるものです。
– 生物学的結果: アポトーシスは通常、炎症を引き起こさずに周囲の組織に細胞が除去されるため、体にとって有益なプロセスです。一方で、ネクローシスは細胞の内容物の漏洩により炎症を引き起こすことがあり、これがさらなる組織の損傷につながることがあります。
これらの違いは、疾患の治療や研究において重要です。例えば、がん治療ではアポトーシスの誘導が治療戦略の一つとなり得ますが、ネクローシスの誘発は望ましくない副作用を引き起こす可能性があります。
疾患における細胞死のタイプの重要性
疾患の治療において、細胞の死の種類を理解することは非常に重要です。アポトーシスとネクローシスを含む細胞死の異なるメカニズムは、治療の設計と実施に直接的な影響を与えます。以下に、この理解がどのように治療に影響を与えるかについて詳しく説明します。
### がん治療
がん細胞は、アポトーシスを回避する能力を獲得することで、無制限に増殖することが多いです。このため、多くのがん治療戦略は、がん細胞にアポトーシスを誘導することを目的としています。たとえば、化学療法や放射線療法は、がん細胞のDNAに損傷を与えることで、細胞が自己破壊するプロセスを誘発します。アポトーシスを効果的に誘導することは、正常な細胞に対する損傷を最小限に抑えつつ、がん細胞を除去する効果的な方法となり得ます。
### 自己免疫疾患
自己免疫疾患では、体の免疫系が正常な細胞を攻撃してしまうため、誤ったアポトーシスの誘導が問題となることがあります。このような状況では、アポトーシスを抑制する治療が有効な場合があります。例えば、特定の薬剤はアポトーシスのシグナル経路をブロックすることで、正常な細胞の過剰な死を防ぎます。
### 炎症性疾患
炎症性疾患では、ネクローシスによる細胞の死が慢性的な炎症を引き起こす原因となることがあります。この場合、細胞の死をコントロールすることで炎症を減少させる治療が目指されます。たとえば、ネクローシスを防ぐことで、細胞の内容物が周囲に漏れ出し、炎症反応を引き起こすのを防ぐことができます。
### 神経変性疾患
アルツハイマー病やパーキンソン病などの神経変性疾患では、神経細胞のプログラムされた死(アポトーシス)が病態の一部として関与しています。これらの疾患においては、アポトーシスを抑制することが神経細胞の保護と病態の進行の遅延につながる可能性があります。
### 結論
細胞死の種類を理解し、適切に管理することは、多くの疾患の治療において中心的な役割を果たします。アポトーシスやネクローシスなどのプロセスを調節することで、疾患の治療法を改善し、患者さんの予後を向上させることができます。これらのメカニズムの詳細な理解は、新しい治療戦略の開発に不可欠です。
細胞死のアポトーシスとネクローシス以外の形態
オートファジー autophagy
オートファジー(Autophagy)とは、細胞が自らの古い部分や不要になったタンパク質、オルガネラ(細胞の構成要素)を分解し、エネルギーや新たな細胞構成要素の材料として再利用する過程です。この自己食作用とも呼ばれるメカニズムは、細胞の健康維持やストレスに対する応答、さらには加齢や病気の進行に関わる重要な生物学的プロセスの一つです。オートファジーが適切に機能しないと、がんや神経変性疾患など、多くの健康問題につながる可能性があります。
エントーシス entosis
エントーシス(Entosis)は、一つの細胞が別の細胞に取り込まれる現象です。このプロセスは、特に上皮細胞(体を覆う表面や臓器の内側を覆う細胞)で観察されます。エントーシスによって取り込まれた細胞は、ホスト細胞内で生存したり、分解されてその成分が再利用されたりします。この現象は、細胞競合、組織の再構築、さらにはがんの進行など、多様な生物学的プロセスに関与していると考えられています。エントーシスは、細胞間相互作用や細胞の生存戦略を理解する上で興味深い研究対象となっています。
アポトーシス研究の最前線
新たなアポトーシス関連因子の発見
アポトーシス研究の最前線では、このプロセスを制御する新たな因子の発見や、アポトーシスが関与する病態の理解が深まりつつあります。最近の研究動向には、以下のような重要な進展があります。
### 新たなアポトーシス調節因子の同定
アポトーシスのプロセスは、様々なシグナル伝達経路や分子によって細かく調節されています。最新の研究では、これまで知られていなかった新しいアポトーシス調節因子が次々と同定されています。これらには、特定のタンパク質、小分子、非コーディングRNAなどが含まれ、それぞれがアポトーシスの異なる段階を制御しています。これらの因子の発見は、アポトーシスのより詳細なメカニズムの理解を深めるとともに、新しい治療標的の同定につながります。
### アポトーシスと疾患の関連性
アポトーシスは、がん、自己免疫疾患、神経変性疾患など、多くの疾患の発症と進行に深く関わっています。最新の研究では、これらの疾患におけるアポトーシスの特異的な役割や、疾患の特定段階でのアポトーシスの変化についての新たな知見が報告されています。これらの研究は、疾患特異的な治療戦略の開発に不可欠な情報を提供します。
### アポトーシスの薬剤誘導
アポトーシスを誘導または抑制する薬剤の開発は、特にがん治療において活発な研究分野です。最近では、特定のアポトーシス調節因子を標的とする小分子薬剤や、アポトーシス経路を特異的に活性化するペプチドなど、新しいクラスの治療薬が開発されています。これらの薬剤は、アポトーシスのプロセスを精密に操作することで、疾患細胞の選択的な死滅を促し、正常細胞への影響を最小限に抑えることを目指しています。
### 技術の進歩とアポトーシス研究
CRISPR-Cas9などのゲノム編集技術や、次世代シークエンシング、単一細胞解析技術の進歓迎は、アポトーシス研究における新たな可能性を開いています。これらの技術により、アポトーシス関連因子の機能解析、遺伝的変異の同定、細胞内でのアポトーシス調節ネットワークのマッピングがこれまでにない精度で可能になっています。
これらの進展は、アポトーシス研究を大きく前進させ、疾患の新しい治療法の開発への道を開いています。今後も、アポトーシスの複雑なネットワークを解き明かし、人間の健康に貢献するための基礎研究が重要となります。
アポトーシスを利用した治療技術
アポトーシス、つまりプログラムされた細胞死を利用した治療技術は、特にがんを含む多様な疾患の管理と治療に革命をもたらしています。アポトーシスを誘導または抑制することにより、治療の効果を高める新しいアプローチが開発されています。以下に、病気の治療におけるアポトーシスの応用例をいくつか紹介します。
1. がん治療
アポトーシス誘導剤: がん細胞を特異的に死滅させるために、アポトーシスを誘導する薬剤が研究されています。これらの薬剤は、がん細胞内の特定のシグナル伝達経路を標的とし、正常細胞には最小限の影響を与えるよう設計されています。例えば、Bcl-2ファミリーのタンパク質を標的とする薬剤は、がん細胞のアポトーシス抵抗性を低下させ、細胞の自滅を促します。
免疫療法: 一部の免疫療法は、がん細胞に対する免疫細胞の攻撃を強化し、結果としてがん細胞のアポトーシスを誘導します。例えば、チェックポイント阻害薬は、免疫系ががん細胞をより効果的に認識し、攻撃するのを助けます。
2. 自己免疫疾患
アポトーシスの抑制: 自己免疫疾患の治療においては、誤った細胞のアポトーシスを抑制することが有効な戦略となる場合があります。例えば、細胞の死を抑制することで、自己反応性T細胞の過剰な活性化と炎症反応を減少させることができます。
3. 神経変性疾患
神経保護戦略: アルツハイマー病やパーキンソン病などの神経変性疾患では、神経細胞のアポトーシスが病態の進行に関与しています。これらの疾患に対する治療戦略の一つとして、神経細胞のアポトーシスを抑制し、細胞死を遅らせることが考えられます。これにより、神経機能の喪失を遅らせ、症状の進行を緩和することが可能になります。
4. 心血管疾患
心筋細胞の保護: 心筋梗塞後の心筋細胞のアポトーシスは、心機能の損失に大きく寄与します。アポトーシスを抑制する介入により、心筋細胞を保護し、心機能の回復を促進する新しい治療法が研究されています。
これらの応用例は、アポトーシスの理解がいかに疾患治療において重要であるかを示しています。アポトーシスを標的とした治療法の開発は、多くの疾患に対してより効果的で副作用の少ない治療オプションを提供する可能性を秘めています。
アポトーシスと治療
アポトーシスを誘発する薬物
アポトーシスを誘発する薬物は、特にがん治療を含む多くの疾患の管理において、重要な役割を果たしています。これらの薬物は、病気の細胞を特定し、プログラムされた細胞死を誘発することで、病気の進行を遅らせたり、治療の成果を高めたりすることが期待されています。以下に、疾患治療における薬物の活用例を紹介します。
1. がん治療におけるアポトーシス誘発薬
がん細胞は、しばしばアポトーシスのプロセスを回避する能力を獲得し、制御不能な増殖をします。アポトーシスを誘発する薬物は、この回避メカニズムを標的とし、がん細胞を選択的に死滅させます。
Bcl-2阻害剤: Bcl-2は、細胞の生存を促進するタンパク質であり、がん細胞ではしばしば過剰に発現しています。Bcl-2阻害剤は、このタンパク質の機能をブロックし、がん細胞のアポトーシスを促進します。
TRAIL受容体アゴニスト: TRAILは、アポトーシスを誘発するための自然なシグナル分子です。TRAIL受容体アゴニストは、がん細胞上のTRAIL受容体を活性化し、細胞死を誘導します。
2. 自己免疫疾患におけるアポトーシス調節薬
自己免疫疾患では、誤った細胞のアポトーシスが炎症と組織損傷を引き起こすことがあります。この場合、アポトーシスの過程を調節する薬物が治療に利用されることがあります。
シグナル伝達調節薬: 細胞死を調節するシグナル経路を標的とすることで、誤ったアポトーシスを抑制し、炎症を軽減する薬物が開発されています。
3. 神経変性疾患における保護戦略
神経変性疾患では、神経細胞の過剰なアポトーシスが問題となります。これらの疾患においては、アポトーシスを抑制することで、神経細胞の生存を延長し、症状の進行を遅らせる戦略が研究されています。
アポトーシスを誘発または抑制する薬物の開発は、疾患の根本的なメカニズムを標的とすることで、より効果的な治療法を提供する可能性を秘めています。しかし、これらの薬物の効果や安全性については、引き続き綿密な研究が必要です。アポトーシスに関連する新しい薬物の発見とその臨床応用は、今後も疾患治療における重要な進展となるでしょう。
アポトーシスの抑制と疾患管理
アポトーシスの抑制は、特定の疾患において治療戦略として重要な役割を果たします。アポトーシス、つまりプログラムされた細胞死が過剰に起こる疾患では、この自然なプロセスを適切に抑制することで、病態の進行を遅らせることが期待されます。以下に、アポトーシス抑制による疾患の進行管理についての例を挙げます。
●神経変性疾患
神経変性疾患、例えばアルツハイマー病やパーキンソン病では、特定の神経細胞がアポトーシスによって死亡し、これが症状の原因となっています。これらの疾患においてアポトーシスを抑制する治療法は、神経細胞の死を減少させ、患者の神経機能の維持や改善を目指します。アポトーシスを抑制するアプローチには、特定のシグナル伝達経路を標的とする薬剤や、細胞死に関与する遺伝子の発現を調節する方法が含まれます。
●心血管疾患
心筋梗塞や心不全などの心血管疾患では、心筋細胞の死が心機能の低下を引き起こします。アポトーシス抑制による治療は、心筋細胞の生存率を高め、心機能を保護することを目的としています。研究により、心筋梗塞後の心筋細胞のアポトーシスを抑制することで、心筋の損傷を軽減し、心機能の回復を促進する可能性が示されています。
●自己免疫疾患
自己免疫疾患においては、体の免疫系が誤って自身の細胞や組織を攻撃し、これがアポトーシスを誘発します。このような疾患におけるアポトーシスの抑制は、炎症反応を減少させ、組織損傷を最小限に抑えることを目的とします。例えば、特定の薬剤が細胞死のシグナルをブロックし、炎症と組織の破壊を抑制することで、疾患の進行を遅らせる効果が期待されます。
●アポトーシス抑制のリスク
アポトーシスは、がん細胞の除去や損傷した細胞のクリアなど、体にとって重要な役割を果たしています。そのため、アポトーシスを抑制する治療法は、正常な細胞死のバランスを乱すリスクを伴います。例えば、アポトーシス抑制が過度になると、異常細胞が体内に蓄積し、がんを含む他の健康問題を引き起こす可能性があります。したがって、アポトーシスを標的とした治療は、慎重に設計され、適切な患者に対してのみ使用されるべきです。
アポトーシス抑制による疾患の進行管理は、特定の疾患において有効な治療選択肢を提供しますが、その応用には細心の注意が必要です。継続的な研究により、より安全で効果的な治療法の開発が進められています。
まとめ
アポトーシス、すなわちプログラムされた細胞死の理解は、生物学と医学の両分野において極めて重要です。このプロセスは、健康な生体の発達、維持、そして病気の状態における細胞の振る舞いを理解する上で中心的な役割を果たしています。以下に、アポトーシスの重要性と、研究の今後の方向性についてまとめます。
●アポトーシスの重要性
生体の発達と維持: アポトーシスは正常な組織の発達、不要な細胞の除去、損傷した細胞のクリアなど、生体の健康を維持するために不可欠です。
疾患の理解: がん、自己免疫疾患、神経変性疾患など、多くの疾患ではアポトーシスの異常が関与しています。アポトーシスの過程を理解することは、これらの疾患の原因を解明し、新たな治療法を開発するために必要です。
治療戦略の開発: アポトーシスを誘発または抑制する治療法は、特定の疾患に対する有効な治療選択肢を提供します。この理解は、治療の精度を高め、副作用を最小限に抑えることを可能にします。
●研究の今後の方向性と期待
新規アポトーシス調節因子の同定: 継続的な研究により、アポトーシスプロセスに関与する新たな因子や経路が明らかになることが期待されます。これは、治療標的の発見に直結します。
疾患特異的なアプローチの開発: 疾患の種類や段階に応じてアポトーシスを調節する方法の開発が期待されます。これにより、治療の効果を高めるとともに、不必要な副作用を避けることができます。
治療薬の精密化: アポトーシスを標的とした治療薬の精密化により、より効果的で安全な治療法の提供が期待されます。また、既存の治療との組み合わせによる相乗効果の探求も進められます。
個別化医療への貢献: 個々の患者の遺伝的背景や疾患の特性に基づく、カスタマイズされたアポトーシス関連治療の開発が期待されます。
アポトーシスに関する深い理解は、生物学的プロセスの本質を解明し、医学の分野における治療の革新に不可欠です。今後の研究により、さらなる知見の獲得と治療法の進化が期待されます。






