目次
MLPA法(Multiplex Ligation-dependent Probe Amplification)は、遺伝子のコピー数変動(CNVs)を検出するための高度に特異的かつ感度の高い分子生物学的技術です。この技術は、特定のDNA配列に対して設計されたプローブを使用して、DNAサンプル内の遺伝子コピー数の増加や減少を検出することにより、遺伝子レベルでの変異を明らかにします。MLPA法は、少量のDNAサンプルから多数の遺伝子を同時に検査できるため、遺伝性疾患、腫瘍、および染色体異常の診断において重要なツールとなっています。
この技術の原理は、DNA断片に特異的なプローブをハイブリダイズさせ、その後、ライゲーション反応によってプローブを連結させることに基づいています。連結されたプローブはPCR増幅によって特定され、遺伝子のコピー数を定量化します。この方法により、標的となる遺伝子領域の微細なコピー数変動も検出することが可能になります。
MLPA法は疾患診断に革命をもたらしています。遺伝性が疑われる多くの疾患、例えば遺伝性がん症候群や遺伝性聴覚障害などにおいて、原因遺伝子のコピー数変動が重要な役割を果たしていることが多いです。MLPA法によって、これらの変動を迅速かつ正確に検出し、個々の患者に対する正確な診断、適切な治療選択、家族計画の指導などが可能になります。
この記事では、MLPA法の基礎原理、その実施方法、そしてこの技術がどのようにして疾患診断に革命をもたらしているかについて詳しく説明します。読者は、MLPA法の技術的詳細、臨床応用の範囲、そしてこの方法が将来の医療にどのような影響を与えうるかについての洞察を得ることができます。また、この技術の利点と限界についても議論し、MLPA法が今後どのように発展していく可能性があるかについての展望を提供します。読者は、遺伝学、分子生物学、および臨床診断の分野における最新の進歩を理解することができるでしょう。
第1章: MLPA法の基礎知識
MLPA法の原理
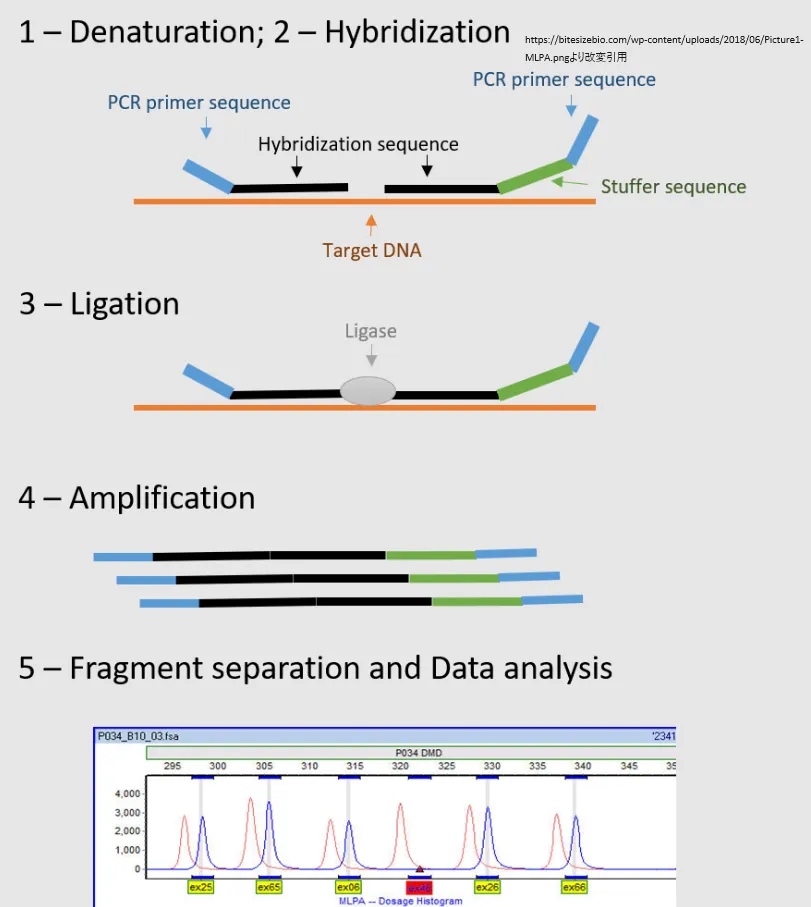
MLPA(Multiplex Ligation-dependent Probe Amplification)法は、DNAのコピー数変異(CNV: Copy Number Variations)を検出するための分子生物学的技術です。この方法は、特定のDNA領域のコピー数を正確に測定することができ、遺伝性疾患、がん、その他の遺伝子異常の研究や診断に広く用いられています。MLPA法の原理と検出プロセスは以下のステップで構成されます。
1. DNAテンプレートの準備
サンプルから抽出したDNAをテンプレートとして使用します。このDNA上で、特定の領域を標的とするプローブが用いられます。
2. プローブの混合とハイブリダイゼーション
MLPAプローブは、2つのオリゴヌクレオチド(短いDNA断片)から構成され、それぞれが標的DNA領域の隣接する部分に特異的に結合します。プローブは標的DNAにハイブリダイゼーション(対合)するように設計されています。
3. ライゲーション
ハイブリダイゼーション後、2つのオリゴヌクレオチドが隣接している場合に限り、ライゲーション酵素によってこれらが連結されます。このライゲーション反応は、標的DNA領域の存在と正確な位置を確認するために不可欠です。
4. PCR増幅
連結されたプローブは、PCR(ポリメラーゼ連鎖反応)によって特異的に増幅されます。各プローブは異なる長さのPCR産物を生成するため、後の分析で個々のプローブを区別することが可能になります。
5. 分析
PCR産物は、キャピラリー電気泳動などの方法でサイズに基づいて分離され、フルオレセンスラベルによって検出されます。プローブごとのピーク領域(または強度)は、特定のDNA領域のコピー数に対応します。正常なコピー数の場合と比較して、ピークの強度が増加または減少している場合、それはコピー数の増加(増幅)または減少(欠失)を示しています。
MLPA法はその高感度と特異性により、少量のサンプルからも正確なコピー数変異の検出を可能にします。この技術は遺伝子の欠失や重複の検出に特に有効で、遺伝性疾患の診断、がん遺伝子のスクリーニング、遺伝子発現の研究など、幅広い応用があります。
キットとアプリケーション
MLPA(多重リガーゼプローブ増幅)は、DNAのコピー数変動(CNV)を検出するための技術であり、特定の遺伝子の欠失や重複を調べることができます。この技術は、特定の遺伝性疾患、がん、その他の病態の診断に有用です。市販されているMLPAキットは、特定の遺伝子や遺伝子領域を対象としており、さまざまな疾患の検出に利用されます。
ここでは、いくつかの一般的なMLPAキットと、それらが対象とする疾患の例を挙げます。詳細なリストや最新の情報を得るためには、キットを提供している企業のウェブサイトを参照することが推奨されます。
1. SALSA MLPA Kits(MRC-Holland)
遺伝性乳がん・卵巣がんキット: BRCA1、BRCA2遺伝子のコピー数変動を検出。
遺伝性大腸がんキット: MLH1、MSH2、MSH6、PMS2、EPCAM遺伝子のコピー数変動を検出。
神経発達障害キット: 自閉症スペクトラム障害や知的障害に関連する遺伝子のコピー数変動を検出。
先天性聴覚障害キット: GJB2遺伝子(コネキシン26)の変異や他の聴覚障害関連遺伝子のコピー数変動を検出。
2. Prenatal MLPA Kits
胎児染色体異常スクリーニングキット: ダウン症候群(21トリソミー)、エドワーズ症候群(18トリソミー)、パトー症候群(13トリソミー)などの染色体異常を検出。
3. Tumor MLPA Kits
がん遺伝子パネルキット: 特定のがん関連遺伝子(例:HER2、EGFR)のコピー数変動を検出して、がんの診断や治療選択に役立てる。
4. Custom MLPA Kits
カスタムデザインキット: 特定の研究プロジェクトや診断目的に合わせて、任意の遺伝子領域のコピー数変動を検出するためにカスタマイズされたキット。
これらのキットは、遺伝子のコピー数変動が疾患の原因や重要な要因となる様々な状態の診断に有用です。MLPA技術を利用することで、迅速かつ正確に遺伝子の異常を検出し、適切な治療法の選択やリスク評価に役立てることができます。
遺伝性疾患の検出
遺伝性疾患、特に筋ジストロフィーなどの病態において、MLPA法(Multiplex Ligation-dependent Probe Amplification)は顕著な利点と実績を持っています。このセクションでは、筋ジストロフィーを含む遺伝性疾患の検出におけるMLPA法の重要性、利点、およびその実績について解説します。
●MLPA法の重要性
遺伝性疾患は、一つまたは複数の遺伝子の変異によって引き起こされる病態であり、これらの変異は遺伝子のコピー数の変動(CNVs)を伴うことがあります。筋ジストロフィーのような疾患では、特定の遺伝子領域の削除や重複が病気の原因となることがよくあります。MLPA法はこれらのコピー数変動を特定し、定量化することができるため、遺伝性疾患の診断に非常に有効です。
●MLPA法の利点
高感度と特異性: MLPA法は非常に高い感度と特異性を持ち、微量のDNAからも正確なコピー数変動を検出できます。
多重検出能力: 多数の遺伝子領域を同時に検査できるため、一度の実験で複数の潜在的な変異をスクリーニングすることが可能です。
迅速な結果取得: MLPA法は迅速に結果を提供でき、診断プロセスを加速します。
少量のサンプルでの実施: 比較的少量のDNAサンプルで実施できるため、サンプルの取得が難しい場合でも適用可能です。
●MLPA法の実績
筋ジストロフィー、特にデュシェンヌ型筋ジストロフィー(DMD)の診断において、MLPA法はDMD遺伝子の大規模な削除や重複を検出する主要な手段となっています。この手法は、DMD遺伝子における変異の約65-70%を占める大規模な削除を検出するために広く使用されており、診断の確実性を高める上で不可欠です。また、DMD遺伝子の重複検出にも有効で、これらの変異を持つ患者の早期発見と適切な治療選択に貢献しています。
●結論
MLPA法は遺伝性疾患の診断、特に筋ジストロフィーのような病態において、その高い感度と特異性、多重検出能力、迅速な結果取得の能力により、重要な役割を果たしています。この技術は、遺伝性疾患の早期発見、診断の精度向上、および適切な治療方針の決定に貢献しており、将来的にはさらに多くの遺伝性疾患の研究と診断に役立つことが期待されます。
第2章: MLPAの実施プロトコル
フローチャートとプロトコル
MLPA(Multiplex Ligation-dependent Probe Amplification)実施におけるステップバイステップガイドとフローチャートを提供します。このガイドは、MLPAプロセスを効率的に進めるための基本的な手順を示しています。ただし、特定のキットやプロトコルによっては、細かい手順に違いがあることを留意してください。
MLPA実施フローチャート
●サンプル準備
DNA抽出: 対象となるサンプルからDNAを抽出します。
●DNA定量
DNAの量を測定し、適切な濃度に調整します。
●プローブハイブリダイゼーション
特定のMLPAプローブと標的DNAを混合し、プローブが標的配列に特異的にハイブリダイズするようにインキュベートします。
●ライゲーション
ハイブリダイズしたプローブのオリゴヌクレオチドをライゲーション酵素を用いて連結します。
●PCR増幅
連結されたプローブを特定のプライマーでPCRにより増幅します。プライマーはフルオレセンスマーカーでラベル付けされていることが多いです。
●電気泳動とデータ分析
PCR産物を電気泳動によりサイズ別に分離し、フルオレセンスディテクターを用いて検出します。
各プローブに対応するピークの強度を分析し、コピー数変異を検出します。
●結果解釈
得られたデータを正常なコントロールサンプルと比較して、コピー数の増減を評価します。
●注意点
MLPA実施には、専用のキットと詳細なプロトコルが必要です。キットの指示に従うことが重要です。
データの解釈には専門的な知識が必要となります。特に、検出された変異が疾患の原因となるかどうかの評価は慎重に行う必要があります。
このフローチャートはMLPA実施の一般的な手順を示していますが、使用するキットや特定の研究目的に応じて、詳細なステップには多少の変更が生じる場合があります。正確な手順については、使用するMLPAキットの製造元が提供するプロトコルを参照してください。
サポートとサービス
MLPA(多重リガーゼプローブ増幅)技術を実施する際には、複数の企業や機関から提供されるサポートサービスや訪問支援サービスを利用することが可能です。これらのサービスは、MLPA実験の計画から実施、結果の解析まで、幅広いサポートを提供し、研究者や診断専門家が正確で信頼性の高いデータを得られるよう支援します。
1. 技術サポートサービス
製品関連の問い合わせ: キットの選択、実験プロトコル、サンプルの準備に関する相談。
実験トラブルシューティング: 実験中に遭遇した問題の解決策提供。
データ解析支援: MLPA結果の解釈に関するガイダンスや専門的アドバイス。
2. 訪問支援サービス
オンサイトトレーニング: 研究所や施設を訪問して、MLPA技術の実施方法や最適な実験設計についてのトレーニングを行う。
実験室設定の最適化: 実験室の設備や実験プロセスの確認、効率化のための提案。
カスタムプロジェクトサポート: 特定の研究目的や診断テスト開発に合わせたカスタマイズされたサポート。
3. オンラインリソースとツール
ウェブセミナーとオンライントレーニング: MLPA技術やデータ解析方法に関するオンライン講座やセミナー。
FAQと知識ベース: よくある質問や実験のヒントが掲載されたオンラインリソース。
ソフトウェアとデータ解析ツール: MLPAデータの解析を支援する専用ソフトウェアやオンラインツール。
これらのサービスを提供する企業や機関には、MRC-Holland(SALSA MLPAキットの製造元)、Agilent Technologies、Thermo Fisher Scientificなどがあります。サポートやサービスの詳細については、各企業のウェブサイトを訪れるか、直接問い合わせることで、最新の情報や具体的なサービス内容を確認できます。また、MLPAを利用している地域の学術機関や研究所からもサポートを受けられる場合がありますので、地元のネットワークを活用するのも一つの方法です。
第3章: MLPA法の応用
デュシェンヌ型とベッカー型筋ジストロフィー
デュシェンヌ型筋ジストロフィー(DMD)とベッカー型筋ジストロフィー(BMD)は、ともにX連鎖遺伝子であるDMD遺伝子の変異によって引き起こされる筋肉障害です。これらの疾患は、遺伝子の異なる部分に生じる変異の種類や範囲によって区別されます。DMDはより重篤な形態であり、早期に進行するのに対し、BMDは比較的軽度で進行が遅いのが特徴です。MLPA法は、DMD遺伝子の大規模な削除や重複といったコピー数変動(CNVs)を検出するための重要なツールとして、これらの疾患の診断に広く利用されています。
MLPA法の適用例
●デュシェンヌ型筋ジストロフィー(DMD)
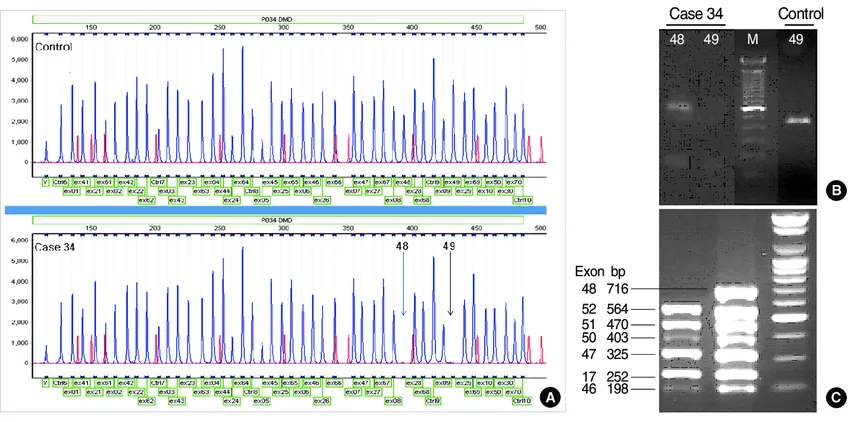
大規模削除の検出: DMD患者の約65%は、DMD遺伝子の一部が欠失していることにより病気が引き起こされます。MLPA法は、これらの大規模な削除を特定し、疾患の特定の変異タイプを確認するのに有効です。
診断の確定: MLPA法による検出は、DMDの臨床症状を持つ患者において、遺伝的診断を確定するための重要な手段です。
DMD症例の多重ライゲーション依存プローブ増幅法(MLPA)、右側は従来の多重PCR、二重プライミングオリゴヌクレオチド(DPO)多重PCR。(A)MLPAにおけるDMD遺伝子のエクソン48と49の欠失(矢印)。(B)レーン2におけるエクソン49の欠失と、コンベンショナル・マルチプレックスPCRのレーン1におけるエクソン48のバンドの存在。(C)グループ3のDPOマルチプレックスPCRにおけるエクソン48の欠失。Mは100bpサイズのマーカー。
●ベッカー型筋ジストロフィー(BMD)
大規模重複の検出: BMD患者の中には、DMD遺伝子の一部が重複していることにより病気が引き起こされるケースがあります。MLPA法は、このような重複を特定するのにも有効であり、BMDの診断に役立ちます。
変異の範囲の特定: MLPA法を使用することで、変異がDMD遺伝子のどの部分に影響しているかを特定でき、これがDMDとBMDの区別に役立ちます。
●MLPA法の特徴
高い感度と特異性: MLPA法は、DMD遺伝子における大規模な削除や重複を高い感度と特異性で検出します。
非侵襲的なサンプル収集: 血液サンプルからDNAを抽出して分析するため、患者にとって非侵襲的です。
迅速な結果取得: 比較的短期間で分析が完了し、迅速な診断に寄与します。
MLPA法はDMDとBMDの診断において重要な役割を果たしており、正確な遺伝的診断によって患者とその家族へのカウンセリングや遺伝子治療への適格性評価など、個別化された医療提供の基盤を築いています。
最新情報と研究動向
最新のMLPA法に関する研究では、特に出生前診断や慢性リンパ性白血病(CLL)の検出において、この技術の有用性が強調されています。
一つの研究では、MLPAを用いて常染色体異常、特にトリソミー13、18、21などの出生前診断に成功しています。この技術は、高リスク妊娠における最も一般的な出生前染色体異常を迅速かつ経済的に検出するために利用されています。MLPAは、標準的なFISH技術やカリオタイピングに代わる迅速な出生前診断法として信頼性があり、100%の感度と特異性を持つと報告されています。この研究では、特に出生前診断におけるMLPAの利点として、その多用途性、高度な自動化、迅速な処理時間、高スループットテストの適性、コスト効率の良さが強調されています。
別の研究では、MLPAを慢性リンパ性白血病(CLL)の患者における染色体異常の包括的な分子細胞遺伝学的ツールとして評価しました。この研究では、MLPAとFISH技術を用いた比較から、MLPAがCLLにおける臨床的に関連する染色体異常を検出するための単独のスクリーニングプラットフォームとしての利用の有効性を検証しています。MLPAは、ほとんどの場合でFISH結果と一致しており、特に13q14の削除やトリソミー12など、CLLの一般的な異常を検出する能力を示しています。しかし、低レベルのモザイク症例ではMLPAによる異常の検出が難しい場合があることも指摘されています。
これらの研究結果から、MLPAは出生前診断や特定の癌の検出において非常に有用なツールであることが示されています。特に、迅速な結果取得が求められる場合や、高スループットでの検査が必要な場合において、MLPAは信頼性高く経済的な選択肢を提供します。また、CLLなどの特定の病態における遺伝子異常の検出にも効果的であることが示されており、今後の研究や臨床応用においてさらなる発展が期待されます。
第4章: MLPA法の実践
ケーススタディ
MLPA(多重リガーゼプローブ増幅)法は、特定の遺伝子のコピー数変動(CNV)を検出するために用いられ、遺伝性疾患、がん、およびその他の条件の診断に有用です。以下に、MLPA法を用いた疾患診断の実際のケーススタディを紹介します。
ケーススタディ1: 遺伝性乳がんと卵巣がん
状況:遺伝性乳がんおよび卵巣がんは、BRCA1とBRCA2遺伝子の変異によって引き起こされることが知られています。この症例では、家族歴に乳がんおよび卵巣がんが多数存在する患者が、遺伝性がんのリスク評価のために遺伝カウンセリングを受けました。BRCA1/2遺伝子の病的変異には、シークエンス法では検出されないエクソン単位の大欠失が5%程度あるため、MLPA法を併用する必要があります。
方法:患者から採取したDNAサンプルを用いて、BRCA1およびBRCA2遺伝子のコピー数変動を検出するためにMLPA法が実施されました。
結果:MLPA分析により、BRCA1遺伝子において、特定の領域の欠失が確認されました。この結果は、患者が遺伝性乳がんおよび卵巣がんのリスクが高いことを示しています。
影響
この情報をもとに、患者は定期的なスクリーニングや予防的手術の選択肢についての情報を提供されました。また、家族成員も同様の遺伝子検査を受けることが推奨され、遺伝的リスクの管理に役立てられました。
ケーススタディ2: 先天性聴覚障害
状況
先天性聴覚障害は、GJB2遺伝子(コネキシン26)の変異によって引き起こされることがあります。このケースでは、新生児聴覚スクリーニングで異常が見つかった乳幼児に対して、遺伝的検査が行われました。
方法
乳幼児から採取したDNAサンプルに対して、GJB2遺伝子のコピー数変動と変異を検出するためにMLPA法とシーケンシングが実施されました。
結果
MLPAにより、GJB2遺伝子においてコピー数の異常が検出され、追加のシーケンシング分析で特定の変異が確認されました。
影響
この診断情報は、聴覚障害の原因を特定するのに役立ち、適切な早期介入プログラムや治療戦略の策定に繋がりました。また、家族への遺伝カウンセリングにより、将来の子供におけるリスクの評価が可能となりました。
これらのケーススタディは、MLPA法が遺伝性疾患の診断においていかに重要な役割を果たしているかを示しています。この技術により、患者やその家族に対して、より適切な医療介入や管理戦略を提供することが可能になります。
第5章: あなたのためのMLPAリソース
SNSとの連携
MLPA(多重リガーゼプローブ増幅)技術に関する情報を共有し、交流するためのSNSプラットフォームやコミュニティは、研究者、診断専門家、および関心を持つ一般の人々にとって貴重なリソースとなります。これらのプラットフォームでは、最新の研究成果、技術のアップデート、実験のトラブルシューティング、キャリア機会など多岐にわたる情報が共有されます。以下に、MLPAに関連する情報を共有するための主要なSNSプラットフォームとコミュニティを紹介します。
1. LinkedIn
専門家グループ: LinkedInには、遺伝学、分子生物学、診断技術に関する多数の専門家グループが存在します。これらのグループでは、MLPA技術に関する最新の研究論文、セミナーの案内、ディスカッションが行われています。
企業ページ: MLPAキットを提供する企業(例:MRC-Hollandなど)のページでは、製品のアップデート、ワークショップ、トレーニングセッションの情報が共有されます。
2. ResearchGate
研究者コミュニティ: ResearchGateは、研究者が自身の研究成果を共有し、他の研究者と交流するためのプラットフォームです。MLPAに関する最新の研究論文やプレプリントが共有され、技術的な質問やアドバイスを求めるディスカッションが活発に行われています。
3. Twitter
科学コミュニケーション: Twitterでは、ハッシュタグ(例:#MLPA、#Geneticsなど)を使って、MLPAに関連する情報がリアルタイムで共有されます。研究者、学会、出版社が最新の研究成果やニュースをツイートし、広範なオーディエンスと交流しています。
4. Facebook
コミュニティグループ: Facebookには、遺伝学や分子生物学に関心を持つ人々のためのグループが多数存在します。これらのグループでは、MLPAを含む診断技術に関する情報交換、経験談の共有、質問の投稿が行われています。
5. YouTube
教育チャンネル: YouTubeには、MLPA技術の基礎から応用までを解説する教育チャンネルやビデオがあります。実験の手順、データ解析の方法、ケーススタディの紹介など、視覚的に学びたい人にとって貴重なリソースです。
これらのSNSプラットフォームやコミュニティを利用することで、MLPAに関する最新の情報を得ることができ、世界中の専門家や同僚とのネットワーキングが可能になります。また、自身の研究成果を共有し、フィードバックを得る場としても活用できます。
オンラインリソース
MLPA(Multiplex Ligation-dependent Probe Amplification)技術に関心がある方向けに、研究や診断作業での使用をサポートするためのオンラインリソースがいくつかあります。
MRC Holland サポートセンターでは、MLPAに関する包括的な教育リソースを提供しています。これには、eラーニングモジュール、指導ビデオ、バーチャルワークショップやウェビナーに関する情報が含まれます。MLPAの仕組みの基礎から実験の実施、Coffalyser.Netを使用したデータ分析まで、学ぶべき内容を体系的に学べる素晴らしい出発点です。これらは、MLPAを始めたばかりの人から、既存の知識を深めたい経験者まで、幅広いユーザーに役立つリソースです 。
MRC Hollandのメインウェブサイトでは、MLPA技術、その応用、およびさまざまな研究や診断目的に利用可能な製品についての詳細情報を提供しています。このサイトでは、遺伝子コピー数変異を検出するMLPAの多様性や、遺伝性疾患や腫瘍の研究におけるその有用性も強調されています。デジタルMLPA、メルトアッセイ、MLPAデータ分析をサポートするソフトウェアツールに関する追加リソースも含まれています。
これらのリソースは、MLPA実験の全プロセスを通じてユーザーを導くように設計されており、基本原理の理解から実験室での実践的な実行、データ分析に至るまで、MLPA実験の成功を支援するための貴重な洞察とサポートを提供します。MLPAを新たに学びたい方でも、既にある程度知識がある方でも、これらのプラットフォームはあなたのMLPA実験の成功を支えるための有益な情報とサポートを提供します。
第6章:MLPAでわかること、わからないこと
MLPA法(Multiplex Ligation-dependent Probe Amplification)は、遺伝子のコピー数変動(CNVs)を検出するための強力なツールですが、この技術には明確な能力と限界があります。以下に、MLPAでわかることとわからないことを詳細に説明します。
MLPAでわかること
コピー数変動(CNVs)の検出: MLPAは、遺伝子の特定領域のコピー数が正常よりも増加しているか、または減少しているかを検出することができます。これには、遺伝子の大規模な削除や重複が含まれます。
特定遺伝子の異常の定量化: MLPAにより、検出された遺伝子の異常の程度(コピー数の具体的な変化)を定量化することが可能です。
複数遺伝子の同時分析: この技術は、一度に複数の遺伝子領域を分析する能力を持っているため、複雑な遺伝性疾患や複数の遺伝子が関与する病態の診断に有用です。
特定の染色体異常の検出: 染色体の特定領域における異常(例えば、特定の症候群に関連する特定の染色体の再配列や変異)もMLPAによって検出可能です。
MLPAでわからないこと
点変異の検出: MLPAは、遺伝子の単一塩基変異や小規模な挿入・欠失(数塩基から数十塩基の範囲)のような微細な遺伝子変異を直接検出することはできません。
遺伝子の機能的影響: MLPAによって遺伝子のコピー数変動が検出された場合でも、その変動が個々の患者における疾患の表現型や病態の重症度にどのように影響するかを示す情報は提供されません。
エピジェネティックな変化: DNAメチル化やヒストンの修飾など、遺伝子の発現を制御するエピジェネティックな変化は、MLPAでは検出できません。
染色体の非構造的異常: 染色体の数や全体的な構造の異常(例えば、アネプロイディー)は、MLPAでは直接的には検出されません。これらは染色体分析や他の遺伝子診断技術によって調べる必要があります。
MLPA法は特定の適用範囲内で非常に有用なツールですが、遺伝子診断の全体像を得るためには、他の遺伝子検査技術や臨床情報と組み合わせて利用する必要があります。
結論
MLPA(多重リガーゼプローブ増幅)法は、遺伝性疾患、がん、および多くの他の条件の診断において重要な役割を果たします。この技術により、特定の遺伝子領域のコピー数変動(CNV)を精密に検出することができるため、遺伝子の欠失や重複が疾患の原因である場合には特に有用です。MLPAは、その高い感度と特異性、比較的低コスト、そして実施の容易さから、研究室や臨床現場で広く採用されています。
●研究や臨床でのMLPA技術の活用
研究者や臨床医は、MLPA技術を以下のような方法で活用することができます。
疾患の原因究明: 遺伝性疾患やがんなどの原因遺伝子のコピー数変動を特定し、疾患のメカニズムの理解を深める。
診断とリスク評価: 特定の遺伝子変異の存在を確認し、患者の疾患リスクや治療反応性を評価する。
カスタマイズされた治療戦略: 遺伝子プロファイリングに基づき、患者個々の治療計画を立案するための情報を提供する。
●アドバイス
MLPA技術を自身の研究や臨床に活用する際には、以下の点に注意することが重要です。
適切なキットの選択: 研究目的や診断対象に最も適したMLPAキットを選択し、正確な結果を得るためのプロトコルに従ってください。
データ解析と解釈: MLPAによるデータ解析は複雑であるため、専門的な知識が必要です。適切なソフトウェアツールを使用し、結果の解釈には慎重を期してください。
品質管理: 実験の再現性と正確性を確保するために、厳格な品質管理プロトコルに従い、実験の各段階でコントロールを使用してください。
●今後の展望
遺伝子検査におけるMLPA法の今後の展望には、以下のような点が考えられます。
技術の進化: MLPA技術は進化し続けており、より高速でコスト効率の良いバリアントが開発される可能性があります。これにより、より多くの研究室や臨床現場での採用が促進されるでしょう。
応用範囲の拡大: 現在利用されている疾患領域に加えて、MLPAは新たな疾患や条件の診断にも応用されるようになるかもしれません。
統合的アプローチ: MLPAは、他の分子生物学的技術と組み合わせて使用されることで、遺伝的プロファイリングの精度をさらに向上させる可能性があります。
MLPA法は、遺伝子検査の分野における重要なツールであり続け、その応用範囲と技術的進歩により、遺伝性疾患の診断、治療、および管理においてさらに重要な役割を果たすでしょう。
付録
FAQ
1. MLPAとは何ですか?
MLPAは、特定のDNA領域のコピー数変異(CNV)を検出するために設計された分子生物学的手法です。この技術は、疾患関連遺伝子のコピー数を正確に測定することができ、遺伝性疾患、がん、およびその他の遺伝子異常の診断と研究に広く用いられています。
2. MLPA実験の基本的な手順は何ですか?
MLPA実験は、DNAサンプルの準備、プローブのハイブリダイゼーション、ライゲーション、PCR増幅、そして電気泳動による産物の解析のステップから成ります。これにより、特定のDNA領域のコピー数を定量化することができます。
3. MLPAで検出できる遺伝子異常の例を教えてください。
MLPAは、遺伝性疾患(例:デュシェンヌ型筋ジストロフィー、ハンチントン病)、がん(例:HER2遺伝子の増幅)、および染色体異常(例:ダウン症候群における21番染色体のトリソミー)など、さまざまな遺伝子異常の検出に使用されます。
4. MLPAデータの解釈における一般的な課題は何ですか?
MLPAデータの解釈は、プローブの特異性、サンプルの品質、実験条件の一貫性など、多くの要因に依存します。一般的な課題には、低レベルのモザイク症の検出、類似した配列間の区別、およびコントロールサンプルとの比較における変動の解釈が含まれます。
5. MLPAと他のCNV検出技術との主な違いは何ですか?
MLPAは、少量のDNAサンプルから特定の遺伝子領域のコピー数を正確に測定できる点で、他のCNV検出技術(例:アレイCGHやqPCR)と区別されます。MLPAは、特定の遺伝子領域に焦点を当てた高い特異性と感度を提供し、比較的低コストで迅速な結果が得られるという利点があります。
6. MLPA実験に必要な特別な機器はありますか?
MLPA実験には、標準的なPCR機器、キャピラリー電気泳動装置(または他の適切な電気泳動システム)、およびデータ解析用の特定のソフトウェア(例:Coffalyser.Net)が必要です。これらの機器とソフトウェアは、MLPAプローブの特異的増幅とデータ解析をサポートします。
用語集
1. MLPA (Multiple Ligation-dependent Probe Amplification)
多重リガーゼ依存性プローブ増幅法。特定のDNA領域のコピー数変動を検出するための分子生物学的手法。
2. プローブ (Probe)
特定のDNA配列に特異的に結合する、短い合成DNA片。MLPAでは、検出対象の遺伝子領域に対応する複数のプローブが使用される。
3. コピー数変動 (Copy Number Variation, CNV)
ゲノム内の特定の領域が通常と異なるコピー数を持つこと。MLPAはこれを検出するために用いられる。
4. リガーゼ (Ligase)
DNAの切れ端を結合させる酵素。MLPAでは、プローブの結合部分を連結させるのに使用される。
5. 増幅 (Amplification)
PCR(ポリメラーゼ連鎖反応)により、特定のDNA領域を大量に複製すること。MLPAでは、リガーゼによって連結されたプローブが増幅される。
6. 定量PCR (Quantitative PCR, qPCR)
DNAのコピー数を定量するために使用されるPCRの一形態。MLPAの結果の解析にしばしば用いられる。
7. ノーマライゼーション (Normalization)
実験データを標準化または正規化するプロセス。MLPAでは、サンプル間での比較を可能にするために重要。
8. コントロールプローブ (Control Probe)
実験の正確性と再現性を確認するために使用される、変動がないと予想される遺伝子領域に結合するプローブ。
9. フラグメント解析 (Fragment Analysis)
増幅されたDNA断片の長さを測定し、特定するプロセス。MLPAでは、プローブによって増幅された断片のサイズを分析するために使用される。
10. キャピラリー電気泳動 (Capillary Electrophoresis)
DNA断片をサイズに応じて分離する方法。MLPA後のフラグメント解析に一般的に用いられる。
【関連記事】
- 遺伝病を理解するためのヒトゲノム入門編【1】ヒトゲノムから染色体へ
- 遺伝病を理解するためのヒトゲノム入門編【2】DNAの構造
- 遺伝病を理解するためのヒトゲノム入門編【3】染色体の構造
- 遺伝病を理解するためのヒトゲノム入門編【4】ヒトゲノムを構成するもの
- 遺伝病を理解するためのヒトゲノム【5】ゲノム情報伝達の仕組み:基礎編
- 遺伝病を理解するためのヒトゲノム【6】ゲノム情報伝達の仕組み:細胞周期
- 遺伝病を理解するためのヒトゲノム【7】ゲノム情報伝達の仕組み:減数分裂
- 遺伝病を理解するためのヒトゲノム【8】ゲノム情報伝達の仕組み:配偶子形成と受精減数分裂