目次
サンガー法 DNA鎖伸長停止法 chain termination method ジデオキシ法
サンガーシークエンシングとは?
サンガー塩基配列決定法は、”DNA鎖伸張停止法” chain termination methodやディデオキシ法とも呼ばれるDNAの塩基配列を決定する方法です。この方法は、ノーベル賞受賞者であるフレデリック・サンガー氏らによって1977年に開発されたもので、その名をとって「サンガー・シーケンス」と呼ばれています。
DNAの一般的な構造や塩基配列の決定(シークエンシング)がどういう意味を持つかについては、リンク先のページを参照してください。
サンガーシークエンシングの仕組み
サンガー塩基配列決定は、開発されたころは手動だったのですが、その後、開発が進み、塩基配列決定装置を介して自動化された方法で行うこともできるようになりました。
その前にDNAの複製についてちょっと復習しましょう。
鋳型DNA(複製したい元となるDNAをこう呼びます)に相補的(塩基には手が2本のものと3本のものがあるので普通は仲間同士でくっつきます。アデニンAはグアニンG,シトシンCはチミンTでしたね!)なDNA鎖を任意の長さまで伸長させることができます。例えば鋳型DNA鎖中のチミン(T)の塩基のところで新規合成を止めたいとしましょう。これはDNAの相補鎖の合成をアデニン(A)で止めるということと等しいのです。
サンガー法の理解の準備
鋳型DNAを準備する
↓
鋳型DNAに相補的なDNA断片(プライマーと呼びます)を加えてアニーリング(一本鎖核酸どうしの相補的な塩基対を会合させて二本鎖にすることを言います)させる.
↓
DNAポリメラーゼ,dNTP,ddATPを加えてDNAの新規合成を開始します。
普通のPCRと違うことに、dNTP,ddATPという用語が出てきました。
DNAポリメラーゼとはプライマーからDNAを5’→3’の方向に伸長する酵素です。
dNTPとはデオキシヌクレオチド三リン酸のことで、それにくっつく塩基はA,T,G,Cの4種類あるためdNTPも4種類(dATP,dTTP,dGTP,dCTP)あることになります。
ddATPとはdATPの3’部位のヒドロキシ基(-OH)がデオキシ(酸素が取れること)されて水素に置換された構造をもっています。DNAの新規合成ではDNA鎖の3’末端のヒドロキシ基とdNTPの5’リン酸基がリン酸結合によってつながるのですが、ddATPがDNA鎖に取り込まれると、OHではなくHなのでリン酸基と結合することが出来ません。このためその先に伸長することができなくなり、相補鎖の合成はddATP と結合した長さで停止します。
同様にして残りの3塩基についてもこの作業を行うことで、鋳型DNA中の異なる位置で合成が停止したDNA断片の全ての組み合わせを得ることができます。
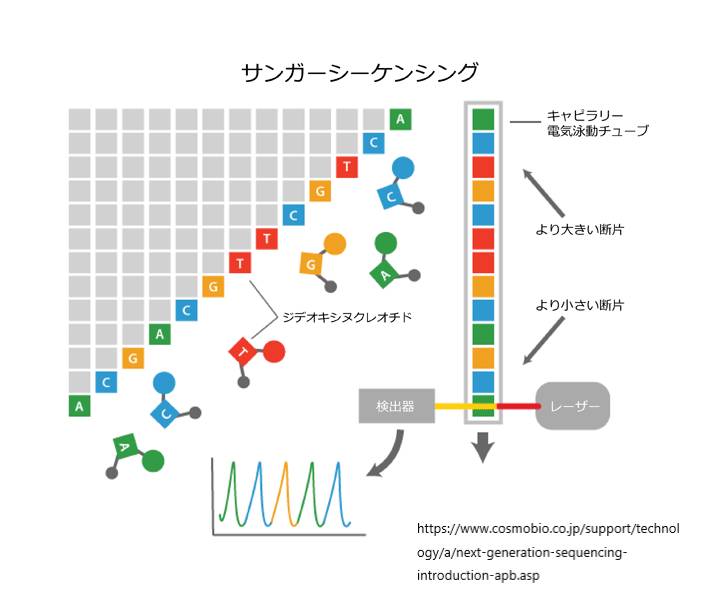
こうして,dNTP(dATP, dGTP, dCTP, dTTP)以外に,DNA鎖の伸長を停止させるddNTP(2′,3′-ジデオキシヌクレオチド;ddATP,ddGTP,ddCTP,ddTTPのいずれか)を少量加えておくと,ddNTPが取り込まれた時点でDNAの合成反応が停止することになります。つまり、ddNTPが伸長中のDNA鎖に取り込まれると,伸長末端にあるヌクレオチドの3’末端が-OH基(ヒドロキシ基)ではなく-Hとなってしまうために,次の塩基が結合できず,DNA鎖の伸長が停止することになりますが,この鎖停止反応はランダムな位置で生じ,鎖長の異なるさまざまなDNA断片が得られることになります.そして,これらのDNA断片の3’末端は加えたddNTPによって決まっていますので,例えばddATPを加えた場合には,DNA断片の3’末端は,必ずA(アデノシン)であるということがわかります.
このような原理から,「ジデオキシ法」では,まず,4種類のdNTP(dATP,dGTP,dCTP,dTTP)と1種類のddNTP(ddATP,ddGTP,ddCTP,ddTTPのいずれか)の混合溶液を用意します.そして,この溶液を用いてDNA合成を行なうと,それぞれのddNTPを取り込んだ時点で反応が停止し,鎖の長さの異なる様々なDNA断片が得られ,これをddATP,ddGTP,ddCTP,ddTTPの4種類ごとに行うことで,DNAの塩基配列を解読することができます.
※32P標識したdCTPなども加えておくことにより,合成されたDNA鎖のみを変性ゲル電気泳動後にオートラジオグラフィーで観察します.DNAの変性とは,二本鎖DNAを一本鎖DNAに解離することをいいます.
※4つの塩基は光の色としてあらわされます。赤青黄緑の順にチミン、シトシン、グアニン、アデニンです。
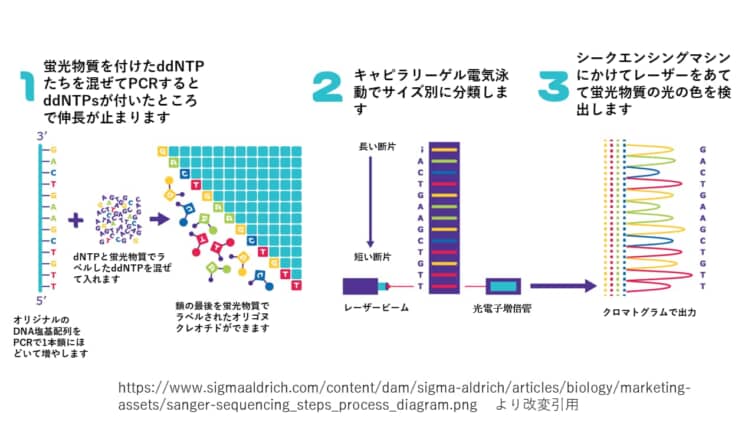
サンガーシークエンスは3つの基本的なステップ
1. 連鎖終結PCRのDNA配列
目的のDNA配列を Chain-termination PCRの鋳型として使用します。 Chain-termination PCRは標準PCRと同じように動作しますが、大きな違いは、ジデオキシリボヌクレオチド(ddNTPs)と呼ばれる修飾されたヌクレオチド(dNTPs)の添加です。ジデオキシという名前から、「デオキシ」が「ジ」つまり2つあることがわかります。化学では数字をモノ、ジ、トリ、テトラ、と数えますので。「デオキシ」はヒドロキシ基の1つが還元されて水素原子に置き換わった糖のことをさします。つまり、普通のDNAにはデオキシリボースが使われるのですが、標準的なPCRの伸長ステップでは、DNAポリメラーゼは、最後のヌクレオチドの遊離3′-OH基と次のヌクレオチドの5′-リン酸との間のホスホジエステル結合の形成を触媒することによって、成長しているDNA鎖にdNTPを追加します。
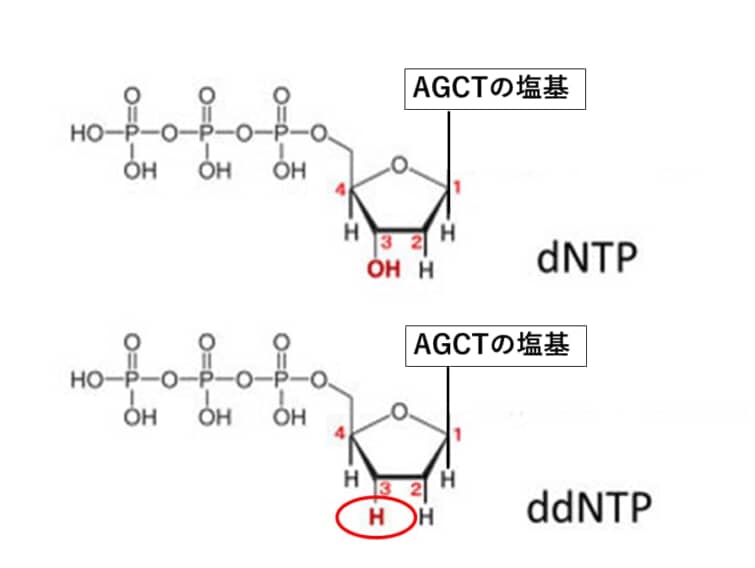
ddNTPはホスホジエステル結合形成に必要な3′-OH基を持たないため、DNAポリメラーゼがランダムにddNTPを組み込むと伸長が停止します。Chain-termination PCRの結果は、目的のDNA配列の数百万から数十億のオリゴヌクレオチドコピーであり、5′-ddNTPによってランダムな長さで終結terminationします。
手動のサンガーシークエンシングでは、4つのPCR反応がセットアップされ、それぞれに1種類のddNTP(ddATP、ddTTP、ddGTP、およびddCTP)のみが混合されています。自動化されたサンガーシークエンシングでは、1回の反応ですべてのddNTPが混合され、4つのdNTPのそれぞれに固有の蛍光ラベルが付けられています。
昔はこれしかなかったので、うっかり結果を意識が飛んで(寝てしまったともいう)見逃したりすると塩基配列が違ってしまう、という馬鹿馬鹿しいことになります。なので、手動のサンガーシークエンスしかできなかった時代、クローニング(DNAから遺伝子を単離して塩基配列を決定する)はもう、研究者にとっては命がけの作業だったのです。びっくりですよね。こうした時代に大学院生だったオジサンたちは、「あの遺伝子の配列は俺が決定したんやー、それで学位もろたんやー」とか自慢話を延々とする傾向にありますが、それくらい大変だった、ということはなんとなく想像してあげてください。「何自慢してるのよ?今それ秒でできるから」なんて言ってはいけませんよ!決して(笑)
2. ゲル電気泳動によるサイズ分離
ステップ2では、鎖状末端のオリゴヌクレオチドをゲル電気泳動によりサイズ別に分離します。ゲル電気泳動では、DNAサンプルをゲルマトリックスの一端に装填し、電流を流します。すべてのDNA断片は質量あたりの電荷が同じなので、オリゴヌクレオチドの移動速度は大きさによってのみ決定されます。フラグメントが小さければ小さいほど、ゲル中を移動する際の摩擦が少なくなり、移動速度が速くなります。その結果、オリゴヌクレオチドは小さい方から大きい方へと配列され、ゲルを下から上へと読み取っていくと長さの通り、つまり塩基配列通りの塩基を読み取ることができます。
手動サンガーシーケンシング法では、4つのPCR反応のそれぞれからのオリゴヌクレオチドは、ゲルの4つの別々のレーンで実行されます。これにより、ユーザーは、どのオリゴヌクレオチドが各ddNTPに対応しているかを知ることができるようになっています。
自動化されたサンガーシークエンシング法では、すべてのオリゴヌクレオチドは、シークエンシングマシン内の単一のキャピラリーゲル電気泳動で実行されます。
3. ゲル分析とDNA配列の決定
ステップ3はいよいよ最後の段階です。単にゲルを読み取って、入力されたDNAの配列を決定していきます。DNAポリメラーゼは、与えられたプライマーを起点として、5’から3’方向にしかDNAを合成しないため、各末端のddNTPは、元の配列の特定のヌクレオチドに対応します。最も短い断片は5’末端から1番目のヌクレオチド終わっています。2番目に短い断片は5’末端から2番目のヌクレオチドで終わっています。
こんな感じで断片の長さと塩基が一対一対応しているので、それを順番に読んでいきます。
手動のサンガーシークエンシングでは、ユーザーは、ゲルの4つのレーンすべてを、下から上に移動しながら一度に読み、レーンを用いて各バンドの末端ddNTPの同一性を決定していきます。
自動化されたサンガー配列決定では、コンピュータは、蛍光を用いて、キャピラリーゲルの各バンドを順番に読み取って、各末端のddNTPの同一性を呼び出す。要するに、各バンドの蛍光タグをレーザーで励起し、その結果として出た光をコンピュータが検出する。4つのddNTPのそれぞれが異なる蛍光ラベルでタグ付けされているため、発光した光を直接末端のddNTPの同一性に結びつけることができます。出力はクロマトグラムと呼ばれ、テンプレートDNAの長さに沿った各ヌクレオチドの蛍光ピークを示します。
Chapter2-3
DNAシークエンサーを用いたジデオキシ法
この記事の著者:仲田洋美医師
医籍登録番号 第371210号
日本内科学会 総合内科専門医 第7900号
日本臨床腫瘍学会 がん薬物療法専門医 第1000001号
臨床遺伝専門医制度委員会認定 臨床遺伝専門医 第755号