目次
この記事では、RNAプロセシングの基礎から、SPRING-8の大型放射光施設を利用した最新のmRNA研究、異常なプロセシングが疾患に起因するメカニズムに至るまで、包括的に解説します。病気の治療法開発における転写調節の重要性にも焦点を当てます。
第1章: RNAプロセシングの基礎
RNAとは何か
RNA(リボ核酸)は、生物の細胞内でDNA(デオキシリボ核酸)の遺伝情報を実行するために不可欠な分子です。DNAが遺伝情報の「設計図」であるとすれば、RNAはその設計図をもとにして実際の「建物」を作り上げるための「作業指示書」に例えられます。RNAは、細胞のタンパク質合成やその他の生命活動を司る多様な役割を持っています。主に以下の三つのタイプが知られています。
●mRNA(メッセンジャーRNA):
mRNAは、DNAからの遺伝情報をリボソーム(細胞内のタンパク質を合成する工場)に運ぶ役割を持ちます。この過程で、DNAの遺伝情報がタンパク質の合成指示に変換されるため、mRNAは「メッセンジャー(伝令)」と呼ばれます。
●rRNA(リボソームRNA):
rRNAはリボソームの主要な構成要素であり、タンパク質合成の場を提供するとともに、タンパク質合成過程の触媒(加速)役割を果たします。
●tRNA(トランスファーRNA):
tRNAは、アミノ酸をリボソームに運び、mRNAが指示する特定の順序でタンパク質を合成するために必要なアミノ酸を供給します。tRNAは、アミノ酸とmRNAのコドン(遺伝情報の単位)を特定の対応関係に基づいて結びつける役割を持ちます。
これらの基本的なタイプのRNA以外にも、RNAは細胞内の様々な調節機能を担う小さなRNA分子(例えば、miRNAやsiRNAなど)を含め、多様な形で存在し、生命活動の多岐にわたる面で重要な役割を果たしています。RNAのプロセシングは、これらRNA分子が遺伝情報に基づいて正確に生成され、適切に機能するために必要な一連の変更プロセスを指します。このプロセスには、キャップ形成、スプライシング(不要な部分の除去と必要な部分の結合)、ポリアデニル化(mRNAの安定性と効率的な翻訳を促す尾部の追加)などが含まれます。
mRNAプロセシングの重要性
mRNAプロセシングは、真核生物の細胞で前駆体mRNA(pre-mRNA)が成熟したmRNAに変換される一連の過程です。このプロセシングは、遺伝情報の正確な流れとタンパク質合成の効率性を確保するために、極めて重要です。主なプロセシングのステップには、キャッピング、スプライシング、およびポリアデニル化が含まれます。以下に、mRNAプロセシングの重要性について詳細を述べます。
1. 遺伝子発現の調節
mRNAプロセシングは、遺伝子発現のレベルを細かく調節するメカニズムの一部です。例えば、代替スプライシングにより、一つの前駆体mRNAから複数の異なる成熟mRNAが生成され、結果として異なるタンパク質が生産されることがあります。これにより、細胞は限られた遺伝子セットから大きなタンパク質の多様性を生み出すことができます。
2. タンパク質の多様性
代替スプライシングは、生物のタンパク質の多様性を大幅に増加させる重要なプロセスです。異なる組織や発達段階で特有のスプライシングバリアントが生成されることにより、細胞特異的な機能を果たすタンパク質が生産されます。
3. 細胞機能と発達
mRNAプロセシングは、細胞の特定の機能を担うタンパク質の生産を可能にし、細胞の分化や発達プロセスに不可欠です。特定のスプライシングイベントは、発達段階や細胞応答に応じて調節されることが多く、生物の適応能力と進化に貢献します。
4. mRNAの安定性と輸送
キャッピングとポリアデニル化は、mRNAの安定性と細胞質への輸送を促進します。これらの修飾は、mRNAが分解されるのを防ぎ、リボソームへ効率的に運ばれることを確実にします。また、翻訳開始の効率性も高めます。
5. 疾患との関連
mRNAプロセシングの異常は、多くの遺伝性疾患やがんの原因となり得ます。例えば、スプライシングの異常は、特定の遺伝子の機能不全や異常タンパク質の産生につながり、病態の発生に寄与します。
mRNAプロセシングの研究は、細胞生物学、分子遺伝学、および医学の分野における基本的な問題に光を当てるだけでなく、新たな治療標的の同定や治療戦略の開発に向けた洞察を提供します。このプロセスの詳細な理解は、生命の根底にあるメカニズムの解明と、疾患の治療法の改善に不可欠です。
基本的なプロセシングステップ: キャップ形成、スプライシング、ポリアデニル化
真核生物のmRNAの成熟には、いくつかの基本的なプロセシングステップがあります。これらのステップは、転写された前駆体mRNA(pre-mRNA)が翻訳のために適切に成熟し、機能するmRNAになるために必要です。主なプロセシングステップにはキャップ形成、スプライシング、そしてポリアデニル化が含まれます。
●キャップ形成
プロセス:転写の初期段階で、pre-mRNAの5′端に特殊なヌクレオチド構造である5’キャップが付加されます。
機能:このキャップは、mRNAの安定性を高め、細胞質への輸送、リボソームによる翻訳の開始、そして核外への輸送を助けます。
RNAプロセシングにおけるキャップ形成は、真核生物の前駆体mRNA(pre-mRNA)の成熟過程において初期に行われる重要な修飾プロセスの一つです。このプロセスでは、pre-mRNAの5’端に特異的な構造である5’キャップが付加されます。このキャップ構造は、mRNAの翻訳効率の向上、安定性の確保、細胞核から細胞質への輸送、および不要な分解からの保護に不可欠な役割を果たします。
キャップ形成のメカニズム
キャップ形成は、転写の非常に早い段階で起こります。具体的なメカニズムは以下のステップで構成されます:
5’トリフォスファターゼ活性: 最初のステップでは、新しく合成されたpre-mRNAの5’端の三重リン酸(トリフォスフェート)が一つ取り除かれます。これにより、5’端に二重リン酸(ジフォスフェート)が残ります。
グアニリルトランスフェラーゼ活性: 次に、特殊な酵素であるグアニリルトランスフェラーゼが作用し、GTP(グアノシン三リン酸)からガンマリン酸をpre-mRNAの5’端に逆向きに(5’から5’の三重リン酸結合で)付加します。これにより、7-メチルグアノシン(m^7G)キャップが形成されます。
メチル化: キャップに付加されたグアノシンはさらにメチル化され、7-メチルグアノシンキャップ(m^7Gキャップ)が完成します。さらに、キャップ構造の最初の数個のヌクレオチドもメチル化されることがあります。
キャップ形成の機能
翻訳の促進: 5’キャップ構造は、リボソームがmRNAに結合し、翻訳を開始するのを助けます。キャップ結合複合体(eIF4Eなど)がキャップに結合し、翻訳開始因子と相互作用して、翻訳の効率を高めます。
mRNAの安定性: キャップは、mRNAが不要な分解から保護されるのを助けます。キャップ構造は、分解酵素からmRNAを保護するバリアとして機能します。
細胞核から細胞質への輸送: キャップは、mRNAが細胞核から細胞質へ輸送される際のシグナルとしても機能します。キャップ結合複合体がこの輸送プロセスに関与します。
キャップ形成は、遺伝子発現の調節とmRNAの機能において中心的な役割を担っています。このプロセスの異常は、翻訳の効率低下やmRNAの不安定化など、細胞機能の障害につながる可能性があります。
●スプライシング
プロセス:スプライシングは、pre-mRNAからイントロン(非コーディング領域)を除去し、エクソン(コーディング領域)を連結させる過程です。
機能:スプライシングによって、不要なシーケンスが取り除かれ、コーディング領域のみがmRNAに残ることで、正しいタンパク質が合成されるようになります。
関連記事:5分でわかるタンパク質生合成:DNAからアミノ酸への旅、リボソームの役割とは?の中でスプライシングについて詳しく説明しています。
●ポリアデニル化
プロセス:mRNAの3′端にポリアデニル酸(ポリ(A)テール)が付加されるプロセスです。このポリ(A)テールは、一連のアデニンヌクレオチドから構成されます。
機能:ポリ(A)テールはmRNAの安定性と翻訳効率を向上させ、核からの輸送を促進します。
これらのプロセシングステップは、mRNAが正確に機能するタンパク質をコードするために不可欠です。異常なプロセシングは、疾患の原因となることがあり、したがってこれらのプロセスは厳密に調節されています。また、特定の遺伝子では、スプライシングのバリアントが異なるタンパク質製品を生み出すことで、遺伝子の機能的多様性に寄与しています。
ポリアデニル化は、mRNAの成熟と機能に不可欠な後生合成修飾プロセスの一つです。このプロセスにより、mRNA分子の3’末端にアデニンヌクレオチドの連続した列(ポリAテール)が付加されます。ポリAテールの付加は、mRNAの安定性、細胞質への輸送、および翻訳効率に影響を与えるため、遺伝子発現の調節において重要な役割を果たします。
ポリアデニル化の機構
ポリアデニル化シグナル: ほとんどの真核生物のmRNAの3’非翻訳領域(3’UTR)には、AAUAAA配列という一般的なポリアデニル化シグナルが存在します。この配列は、ポリアデニル化酵素複合体を3’末端に誘導し、ポリAテールの合成を開始させる信号として機能します。
切断とポリAテールの付加: ポリアデニル化酵素複合体は、ポリアデニル化シグナルの約10〜30塩基対下流でmRNAを切断し、その切断された末端にポリAテールを付加します。
ポリアデニル化の生物学的意義
mRNAの安定性: ポリAテールは、mRNA分子の分解を遅らせることによって、mRNAの安定性を高めます。長いポリAテールを持つmRNAは、一般により長寿命です。
翻訳の促進: ポリAテールは、リボソームによる翻訳開始の効率を高める役割も果たします。ポリA結合タンパク質(PABP)はポリAテールに結合し、翻訳の開始複合体の形成を促進します。
細胞質への輸送: mRNAの細胞核から細胞質への輸送も、ポリAテールに依存しています。ポリAテールは、mRNA輸送関連タンパク質と相互作用し、効率的な輸送を促進します。
ポリアデニル化部位の選択
多くの遺伝子では、複数のポリアデニル化部位が存在し、細胞のタイプ、発達段階、または環境条件に応じて異なるポリアデニル化部位が選択されることがあります。この選択的ポリアデニル化により、異なる3’UTR長を持つmRNAバリアントが生じ、mRNAの安定性、局在、または翻訳効率が変化する可能性があります。これは、遺伝子発現の微妙な調節に寄与し、細胞の特異的なニーズに応じたタンパク質の生産を可能にします。
βサラセミアにおけるポリアデニル化シグナルの変異は、ポリアデニル化プロセスの重要性を示す一例であり、適切なポリAテールの付加が行われない場合、mRNAの安定性や翻訳効率に深刻な影響を及ぼす可能性があることを示しています。遺伝子発現の精密な調節には、ポリアデニル化とその制御メカニズムの理解が不可欠です。
第2章: 大型放射光施設SPRING-8とは
SPRING-8の概要
SPRING-8は、世界最高峰の輝度を誇る大型放射光施設の一つで、日本の兵庫県に位置しています。放射光は、電子がほぼ光速で円軌道を回る際に放出される強力な電磁波で、X線から紫外線、可視光線に至るまでの広範囲の波長を含みます。この放射光を利用することで、物質の微細構造を原子レベルで観察することが可能となり、物理学、化学、生物学、医学、工学など幅広い分野での研究に不可欠なツールとなっています。
SPRING-8の施設は、1997年に運用を開始し、日本原子力研究開発機構(JAEA)と理化学研究所が共同で管理運営しています。主な特徴としては、以下のような点が挙げられます。
●高輝度:SPRING-8は、その高い輝度により、極めて小さな試料や薄い試料の詳細な観察を可能にします。また、高速で動く現象のリアルタイム観察や、非常に弱い信号の検出も可能です。
●広範な研究分野:生命科学から物質科学、環境科学まで、非常に幅広い分野の研究が行われています。例えば、タンパク質の結晶構造解析、新素材の開発、環境汚染物質の分析などがあります。
●先進的な実験設備:多数のビームライン(放射光を利用した実験装置)が設置されており、それぞれ特定の研究目的に最適化されています。これにより、研究者は自分の研究課題に最適な条件下で実験を行うことができます。
RNA研究においてもSPRING-8は重要な役割を果たしています。例えば、タンパク質とRNAの相互作用の解明、RNA分子の立体構造の詳細な解析、RNAプロセシングに関与する酵素の機能解析など、基礎研究から応用研究まで幅広く貢献しています。これらの研究は、新しい薬剤の開発や遺伝子治療など、将来の医療応用に向けた基盤を築くものと期待されています。
RNA研究におけるSPRING-8の役割
SPRING-8は、日本にある世界最高峰の放射光施設の一つで、科学研究の多岐にわたる分野で使用されています。この施設は、非常に高い輝度のX線を生成し、物質の構造や性質を原子レベルで詳細に観察することができます。RNA研究においても、SPRING-8は重要な役割を果たしています。以下に、その応用例を挙げます。
●RNAの構造解析
SPRING-8で生成される高輝度X線を利用することで、RNA分子やRNAを含む複合体の精密な三次元構造を明らかにすることが可能です。これにより、RNAの機能的な理解を深めることができます。
●RNAとタンパク質の相互作用
RNAは、リボソーム、スプライソソームなど、多くのタンパク質と複合体を形成して機能します。SPRING-8を使用して、これらの複合体の構造を詳細に解析することで、RNAとタンパク質の相互作用のメカニズムを理解することができます。
●RNAのダイナミクス
RNA分子は、その機能を果たすために特定の構造へと折りたたまれます。SPRING-8を用いたタイムリゾルブド(時間分解能のある)実験により、RNAの折りたたみや構造変化のダイナミクスを観察することが可能です。これは、RNAの機能的な理解を深める上で重要な情報を提供します。
●薬剤設計への応用
RNAを標的とした新しい薬剤の開発には、標的RNAの正確な構造情報が不可欠です。SPRING-8で得られる詳細な構造データは、RNAを標的とした薬剤の設計に直接的に貢献します。
●疾患関連RNAの研究
特定の疾患に関連するRNA分子の構造を解析することで、疾患の分子メカニズムの理解が進みます。例えば、がんや遺伝性疾患における異常なRNA構造の同定が可能です。
SPRING-8のような先進的な放射光施設は、RNA研究における新しい発見や技術革新を促進するための強力なツールを提供します。これにより、基礎生物学の進展だけでなく、医療や薬学への応用に向けた重要なステップを踏み出すことができます。
第3章: mRNAプロセシングの高度なメカニズム
プロセシングの異常と疾患発生の関係
RNAプロセシングの異常は、さまざまな疾患の発生に直接関係しています。RNAプロセシングとは、前駆体RNA(pre-mRNA)から成熟したmRNAを生成する過程であり、このプロセスにはキャップ形成、スプライシング、ポリアデニル化などが含まれます。これらのステップが適切に行われない場合、不正確または機能不全のmRNAが生成され、結果としてタンパク質の合成が不適切になることがあります。このような異常は、遺伝性疾患、がん、神経退行性疾患など、多岐にわたる健康問題に寄与する可能性があります。
●遺伝性疾患
遺伝性疾患の多くは、特定の遺伝子の変異によって引き起こされますが、RNAプロセシングの異常によっても発生します。例えば、筋ジストロフィーの一種であるミオトニックジストロフィーは、特定の遺伝子領域の異常な繰り返しによってRNAプロセシングが妨げられることで起こります。この異常が筋肉細胞内での正常なタンパク質の生成を阻害し、筋力の低下や筋肉の萎縮などの症状を引き起こします。
●がん
がん細胞は、異常な増殖能力を持ちますが、この能力はしばしばRNAプロセシングの変更によって支えられています。例えば、特定のスプライシング因子の過剰発現や機能不全は、がん細胞が成長し続けるために必要なタンパク質の生産を促進することがあります。さらに、異常なスプライシングは、がん細胞が薬物治療に対して耐性を持つ原因となることもあります。
●神経退行性疾患
アルツハイマー病、パーキンソン病、筋萎縮性側索硬化症(ALS)などの神経退行性疾患も、RNAプロセシングの異常と関連しています。これらの疾患では、特定のRNA結合タンパク質の機能不全により、神経細胞内のRNAプロセシングが不適切になり、細胞死に至る可能性があります。例えば、ALSでは、特定のRNA結合タンパク質が異常な凝集体を形成し、正常なRNAプロセシングを妨げることが知られています。
RNAプロセシングの異常が様々な疾患に関与することは、このプロセスの正確さが細胞機能と健康にとっていかに重要であるかを示しています。これらの知見は、新しい診断方法や治療戦略の開発に向けた研究に貴重な洞察を提供しています。
メチル化とその調節機構
RNAプロセシングにおけるメチル化は、特定のRNA分子上のアデノシンやシトシン残基にメチル基を付加する化学的修飾です。このメチル化は、RNA分子の構造、機能、およびその運命に大きな影響を及ぼします。RNAメチル化は、特にmRNA、tRNA、rRNA、および非コーディングRNAなど、多様なRNA種に見られます。以下に、RNAメチル化の重要性と調節機構について説明します。
●RNAメチル化の種類と機能
N6-メチルアデノシン(m6A)メチル化: mRNAのメチル化で最も一般的であり、mRNAの安定性、輸送、局在、翻訳効率、およびスプライシングに影響を与えます。
5-メチルシトシン(m5C)メチル化: tRNAやrRNAでよく見られ、RNAの安定性や翻訳の精度に寄与します。
7-メチルグアノシン(m7G)キャッピング: mRNAの5’端に見られ、mRNAの安定性、輸送、翻訳開始に重要な役割を果たします。
2′-O-メチル化: rRNAやsnRNAに見られ、RNAの構造の安定性と機能に寄与します。
●RNAメチル化の調節機構
「ライター」: RNAメチル化酵素(メチルトランスフェラーゼ)は、「ライター」として機能し、メチル基をRNA分子に付加します。例えば、METTL3-METTL14複合体はm6Aメチル化を触媒します。
「イレイサー」: メチル化されたRNAからメチル基を除去する酵素は、「イレイサー」として機能します。例えば、FTOとALKBH5はm6Aメチル化を除去することが知られています。
「リーダー」: メチル化されたRNAを認識し、結合するタンパク質は、「リーダー」として機能します。これらのタンパク質は、メチル化されたRNAの運命を決定する役割を持ちます。例えば、YTHドメインを持つタンパク質はm6Aメチル化されたmRNAを認識します。
●RNAメチル化の生物学的意義
RNAメチル化は、遺伝子発現の微妙な調節に寄与し、細胞の発達、分化、応答メカニズムに影響を及ぼします。不適切なメチル化パターンは、がんを含む多くの疾患の発生に関連していることが示されています。したがって、RNAメチル化の調節機構の理解は、これらの疾患の診断、予防、治療において重要な意味を持ちます。
総じて、RNAメチル化とその調節機構の研究は、RNA生物学の理解を深めるだけでなく、新しい治療標的の同定に繋がる可能性があります。
RNA編集と疾患との関連性
RNA編集は、RNA分子上でのヌクレオチド配列の修正プロセスであり、この過程によって生成されるRNA分子は、DNAテンプレートと異なる情報を持つことがあります。RNA編集は、生物の遺伝的情報の表現を多様化させ、細胞の機能や適応性に影響を与える重要な機構です。RNA編集の不具合は、さまざまな疾患の原因となることが知られています。
RNA編集の主なタイプ
ADAR(Adenosine Deaminases Acting on RNA)によるA-to-I編集:
アデノシン(A)がイノシン(I)に変換されます。イノシンは翻訳時にグアノシン(G)として扱われるため、タンパク質のアミノ酸配列に影響を与えることがあります。
APOBEC(Apolipoprotein B mRNA Editing Enzyme, Catalytic Polypeptide-Like)によるC-to-U編集:
シトシン(C)がウラシル(U)に変換されることで、RNA分子の配列が変更されます。
RNA編集と疾患
RNA編集の異常は、神経疾患、がん、感染症など、多くの疾患と関連しています。
神経疾患:
A-to-I編集の異常は、てんかん、筋萎縮性側索硬化症(ALS)、うつ病、アルツハイマー病など、さまざまな神経疾患の発症に関連していることが報告されています。
RNA編集の不具合により、神経伝達物質受容体の機能が変化し、神経系の機能障害が引き起こされる可能性があります。
がん:
RNA編集の異常は、腫瘍の成長、進行、転移に関わる遺伝子の発現や活性を変化させ、がんの発生に寄与することが示されています。
特に、APOBECファミリーの過剰な活動は、DNA変異の増加と関連しており、がん細胞の遺伝的多様性を高める可能性があります。
感染症:
RNAウイルス(例:HIV)は、ホスト細胞内でのRNA編集機構を利用または回避することで、抗ウイルス応答から逃れることがあります。
RNA編集酵素の活性がウイルスRNAの編集に関与し、ウイルスの増殖や変異に影響を与えることがあります。
RNA編集の異常が疾患にどのように関与しているかを理解することは、新たな治療法の開発につながります。例えば、特定のRNA編集活動を調節することにより、疾患の進行を遅らせたり、症状を改善させたりする治療戦略が考えられます。
第4章: 病気の診断と治療におけるRNAプロセシングの利用
RNAプロセシング異常による疾患の例
RNAプロセシング異常は、細胞内でのRNAの成熟や加工が不適切に行われることにより生じ、多くの遺伝性疾患や疾病状態を引き起こします。RNAプロセシングには、前駆体mRNA(pre-mRNA)のスプライシング、5’キャップの付加、3’エンドのポリアデニル化などが含まれます。これらのプロセスがうまく機能しないと、細胞は不正確なmRNAを生成し、それによって機能不全のタンパク質が生産されたり、タンパク質が全く生産されなかったりする可能性があります。以下は、RNAプロセシング異常による疾患の例です。
●筋ジストロフィー: 特に筋緊張性ジストロフィーは、DMPK遺伝子のCTGトリピレットリピート拡大によって引き起こされます。この拡大は、mRNAの代謝異常を引き起こし、筋肉細胞でのタンパク質の合成に影響を与えます。
●脊髄小脳失調症: 特定の形式のこの病気は、遺伝子内のCAGリピートの拡大によって特徴づけられ、異常なスプライシングを引き起こすことが知られています。
●前頭側頭葉変性症(FTLD)と筋萎縮性側索硬化症(ALS): これらの病気は、TDP-43やFUSといったRNA結合タンパク質の機能不全に関連しています。これらのタンパク質は正常なRNAプロセシングに必要であり、その異常は神経細胞の死につながります。
▽TDP-43(TAR DNA-binding protein 43)は、細胞の正常な機能に必要な多くのRNAプロセシングプロセスに関与するタンパク質です。正式名称はTARDBP(TAR DNA-binding proteinの遺伝子)で、主に核内に存在し、RNAのスプライシング、転写の調節、mRNAの安定性、およびmRNAの輸送など、RNAの代謝において重要な役割を果たします。TDP-43は、特に神経系細胞で豊富に発現していることが知られています。
TDP-43の異常は、特に神経変性疾患と強く関連しています。最も注目されているのは、筋萎縮性側索硬化症(ALS)と前頭側頭葉変性症(FTLD)です。これらの疾患では、TDP-43が細胞核から細胞質に異常蓄積し、不溶性の凝集体を形成することが観察されます。この異常なTDP-43の細胞質蓄積は、神経細胞の機能障害や細胞死を引き起こすと考えられています。
TDP-43の細胞質蓄積は、その機能の喪失や異常な機能を示す可能性があります。例えば、TDP-43がRNAプロセシングプロセスに正常に関与できない場合、必要なタンパク質の生成が阻害されたり、不適切なタンパク質が生成される可能性があります。このような変化は、特に神経細胞のような高度に特殊化された細胞で致命的です。
また、TDP-43は他の神経変性疾患、例えばアルツハイマー病、パーキンソン病、レビー小体病などでも異常蓄積が観察されることがあり、これらの疾患における役割も積極的に研究されています。
TDP-43の異常が神経変性疾患の発症にどのように寄与するのか、またこれを治療するための戦略は何かについての研究は、現在も積極的に行われています。これには、TDP-43の機能を正常化する薬剤の開発や、異常なTDP-43の除去を促進する戦略などが含まれます。
▽FUS(Fused in Sarcoma)は、RNA結合タンパク質の一つで、細胞内でのRNAのプロセシング、輸送、および代謝に重要な役割を果たします。このタンパク質は、遺伝子発現の調節、細胞の成長と分化、およびDNAの修復にも関与しています。FUSは特に、神経細胞で豊富に発現しており、神経系の発達と機能維持に重要です。
FUSは、以下のような多様な生物学的プロセスに関与します。
RNAスプライシング: FUSは、前駆体mRNAのスプライシングに関与する複数のタンパク質と相互作用します。これにより、RNA分子の成熟と機能的なmRNAへの加工が促進されます。
転写の調節: FUSは転写因子と相互作用し、特定の遺伝子の転写を直接的または間接的に調節することができます。
RNAの輸送と局在: 細胞内でのmRNAの適切な輸送と局在は、タンパク質の合成が細胞の特定の部位で効率的に行われるために重要です。FUSは、このプロセスにも関与しています。
ストレス顆粒の形成: 細胞ストレス時、FUSはストレス顆粒の形成に関与し、RNA分子の安定性と翻訳を調節することで、細胞の生存をサポートします。
FUSの機能不全は、特に神経変性疾患の発症と密接に関連しています。FUS遺伝子の変異は、筋萎縮性側索硬化症(ALS)や前頭側頭葉変性症(FTLD)の一部の症例において同定されています。これらの疾患においては、FUSタンパク質が異常に細胞質に蓄積し、タンパク質の凝集体を形成することが観察されます。この異常な蓄積は、神経細胞の機能障害や細胞死を引き起こすと考えられています。
FUSに関連する神経変性疾患の研究は、このタンパク質の生物学的機能と疾患メカニズムのより深い理解をもたらし、将来の治療戦略の開発に貢献する可能性があります。
●遺伝性血小板症: RNAスプライシング因子であるSF3B1や他のスプライシング関連遺伝子の変異によって引き起こされることがあります。これらの変異は血液細胞の発達に影響を与えます。
●サラセミア: βサラセミアは、βグロビン遺伝子の変異によって引き起こされ、正常なスプライシングプロセスの妨げとなります。これにより、ヘモグロビンの不適切な形成が生じ、貧血を引き起こします。βサラセミア患者ではポリアデニル化シグナルの変異が認められ、3’側の適切な切断にポリアデニル化シグナルの重要性が明らかとなりました。
●一部のがん: RNAプロセシング異常は、がん細胞の成長と生存にも関係しています。例えば、SRSF1、SRSF6、hnRNPA1といったスプライシング因子の過剰発現は、腫瘍の成長を促進することが知られています。
これらの疾患は、RNAプロセシングの異常がどのように様々な病態を引き起こす可能性があるかを示しています。遺伝子の変異だけでなく、RNAプロセシングに関与するタンパク質の異常も病気の原因となり得ます。
疾患診断におけるRNA分析の利点
RNAプロセシングの調節に関する治療法開発は、遺伝子発現の精密な制御が必要な多くの疾患に対する新たな治療戦略を提供する可能性があります。RNAプロセシングには、スプライシング、エディティング、輸送、翻訳調節など、複数の段階が含まれており、これらの過程の異常はがん、神経変性疾患、代謝疾患など様々な疾患の原因となり得ます。
●RNAプロセシングの調節による治療法の開発
スプライシング調節: RNAスプライシングは、前駆体mRNAから不要なイントロンを除去し、エクソンを結合させる過程です。特定のスプライシング異常を正常化するために、小分子化合物やアンチセンスオリゴヌクレオチド(ASOs)が開発されています。これらは特定のスプライシングサイトに結合して、スプライシングパターンを変更することができます。
RNAエディティング: RNAエディティングは、RNA分子上の核酸の塩基を変更することにより、RNAのコード性を変化させることができます。この技術を利用した治療法は、特定の遺伝子変異を修正し、疾患の原因となる異常なタンパク質の生成を防ぐことが可能です。
mRNA輸送および局在の調節: 細胞内でのmRNAの適切な輸送と局在は、タンパク質の正確な発現に不可欠です。特定のRNA結合タンパク質やシグナル配列を標的とすることで、治療目的でのmRNAの細胞内分布を変更することができます。
翻訳の調節: 翻訳開始因子やその他の翻訳関連因子を標的とすることにより、特定のmRNAの翻訳を促進または抑制することが可能です。これにより、病気関連タンパク質の発現を調節する新しい治療法が開発されています。
●治療法開発への挑戦
特異性と安全性: RNAプロセシングを標的とした治療法は、高い特異性を持つ必要があります。誤ったターゲットに作用すると、非意図的な副作用を引き起こす可能性があります。
配送システム: RNAを標的とした治療物質や小分子化合物を細胞内に効率的に配送することは、依然として大きな課題です。特に、中枢神経系のような障壁が存在する組織への配送は難しいです。
耐性の問題: 治療に使用される分子が効果を失う可能性があり、長期的な治療効果を維持するためには、複数の標的やアプローチの組み合わせが必要になることがあります。
RNAプロセシングの調節による治療法開発は、多大な可能性を秘めていますが、その実現にはまだ多くの課題があります。これらの課題を克服するためには、基礎研究から臨床試験に至るまで、綿密な研究と協力が必要です。
治療法開発に向けたプロセシングの調節
RNA分析が疾患診断において有用である理由はいくつかあります。以下に、その主な利点を挙げます。
遺伝子発現の詳細なプロファイル: RNA分析は、細胞や組織内での遺伝子発現の動態を理解することを可能にします。これにより、正常な状態と疾患状態を比較し、特定の疾患や状態に関連する遺伝子発現の変化を特定できます。
早期診断と予後の予測: 特定のRNA分子やそのパターンは、疾患の早期段階での変化を示すバイオマーカーとして機能することがあります。これにより、疾患の早期診断や進行の監視、さらには患者の予後の予測が可能になります。
疾患の分子メカニズムの解明: RNA分析により、疾患の原因となる遺伝子やパスウェイの変化を特定できます。これは、疾患の基本的な分子メカニズムを理解し、新たな治療標的を発見するための重要な手がかりとなります。
パーソナライズドメディシンへの応用: 患者特有のRNAプロファイルを分析することで、その人に最も効果的な治療法や薬剤を特定することができます。これは、パーソナライズドメディシンの実現に向けた重要なステップです。
治療効果のモニタリング: RNA分析は、治療による遺伝子発現の変化を監視し、治療の有効性を評価するために使用されます。これにより、治療計画の調整や個々の患者に最適な治療法の選択が可能になります。
非侵襲的サンプリング: 血液中の循環RNAやエクソソームRNAなど、非侵襲的にサンプルを採取して分析することが可能です。これにより、患者への負担を軽減しつつ、疾患の診断やモニタリングを行うことができます。
RNA分析は、これらの利点を活かして、疾患診断、治療選択、治療効果のモニタリングに革命をもたらす可能性があります。これは、個々の患者に合わせたより効果的でパーソナライズされた医療の提供に貢献するでしょう。
第5章: 東京大学と東京大学医科学研究所による最新研究
東京大学におけるRNAプロセシング研究の歴史
東京大学ではRNAプロセシングに関する研究が盛んに行われてきました。以下に、RNAプロセシングの歴史と一部の成果を紹介します。
●RNAのエクソンとイントロン構造の発見 (1970年代):
1970年代にRNAのエクソンとイントロン構造が発見されました。これはRNAスプライシングの制御機構に関する重要な研究であり、RNAの遺伝情報の処理において重要な役割を果たしています1。
●自己複製する最小のRNAの発見 (2023年):
東京大学の研究者は、わずか20塩基の短いランダム配列のRNA集団から特定のRNA配列と構造が自発的に出現し、さらにそれらが自己複製することを世界で初めて実証しました。この研究は、原始的な生命が情報や機能を拡張して複雑化していく過程の一端を明らかにし、生命の起源の解明に寄与しています。
●mRNAワクチンの研究開発 (1990年以降):
東京大学医科学研究所の石井健教授によれば、mRNAワクチンを含む様々なワクチンの研究開発に長年携わってきました。mRNAは生物の体内に豊富に存在し、mRNAワクチンはウイルスの情報を記載したRNAを体内に入れてたんぱく質を作らせ、免疫細胞を訓練してウイルスに対する免疫をつける仕組みを利用しています34。
これらの研究成果は、RNAの役割や進化に関する理解を深め、将来的には医療や生命科学の分野に大きな影響を与えることが期待されています。
東京大学医科学研究所の研究成果と今後の展望
東京大学医科学研究所のRNAプロセシング研究部門は、近年、膨大な種類の機能性RNAが発見されています。これらの機能性RNAに関する研究成果は、学術研究の発展に加え、病気の原因解明や治療という実用的な応用研究の発展とその実現にも大きく貢献しています。
この研究部門では、次世代の医薬開発と生体分子機能の解明を目的に、RNAを用いた生理活性物質制御の研究を行っています。具体的には、RNAの新しい機能のメカニズムを分子生物学的・生化学的・細胞生物学的に解析し、ゲノム情報を活用したゲノムワイドな作用機序について研究しています。
このような研究は、将来的には遺伝子治療薬や新たな医薬品の開発に寄与することが期待されています。RNAの役割を理解することで、疾患の治療法や予防法に新たな道を切り拓くことができるかもしれません。
第6章: 研究と治療の未来
RNAプロセシング研究の新たな方向性
RNAプロセシングの研究は、遺伝学、分子生物学、細胞生物学の分野において急速に進展しており、新たな技術と発見がこの領域を大きく拡張しています。この研究の新たな方向性は、疾患の理解を深め、将来の治療法の開発に貢献する可能性を秘めています。以下は、RNAプロセシング研究のいくつかの新たな方向性です。
高スループットシークエンシング技術の利用: RNAシークエンシング技術の進化は、細胞内のRNA分子のダイナミクスを詳細に理解するのに役立っています。特に、シングルセルRNAシークエンシング(scRNA-seq)は、個々の細胞レベルでのRNAプロセシングの違いを解明するのに有効です。
●RNA編集の研究: RNA編集は、転写後にRNA分子が化学的に修正されるプロセスです。ADARやAPOBECなどのRNA編集酵素の役割を理解することで、遺伝子発現の調節機構や自己非自己識別、さらには疾患発症メカニズムについての知識が深まります。
RNA編集は、転写後のRNA分子に化学的な修正を加えるプロセスであり、その結果としてRNAの塩基配列がDNAテンプレートとは異なる配列に変化します。このプロセスは、特定の細胞型、組織、または発達段階で特有のタンパク質のバリアントを生成するために、遺伝情報の表現を細かく調節する手段を提供します。
RNA編集の主な形式
RNA編集の最も一般的な形式の一つは、アデノシンからイノシンへの変換(A-to-I編集)です。これは、特にヒトを含む脊椎動物で広く観察されます。イノシンは、翻訳の際にグアノシン(G)として扱われるため、RNA編集はタンパク質のアミノ酸配列に直接影響を与えることがあります。この変換は、ADAR(Adenosine Deaminases Acting on RNA)という酵素によって触媒されます。
RNA編集の影響
タンパク質の多様性の増加: RNA編集により、同じDNA配列から異なるタンパク質が生成されるため、生物のタンパク質の多様性が増します。これにより、生物は様々な環境や状況に適応する能力を高めます。
神経系の機能調節: 神経系では、RNA編集がシナプスの形成や神経伝達物質の受容体の機能調節など、神経系の正常な機能維持に重要な役割を果たします。例えば、グルタミン酸受容体やセロトニン受容体のRNA編集は、その活性やリガンドへの親和性を変化させることが知られています。
遺伝子発現の調節: RNA編集は、mRNAの安定性や翻訳効率にも影響を与えることがあり、遺伝子の発現レベルの調節に寄与します。
RNA-DNA配列の相違
RNA編集によるRNA-DNA配列の相違は、セントラルドグマにおいてRNAやタンパク質のアミノ酸配列が直接DNA配列から決定されるという考え方に挑戦します。これは、生物が遺伝情報を利用して機能的な多様性を実現するための追加的な機構を持っていることを示しています。RNA編集は、生物の複雑性と適応性の理解を深める重要な要素となっています。
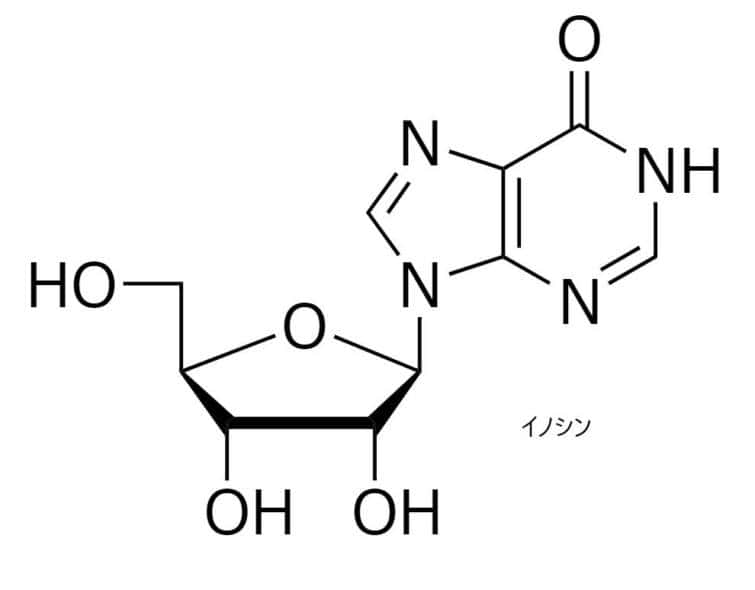
RNA編集により特定部位のアデノシン(A)の脱アミノ化が起こってDNA配列中のAが、RNAでイノシンに変換され、これが翻訳するときにGと読まれ、特に神経系の遺伝子発現やタンパク機能を変化させてしまうのです。
●非コードRNAの機能解析: 長い非コーディングRNA(lncRNA)や小さな非コーディングRNA(例:miRNA)は、遺伝子の発現を調節する重要な役割を果たしています。これらのRNA分子の機能と、疾患における役割の解明は、新たな治療標的の同定につながる可能性があります。
●RNA結合タンパク質の研究: RNA結合タンパク質(RBPs)は、RNAのプロセシング、輸送、安定性、翻訳の調節に不可欠です。RBPsとRNA分子との相互作用を詳細に理解することで、RNAメタボリズムの異常が関連する疾患のメカニズムを明らかにすることができます。
●CRISPR-Casシステムを用いたRNA操作: CRISPR-Cas技術は、ゲノム編集に革命をもたらしましたが、最近ではRNA編集にも応用されています。これにより、特定のRNA分子を標的とすることで、疾患モデルの作成や治療法の開発が可能になります。
●疾患モデルの発展: 人工多能性幹細胞(iPSCs)やオルガノイドを使用した疾患モデルは、RNAプロセシング異常が関与する疾患の生物学的基盤を解明する上で重要なツールです。これらのモデルを用いることで、疾患特異的なRNAプロセシングパターンを特定し、新たな治療標的を発見することが期待されます。
これらの新たな方向性は、RNAプロセシングの複雑さとその生物学的および医学的重要性を浮き彫りにしています。研究の進展により、RNAプロセシングが関与する疾患のより良い理解と治療法の開発が進むことが期待されます。
疾患治療に向けた新技術の開発
RNAプロセシングに関連する技術は、疾患治療において大きな可能性を秘めています。RNAプロセシングとは、pre-mRNA(前駆体mRNA)が成熟mRNAへと加工される一連の過程を指し、スプライシング、エディティング、輸送などのプロセスを含みます。これらの過程は細胞の機能と遺伝子発現の調節に不可欠であり、不具合が生じると多くの疾患が引き起こされることが知られています。以下に、疾患治療に向けた新技術の開発で特に注目されている領域をいくつか紹介します。
1. RNA干渉(RNAi)技術
RNA干渉は、特定のmRNAを標的として選択的に沈黙させることにより、病気関連遺伝子の発現を抑制する技術です。この技術は、がん、感染症、遺伝性疾患などの治療において有望な結果を示しています。
2. mRNAワクチンと治療
mRNAワクチンは、特定の抗原コードを持つmRNAを体内に導入し、自身の細胞を使って抗原タンパク質を産生させることで免疫反応を引き起こす技術です。COVID-19パンデミックにおいて大きな成功を収めたこの技術は、がんや自己免疫疾患の治療にも応用されています。
3. RNAエディティング
RNAエディティング技術は、特定のRNA分子の塩基配列を直接編集し、遺伝子の機能を修正または調節することができます。この技術は、遺伝性疾患の原因となる遺伝子変異を修正するために研究されています。
4. アンチセンスオリゴヌクレオチド(ASO)
アンチセンスオリゴヌクレオチドは、特定のmRNAに結合してその機能をブロックまたは変更する短いDNAまたはRNAの断片です。これにより、疾患関連遺伝子の発現を効果的に抑制することができます。神経変性疾患や特定の遺伝子疾患の治療において、既にいくつかのASOが承認されています。
5. CRISPR-Cas9を用いたRNAターゲティング
CRISPR-Cas9技術は、ゲノム編集に革命をもたらしましたが、最近ではRNAを標的とする応用も開発されています。このアプローチは、疾患関連遺伝子のRNAを特異的に編集または調節することにより、治療に役立てることが可能です。
これらの技術は、疾患治療のパラダイムを変える可能性を秘めており、遺伝性疾患、がん、感染症など多岐にわたる疾患に対する治療法の開発に寄与しています。これらの進歩は、個々の患者に対するより効果的でパーソナライズされた治療戦略の実現に向けた一歩となるでしょう。
【関連記事】
- 遺伝病を理解するためのヒトゲノム入門編【1】ヒトゲノムから染色体へ
- 遺伝病を理解するためのヒトゲノム入門編【2】DNAの構造
- 遺伝病を理解するためのヒトゲノム入門編【3】染色体の構造
- 遺伝病を理解するためのヒトゲノム入門編【4】ヒトゲノムを構成するもの
- 遺伝病を理解するためのヒトゲノム【5】ゲノム情報伝達の仕組み:基礎編
- 遺伝病を理解するためのヒトゲノム【6】ゲノム情報伝達の仕組み:細胞周期
- 遺伝病を理解するためのヒトゲノム【7】ゲノム情報伝達の仕組み:減数分裂
- 遺伝病を理解するためのヒトゲノム【8】ゲノム情報伝達の仕組み:配偶子形成と受精減数分裂






