目次
エピジェネティクスは、遺伝子の機能が変化するメカニズムを探る学問であり、DNA配列の変更なしに遺伝子の活性が制御されることに焦点を当てます。この入門記事では、DNAメチル化やヒストン修飾などのエピジェネティックな現象と、これらが人間の健康や疾患にどのように影響を及ぼすかを解説します。最新の研究から日常生活における応用まで、エピジェネティクスの魅力とその生命科学における重要性を紐解いていきます。
エピジェネティクスとは?
定義と基本概念
エピジェネティクスは、遺伝子の発現に影響を与えるが、DNAの配列自体は変化しない一連の現象を指します。この分野は、遺伝子のオン・オフを切り替える様々なメカニズムや、細胞の特性や機能がどのように環境や生活習慣によって変化するかを研究しています。エピジェネティクスの変化は、細胞分裂時にも次世代の細胞に伝わることがあり、時には数世代にわたって影響を及ぼすこともあります。
主要なエピジェネティックメカニズム
- DNAメチル化: DNAのシトシン塩基にメチル基が付加され、遺伝子の発現が抑制される現象です。DNAメチル化のパターンは細胞の種類によって異なり、発生や細胞分化に重要な役割を果たします。
- DNAメチル化: DNAのシトシン塩基にメチル基が付加され、遺伝子の発現が抑制される現象です。DNAメチル化のパターンは細胞の種類によって異なり、発生や細胞分化に重要な役割を果たします。
- DNAメチル化: DNAのシトシン塩基にメチル基が付加され、遺伝子の発現が抑制される現象です。DNAメチル化のパターンは細胞の種類によって異なり、発生や細胞分化に重要な役割を果たします。
- ヒストン修飾: ヒストンタンパク質に化学基が付加されることで、DNAの巻きつき具合が変わり、遺伝子のアクセシビリティが調整されます。アセチル化、メチル化、リン酸化など、様々な修飾が存在します。
- ノンコーディングRNA: マイクロRNAや長鎖ノンコーディングRNAなど、タンパク質をコードしないRNA分子が遺伝子の発現を調節する役割を持ちます。これらはmRNAの翻訳を抑制したり、特定の遺伝子領域の構造を変化させたりします。
エピジェネティクスの重要性
エピジェネティクスは、遺伝情報の読み出し方を調節することで、生物の多様性や適応性を高める基盤となります。また、がんや心血管疾患、神経発達障害など、多くの疾患の発症機序にエピジェネティックな変化が関与していることが明らかになっています。そのため、エピジェネティクスの研究は新たな治療法や予防法の開発に向けた重要な鍵を握っています。
この分野の理解を深めることは、生命の複雑な調節機構を解き明かし、健康や疾患に関する新しい知見を得るための基盤となります。
遺伝性とエピジェネティックの関連
遺伝性とエピジェネティックスは、生物学的特徴や疾患の発現において互いに重要な役割を果たしますが、そのメカニズムや影響の仕方は異なります。これらの概念を理解することは、特に性分化疾患(DSD)などの複雑な条件における発症メカニズムや治療法の開発において重要です。
遺伝性
遺伝性は、親から子へとDNAの形で遺伝情報が伝達されるプロセスを指します。これには、遺伝子の変異や特定の遺伝子配列が含まれ、個体の形質や疾患のリスクを決定します。遺伝子はタンパク質の設計図として機能し、身体の成長、発達、機能のために必要なタンパク質を合成する指示を提供します。遺伝性疾患は、遺伝子変異によって直接引き起こされる状態であり、これらの変異は親から子へと遺伝することがあります。
エピジェネティックス
エピジェネティックスは、遺伝子の活性を変化させるがDNA配列自体は変更しない一連のプロセスを指します。エピジェネティックな変化は、遺伝子の発現を制御し、特定の遺伝子がオンまたはオフになるかを決定することにより、個体の発達、病気の感受性、および環境因子への反応に影響を与えます。エピジェネティックなメカニズムには、DNAメチル化、ヒストン修飾、ノンコーディングRNAの活動などがあります。これらの変化は、生活習慣、栄養状態、ストレス、化学物質への暴露など、外部からの環境因子によって引き起こされることがあります。
遺伝性とエピジェネティックスの関連
遺伝性とエピジェネティックスは相互に作用し合い、生物学的特性や健康状態の決定に寄与します。たとえば、遺伝的素因はエピジェネティックな変化の感受性を高めることがあり、その逆もまた真です。エピジェネティックな調節は、遺伝的に予め決定された発現パターンを変更することができ、これにより同じ遺伝子セットを持つ個体でも、異なる環境条件下で異なる表現型が現れることがあります。
疾患への影響
性分化疾患の文脈では、遺伝的変異はDSDの原因として直接的な役割を果たすことがありますが、エピジェネティックな調節がこれらの条件の表現や重症度に影響を及ぼす可能性もあります。エピジェネティックな変化による遺伝子の発現調節は、性ホルモンの感受性や代謝経路に影響を与え、DSDの臨床的特徴に多様性をもたらすことがあります。
遺伝性とエピジェネティックスの関連を理解することは、個別化医療への道を開き、特にDSDを含む複雑な疾患に対するより効果的で個人に合わせた治療戦略の開発に貢献する可能性があります。研究者たちは、これらのメカニズムをさらに解明し、将来の治療法の革新に役立てるために努力を続けています。
エピジェネティクスの研究と歴史
研究の進化と次世代シーケンス
エピジェネティクス研究の進化は、遺伝情報の読み出し方に影響を与えるDNA以外の要因を解明する分野です。DNAメチル化、ヒストン修飾、ノンコーディングRNAなどのエピジェネティックな変化は、遺伝子の発現を調節し、多くの生物学的プロセスや疾患の発症に関与しています。次世代シーケンス(NGS)技術の出現と進化は、エピジェネティクス研究を大きく前進させ、この複雑な調節システムの理解を深めることを可能にしました。
エピジェネティクス研究の進化
エピジェネティクスの概念は20世紀半ばに初めて導入されましたが、研究の主流となったのは近年のことです。エピジェネティクスは、環境因子や生活習慣が遺伝子発現に与える影響、そしてこれらの影響がどのように遺伝するかを研究します。エピジェネティクスの研究は、がん、神経疾患、代謝症候群、心理学的状態など、さまざまな疾患の発症メカニズムを理解する上で不可欠な役割を果たしています。
次世代シーケンス(NGS)とエピジェネティクス
次世代シーケンス技術は、DNAやRNAの配列を迅速かつ大規模に解析することを可能にしました。エピジェネティクス研究においてNGSが果たす役割は以下の通りです。
- DNAメチル化解析: NGSは、ゲノム全体のメチル化パターンを高解像度でマッピングすることを可能にします。これにより、特定の疾患や状態に関連するメチル化変化を特定できます。
- ヒストン修飾のマッピング: NGSを利用することで、ヒストン修飾がゲノム上でどのように分布しているかを詳細に調べることができ、遺伝子発現の調節メカニズムを理解する手がかりを提供します。
- ノンコーディングRNAの同定と定量: 小さなRNA分子、特にmiRNAやlncRNAなど、遺伝子の発現を調節するノンコーディングRNAの役割を解明するためにNGSが使用されます。
研究の展望
エピジェネティクスとNGS技術の進化は、遺伝子発現の調節に関する新しい理解をもたらし、個別化医療への応用を含め、未来の医学に革命を起こす可能性を秘めています。特に、エピジェネティックな変化を逆転させることによる疾患治療の新しいアプローチが期待されています。さらに、エピジェネティックマーカーを利用した疾患の早期診断やリスク評価も、将来的には可能になるかもしれません。
次世代シーケンス技術の継続的な進化とともに、エピジェネティクス研究はさらに深まり、生命科学のさまざまな分野において新たな発見と応用が期待されています。
重要な発見と学術的貢献
エピジェネティクスの研究分野には、多くの重要な発見があり、それらは生命科学や医学における理解を大きく進展させてきました。以下は、エピジェネティクスにおけるいくつかの画期的な発見と、その学術的貢献についてです。
1. バラ色のアザミの発見
1940年代、バーバラ・マクリントックはトウモロコシの遺伝子が染色体上で位置を変えることができる「転移因子」を発見しました。彼女のこの発見は、遺伝子の発現に影響を与えるエピジェネティックなメカニズムの初期の証拠とされ、1983年にはノーベル生理学・医学賞を受賞しました。マクリントックの研究は、遺伝子の動的な性質と複雑な調節機構を理解する上での基礎を築きました。
2. X染色体不活化の発見
メアリー・ライオンは、哺乳類の雌の細胞において、二つのX染色体のうち一つが不活化されるという現象を1960年代に提唱しました。このX染色体不活化はエピジェネティックなメカニズムによって行われ、性染色体の不均衡を調節します。ライオンの発見は、性差を含む遺伝的表現型の多様性を理解する上で重要な役割を果たしています。
3. DNAメチル化と遺伝子サイレンシング
1970年代には、DNAメチル化が遺伝子の発現を抑制する重要なメカニズムであることが明らかになりました。この発見は、遺伝子がオンまたはオフになるエピジェネティックな制御の基本原理を提供しました。DNAメチル化は、がんを含む多くの疾患の発症メカニズムと密接に関連しています。
4. ヒストン修飾の発見
2000年代初頭、ヒストンタンパク質における化学的修飾が遺伝子発現の調節に重要であることが広く認識され始めました。ヒストン修飾(例えばアセチル化やメチル化)によって、染色体の構造が変化し、遺伝子がアクセスしやすくなったり、アクセスが制限されたりします。この発見は、細胞の遺伝子発現パターンを理解する上での大きな進歩となりました。
5. ノンコーディングRNAの役割の発見
近年、ノンコーディングRNAが遺伝子の発現を調節する重要なエピジェネティックな役割を果たすことが明らかになりました。これらのRNA分子は、遺伝子のサイレンシング、プロモーター領域の調節、クロマチンの構造変化など、多様なメカニズムを介して作用します。ノンコーディングRNAの研究は、疾患の診断や治療の新たなアプローチを提供しています。
これらの発見は、エピジェネティクスの分野を形成し、発展させてきた基盤です。エピジェネティックな変化が生物の発達、健康、疾患に及ぼす影響の理解は、今後も生命科学や医学の進歩に不可欠な要素であり続けるでしょう。
エピジェネティクスのメカニズム
DNAメチル化とヒストン修飾
エピジェネティクスは、遺伝子の活性化や抑制を制御するメカニズムであり、DNAの配列を変えることなく遺伝子の発現パターンに影響を与えます。エピジェネティクスの主要なメカニズムには、DNAメチル化とヒストン修飾があります。これらのプロセスは、細胞の特定の時期や特定の環境下での遺伝子のオン/オフを調節し、発達、老化、疾患の進行といった多くの生物学的プロセスに重要な役割を果たします。
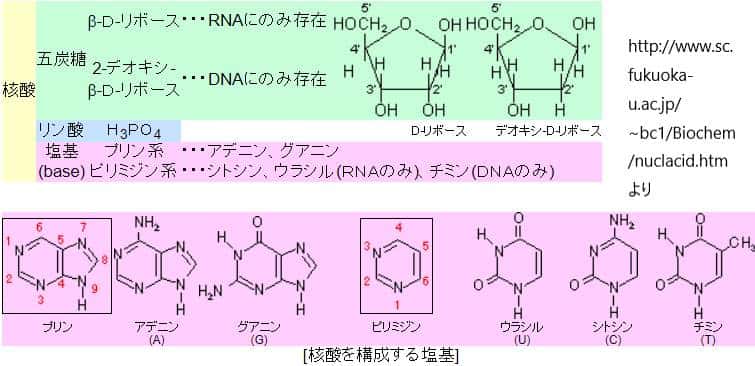
DNAメチル化
DNAメチル化は、シトシン塩基の5位炭素にメチル基(-CH3)を付加する化学修飾プロセスです。このメチル化は主にCpGダイヌクレオチド(シトシンの後にグアニンが来る配列)に発生します。DNAメチル化は一般的に遺伝子の発現を抑制する役割を果たし、特に遺伝子のプロモーター領域にメチル基が付加された場合、その遺伝子は通常、沈黙化されます。このプロセスは、細胞分化、X染色体の不活性化、インプリンティング、老化、がんの進行などに関与しています。
ヒストン修飾
ヒストン修飾は、DNAが巻き付いているタンパク質であるヒストンのアミノ酸残基に対する化学的変更を指します。これにはアセチル化、メチル化、リン酸化、ウビキチン化など多様な修飾が含まれます。ヒストンのアセチル化(アセチル基の付加)は一般的に遺伝子の発現を促進し、DNAがヒストンから緩やかに巻き解けることを可能にし、転写因子がアクセスしやすくなります。逆に、ヒストンのメチル化はコンテクストに依存し、遺伝子の活性化または沈黙化のいずれかを促進することがあります。
これらのエピジェネティックな修飾は、細胞の型に応じて遺伝子の特定のセットを活性化または非活性化することにより、細胞のアイデンティティを維持するのに役立ちます。例えば、肝細胞と脳細胞は同じDNAを持っていますが、エピジェネティックな修飾のパターンの違いにより、それぞれ異なる遺伝子が活性化され、異なる細胞機能が実現されます。
まとめ
DNAメチル化とヒストン修飾は、遺伝子の発現を調節するエピジェネティックなメカニズムの2つの主要な例です。これらのメカニズムにより、遺伝子の発現は遺伝的指令だけでなく、細胞の経験や環境に応じて柔軟に調整されることが可能になります。エピジェネティックな変化は、健康と病気の両方の文脈で重要であり、研究者はこれらのプロセスをさらに理解し、新しい治療法の開発に役立てることを目指しています。
エピジェネティックな制御の例
エピジェネティックな制御は、遺伝子の発現をDNAの配列を変えることなく調節する一連の機構を指します。これらの機構は、生物の発達、細胞の分化、疾患の発生と進行において重要な役割を果たします。以下は、エピジェネティックな制御の具体的な例です。
1. DNAメチル化
DNAメチル化は、シトシン塩基にメチルグループが付加されることによって発生します。このエピジェネティックな修飾は、遺伝子プロモーター領域のメチル化により遺伝子発現が抑制されることが多いです。例えば、がん細胞では、正常な細胞成長を抑制する遺伝子のプロモーター領域が過剰にメチル化され、その結果、これらの遺伝子がサイレンスされることがあります。
DNAメチル化はシトシン塩基のピリミジン環の5位にある炭素のメチル化により生じます。
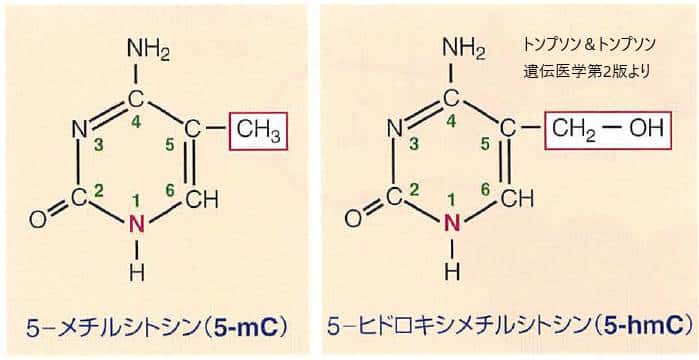
過剰なDNAメチル化は遺伝子発現が抑制されている目印です。細胞分化や発生段階での特定の遺伝子発現プログラムにともなってよく用いられています。一般的に、DNAメチル化はCpGジヌクレオチドのCで起こります。、 つまり、シトシン、グアニンと続くジヌクレオチドのシトシンがメチル化されて5メチルシトシンになることがDNAメチル化です。メチル化CpGに特異的に結合するタンパクが遺伝子発現を抑制し、さらにはこのタンパクにクロマチン修飾酵素が結合して転写を抑制します。5-メチルシトシン(5-mC)の存在は細胞分裂の過程を経て忠実に伝達される安定したエピゲノムの目印となっています。
がんではしばしばメチル化状態が変化していて、大きなゲノム領域での低メチル化や、特にCpGアイランドでの部分的な高メチル化がみられます。
過剰な脱メチル化は生殖細胞や発生の初期段階に起こっていて、クロマチン環境の再設定により接合子や幹細胞たちでの全能性あるいは多能性と呼ばれるポテンシャルが回復します。
この再プログラミングの過程には5-mCからDNAの脱メチル化の中間体と考えられる5ーヒドロキシメチルシトシン5-hmCへの酵素的転換が関与しているようなのですが、まだ詳細はわかっていません。一般的には5-mCレベルは成人組織では安定で全シトシンの約5%、5-hmC レベルははるかに微量かつ全シトシンの0.1-l%とよく変動します。
5-hmCはゲノムに広く存在していますが、調節領域で最も高レベルなので、特定のプロモーターやエンハンサーの調節に関与している可能性があります。
2. ヒストン修飾
ヒストン修飾は、ヒストンタンパク質に対する化学的変更(アセチル化、メチル化、リン酸化など)によってDNAの構造とアクセス性が変化します。ヒストンのアセチル化は一般に遺伝子発現の促進と関連しており、逆にメチル化は遺伝子発現の抑制または促進に影響を与えることができます。これらの修飾は、遺伝子が活性化されるか、またはサイレンスされるかを決定するのに重要です。
エピゲノムの目印のメチル化以外のもう一つは、H2A、H2B、H3、H4といったコアヒストンの修飾です。これらの修飾には特定のアミノ酸残基のメチル化、リン酸化、アセチル化などがあります。
エピゲノムの修飾は、クロマチンの凝縮やアクセスしやすさに影響したり、シグナルに応じてその部位の遺伝子発現を活性化したり抑制したりするタンパク複合体にシグナルを出したりすることにより遺伝子発現に影響を及ぼすと考えられています。
修飾部位は実験的に調べることができ、修飾部位を特異的に標識する抗体を用いてゲノム規模に解析すると、そうした部位が何十も確認できます。
さまざまな組織や細胞種でのプロモーター、エンハンサー、遺伝子の様々なヒストン修飾の特異的なパターンが見つかっています。50近い細胞種で最もよく見られる12種類の修飾を解析しそれぞれのクロマチンプロファイルを統合して、 ヒトゲノムの半分以上に推定される機能を割り当てました。この知見から示唆されたことは、従来の意味のコード領域はゲノム中の2%にも満たないことから、機能をもつゲノム領域は非常に少ないと考えられていたが細胞種を区別する遺伝子発現パターンの決定に果たすゲノムの機能は直接的・間接的問わず従来の予想よりはるかに大きいことがわかってきました。
●H3K9メチル化
9番目のリシンがメチル化したヒストンH3(H3K9メチル化、Kはリシンを示す。アミノ酸記号のリンクを参照してください)
発現が抑制されたゲノム領域の抑制の目印。
●H3K27アセチル化
27番目のリシンがアセチル化したヒストンH3(H3K27アセチル化)
活性化される調節領域の目印。
3. ノンコーディングRNAによる制御
ノンコーディングRNAは、遺伝子の発現を調節する様々な方法で機能します。例えば、微小RNA(miRNA)は特定のメッセンジャーRNA(mRNA)に結合し、そのmRNAの翻訳を阻害するか、分解を促進することによって遺伝子発現を抑制します。これにより、細胞内でのタンパク質のレベルが精密に調節されます。
4. X染色体不活化
哺乳類の雌では、二つあるX染色体のうちの一つがランダムに不活化されます。これは、X染色体上の遺伝子が過剰に発現することを防ぐためです。X染色体不活化は、XISTというノンコーディングRNAによって誘導され、特定のX染色体全体がメチル化され、ヒストンが修飾されることで遺伝子がサイレンスされます。
これらのエピジェネティックな制御機構は、細胞や組織の特定の状態を維持するために、または外部の環境変化に対して適応するために不可欠です。また、これらの機構の異常は、がんや神経退行性疾患などの多くの疾患の根底にあり、エピジェネティクスの研究はこれらの疾患の理解と治療の開発に役立つ可能性があります。
エピジェネティクスと疾患
エピジェネティクスが関わる主な疾患
エピジェネティクスは、DNAの配列を変更せずに遺伝子の活性を制御する一連のメカニズムを指し、疾患の発生と進行において重要な役割を果たします。エピジェネティックな変化は、正常な細胞機能の維持に不可欠ですが、不適切なエピジェネティックな調整が起こると、さまざまな疾患のリスクが高まります。
エピジェネティクスとがん
がんは、エピジェネティックな変化と最も密接に関連する疾患の一つです。特定の遺伝子の発現が不適切に制御されることで、細胞の増殖が促進されたり、細胞死のプログラムが阻害されたりします。例えば、腫瘍抑制遺伝子のプロモーター領域の過剰なDNAメチル化は、これらの遺伝子の沈黙化につながり、細胞の成長制御機構の喪失に寄与します。同様に、ヒストンの修飾パターンの変化も、がん遺伝子の活性化や腫瘍抑制遺伝子の非活性化に関与しています。
エピジェネティクスと神経精神疾患
神経精神疾患もまた、エピジェネティックな変化によってその発症や進行が影響を受けることが示されています。ストレス、栄養状態、薬物暴露などの環境因子は、脳内の遺伝子発現パターンを変化させるエピジェネティックな調整を引き起こすことがあり、これがうつ病、統合失調症、自閉症スペクトラム障害などの疾患の発生に寄与する可能性があります。
エピジェネティクスと心血管疾患
心血管疾患のリスクも、エピジェネティックなメカニズムによって部分的に調節されることがあります。例えば、過剰なDNAメチル化は、血管炎症や動脈硬化の発展に関与する遺伝子の発現を変化させることがあります。また、生活習慣の選択がエピジェネティックなプロファイルに影響を与え、心血管系の健康に長期的な影響を及ぼす可能性があります。
エピジェネティクスと代謝疾患
肥満や2型糖尿病などの代謝疾患は、エピジェネティックな調整の変化によって影響を受ける可能性があります。食事や運動などの生活習慣が、代謝関連遺伝子のエピジェネティックな調整を通じてエネルギー代謝に影響を及ぼし、これらの疾患の発症リスクを高めることがあります。
結論
エピジェネティックスは、疾患の発生、発症、進行において重要な役割を果たします。これらの発見は、疾患の新たな予防戦略や治療法の開発につながる可能性があります。例えば、DNAメチル化パターンやヒストン修飾を正常化する薬物は、特定のがんや他の疾患の治療において有望なアプローチと考えられています。エピジェネティックな研究はまだその初期段階にあり、これらのメカニズムの完全な理解に向けた研究が今後も続けられることが期待されています。
疾患研究への影響と治療への応用
エピジェネティクスは、遺伝子の活性を変化させるがDNA配列自体を変えない一連の生物学的プロセスを指します。この分野の研究は、疾患の発生機序の理解と、新たな治療法の開発に大きな影響を与えています。エピジェネティックな変化には、DNAメチル化、ヒストン修飾、ノンコーディングRNAの活動などが含まれ、これらの変化はがん、神経障害、心血管疾患、自己免疫疾患など多くの病状に関連しています。
疾患研究への影響
病態生理学の解明:
エピジェネティクスの研究は、特定の疾患における遺伝子発現の異常を明らかにし、その病態生理を理解するのに役立ちます。たとえば、特定のがんで見られるDNAメチル化のパターンが、腫瘍の成長や転移にどのように寄与しているかを示すことができます。
早期診断とリスク評価:
エピジェネティックマーカーは、がんやアルツハイマー病などの疾患の早期診断やリスク評価に有用です。これらのマーカーは、疾患の初期段階での変化を示すことが多く、予後の改善につながる早期介入の可能性を開きます。
環境因子との関係:
エピジェネティクスは、環境因子が遺伝子発現に与える影響の橋渡しをします。食生活、ストレス、化学物質への曝露など、生活習慣が疾患の発生にどのように関与するかを理解することができます。
治療への応用
エピジェネティック療法:
DNAメチル化阻害剤やヒストン脱アセチル化酵素(HDAC)阻害剤など、エピジェネティックな変化を標的とした薬剤が、特にがん治療において有効性を示しています。これらの薬剤は、異常な遺伝子発現を正常化し、腫瘍の成長を抑制することができます。
パーソナライズドメディシン:
患者個々のエピジェネティックなプロファイルを基にした治療戦略の開発が進んでいます。これにより、より効果的で副作用の少ない治療法の提供が可能になります。
ライフスタイル変更の推奨:
適切な食生活や運動がエピジェネティックな変化に良い影響を与え、疾患のリスクを減少させる可能性があります。このため、予防医学においてもエピジェネティクスは重要な役割を果たします。
エピジェネティクスの研究は、疾患の根本的なメカニズムを理解し、新たな治療法を開発するための重要な手段となっています。今後も、この分野の進展が疾患治療のパラダイムを変えていくことが期待されます。
エピジェネティクスのリソースとツール
研究に役立つ主要リソースとデータベース
エピジェネティクスの研究においては、データの収集、解析、共有が不可欠です。この目的のために開発された多くのリソースとデータベースがあります。これらは、エピジェネティックな変化の広範なカタログ、研究ツール、および分析ソフトウェアを提供しています。以下に、エピジェネティクス研究に役立つ主要なリソースとデータベースを紹介します。
1. ENCODE (Encyclopedia of DNA Elements)
ENCODEプロジェクトは、ヒトゲノムの機能的要素を特定し、カタログ化することを目的としています。このデータベースには、ヒストン修飾、DNAメチル化、ノンコーディングRNAの発現など、エピジェネティックな情報が豊富に含まれています。
2. TCGA (The Cancer Genome Atlas)
TCGAは、がん細胞の遺伝子発現、遺伝的変異、DNAメチル化パターンを含む広範なゲノムデータを提供します。がんのエピジェネティクス研究において重要なリソースです。
3. Roadmap Epigenomics Project
このプロジェクトは、多様なヒト細胞と組織におけるエピジェネティックな変化の包括的なマップを作成しています。DNAメチル化、ヒストン修飾、クロマチンアクセシビリティなどのデータが含まれます。
4. GEO (Gene Expression Omnibus)
GEOは、遺伝子発現データセットおよびその他の機能ゲノミクスセットをアーカイブするデータベースです。エピジェネティクス研究に関連する多くの実験データが含まれています。
5. dbGaP (Database of Genotypes and Phenotypes)
dbGaPは、遺伝的変異と表現型データを結びつける研究結果を収集し、提供するデータベースです。エピジェネティクスの観点から、遺伝子発現やメチル化パターンと疾患の関連を探るのに役立ちます。
6. epiRBase
ノンコーディングRNAとその標的遺伝子との相互作用に特化したデータベースです。ノンコーディングRNAによるエピジェネティックな調節メカニズムの理解に貢献します。
7. MethDB
DNAメチル化に特化したデータベースで、メチル化パターン、関連する疾患、メチル化関連遺伝子の情報を提供します。このリソースは、特定のメチル化イベントが疾患発生にどのように関与するかを理解するのに役立ちます。
これらのリソースとデータベースを活用することで、エピジェネティクスの研究者は、遺伝的およびエピジェネティックな変化の複雑なネットワークを解明し、生命の多様性と疾患のメカニズムをより深く理解することができます。
実験手法と機器、CHIP技術
エピジェネティクスの研究では、遺伝子の発現を制御するエピジェネティックな修飾を検出し、分析するために多様な実験手法と機器が用いられます。これらの技術は、DNAメチル化パターン、ヒストンの修飾状態、クロマチンの構造変化などを調べるために開発されています。ChIP(クロマチン免疫沈降)技術は、エピジェネティクス研究において特に重要な方法の一つです。
エピジェネティクスの実験手法
DNAメチル化解析:
ビスルフィートシークエンシング: DNAをビスルフィート処理してメチル化シトシンを特定し、メチル化パターンを全ゲノムレベルで解析します。
メチル化特異的PCR (MSP): ビスルフィート処理したDNAを用いて、特定の遺伝子領域のメチル化状態をPCRで検出します。
ヒストン修飾解析:
ウェスタンブロッティング: 特定のヒストン修飾を検出するために抗体を用いるタンパク質分析技術。
質量分析 (MS): ヒストンタンパク質の精密な修飾状態を特定するための高度な分析技術。
クロマチン構造解析:
クロマチン免疫沈降 (ChIP): 特定の修飾を持つヒストンまたは特定の転写因子に結合しているDNA領域を同定するために使用されます。
ATAC-seq (Assay for Transposase-Accessible Chromatin using sequencing): クロマチンのアクセシビリティを測定し、転写が活性化されている領域を特定します。
ChIP技術
クロマチン免疫沈降(ChIP)は、特定の転写因子やヒストン修飾が結合しているDNA領域を同定する強力な技術です。このプロセスは、次のステップで構成されます。
固定化: 細胞をフォーマルデヒドなどの化学物質で処理し、タンパク質とDNAの間の相互作用を固定化します。
ソノケーションまたは酵素処理: クロマチンを物理的に断片化し、アクセスしやすくします。
免疫沈降: 特定のヒストン修飾または転写因子に対する抗体を使用して、修飾されたクロマチン断片を選択的に捕捉します。
DNAの精製と同定: タンパク質-DNA複合体からDNAを精製し、PCR、シークエンシング、またはチップオンチップ分析を通じて、結合しているDNA領域を同定します。
ChIP-seq(クロマチン免疫沈降後のシークエンシング)は、全ゲノムスケールで特定のタンパク質-DNA相互作用をマッピングするために広く用いられています。この技術は、転写制御ネットワーク、エピジェネティックな修飾のパターン、遺伝子発現の調節機構を理解する上で貴重な情報を提供します。
結論
エピジェネティクスの実験手法と機器は、生物学的複雑さを理解し、疾患のメカニズムを解明するための重要なツールです。特にChIP技術は、エピジェネティックな研究において不可欠な方法であり、遺伝子の制御機構と疾患との関連を探求する上で中心的な役割を果たしています。
エピジェネティクスの社会への影響
SNSと公式情報源
エピジェネティクスに関する情報を提供するソーシャルネットワークサービス(SNS)アカウントや公式情報源を探す場合、以下のようなアプローチをお勧めします。ただし、特定のアカウントやウェブサイトを紹介することはできませんが、一般的なガイドラインとして以下の情報を提供します。
専門家や研究機関のSNSアカウント
大学や研究機関: 多くの大学や研究機関では、自らの研究成果を広く一般に伝えるためにSNSを活用しています。これらのアカウントでは、エピジェネティクスを含む最新の科学的発見が共有されることがあります。
研究者個人のアカウント: エピジェネティクスの分野で活躍する研究者や科学者も、自分の研究や興味のあるトピックについてSNSで情報を共有しています。これらのアカウントをフォローすることで、分野の最先端に触れることができます。
学会や専門団体: エピジェネティクスや関連分野の学会や専門団体は、定期的に学術会議の情報や重要な研究成果をSNSで共有しています。これらのアカウントは、専門的な情報源として非常に価値があります。
公式情報源
学術ジャーナル: エピジェネティクスに関連する研究を発表している学術ジャーナルは、最新の研究成果を知るための重要な情報源です。多くのジャーナルでは、オンラインで研究記事を公開しており、一部は無料でアクセス可能です。
学術データベース: PubMedやGoogle Scholarなどの学術データベースを利用することで、エピジェネティクスに関する論文やレビュー記事を検索することができます。
専門のニュースサイト: 科学研究や医学の最新ニュースを取り扱うウェブサイトも、エピジェネティクスの研究進展についての情報を提供しています。これらのサイトは、研究成果を一般向けにわかりやすく解説していることが多いです。
注意点
情報の正確性: 情報の出所を確認し、信頼できるソースから得られた情報に基づいて行動することが重要です。
最新の情報: 科学の分野では新しい発見が常に行われているため、最新の情報を得るために定期的にチェックすることが推奨されます。
エピジェネティクスに関する情報を探求する際には、上記のガイドラインに従って、信頼性の高いソースを見つけることが重要です。
エピジェネティクスを学ぶためのセミナーとSchool
エピジェネティクスを学ぶためのセミナーや教育機関(School)を探す際には、以下のような方法や場所で情報を得ることができます。これらはエピジェネティクスの基礎から応用、最新の研究トピックまで幅広く学ぶためのリソースです。
●オンラインコースとMOOCs(大規模公開オンライン講座)
CourseraやedX: これらのプラットフォームでは、世界中の大学や研究機関が提供するエピジェネティクスに関するコースを見つけることができます。初心者向けから上級者向けまで、幅広いレベルのコースがあります。
Khan Academy: 基礎レベルでの生物学や遺伝学のコースを提供しており、エピジェネティクスの基本概念を理解するのに役立つかもしれません。
●大学や研究機関
多くの大学や研究機関では、エピジェネティクスに関連する学部・大学院コースや短期セミナーを提供しています。これらのプログラムは、深い理解を求める学生や研究者に向けて設計されており、しばしば実験室での実習や最新の研究成果に基づいた講義が含まれます。
●専門学会やカンファレンス
エピジェネティクス関連の学会やカンファレンスは、最新の研究成果を学び、分野の専門家とネットワーキングする絶好の機会です。これらのイベントでは、通常、セミナーやワークショップが開催され、参加者が直接知識を深めることができます。
●その他のリソース
科学雑誌や専門誌: 「Nature」や「Science」のような科学雑誌は、エピジェネティクスの最新の研究トピックに関するレビュー記事や研究論文を定期的に掲載しています。
専門のウェブサイトやブログ: エピジェネティクスに焦点を当てた専門のウェブサイトやブログは、研究のハイライト、インタビュー、教育資料を提供しており、この分野について学ぶための有益な情報源となります。
エピジェネティクスは急速に進化している分野であるため、最新の情報にアクセスするためには、定期的にこれらのリソースをチェックすることが重要です。また、自分の学習目標や関心に合わせて、適切なレベルと形式の教育プログラムを選択することが大切です。
よくある質問とその回答
Q1: エピジェネティクスとは何ですか?
A1: エピジェネティクスは、遺伝子の活性を変化させるがDNAの配列自体は変更しない一連の生物学的過程を指します。この調節は、DNAメチル化、ヒストン修飾、ノンコーディングRNAの活動などによって行われ、細胞の機能や遺伝子の発現パターンに影響を与えます。
Q2: エピジェネティックな変化は遺伝しますか?
A2: 一部のエピジェネティックな変化は親から子へと遺伝する可能性があります。これにより、環境や生活習慣が将来の世代に影響を及ぼすことがありますが、この現象はまだ完全には理解されていません。
Q3: エピジェネティクスが健康にどのように影響を与えますか?
A3: エピジェネティクスは、疾患の発症や進行に大きな役割を果たします。例えば、がん、心血管疾患、精神疾患など多くの病状は、エピジェネティックな変化によってその発現や重症度が変わることがあります。また、生活習慣や環境因子によるエピジェネティックな変化は、健康状態に直接的な影響を及ぼすことがあります。
Q4: エピジェネティクスを変化させることは可能ですか?
A4: はい、エピジェネティックな変化は可逆的であり、生活習慣の変更、薬物療法、栄養摂取などによって変化させることが可能です。これは、特定の疾患の治療や予防に新たなアプローチを提供する可能性があります。
Q5: エピジェネティクスの研究はどのような意義がありますか?
A5: エピジェネティクスの研究は、生物学的複雑さと多様性を理解する上で不可欠です。また、疾患の新たな治療法や予防策の開発、健康維持のための戦略立案に役立ちます。エピジェネティクスは、遺伝子だけでなく、環境や生活習慣が私たちの健康にどのように影響を与えるかを明らかにすることにより、パーソナライズドメディスンの進展にも貢献しています。
最新情報とトピックス
最近のエピジェネティクスの研究では、健康と疾患に対するエピジェネティックメカニズムの影響について、新たな理解を深めるいくつかの画期的な発見がなされました。以下は、最新の研究ニュースに基づいたハイライトです。
Bdelloid Rotifersにおける新規エピジェネティックマークの発見:研究者たちは、以前は細菌でのみ知られていたN4-メチルシトシン (4mC)という第三の主要なエピジェネティックマークをbdelloid rotifersrらが同定しました。この発見は、異なる生物におけるエピジェネティック調節の理解に新たな層を加えます。
水ミジンコにおける汚染のエピジェネティック効果:環境因子によって誘発されたエピジェネティック修正が、人口に長期間にわたる影響を及ぼし、進化過程に影響を与える可能性があることを示唆する研究があります。低用量の汚染物質であっても、世代を超えたエピジェネティック効果を誘発し、それが多くの世代にわたって安定して伝わることを示しています。
血管生成のためのユニークな「スイッチ」の発見:科学者たちは、出生後の期間に血管発達に必須な遺伝子を誘導する転写因子に関連する特定の「スイッチ」を発見しました。この発見は、血管発達と疾患の理解に重要な意味を持ちます。
親特異的遺伝子活性化のエピジェネティックメカニズムの解読:遺伝的刷り込みの現象、つまり一方の親(母親または父親)から受け継がれた遺伝子のみが活性化されるという現象に関する洞察が提供され、遺伝性疾患、がん、心血管疾患の理解に寄与しています
植物におけるエピゲノムの多様化:CLASSY遺伝子ファミリーが、組織特異的な方法でゲノムのどの部分をオフにするかを調節することが示されました。この研究は、CLSY遺伝子をエピジェネティック多様性と調節の背後にある主要因子として同定しています。
父親から受け継いだIGF2遺伝子のインプリンティング制御領域がメチル化されていない場合、病気を引き起こす可能性があることがわかりました。
これらの発見は、エピジェネティック調節の複雑さと重要性を強調し、健康と疾患の理解を深めるために新たな道を開きます。エピジェネティックマークやメカニズムの発見は、私たちのゲノムと環境との間の動的な相互作用の理解を提供し、疾患の分子基盤の理解と標的治療戦略の開発に貢献する可能性があります。
【関連記事】
- 遺伝病を理解するためのヒトゲノム入門編【1】ヒトゲノムから染色体へ
- 遺伝病を理解するためのヒトゲノム入門編【2】DNAの構造
- 遺伝病を理解するためのヒトゲノム入門編【3】染色体の構造
- 遺伝病を理解するためのヒトゲノム入門編【4】ヒトゲノムを構成するもの
- 遺伝病を理解するためのヒトゲノム【5】ゲノム情報伝達の仕組み:基礎編
- 遺伝病を理解するためのヒトゲノム【6】ゲノム情報伝達の仕組み:細胞周期
- 遺伝病を理解するためのヒトゲノム【7】ゲノム情報伝達の仕組み:減数分裂
- 遺伝病を理解するためのヒトゲノム【8】ゲノム情報伝達の仕組み:配偶子形成と受精減数分裂






