疾患概要
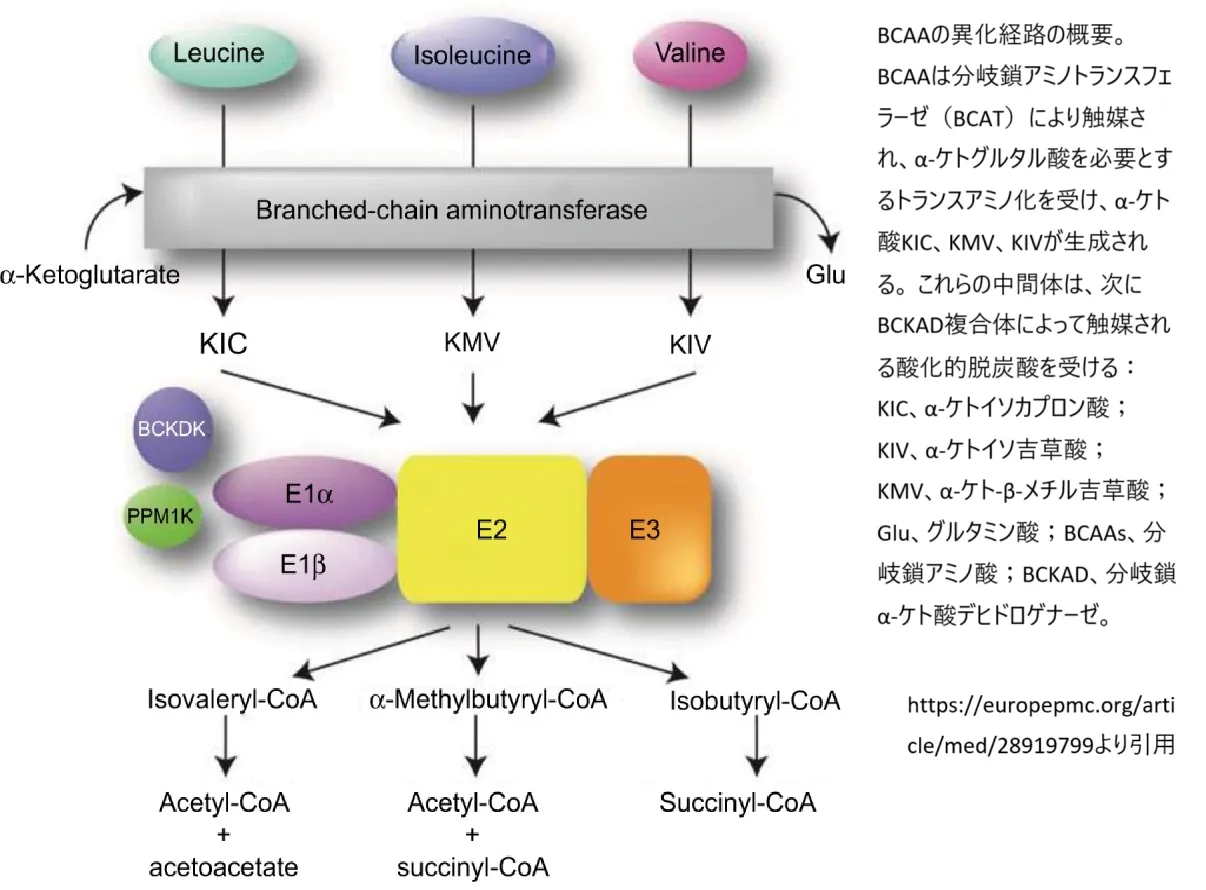
メープルシロップ尿症(MSUD)は、複数の遺伝子の変異によって引き起こされる可能性があり、主に3つの遺伝子が関与しています。これらの遺伝子は染色体19q13上のBCKDHA、染色体6q14上のBCKDHB、染色体1p21上のDBTで、分岐鎖α-ケト酸デヒドロゲナーゼ複合体(BCKDC)の触媒成分をコードしています。この複合体は、ロイシン、イソロイシン、バリンといった分岐鎖アミノ酸の代謝に不可欠です。
さらに、第3の構成要素であるE3(DLD;238331)の変異もMSUDと関連がありますが、これは染色体7q31上に位置し、DLD欠損症(DLDD;246900)として知られています。この状態は、MSUDと重複する症状を示すものの、より重篤な形態を取ることがあり、時にMSUD3とも呼ばれます。これらの遺伝子変異により、MSUDが引き起こされると、患者は代謝異常による様々な健康問題に直面することになります。
メープルシロップ尿症(MSUD)1a型
Maple syrup urine disease, type Ia メープルシロップ尿症Ia型 248600 AR 3
メープルシロップ尿症(MSUD)1a型は、BCKDHA遺伝子の変異によりb引き起こされる遺伝性代謝障害です。この遺伝子には80以上の変異が確認されており、これらの変異は多くの場合、生後すぐに明らかになる重症の病型を引き起こします。MSUDの名前は、患者の尿に特徴的な甘い臭いがあることから来ています。
MSUDの主な症状には、哺乳不良、嘔吐、元気のなさ(嗜眠)、異常な運動、発達の遅れなどがあります。BCKDHA遺伝子の変異は、分岐鎖α-ケト酸デヒドロゲナーゼ(BCKD)酵素複合体のαサブユニットのアミノ酸配列に影響を及ぼし、一般的には1個のアミノ酸の変化が見られます。特にオールド・オーダー・メノナイト集団で一般的な変異は、438位のチロシンがアスパラギンに置き換わるもの(Tyr438AsnまたはY438Nと表記)です。
この変異により、BCKD酵素複合体の機能が損なわれ、体内でロイシン、イソロイシン、バリンの効果的な分解が妨げられます。これにより、これらのアミノ酸とその副産物が体内に蓄積し、細胞や組織、特に神経系に対して毒性を示します。その結果、発作、発達遅延、およびMSUDに関連するその他の健康問題が引き起こされる可能性があります。
メープルシロップ尿症(MSUD)1b型
Maple syrup urine disease, type Ib メープルシロップ尿症Ib型 248600 AR 3
メープルシロップ尿症(MSUD)患者において、BCKDHB遺伝子には90以上の変異が確認されています。これらの変異は主に、生後間もない時期に重症の病型を引き起こすことが多いです。MSUDの名前は、罹患した乳幼児の尿に特徴的な甘い臭いがすることから来ています。症状には乳不良、嘔吐、元気のなさ(嗜眠)、異常な運動、発育の遅れなどが含まれます。
BCKDHB遺伝子の変異の多くは、BCKD酵素複合体のβサブユニット中の単一アミノ酸の変化を引き起こします。例えば、βサブユニットの183位のアルギニンをプロリンに置き換える変異(Arg183ProまたはR183P)などがあります。また、遺伝子内に少量のDNAが挿入または欠失することによる変異も存在します。
これらの変異は、BCKD酵素複合体の正常な機能を破壊し、ロイシン、イソロイシン、バリンの効果的な分解を妨げます。結果として、これらのアミノ酸とその副産物が体内に蓄積し、細胞や組織、特に神経系に有毒な影響を及ぼします。これは発作、発達遅延、MSUDに関連するその他の健康問題を引き起こす可能性があります。
メープルシロップ尿症(MSUD)2型
メープルシロップ尿症(MSUD)患者におけるDBT遺伝子の変異は70以上確認されており、多くは軽度の変異型です。これらの変異は通常、乳幼児期や小児期に明らかになり、適切な治療が行われない場合、発達遅延やその他の健康問題を引き起こす可能性があります。
メープルシロップ尿症では、DBT遺伝子に70種類以上の変異が確認されていますが、多くは軽度なケースで、乳児期後半から小児期に症状が現れます。治療がない場合、発育遅延やその他の健康問題を引き起こすことがあります。DBT遺伝子の変異は、DNAの塩基対の変化や少量の挿入・欠失によって起こり、これによりE2成分の機能が阻害されます。結果として、BCKD酵素複合体がロイシン、イソロイシン、バリンを分解できなくなり、これらのアミノ酸が体内に蓄積し、特に神経系に悪影響を与えます。これにより、発育遅延や他の健康問題が発生します。
DBT遺伝子の変異には、単一のDNA構成要素(塩基対)の変化や、遺伝子内に少量のDNAが挿入または欠失することが含まれます。これらの変化は分岐鎖α-ケト酸デヒドロゲナーゼ(BCKD)酵素複合体のE2成分の正常な機能を破壊し、ロイシン、イソロイシン、バリンの効果的な分解を妨げます。結果的に、これらのアミノ酸とその副産物が体内に蓄積し、細胞や組織、特に神経系に対して毒性を示します。この蓄積により、発達遅延やMSUDに関連する他の健康問題が引き起こされる可能性があります。
メープルシロップ尿症に共通する症状など
メープルシロップ尿症(MSUD)は、特定のアミノ酸を適切に処理できない遺伝性の疾患です。この病気の名前は、罹患した乳幼児の尿に特有の甘い臭いがあることからつけられました。この疾患には哺乳不良、嘔吐、元気のなさ(無気力)、異常な動き、発達遅延などの特徴があります。治療を受けない場合、メープルシロップ尿症は発作、昏睡、さらには死に至る危険があります。
メープルシロップ尿症は、その徴候や症状のパターンに基づいて分類されることが一般的です。最も一般的で重篤な形態は古典型で、これは生後すぐに症状が現れます。変異型は乳幼児期や小児期、あるいはそれ以降に発症することがあり、一般に軽症ですが、適切な治療が行われない場合には発育遅延やその他の健康上の問題を引き起こす可能性があります。
命名法
MSUD IA型:E1-αサブユニット遺伝子の変異に起因するメープルシロップ尿症。このサブユニットはBCKD複合体の機能に重要で、変異は古典型MSUDを引き起こすことが多いです。
MSUD IB型:E1-βサブユニット遺伝子の変異によるもの。E1-βサブユニットもBCKD複合体の重要な部分であり、この変異によってMSUDが発生します。
MSUD II型:E2サブユニット遺伝子の欠損に起因。E2サブユニットはBCKD複合体の中心的な部分であり、その欠損はメープルシロップ尿症の異なる形態を引き起こす可能性があります。
MSUD III型:E3サブユニットの変異による表現型。ただし、Chuang and Shih (2001)によると、このタイプの疾患はMSUD III型と呼ばれることもありますが、一般的にはE3またはジヒドロリポアミド脱水素酵素欠損症(246900)として知られています。このサブユニットの変異は、Hong et al. (1996)の要約によると、他の代謝障害を引き起こすこともあります。
さらに、PPM1K遺伝子の変異(611065)によって引き起こされるMSUDの軽度変異型(MSUDMV; 615135)も存在します。この変異型は、BCKD複合体の活性を調節するため、MSUDのより軽い形態を示すことがあります。
臨床的特徴
古典的重症MSUD
古典的重症MSUDは、Menkesら(1954年)によって最初に報告された家族性の症候群です。生後1週目に発症し、3ヵ月以内に死亡することが多い。尿はメープルシロップのような臭いがする特徴があります。
Westallら(1957年)は、この症候群を「メープルシロップ尿症」と命名し、分岐鎖アミノ酸の濃度が異常に高いことを発見しました。
Menkes(1959年)は、患者の尿から対応するケト酸を単離し、分岐鎖アミノ酸の代謝経路が障害されていることを示しました。
Dancisら(1960年)はこの疾患を「分岐鎖ケト酸尿症」とも呼びました。
古典的MSUDでは、BCKD複合体の活性が非常に低く、新生児は通常、生後4~7日に症状が出現します。
Wongら(1972年)は古典的なMSUDの症例を報告しました。
DiGeorgeら(1982年)は、特定の食事を与えた場合のMSUDの進行について重要な観察を行いました。
Shih(1984年)は、新生児スクリーニングで古典的なMSUDが見逃される可能性があることを指摘しました。
Frezalら(1985年)は、異なるタイプのMSUDが同じ家族に発生するケースを観察しました。
Kaplanら(1989年)は、MSUDの子供たちの心理検査を行い、早期治療の重要性を強調しました。
Van Calcarら(1992年)は、食事制限による治療に成功した古典的MSUDの女性のケースを報告しました。
このように、古典的重症MSUDに関する多くの研究が行われており、その理解と治療法の向上に貢献しています。
中間型メープルシロップ尿症(MSUD)
中間型メープルシロップ尿症(MSUD)は、症状の重症度が古典的MSUDと軽症MSUDの間に位置する形態です。1970年にSchulmanらによって初めて報告されたこの形態の患者は、身体的発育は正常でしたが、重度の発達遅滞が見られました。この患者は蛋白質制限には反応があったものの、チアミン投与には反応がなかったと報告されています。また、白血球と線維芽細胞でBCKD酵素複合体の活性が15〜25%残存していました。
Kalyanaramanらは、運動亢進と精神遅滞を示す中間型MSUDの患者2人を報告し、Chhabriaらは眼球麻痺を示した新生児を報告しましたが、これらも中間型MSUDであることが判明しました。
1985年、Gonzalez-Riosらは、ケトアシドーシス性昏睡、易刺激性、哺乳不良、成長・発達遅延の既往を有する男児を報告しました。この患者はBCKD複合体のE1成分の欠損があるものの、酵素活性は残存していました。チアミン投与には反応がなく、分岐鎖アミノ酸の制限により改善が見られました。
2001年、Schadewaldtらは、MSUD患者における全身のL-ロイシン酸化を測定しました。古典的MSUDの患者では酸化がほとんど行われず、重篤な変異型の女性では酸化率がコントロールの約4%でした。中間型を含む軽症の患者では、全身のL-ロイシン酸化の残存率はかなり高く、コントロールの19〜86%(平均59±24%)でした。これは、線維芽細胞の分岐鎖2-オキソ酸デヒドロゲナーゼ複合体活性の残存率よりも高い数値です。
間欠型メープルシロップ尿症(MSUD)
間欠型メープルシロップ尿症(MSUD)は、症状の発現が周期的で、しばしば無症状の期間が存在するMSUDの一形態です。このタイプのMSUDは、古典型MSUDと異なり、症状が時々発生することが特徴です。主な研究報告は以下の通りです:
Morris et al. (1961, 1966): Morrisらは、24ヵ月齢の女性の間欠性MSUDを報告しました。彼女は16ヵ月齢まで無症状でしたが、中耳炎の後に運動失調、嗜眠、半昏睡、尿中の分岐鎖ケト酸の上昇などの症状が出現しました。彼女の弟も10ヵ月齢で急性発作を経験しました。彼らには食事による蛋白質制限が有効であったことが示されました。
Dancis et al. (1967): Dancisらは2つの家系の兄弟における間欠性MSUDを観察しました。これらの子供たちは尿中の分岐鎖アミノ酸とケト酸の上昇、および尿の特有の臭いを伴う一過性の神経障害を経験しました。症状の発現が遅く、発作と発作の間は臨床的に正常であったことから、古典型MSUDとは異なるとされました。
Goedde et al. (1970): Goeddeらは間欠型MSUDを持つノルウェー人の2家族を報告しました。彼らは、間欠型MSUDでは両親のうち1人だけが酵素活性の低下を示すことを観察しました。
Van der Horst and Wadman (1971): この研究では、精神遅滞と重篤なアシドーシスのエピソードを有する間欠型MSUDの症例が報告されましたが、食事療法により部分的に回復しました。
その他の報告: KiilとRokkones (1964)、Valmanら (1973)、およびIndoら (1988) によっても間欠型MSUDの症例が報告されています。
これらの報告は、間欠型MSUDが古典型MSUDとは異なる臨床的特徴を持つことを示しています。特に、症状の間欠的な発現や、特定の家族歴におけるパターンが注目されています。
チアミン反応性メープルシロップ尿症(MSUD)
チアミン反応性メープルシロップ尿症(MSUD)は、特定の治療法に反応するMSUDの一種です。
Scriverら(1971年)は、食事制限とチアミン塩酸塩(1日10mg)の投与によって高アミノ酸血症が完全に改善されたMSUDの変種を報告しました(1985年のScriverらの研究も参照)。また、Duranら(1978年)とDuran and Wadman(1985年)も、チアミン投与によるMSUDの治療成功を報告しています。
Chuangら(1982年)は、チアミン応答性MSUDにおいてBCKDH複合体活性が正常の約30~40%であることを発見しました。さらなる研究により、チアミン応答性MSUDでの主な欠陥が、変異型BCKDのチアミンピロリン酸に対する親和性の低下であることが示されました。
チアミン投与に反応するMSUDの2症例において、Zhangら(1990年)はE1-αサブユニットの遺伝子配列が正常であることを発見しました。これは、チアミン結合部位がE1-βサブユニットに関与している可能性、E1-αサブユニット上に結合部位が存在するが、他の部位の変異によりチアミン結合部位の親和性が変化している可能性、またはチアミンに対する臨床反応がE1-βまたはE2タンパク質の変異による酵素の安定化によるものである可能性が考えられます。
フェヌグリーク茶による「偽メープルシロップ尿症」
チュニジアのMonastiriら(1997年)の報告によると、地中海沿岸の人々にはメープルシロップがほとんど知られていないため、MSUD(メープルシロップ尿症)の尿の臭いはメープルシロップよりもフェヌグリークを連想させるとされています。フェヌグリーク豆は地中海沿岸で病人のための煎じ薬として伝統的に使用されており、その香ばしい匂いは地域ではよく知られています。
Monastiriらは、地中海沿岸諸国の医師に対して、新生児の神経学的苦痛を伴う尿にフェヌグリーク臭があれば、MSUDを疑うべきであると示唆しています。
Sewellら(1999年)は、フェヌグリーク茶の飲用が原因で「偽メープルシロップ尿症」を起こしたエジプト人乳児の症例を報告しています。この乳児はフェヌグリークの種子を含むハーブティーを飲んだ後、マギー(調味料)に似た香りの尿を排泄しました。
乳児の尿からはメープルシロップ尿症の香りの原因となる化合物ソトロンが検出され、これはフェヌグリークの種子から作られたお茶に含まれていたことが判明しました。
特に中東諸国からの乳幼児を診察する際、医師はフェヌグリーク茶の摂取を考慮し、不必要で費用のかかる検査を避けるべきであるとされています。
この研究は、地域や文化によって症状の解釈が異なること、そして特定の食品や飲料が病気の診断に影響を与える可能性があることを示しています。
遺伝的異質性
メープルシロップ尿症(MSUD)の遺伝的異質性に関する重要な研究は以下の通りです。
Lyons et al. (1973): この研究では、異なる患者の線維芽細胞から作られたヘテロカリオン(異なる遺伝的背景を持つ細胞が融合した細胞)を用いて、MSUDにおける遺伝的異質性を探求しました。ある患者からの線維芽細胞が、BCKD(分岐鎖ケト酸デヒドロゲナーゼ)のレベルを増加させることで、別の患者からの線維芽細胞を補完する現象が観察されましたが、臨床的発現との直接的な相関は見られませんでした。
Singh et al. (1977) と Jinno et al. (1984): これらの研究もまた、遺伝的異質性に答えるための相補性解析を行いました。特にJinnoらは、リンパ球細胞株を用いた研究でその有用性を示し、2つの相補群を特定しました。この2つのグループは、3つが変異型MSUD患者から、2つが古典型MSUD患者から得られたもので、臨床的なグループに対応していました。
Indo et al. (1988): この研究では、MSUDの表現型に対応すると考えられるBCKDH複合体酵素活性の変化と動態を発見しました。古典型、中間型、間欠型のMSUDでは、複合体活性のレベルが上昇し、それぞれ異なる動態(シグモイド型、シグモイド型に近い型、双曲線型)を示しました。
Fisher et al. (1989): この研究では、血縁関係のない7人のMSUD患者の細胞培養において、E1-αおよびE2タンパク質のノーザンおよびウェスタンブロット分析を行い、mRNAとタンパク質のサブユニットの含量に基づいて、いくつかの異なる分子表現型を示しました。これはMSUDの遺伝的複雑性を実証するものでした。
これらの研究は、MSUDが遺伝的に多様であることを示しています。遺伝的異質性は、症状の発現、酵素活性のレベル、および分子表現型の違いにより明らかにされています。
遺伝
頻度
メープルシロップ尿症は、世界全体で推定して新生児約185,000人に1人の割合で発症する疾患です。特に、オールド・オーダー・メノナイトの集団ではこの病気がより一般的であり、新生児約380人に1人の割合で発生すると推定されています。
原因
これらの遺伝子のいずれかに変異が生じると、タンパク質複合体の機能が低下または失われ、ロイシン、イソロイシン、バリンの適切な分解が妨げられます。これにより、これらのアミノ酸とその代謝産物が体内に蓄積し、高濃度では脳や他の器官にとって有毒になります。この蓄積はメープルシロップ尿症に関連する深刻な健康問題を引き起こす可能性があります。
研究者たちは、メープルシロップ尿症と関連があるかもしれない、同じタンパク質複合体に作用する他の遺伝子についても研究を進めています。
治療・臨床管理
Bodner-Leideckerら(2000年): 7歳の古典的MSUD患者が、A型肝炎感染による末期肝不全のため同所肝移植を受けた事例を報告。移植後は制限のない食事を維持し、分岐鎖L-アミノ酸と2-オキソ酸の血漿中濃度は安定していたが、L-アロイソロイシン濃度は著しく上昇していた。この患者は、L-アロイソロイシンとロイシンの排泄速度が正常であったが、肝外からの基質供給の増加が血漿中濃度の上昇の原因であると示唆された。
Mortonら(2002): BCKDHA遺伝子のY393N変異のホモ接合体を持つメノナイト系MSUD患者35人と、Y393N変異とスプライスサイト変異の複合ヘテロ接合体を持つ非メノナイト系患者1人を報告。罹患した新生児は、生後12~24時間の間にアミノ酸分析によって同定された。生後3日以降に診断された乳児18名は、メープルシロップ様の臭い、ジストニック姿勢、痙攣、脳浮腫などの神経学的障害を有していた。全36例の追跡調査では、新生児期以降の全入院率は低く、全例が良好な発達転帰を示した。Mortonらは、内因性蛋白異化を抑制し、蛋白合成を維持し、アミノ酸欠乏を防ぎ、血清浸透圧を正常に保つ治療プロトコルを提案し、生後数日以内の診断の重要性を強調した。
これらの研究は、MSUDの早期診断と適切な管理が重要であること、さらに特定の場合には肝移植が有効な治療選択肢となり得ることを示しています。
分子遺伝学
古典的MSUD患者において、Zhangら(1989、1991)はE1-αサブユニットをコードする遺伝子に変異を同定しました(608348.0001)。後に、Chuangら(1994)はこの患者のBCKDHA遺伝子に2番目の変異を同定しました(608348.0002)。それぞれの親は1つの突然変異に対してヘテロ接合体でした。
血縁関係のないヒスパニック系メキシコ人の中間型MSUD患者4人のうち3人で、Chuangら(1995)はBCKDHA遺伝子にホモ接合性の突然変異を同定しました(608348.0003)。4番目の患者は別の変異(608348.0004)のホモ接合体でした。
PatelとHarris(1995)はBCKDHA遺伝子で報告された7つの点突然変異、1つの小さな欠失、1つの小さな挿入を模式的に示しました。
E1-βサブユニット遺伝子の突然変異
信国ら(1991)は古典的MSUDの患者においてE1-β遺伝子のエクソン1にホモ接合性の11-bp欠失を同定しました(248611.0001)。
アシュケナージ系ユダヤ人の古典的MSUD患者7人中6人において、Edelmannら(2001)はBCKDHB遺伝子のR183P変異(248611.0002)のホモ接合または複合ヘテロ接合を同定しました。
Chuangら(2004)は、イスラエル人の古典的MSUD患者3人においてBCKDHB遺伝子(248611.0003-248611.0006)のホモ接合体または複合ヘテロ接合体変異を同定しました。
E2成分遺伝子の変異
古典的MSUDの症例において、Herringら(1991)はBCKDH複合体のE2成分をコードするDBT遺伝子に124bpの欠失を同定しました(248610.0001)。
チアミン応答性MSUD患者の細胞株において、Fisherら(1991)はDBT遺伝子(248610.0002および248610.0003)の突然変異の複合ヘテロ接合を同定しました。
MSUDの中間型を持つ日本人患者において、鶴田ら(1998)はDBT遺伝子の突然変異(248610.0005-248610.0008)のホモ接合性または複合ヘテロ接合性を同定しました。
これらの研究は、MSUDの異なる亜型や個別の遺伝的変異の理解を深める上で重要な役割を果たしています。
遺伝子型と表現型の関係
Flaschkerら(2007年)は、MSUDの変異型患者15人を研究し、重篤な表現型はBCKDHA遺伝子の変異と関連していること、軽度な変異型はBCKDHBおよびDBT遺伝子の変異と関連している傾向があることを発見しました。
これらの研究は、MSUDにおける遺伝子の変異と臨床的転帰の関係を明らかにし、患者の管理と治療戦略に重要な情報を提供しています。特に、患者のIQや代謝状態などの臨床的転帰に関して、遺伝子型の影響を理解することが重要です。また、これらの発見は、早期発見と適切な食事療法の導入が治療の成功において重要であることを強調しています。
集団遺伝学
MSUDの発生率が最も高いとされるのはペンシルバニア州のオールド・オーダー・メノナイトで、出生176人に1人の頻度で古典的MSUDが見られました(DiGeorgeら、1982年)。
Matsudaら(1990)はメノナイトの症例に特異的な遺伝子欠損を発見しました。
ChuangとShih(2001)は、MSUDの世界的な発生率は出生185,000人に1人であると指摘しています。
NellisとDanner(2001)は、臨床的にMSUDと診断された63人の細胞を調査し、E1-α遺伝子の突然変異が33%、E1-β遺伝子の突然変異が38%、E2遺伝子の突然変異が19%であることを発見しました。
Quentalら(2008、2009)は、ポルトガル南部のジプシーコミュニティーにおいて、BCKDHA遺伝子に特定のホモ接合性欠失を同定し、ポルトガル系ジプシーにおける創始者変異であることを明らかにしました。
Feuchtbaumら(2012)は、カリフォルニア州で生まれた新生児を対象にした大規模スクリーニングを実施し、中東、フィリピン、ヒスパニックなど特定の民族グループにおけるMSUDの推定有病率を報告しました。
これらの研究は、MSUDの発生率が特定の民族や地域集団で高いことを示しており、遺伝的背景や民族的特徴がMSUDの発生に影響を与える可能性があることを示唆しています。また、新生児スクリーニングの重要性を強調し、早期発見と適切な治療による管理が重要であることを示しています。
動物モデル
メープルシロップ尿症(MSUD)の理解を深めるために、動物モデルが重要な役割を果たしています。
無角のヘレフォード子牛における研究
Zhangら(1991)は、メープルシロップ尿症を発症した無角のヘレフォード子牛において、E1-α遺伝子のCからTへの置換を証明しました。この置換は、タンパク質のリーダーペプチドに停止コドンを導入しました。
胚性ラットニューロンにおける研究
Gortzら(2003)は、一次解離した胚性ラットニューロンにおいて、自発的ネットワーク活性が細胞外ロイシンやα-ケトイソカプロン酸の増加により用量依存的に可逆的に減少またはブロックされることを発見しました。対照的に、静止電位、膜電流、および細胞内カルシウムはこれらの物質の影響を受けませんでした。彼らは、グルタミン酸作動性/GABA作動性神経伝達物質の放出の異常または濃度の不均衡が、MSUDにおける急性の神経細胞機能障害を引き起こすと結論づけました。
ENU誘発マウス突然変異誘発プログラムにおける研究
Wuら(2004)は、大規模なN-エチル-N-ニトロソ尿素(ENU)誘発マウス突然変異誘発プログラムにおいて、血清中の分岐鎖アミノ酸の顕著な上昇とアルギニンの中程度の増加を特徴とする表現型を同定しました。臨床的には、罹患マウスは成長障害、衰弱、自発運動の低下、薄毛を示し、これはメープルシロップ尿症のヒトに見られる特徴でした。彼らは、Bcat2遺伝子のエクソン2およびイントロン2の5-プライムスプライシング部位のコンセンサス配列にホモ接合性のT-to-C転移を同定し(113530)、エクソン2の欠失をもたらしました。RT-PCRでは、筋肉と肝臓のBcat2 mRNAの量がコントロールと比較して著しく減少しました。著者らは、エクソン2にはミトコンドリア標的化リーダー配列が含まれていることを指摘しました。分岐鎖アミノ酸の少ない食事は、マウスの臨床的改善をもたらしました。
これらの動物モデルは、MSUDのメカニズムの解明と治療法の開発において非常に重要な役割を担っています。
疾患の別名
BRANCHED-CHAIN ALPHA-KETO ACID DEHYDROGENASE DEFICIENCY
BCKD DEFICIENCY
KETO ACID DECARBOXYLASE DEFICIENCY
MAPLE SYRUP URINE DISEASE, CLASSIC, INCLUDED
MAPLE SYRUP URINE DISEASE, INTERMEDIATE, INCLUDED
MAPLE SYRUP URINE DISEASE, INTERMITTENT, INCLUDED
MAPLE SYRUP URINE DISEASE, THIAMINE-RESPONSIVE, INCLUDED
MAPLE SYRUP URINE DISEASE, TYPE IA, INCLUDED; MSUD1A, INCLUDED
MAPLE SYRUP URINE DISEASE, TYPE IB, INCLUDED; MSUD1B, INCLUDED
MAPLE SYRUP URINE DISEASE, TYPE II, INCLUDED; MSUD2, INCLUDED
BCKD deficiency
Branched-chain alpha-keto acid dehydrogenase deficiency
Branched-chain ketoaciduria
Ketoacidemia
MSUD
分岐鎖ケト酸尿症
分岐鎖α-ケト酸デヒドロゲナーゼ欠損症
bckd欠損症
ケト酸脱炭酸酵素欠損症
メープルシロップ尿症、古典的、含む
メープルシロップ尿症、中間型を含む
メープルシロップ尿症、間欠性、含む
メープルシロップ尿症、チアミン反応性、含まれる
メープルシロップ尿症、ia型、含まれる; msud1a、含まれる
メープルシロップ尿症、ib型、含まれる;msud1b、含まれる
メープルシロップ尿症II型、含まれる; msud2、含まれる
BCKD欠損症
分岐鎖α-ケト酸デヒドロゲナーゼ欠損症
分岐鎖ケトアシド尿症
ケトアシド血症
メープルシロップ尿症の理解と管理
新生児マススクリーニングによる早期発見
新生児マススクリーニングは、メープルシロップ尿症などの先天的疾患を早期に発見するための重要な手段です。このスクリーニングにより、新生児の血液から特定の異常を検出し、早期に適切な治療を開始することが可能になります。早期発見と治療は、病気の進行を防ぎ、患者の生活の質を向上させることに貢献します。
メープルシロップ尿症は、約50万出生に1名の頻度で見つかっています。年間発見数についての具体的な数値はこの情報からは直接得られませんが、日本において新生児の数が年間約100万人程度であることを考慮すると、2年に1人程度、またはそれよりわずかに高い頻度で発見されている可能性があります。また、別の情報源では、メープルシロップ尿症の年間発見数は0〜5人程度と記載されています。これは、疾患の発生頻度が非常に低く、年によって発見される数にばらつきがあることを示しています。
症状の特徴とその進行
メープルシロップ尿症(MSUD)は、体内で特定のアミノ酸(ロイシン、イソロイシン、バリン)の分解がうまく行われない遺伝子障害です。この病気は、代謝異常によって特有の甘い匂い(メープルシロップのような匂い)が尿や体臭に現れることが特徴です。主な症状としては、以下のようなものがあります。
1. 早期の症状:
– 食欲不振: 新生児期に見られる最初の兆候の一つ。
– 嘔吐: 食べたものを保持できない状態。
– けいれん: 神経系に影響が及び、けいれんを起こすことがあります。
– 意識障害: 意識がもうろうとした状態や昏睡に至ることも。
2. 進行すると現れる症状:
– 発育遅延: 神経発達の遅れが見られる場合があります。
– 筋緊張の異常: 筋肉が異常に強張るか、反対に極端に弛緩します。
– 精神運動の遅れ: 歩行や話す能力の獲得が遅れることがあります。
– 呼吸困難: 進行すると呼吸管理が難しくなる場合があります。
メープルシロップ尿症(MSUD)における血中ロイシン濃度の増加は、症状の重篤化と密接に関連しています。ロイシンは、分枝鎖アミノ酸の一つであり、MSUD患者ではその代謝が適切に行われないため、血中濃度が異常に高くなります。ロイシンの濃度に応じて現れる症状は以下の通りです。
– ロイシン値が10~20 mg/dL(760-1,500μmol/L)の場合:
– 哺乳力の低下: 新生児や乳幼児では、哺乳力が落ち、栄養摂取が困難になります。
– 嘔吐: 食事を摂った後に嘔吐を繰り返すことがあり、脱水や栄養不良に繋がるリスクがあります。
– ロイシン値が20 mg/dL(1,500μmol/L)以上の場合:
– 意識障害: 意識が混濁し、最悪の場合は昏睡状態に陥ることがあります。
– 筋緊張低下: 筋肉の緊張が異常に低くなり、身体のコントロールが難しくなります。
– けいれん: 神経系の影響により、けいれん発作が起こることがあります。
– 呼吸困難: 呼吸制御の障害により、呼吸が浅くなったり、困難になったりします。
– 後弓反張: 背中を弓なりに反らせる痙攣状態が見られることがあります。
これらの症状は、MSUDの進行を示しており、即座に医療介入が必要です。特にロイシン値が高い状態では、生命を脅かす緊急事態となり得るため、迅速な治療が求められます。治療には、食事療法によるアミノ酸制御、輸液療法による代謝産物の排出促進、必要に応じて透析を行うことが含まれます。定期的な血液検査によるモニタリングと、状態に応じた治療の調整が重要です。
MSUDの症状は、個人によって異なり、軽度から重度までさまざまです。未治療の場合、特に新生児期には急速に病状が悪化し、生命に危険を及ぼすこともあります。そのため、早期発見と治療が非常に重要です。治療には、厳格な食事療法や特定のアミノ酸を制限した食事、緊急時には輸液や透析を行うこともあります。定期的なフォローアップと適切な管理によって、多くの患者は比較的正常な生活を送ることが可能になります。
治療法:アミノ酸制御と輸液療法
メープルシロップ尿症(MSUD)の治療法は、主にアミノ酸の摂取量を制御する栄養療法と、必要に応じて行う輸液療法に基づいています。これらの治療は、体内に蓄積される有害な物質を減少させ、症状の管理を目指します。
### アミノ酸制御
アミノ酸制御の治療は、特にロイシン、イソロイシン、バリンといった分枝鎖アミノ酸(BCAA)の摂取量を厳しく管理します。これらのアミノ酸は、MSUD患者にとって体内で適切に代謝されず、高濃度で蓄積すると毒性を持つためです。患者は特別に調製された低タンパク食品や特殊ミルクを使用し、日常の食事からこれらのアミノ酸の摂取量を制限します。治療食は、個々の患者の年齢、体重、健康状態、血液検査の結果に基づいて、栄養士や医師により厳密に計画されます。
### 輸液療法
病状が悪化したり、手術、感染症、その他のストレス要因によってアミノ酸の血中濃度が急激に上昇した場合、輸液療法が行われることがあります。この治療では、点滴を通じて体内にグルコースやインスリン、電解質などを補給し、代謝を促進し、有害物質の排出を助けます。場合によっては、透析を用いて血液中の過剰なアミノ酸を直接除去することもあります。
これらの治療法は、MSUD患者が健康な生活を送るための重要な手段です。治療は一生涯にわたり続ける必要があり、定期的な医療機関でのチェックアップが必須となります。治療計画の成功は、患者本人や家族の協力、教育、そしてサポート体制に大きく依存しています。
治療の新展開と患者サポート
特殊ミルクによる栄養管理
メープルシロップ尿症(MSUD)における特殊ミルクによる栄養管理は、この遺伝子代謝疾患の治療において重要な役割を果たします。MSUDの患者は、分枝鎖アミノ酸(BCAA)であるロイシン、イソロイシン、バリンの代謝に問題を抱えており、これらのアミノ酸が体内に過剰に蓄積すると、神経毒性を持ち、重篤な健康問題を引き起こす可能性があります。
特殊ミルクは、これらのBCAAの含有量が極めて低いか、または全く含まれていない特別な配合をしています。これにより、患者は必要な栄養を摂取しつつも、BCAAの摂取量を厳しく制限することができます。このような特殊ミルクを利用することで、日々の食事管理が容易になり、MSUD患者の健康維持に寄与します。
特殊ミルクの利用は、患者の年齢、体重、健康状態、そして血液検査によるアミノ酸濃度のモニタリング結果に基づいて個別に調整されます。乳幼児期から成人期にかけて、患者の成長や活動レベルの変化に合わせて、特殊ミルクの種類や量、その他の食事内容が定期的に見直される必要があります。
特殊ミルク以外にも、MSUD患者は特別に調整された低タンパクの固形食品を食事に取り入れることが多く、総合的な栄養管理計画の一環として、栄養士や医師と密接に協力しながら、個々のニーズに合った食事計画を立てます。
特殊ミルクによる栄養管理は、MSUDの患者が健康な成長を遂げ、生活の質を向上させる上で不可欠な治療方法の一つです。
フェニルケトン尿症やメープルシロップ尿症などの疾患に必要な特殊ミルクは、蹴校保険の対象であり、小児の慢性的な特定疾患の医療費を助成する制度の対象です。この制度を利用すれば、特殊ミルクの費用の一部を国が支払い、残りは患者自身が負担します。
医療費支援と指定難病制度の利用
メープルシロップ尿症(MSUD)は、日本において指定難病に認定されており、この認定を受けることで、患者およびその家族は医療費支援を受けることが可能になります。指定難病制度は、重篤で長期にわたる治療が必要な疾患に対して、医療費の負担を軽減し、患者のQOL(生活の質)の向上を支援する目的で設けられています。
### 医療費支援の内容
– 公的支援: 指定難病に対する治療に関連する医療費の自己負担が軽減されます。具体的には、治療費、薬剤費、特殊ミルクや栄養管理に必要な食品の購入費用などが対象となります。
– 自己負担額の上限制: 患者の所得に応じて、自己負担額には上限が設けられており、それを超える医療費は公費で支援されます。
– 障害者手帳: 条件によっては、障害者手帳の交付を受けることができ、医療費以外にもさまざまな支援を受けることが可能です。
### 利用方法
1. 難病医療提供体制: MSUDの治療を行っている専門医や施設を確認します。
日本小児内分泌学会の内分泌代謝科(小児科)専門医がいる施設をお探しください。こちらのHPに掲載されています。
2. 申請: 指定難病に関する診断書を専門医に作成してもらい、市町村役場や保健所に提出して難病患者医療受給者証を申請します。
3. 受給者証: 申請が認められると、受給者証が交付され、医療費の自己負担軽減が適用されます。
医療費支援と指定難病制度の利用は、MSUD患者とその家族にとって、治療を続ける上で大きな支えとなります。しかし、制度の詳細や申請方法には変更がある場合もあるため、最新の情報を確認し、必要な手続きを行うことが重要です。
精神的・社会的サポートの強化
メープルシロップ尿症(MSUD)の患者とその家族にとって、精神的・社会的サポートの強化は非常に重要です。この遺伝子疾患は、生活のあらゆる側面に影響を及ぼすため、適切なサポート体制の確立が不可欠です。まず、患者と家族への教育が基本となります。病状の理解を深めることで、日常生活における食事管理や健康管理の方法を適切に実践できるようになります。また、専門家による心理的支援も重要です。病気への不安やストレスに対処するためのカウンセリングや心理療法が、患者と家族の心の負担を軽減します。
さらに、社会的サポートの充実も求められます。地域社会やオンラインコミュニティにおけるサポートグループへの参加が、情報交換や経験の共有、相互の励ましを通じて、患者と家族の精神的な健康を支えます。これにより、孤立感の軽減や社会的なつながりの強化が図られます。
患者会:日本メープルシロップ尿症の会
また、医療機関や福祉サービスとの連携も不可欠です。医師、栄養士、ソーシャルワーカーなどの専門家チームによる一貫したサポートが、病気の管理と患者のQOL(生活の質)の向上につながります。公的な支援制度の活用についての情報提供や手続きのサポートも、経済的な負担の軽減に貢献します。
メープルシロップ尿症における精神的・社会的サポートの強化は、患者とその家族が日々直面する課題に対処し、より良い生活を送るための基盤となります。適切な知識と支援体制のもとで、病気と向き合うことが、患者の自立と社会参加を促進し、全体的な福祉の向上に寄与します。
メープルシロップ尿症と生活の質
慢性症状の管理と日常生活の工夫
メープルシロップ尿症(MSUD)の慢性症状の管理と日常生活での工夫は、患者とその家族にとって長期的な健康維持と生活の質の向上を目指す上で重要です。MSUDの管理において最も重要なのは、厳格な食事療法の遵守です。特定のアミノ酸の摂取を制限し、血中のレベルを安定させることが必要です。このため、専門の栄養士と協力して、個々の患者に合わせた食事プランを作成し、定期的に評価と調整を行うことが大切です。
また、定期的な血液検査を通じて、アミノ酸のレベルをモニタリングし、食事療法や必要に応じてサプリメントの調整を行います。このプロセスは、患者や家族が自分自身で行うことができるよう、適切な教育と訓練が必要です。
日常生活における工夫としては、食事の準備や選択において、許容される食品と避けるべき食品を明確にすることが挙げられます。外食や学校給食など、家庭外での食事においても、事前に食事内容を確認し、必要に応じて代替の食事を準備するなどの対策が必要です。
ストレスや疲労が症状を悪化させる可能性があるため、適度な休息とリラクゼーションの時間を確保することも大切です。また、体調変化に敏感であること、そして異常を感じた際には迅速に医療機関に連絡を取ることが重要です。
MSUDの患者と家族は、日々の生活の中で遭遇するさまざまな挑戦に対処するために、医療チームやサポートグループからの支援を受けることができます。このようなサポートを活用することで、病気の管理を効果的に行い、日常生活の質を向上させることが可能になります。
予後と生活の質の向上に向けた取り組み
メープルシロップ尿症(MSUD)の予後は、早期診断と適切な管理に大きく依存します。治療と日々のケアにおいて、継続的な食事管理と医療チームとの密接な連携が重要となります。生活の質(QOL)の向上に向けた取り組みでは、以下の点が特に重視されます。
### 1. 早期診断と介入
新生児スクリーニングによる早期診断が、重篤な合併症を防ぎ、より良い予後をもたらします。診断後は直ちに適切な食事療法を開始し、必要に応じてサプリメントを用いて栄養バランスを調整します。
### 2. 厳格な食事管理
MSUDの管理の中心は、特定のアミノ酸の摂取を制限することです。栄養士と連携して、個別に最適化された食事計画を立て、定期的に調整します。この食事療法は、一生涯にわたって続ける必要があります。
### 3. 定期的なモニタリングと調整
血液検査を定期的に行い、血中のアミノ酸濃度をモニタリングします。これにより、食事計画やサプリメントの量の調整が可能になり、病状のコントロールをより良く行えます。
### 4. 教育とサポート
患者とその家族に対する教育とサポートは、病気の管理と生活の質の向上に不可欠です。病状、食事療法、日常生活での注意点についての情報提供を行い、患者と家族が自信を持って病気と向き合えるよう支援します。
### 5. 社会的支援と精神的健康
社会的な支援ネットワークの構築や、心理的な支援の提供も重要です。サポートグループやカウンセリングを通じて、患者と家族が情報を共有し、励まし合える環境を作ります。また、ストレス管理の技術を身につけることで、精神的な健康を保ちます。
### 6. 継続的な医療ケア
定期的な医療チェックアップと、発症した場合の迅速な治療が、長期的な健康を維持する上で欠かせません。特に感染症などの健康問題が生じた際は、早期に医療機関を受診することが重要です。
メープルシロップ尿症の患者が、より良い予後と生活の質を目指す上で、これらの取り組みは非常に重要です。患者とその家族が病気の管理に自信を持ち、支援を受けながら前向きに生活できるよう、継続的なサポートと教育が必要です。
家族とのコミュニケーションの重要性
メープルシロップ尿症(MSUD)は、生まれつきの代謝異常症の一つで、特有の甘い匂いがする尿が特徴です。この病気は、体内で特定のアミノ酸が正常に分解されないことによって引き起こされます。家族とのコミュニケーションは、MSUDを持つ子供を持つ家族にとって非常に重要です。MSUDの管理と治療は、生涯にわたる取り組みであり、家族全員の理解と協力が必要です。正しい食事管理、定期的な健康チェック、そして症状の早期発見と対処は、この病気の影響を最小限に抑える上で欠かせません。家族とのオープンなコミュニケーションは、病気への理解を深め、子供が直面する可能性のある挑戦を共に乗り越えるためのサポートシステムを構築するのに役立ちます。親や兄弟姉妹が病気の知識を共有し、感情や不安をオープンに話し合うことで、家族内での支え合いが生まれ、子供が健やかに成長するための環境が整います。
研究と未来への期待
遺伝子療法の可能性
メープルシロップ尿症(MSUD)における遺伝子療法の可能性は、この遺伝性代謝異常症の治療法を根本から変革するものです。MSUDは特定のアミノ酸の代謝に関与する酵素の活性不足によって引き起こされるため、遺伝子療法はこの酵素の遺伝子異常を直接修正することで病気を治療するアプローチです。この療法は、患者の細胞に正常な遺伝子を導入し、酵素の正常な生産を再開させることを目指します。この技術が成功すれば、従来の食事制限や補助的治療に頼ることなく、MSUDの影響を劇的に軽減または完全に克服することが可能になります。
遺伝子療法の実現には、安全性と効果を確認するために、まずは厳格な臨床試験が必要です。これらの試験では、治療がMSUDを持つ患者にとって安全であるか、また実際に代謝異常を改善できるかが検証されます。成功すれば、MSUDだけでなく、他の遺伝性代謝異常症の治療法開発にも大きな影響を与えることになります。
遺伝子療法はまだ研究段階にあり、多くの課題を克服する必要がありますが、このアプローチはMSUD患者とその家族にとって大きな希望となっています。最終的には、遺伝子療法がメープルシロップ尿症の治療法として実用化されれば、生活の質の向上だけでなく、生命を脅かす症状のリスクを大幅に減少させることが期待されます。
メープルシロップ尿症(MSUD)は、臨床的な肝臓移植(OLT)のデータが示すように、体内のブランチ鎖α-ケト酸脱炭酸酵素(BCKD)の活性が不完全に回復しても(正常活性の9-13%まで)、十分な治療効果が得られることから、肝臓をターゲットとした遺伝子治療にとって理想的な対象とされています。現在までに、マウスで治療に成功しており、近い将来、人体に応用されるかもしれません。
新しい治療法の開発と臨床試験
メープルシロップ尿症に対する新しい治療法の開発は、病気の管理と患者の生活の質の向上に向けた大きな進歩を意味します。科学技術の進歩に伴い、遺伝子療法や酵素代替療法などの画期的な治療法が研究されています。これらの新しいアプローチは、病気の根本的な原因に焦点を当て、従来の食事療法や補助的治療よりも効果的にメープルシロップ尿症の影響を軽減する可能性があります。
臨床試験は、これらの新しい治療法が安全で有効であることを確認するために不可欠です。試験を通じて、治療法の効果、副作用、適切な投与量などが評価されます。患者や家族にとって、臨床試験への参加は、最先端の治療にアクセスする機会を提供すると同時に、将来の患者のために貢献する方法の一つです。しかし、臨床試験にはリスクとベネフィットが伴うため、参加を決定する前に医師と十分な話し合いを行い、試験の目的、期間、期待される結果について理解することが重要です。
新しい治療法の開発と臨床試験は、メープルシロップ尿症の治療において新たな希望をもたらしています。これらの進歩が、患者とその家族にとってより良い未来を実現する鍵となることを期待しています。
臨床試験情報
患者と医療従事者のための教育プログラム
患者と医療従事者のための教育プログラムは、双方のコミュニケーションと理解を深め、医療の質を向上させる重要な役割を果たします。このプログラムは、患者が自身の健康状態や治療方法について正確な知識を得ることを支援し、自己管理能力を高めることを目指しています。また、医療従事者に対しては、患者中心のケアを提供するためのコミュニケーションスキルや教育方法に関するトレーニングを提供します。効果的な教育プログラムは、最新の医療情報と研究に基づいており、対象となる患者や医療従事者のニーズに合わせてカスタマイズされています。これにより、患者の満足度の向上、再入院率の低下、治療結果の改善といったポジティブなアウトカムが期待できます。患者と医療従事者が共に学び、成長することで、より良い医療サービスの提供が可能になります。
疾患の生物学的背景
アミノ酸の分枝鎖の重要性と代謝異常
分枝鎖アミノ酸(BCAA)は、バリン、ロイシン、イソロイシンの3種類の必須アミノ酸を指し、その名前は分子構造が分枝していることに由来します。これらは人体で合成されず、食事から摂取する必要があるため「必須アミノ酸」と呼ばれます。分枝鎖アミノ酸は、筋肉の合成と分解の調節、運動中のエネルギー源としての役割、さらには食欲制御や疲労感の軽減など、人体のさまざまな重要な機能に影響を及ぼします。
代謝異常が起こると、これら分枝鎖アミノ酸の正常な処理が妨げられ、体内に蓄積することがあります。メープルシロップ尿症(MSUD)は、この代謝異常の一例で、分枝鎖アミノ酸の分解に関わる特定の酵素が欠如または不足しているために生じます。この状態では、分枝鎖アミノ酸とその代謝産物が異常に蓄積し、神経系への毒性を示して重篤な健康問題を引き起こす可能性があります。
MSUDの管理には、バリン、ロイシン、イソロイシンの摂取量を厳しく制限した特別な食事が必要です。この食事療法により、分枝鎖アミノ酸の体内蓄積を防ぎ、代謝異常の症状の発現を最小限に抑えることが目指されます。しかし、このような厳格な食事管理は患者とその家族にとって大きな負担となり得るため、新しい治療法の開発が望まれています。
分枝鎖アミノ酸の代謝異常は、MSUDのような特定の遺伝疾患を通じてその重要性が強調されます。これらのアミノ酸のバランスが崩れると、人の健康に重大な影響を及ぼすことから、適切な摂取と代謝がいかに重要であるかがわかります。
ロイシン、イソロイシン、バリンの役割
ロイシン、イソロイシン、バリンは、分枝鎖アミノ酸(BCAA)の一群を形成し、人体における重要な役割を担っています。これらのアミノ酸は、筋肉合成の促進、運動時のエネルギー供給、体内の代謝調節など、多方面にわたって機能します。以下に、各アミノ酸の特定の役割について詳しく説明します。
### ロイシン
ロイシンは、筋タンパク質の合成を刺激することで知られており、筋力の増加や筋肉量の維持に非常に重要です。また、傷害後の回復プロセスを促進する作用もあり、運動選手や筋トレ愛好者にとって特に重要なアミノ酸です。さらに、ロイシンは食欲制御に関与するホルモンの調節にも一役買っています。
### イソロイシン
イソロイシンは、エネルギー供給の役割を持ち、筋肉組織でのグルコース取り込みを促進することにより、持久力や運動パフォーマンスの向上に寄与します。また、傷害の回復や筋肉の修復プロセスにも関与し、免疫機能のサポートにも重要な役割を果たします。
### バリン
バリンもまた、筋肉のエネルギー源として機能し、運動中の疲労感の軽減に寄与することが示されています。さらに、バリンは肝臓でのアミノ酸の代謝に重要な役割を果たし、体内の窒素バランスの維持にも関与しています。
これらの分枝鎖アミノ酸は、単独での役割に加え、互いに補完し合う形で体内で作用します。適切な比率でこれらのアミノ酸を摂取することは、健康維持や運動パフォーマンスの向上、疾病からの回復など、多くの面で利益をもたらします。したがって、バランスの取れた食事を通じてこれらの必須アミノ酸を適切に摂取することが推奨されます。
社会とメープルシロップ尿症
患者数の現状と社会的認識
日本におけるメープルシロップ尿症の患者数に関しては、正確な最新データを提供することが難しいですが、公開されている情報や研究によれば、患者数は比較的少なく、約100人程度とされています。メープルシロップ尿症は、希少疾患(レアディジーズ)に分類されるため、患者数が限られており、社会的認識も高まりつつあるものの、まだまだ認知度は低い状況です。日本では新生児スクリーニングにより早期発見・早期治療が可能となっているため、患者とその家族への支援体制の整備や、疾患に対する正しい理解を深める取り組みが重要とされています。このような希少疾患に対する支援と認識の向上は、患者とその家族が直面する多くの課題に対処するために欠かせないものです。
医療システムとメープルシロップ尿症の治療費用
日本におけるメープルシロップ尿症の治療費用は、疾患の希少性と治療に必要な長期間の管理・対応を考慮すると、相当な負担になる可能性があります。しかし、日本の医療システムでは、高額な治療費に対していくつかの支援策が用意されています。
まず、新生児期に発見されることが多いメープルシロップ尿症は、特定疾患治療研究事業による支援の対象となることがあります。これにより、治療に必要な特定の栄養補助食品やアミノ酸調整食などの費用が補助される場合があります。
さらに、日本では高額療養費制度があり、一定額を超える自己負担が発生した場合、その超過分については払い戻しを受けることができます。この制度は、慢性的に医療費がかかる疾患を持つ患者や家族にとって大きな支えとなっています。
また、医療費の自己負担額は年齢や所得によって変動し、小児期の患者に関しては、低い自己負担率が適用されることが多いです。さらに、地域によっては独自の支援策を設けている場合もあります。
これらの支援制度を利用することで、メープルシロップ尿症の患者やその家族は、治療に必要な費用の一部を軽減することが可能です。しかし、支援の範囲や条件は変更されることがあるため、最新の情報を得るためには、医療機関や専門家に相談することが重要です。
公共政策と患者サポートの強化
メープルシロップ尿症(MSUD)に対する公共政策と患者サポートの強化は、この希少疾患を持つ患者及びその家族が直面する多くの課題に対処するために極めて重要です。日本を含む多くの国では、希少疾患に対する公的支援の体系を構築し、継続的な改善を行っています。
### 公共政策の強化
1. **新生児スクリーニングの普及**: MSUDは早期発見が治療成功の鍵を握ります。公共政策として、全ての新生児に対するスクリーニングの普及を促進することで、早期に疾患を特定し、迅速な治療を開始できるようにすることが求められます。
2. **特定疾患治療研究事業の拡大**: MSUDを含む希少疾患に対する治療費の支援を強化し、患者や家族の経済的負担を軽減するために、特定疾患に対する公的支援の枠組みを拡大することが重要です。
3. **研究と治療法の開発**: 希少疾患に対する研究資金の確保と、新しい治療法や管理法の開発を促進する政策が必要です。これにより、患者の生活の質の向上と治療成果の改善が期待できます。
### 患者サポートの強化
1. **情報提供と啓発活動**: 患者とその家族がMSUDについての正確な情報を容易に入手できるようにすること、及び社会全体の認識を高めるための啓発活動が重要です。正しい知識の普及により、患者への理解とサポートが促進されます。
2. **患者団体との連携**: 患者団体やサポートグループとの連携を通じて、患者と家族が直面する社会的、精神的、経済的な課題に対する支援を提供します。相互支援のネットワークを構築することで、患者と家族が孤立感を感じることなく、必要な情報や助言を得られるようにすることが目標です。
3. **専門家による継続的な教育**: 医療従事者や関連する専門家への継続的な教育を通じて、MSUDの最新の治療法や管理技術に関する知識の更新を促します。これにより、患者に対してより効果的な治療とサポートが提供できるようになります。
以上のように、メープルシロップ尿症に対する公共政策と患者サポートの強化は、患者とその家族がより良い生活を送るための基盤となります。社会全体での理解と支援の促進が、この希少疾患に対する取り組みの鍵を握っています。