承認済シンボル:BCKDHA
遺伝子名:branched chain keto acid dehydrogenase E1 subunit alpha
参照:
HGNC: 986
AllianceGenome : HGNC : 986
NCBI:593
遺伝子OMIM番号608348
Ensembl :ENSG00000248098
UCSC : uc002oqq.4
遺伝子のlocus type :タンパク質をコードする
遺伝子のグループ:
遺伝子座: 19q13.2
遺伝子の別名
BCKDH E1-alpha
branched chain keto acid dehydrogenase E1, alpha polypeptide (maple syrup urine disease)
MSUD1
ODBA_HUMAN
2-oxoisovalerate dehydrogenase (lipoamide)
branched chain keto acid dehydrogenase E1, alpha polypeptide
MSU
maple syrup urine disease
2-oxoisovalerate dehydrogenase subunit alpha, mitochondrial
概要
BCKD酵素複合体は、3つの特定のアミノ酸、すなわちロイシン、イソロイシン、バリンの正常な分解を担っています。これらのアミノ酸は食事から得られ、特に牛乳、肉、卵などのタンパク質を豊富に含む食品に多く含まれています。この酵素複合体は、ミトコンドリアで活動し、ミトコンドリアは細胞内でエネルギーを生産する特殊な構造です。ロイシン、イソロイシン、バリンの分解により、体がエネルギーとして利用できる分子が生産されます。
BCKDHA遺伝子は、分岐鎖α-ケト酸(BCAA)デヒドロゲナーゼ複合体(BCKD; EC 1.2.4.4)のE1-αサブユニットをコードしており、この複合体はイソロイシン、ロイシン、バリン由来の分岐鎖α-ケト酸の酸化的脱炭酸を触媒するミトコンドリア内の酵素複合体です。この反応は、分岐鎖アミノ酸の代謝における主要な第二ステップを担っています(Wynn et al.による)。
BCKD複合体は、3つの異なる触媒成分で構成されています。これらは、α2-β2のヘテロ4量体である分岐鎖α-ケト酸脱炭酸酵素(E1)、ホモ24量体のジヒドロリポイルトランスアシラーゼ(E2; 248610)、そしてホモ2量体のジヒドロリポアミド脱水素酵素(E3; 238331)です。E1はチアミンピロリン酸(TPP)依存性の酵素で、この反応は不可逆的であり、BCAAの酸化過程の初期段階を形成します。また、BCKDHB遺伝子(248611)は、この複合体のE1のβサブユニットをコードしています。この複合体には、制御機能を果たすキナーゼとホスホリラーゼという2つの酵素も含まれています。
遺伝子の発現とクローニング
同じく1988年、Zhangらはヒト肝臓のcDNAライブラリーからBCKDHA遺伝子に対応するcDNAを分離しました。この遺伝子から予測される378アミノ酸のタンパク質は、ラットの酵素サブユニットと96%の同一性を持っていました。また、リン酸化部位を取り囲むアミノ酸はヒトとラットで完全に同じであることがわかりました。ノーザンブロット分析により、1.8kbのmRNAが肝臓でのみ存在し、正常な線維芽細胞よりもそのレベルが高いことが示されました。
1989年、FisherらはE1-αサブユニットが400アミノ酸で構成され、推定分子量が約46kDであることを発見しました。1991年、DariushらはBCKDHA遺伝子の3プライム非翻訳領域の完全な塩基配列を報告し、この遺伝子が複数の転写開始部位(+1、+18、+22塩基位置)を持つことを見出しました。
1998年、WynnらはBCKDHAタンパク質の分子量が45.5kDであることを報告しました。
遺伝子の構造
マッピング
遺伝子の機能
分岐鎖α-ケト酸デヒドロゲナーゼ(BCKD)複合体は、分岐鎖アミノ酸であるロイシン、イソロイシン、バリンの代謝の第二段階を触媒するミトコンドリア内酵素複合体です。BCKD複合体は、3つの触媒成分、すなわちヘテロ4量体の分岐鎖α-ケト酸デカルボキシラーゼ(E1)、ジヒドロリポイルトランスアシラーゼ(E2)、ジヒドロリポアミドデヒドロゲナーゼ(E3)から成り立っています。この遺伝子はE1のαサブユニットをコードしており、この遺伝子に変異があるとメープルシロップ尿症IA型を引き起こす可能性があります。また、この遺伝子には異なるアイソフォームをコードする複数の転写バリアントが存在します。これらの情報はRefSeqの2009年9月の更新から得られています。
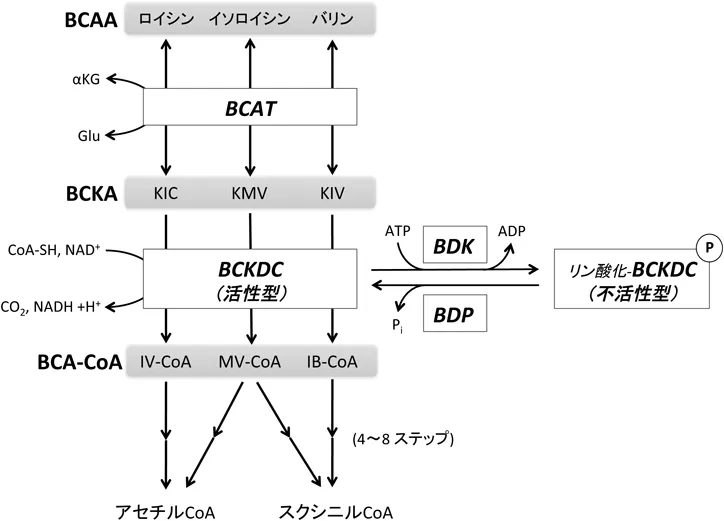
BCAA(分岐鎖アミノ酸)の代謝過程
BCAA(分岐鎖アミノ酸)はミトコンドリア内で6~10ステップの反応を経て分解され、最終的にアセチルCoAまたはスクシニルCoAに変換されますが、最初の2ステップはBCAAすべてに共通しています。第1ステップでは、BCATによってBCAAのアミノ基がα-ケトグルタル酸に転移され、分岐鎖α-ケト酸(BCKA)が生成されると同時に、グルタミン酸も生成されます。この反応は可逆的です。
BCATには、ミトコンドリアに局在するBCATmと細胞質に局在するBCATcの二つのアイソザイムがあります。BCATmはほぼ全ての体組織で発現し、BCAA分解の主要な酵素であるとされていますが、肝臓では発現量が非常に低いため、他の必須アミノ酸と異なり、BCAAは肝臓で分解されません。一方、BCATcは主に脳神経系で発現しており、最近の研究では活性化したT細胞や一部のがん細胞など、増殖の盛んな細胞での発現増加が報告されています。BCATmがBCAAの分解に関与する一方で、BCATcは細胞質でグルタミン酸の生成に作用し、神経伝達や細胞増殖に重要な役割を果たしていると考えられています。
第2ステップでは、分岐鎖α-ケト酸脱水素酵素複合体(BCKDC)によって分岐鎖α-ケト酸(BCKA)が分岐鎖アシルCoA(BC-CoA)に変換され、この過程でCO2とNADHが生成されます。この反応は、E1(分岐鎖α-ケト酸デカルボキシラーゼ)、E2(ジヒドロリポイルトランスアシラーゼ)、E3(ジヒドロリポアミドデヒドロゲナーゼ)という3つのサブユニットによる不可逆的な酸化的脱炭酸反応であり、BCAA分解の律速段階とされています。BCKDCは、特異的なリン酸化酵素BDKによって不活性化され、脱リン酸化酵素BDPによって活性化されます。
第3ステップ以降、BCAAはそれぞれ異なる経路を経て分解され、最終的にアセチルCoAまたはスクシニルCoAになり、TCA回路に供給されます。
分子遺伝学
中間程度のMSUDを持つ血縁関係のないヒスパニック系メキシコ人患者4人のうち3人において、1995年にChuangらはBCKDHA遺伝子にホモ接合性の突然変異(608348.0003)を特定しました。残る1人の患者は、同じ遺伝子の異なる変異(608348.0004)のホモ接合体でした。
この研究は、メープルシロップ尿症の原因となる遺伝的変異の特定において重要な進歩を示しています。患者ごとに異なる遺伝的変異が存在することが明らかになり、これにより個別の診断や治療法の開発に役立つ可能性があります。
アレリックバリアント
.0001 メープルシロップ尿症、古典的、ia型
BACKDHA, TYR393ASN
メープルシロップ尿症(MSUD1A; 248600)の古典的症例において、Zhangら(1989, 1991)はE1-αサブユニット遺伝子のT-A転座を同定し、tyr394からasnへの置換(TYR394ASN)を生じた。この患者の罹患していない父親はこの突然変異対立遺伝子をヘテロ接合体で持っていたが、患者の罹患していない母親はこの突然変異を持っていなかったが、それでも正常なmRNAと蛋白質の約半分しか発現していなかった。この患者はY394N変異のヘテロ接合体であったが、mRNAとして発現していたのは異常対立遺伝子だけであった。Zhangら(1989)は、この患者は複合ヘテロ接合体であり、父親から突然変異Y394N対立遺伝子を受け継ぎ、母親からはおそらくE1-α対立遺伝子の一方の発現を消失させる調節障害を含む別の対立遺伝子を受け継いだと結論づけた。しかし、Chuangら(1994)は同じ家系をさらに調査し、罹患児とその母親がE1-αサブユニット遺伝子のエクソン7に8bpの欠失を持つヘテロ接合体であり(887-894del; 608348.0002)、255番目のコドンがナンセンスであることを証明した。Chuangら(1994)は、2番目の対立遺伝子が以前は調節変異であると仮定されていたこと、患者とその母親が遺伝子のプロモーター調節領域でA-Tの転座を持つヘテロ接合体であったことを指摘したが、これは正常な多型であることが判明した。
MSUD1Aの2例のメノナイトの細胞株で、Matsudaら(1990)は同じY394N変異を証明した。彼らは、E1-βサブユニット遺伝子は正常であるが、この遺伝子に関連した交差反応物質は証明できなかったと述べており、E1-α遺伝子の変異がE1-βサブユニットの不安定性をもたらすことを示唆している。
BCKDHA遺伝子の構造と配列に関する追加情報を報告したDariushら(1991)は、エクソン9にMennonite突然変異が含まれていると結論し、彼らは番号付けの違いを反映してtyr393-to-asn(Y393N)と呼んだ。彼らは、ホモ接合体変異が変異型E1α転写産物においてエクソン6のスキップを引き起こすようであると報告した。Fisherら(1991, 1991)もMSUD1Aを持つPennsylvania MennoniteにおいてY393N変異を同定し、Y393N変異がE1成分の集合を阻害するという証拠を提示した。
Mitsubuchiら(1992)は、ペンシルバニア・メノナイト集団における変異型BCKDHA遺伝子を迅速かつ容易に検出するための、プライマー特異的制限地図の改変を含む技術について述べている。
Wynnら(1998)は大腸菌におけるY393N変異タンパク質の詳細な機能発現研究を行った。変異型タンパク質は野生型タンパク質に比べてE1-βタンパク質との会合速度が遅く(10〜20分に対して2時間以上)、分子量83kDの二量体を形成するだけで、完全な四量体は形成しなかった。酵素活性は残存せず、変異体タンパク質の熱安定性は野生型に比べて低下していた。
Puffenberger (2003)は、Y393N変異はペンシルバニア州南東部のOld Order Mennoniteに高い頻度で存在すると報告している。1985年から1994年にかけて、6,810人のオールド・オーダー・メノナイトの子供のうち19人がMSUD1Aを持って生まれた(0.279%、約358人に1人)。Puffenberger (2003)は、保因者頻度は7.96%、突然変異対立遺伝子頻度は4.15%と推定している。Old Order Mennonite MSUD1Aの全兄弟姉妹の平均近交係数は2.19%であった。
.0002 メープルシロップ尿症、古典的、ia型
bckdha、8-bp欠失、887-894
Chuangら(1994)による古典的メープルシロップ尿症(MSUD1A; 248600)患者において複合ヘテロ接合状態で見つかったBCKDHA遺伝子の8-bp欠失(887_894del)については、608348.0001を参照。
.0003 メープルシロップ尿症、中間型、ia型
BACKDHA, GRI245ARG
中間のメープルシロップ尿症(MSUD1A; 248600)を持つ血縁関係のないヒスパニック系メキシコ人患者4人のうち3人において、Chuangら(1995)はBCKDHA遺伝子のエクソン7に895G-A転移のホモ接合性を見いだし、その結果、gly245からarg(G245R)への置換が生じた。
Wynnら(1998)は大腸菌でG245R変異タンパク質の詳細な機能発現研究を行った。変異体タンパク質は、野生型タンパク質と比較してE1-βタンパク質との会合速度が中程度に遅かったが(10〜20分に対して30〜40分)、G245Rタンパク質は完全な4量体を形成した。残存酵素活性は正常対照の2.66%であった。変異タンパク質の熱安定性は野生型に比べて低下していた。
0.0004 メープルシロップ尿症、中間型、ia型
メープルシロップ尿症、古典的、ia型、含む
bckdha, phe364cys
ヒスパニック系メキシコ人の中間型メープルシロップ尿症患者(MSUD1A; 248600)において、Chuangら(1995)はBCKDHA遺伝子のホモ接合性1253T-G転座を同定し、phe364-to-cys(F364C)置換をもたらした。
Wynnら(1998)はF364C変異タンパク質の大腸菌での詳細な機能発現研究を行った。変異型タンパク質は野生型タンパク質に比べてE1-βタンパク質との会合速度が遅く(10〜20分に対して2時間以上)、完全な4量体ではなく2量体を形成するだけであった。酵素活性は残存せず、変異体タンパク質の熱安定性は野生型に比べて低下していた。Wynnら(1998)は、関連する表現型は古典的なMSUDであると述べている。
.0005 メープルシロップ尿症、古典的、ia型
BACKDHA, ARG220TRP
古典的メープルシロップ尿症(MSUD1A; 248600)患者由来の線維芽細胞において、Wynnら(1998)はBCKDHA遺伝子における2つの変異、すなわちarg220-trp(R220W)置換をもたらすC-to-T転移とY393N(608348.0001)の複合ヘテロ接合を同定した。大腸菌での詳細な機能発現研究により、R220Wタンパク質はE1-βサブユニットと正常なアセンブリー動態を示し、完全な4量体を形成することがわかった。しかし、検出可能な酵素活性はなく、熱安定性も軽度低下していた。
.0006 メープルシロップ尿症、古典的、ia型
BACKDHA, GLY204SER
古典的メープルシロップ尿症(MSUD1A; 248600)患者由来の線維芽細胞において、Wynnら(1998)はBCKDHA遺伝子の2つの変異の複合ヘテロ接合性を同定した:G-to-A転移によるgly204-to-ser(G204S)置換とY393N(608348.0001)。大腸菌での詳細な機能発現研究により、G204Sタンパク質は野生型と比較してE1-βサブユニットとの会合速度が遅い(10〜20分に対して2時間以上)ことがわかったが、4量体は形成された。酵素活性は検出されず、G204Sタンパク質は野生型に比べて熱安定性が低下していた。
.0007 メープルシロップ尿症、古典的、ia型
BCCDHA, THR265ARG
古典的メープルシロップ尿症(MSUD1A; 248600)患者由来の線維芽細胞において、Wynnら(1998)は、BCKDHA遺伝子における2つの変異、すなわち、thr265からargへの置換(T265R)をもたらすCからGへの転位、および切断変異の複合ヘテロ接合を同定した。大腸菌での詳細な機能発現研究により、T265Rタンパク質は不溶性で、37℃ではE1-βサブユニットと共集合しないことがわかった。しかし、T265Rタンパク質は28℃ではE1-βと共集合し、酵素活性を持たない少量の完全な4量体を形成した。T265Rタンパク質はまた、野生型に比べて熱安定性が著しく低下していた。Wynnら(1998)は、thr265残基が適切なフォールディングに重要であることを示唆した。
.0008 メープルシロップ尿症、古典的、ia型
bckdha, cys219trp
イスラエルの古典的メープルシロップ尿症(MSUD1A; 248600)の男児において、Chuangら(2004)はBCKDHA遺伝子のホモ接合性のC-G転座を同定し、cys219-trp(C219W)置換をもたらした。C219W変異サブユニットを用いたin vitroの機能発現研究では、BCKDサブユニットの組み立てに欠陥があり触媒活性がないこと、補酵素チアミンとの結合親和性が低下していることが示された。
.0009 メープルシロップ尿症、古典的、ia型
BCKDHA、1-bp欠損、117c
Quentalら(2008)は、ポルトガル南部のジプシーコミュニティーに住む古典的メープルシロップ尿症(MSUD1A; 248600)の11人の小児において、BCKDHA遺伝子のホモ接合性の1-bp欠失(117delC)を同定し、その結果、フレームシフトと61残基しかない切断タンパク質をもたらした。この変異はナンセンスを介したmRNAの崩壊をもたらすと考えられる。Quentalら(2009)は、ハプロタイプ解析により、117delC変異がポルトガル系ジプシーにおける創始者変異であり、保因者頻度は1.4%と推定されることを示した。この欠失を持つ無関係のスペイン人患者(ジプシー由来ではない)はハプロタイプを共有しておらず、この欠失は独立して発生したことを示している。この欠失はポリCトラクト内に存在し、BCKDHA遺伝子の変異ホットスポットである可能性がある。