目次
Von Hippel-Lindau(VHL)病は、遺伝性の常染色体優性症候群であり、様々な良性および悪性腫瘍によって発現する。VHL疾患の診断因子となるVHL遺伝子の変異は、約36,000人に1人の割合で存在する。
疾患の初期症状は小児期、青年期、成人期に発現し、初発時の平均年齢は約26歳である。
VHL関連腫瘍には以下のようなものがある。
- 脳(小脳)および脊椎の血管芽細胞腫
- 網膜毛細血管芽細胞腫(網膜血管腫)
- 明細胞腎細胞癌(RCC)
- 褐色細胞腫
- 中耳内リンパ嚢腫瘍
- 膵臓の漿液性嚢胞腺腫および神経内分泌腫瘍
- 精巣上体および広靭帯の乳頭状嚢胞腺腫
-
VHL病の病型
-
VHL疾患の家系は、褐色細胞腫を発症する可能性に基づいてタイプ1と2に分けられている。タイプ2の家系は、VHL遺伝子にミスセンス変化をコードする病原性変異体を有する可能性が高い。
- 1型
- 1型疾患の血統の患者は、褐色細胞腫(1A型)を発症するリスクが大幅に低く、褐色細胞腫と腎細胞がん(RCC;1B型)の両方のリスクが低いが、他のVHL関連病変のリスクは高い。1B型は近傍のBRK1遺伝子を含む特異的な欠失によるものである。
- 2型
- 2型の血統は褐色細胞腫の発症リスクが高い。2型はRCCの発症リスクによって細分化される。2A型および2B型家系はそれぞれRCCの発生率が低く、高いが、2C型家系はRCCまたは血管芽腫を伴わない褐色細胞腫のみの発生を特徴とする。これらの亜分類は目安として用いるべきであり、絶対的なものではない。例えば、2C型の特徴を呈する患者では、他のVHL関連病変に対するサーベイランスを継続すべきである。
VHL疾患患者の生存率およびQOLを向上させるため、VHL患者に対するサーベイランス戦略が開発され、定期的に更新されるようになり、転移や他の合併症の発症前に無症状の小さな腫瘍を発見できるようになった。さらに、例えば、RCCにおける腎温存手術などの治療法の進歩により、治療が必要な場合の腎不全の発生率が低下し、転帰が改善した。
VHL疾患の分子病態は “2ヒット “モデルに従う。罹患患者は生殖細胞系列の機能喪失型変異体を持っており、この変異体はすべての細胞でVHL遺伝子の1コピーを不活性化する。病気が起こるためには、体細胞性の病原性変異体や2番目の対立遺伝子の欠失、あるいはそのプロモーターの過剰メチル化によって、2番目の正常な対立遺伝子の発現が失われなければならない。
-
分子生物学的病因
-
フォン・ヒッペル・リンダウ(VHL)遺伝子は1990年代初頭に染色体3p25にマッピングされクローニングされた。その遺伝子産物であるVHLは、癌抑制タンパク質として機能する。例えば、網膜芽細胞腫1(RB1)遺伝子などの他の癌抑制遺伝子病原性バリアントと同様に、生殖細胞系列の機能喪失変異体が全細胞のVHL遺伝子の1コピーを不活性化する「2ヒット」モデルがVHL疾患について検証されている。VHL関連腫瘍が発生するためには、2番目の対立遺伝子の体細胞変化もしくは欠失、またはそのプロモーターの過剰メチル化によって、2番目の正常対立遺伝子の発現が失われなければならない。散発性の腎細胞癌では、両方の対立遺伝子の体細胞変化によるVHLの不活性化が非常に一般的である。
VHLタンパク質は、エロンギンB、エロンギンC、カリン2などの他のタンパク質と安定した複合体を形成する。この複合体はいくつかのタンパク質をプロテアソーム分解の標的とし、それによって細胞内のレベルを調節している。この複合体のVHL成分は、標的分子に対するE3ユビキチンリガーゼとして機能する。VHL複合体に結合すると、標的分子はユビキチンと共有結合し、プロテアソームによる標的タンパクの分解を促進する。
関連記事:ユビキチン
VHLは、E3ユビキチンリガーゼとしての機能に加えて、一次繊毛の維持、細胞質分裂の制御、微小管機能の制御、細胞外マトリックスの完全性、細胞周期の制御など、いくつかの重要な細胞機能を果たしている。VHL遺伝子の病原性変異体もまた、真性多血症の先天性型と関連している。
HIF1A/HIF2A
低酸素誘導因子1α(Hypoxia Inducible Factor1A; HIF1A)および2α(HIF2A)は、VHLによって制御される主要タンパク質の2つである。
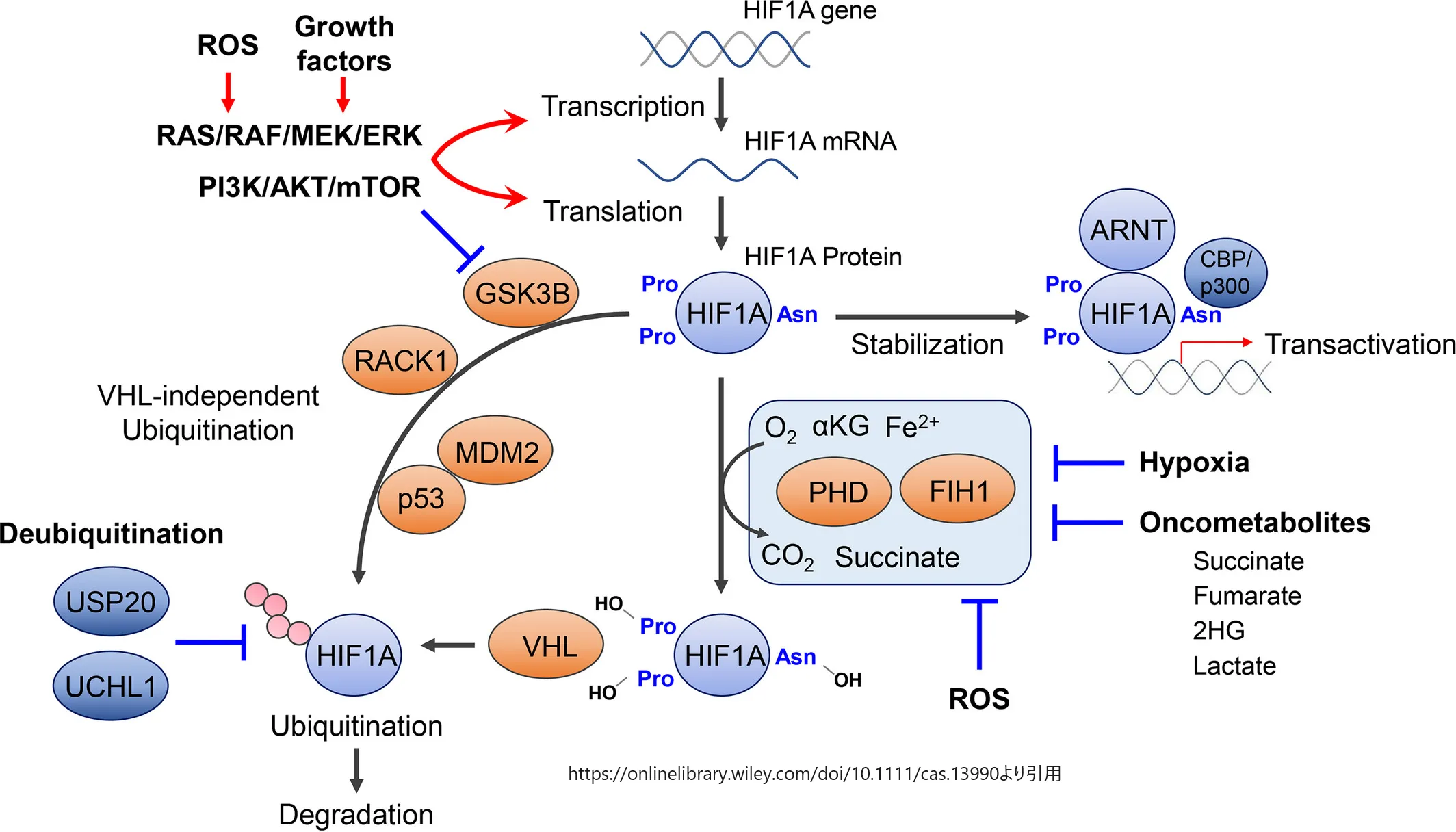
onlinelibrary.wiley.com/doi/10.1111/cas.13990
より引用 低酸素および擬似低酸素における低酸素誘導因子1α(HIF1A)の制御
HIF1Aの発現は、転写、翻訳、翻訳後レベルで厳密に制御されている。HIF1Aタンパク質の安定性は、酸素依存性プロリルヒドロキシラーゼドメインタンパク質(PHD)-フォン・ヒッペル・リンダウ腫瘍抑制タンパク質(VHL)軸によって制御されている。HIF1Aサブユニット阻害剤FIH1もHIF1Aの転写活性を抑制する。HIF1Aの翻訳後修飾に重要なこれらの酵素は、触媒反応に酸素、Fe2+、α-ケトグルタル酸を必要とする。したがって、酸素だけでなく、いくつかの代謝産物もこれらの酵素を阻害することができる。マウスダブルミニッツ2ホモログ(MDM2)/p53、活性化Cキナーゼ1受容体(RACK1)、およびグリコーゲン合成酵素キナーゼ-3β(GSK3B)は、HIF1Aタンパク質のVHL非依存性ユビキチン化過程に関与している。HIF1Aタンパク質の脱ユビキチン化は、HIF1Aタンパク質の安定性にも影響する可能性がある。ARNT、アリール炭化水素受容体核移行因子;Asn、アスパラギン;CBP、CREB結合タンパク質;Pro、プロリン;ROS、活性酸素種;UCHL1、ユビキチンC末端ヒドロラーゼ-L1;USP20、ユビキチン特異的ペプチダーゼ20HIF1AとHIF2Aは、多くの重要な細胞プロセスを制御する転写因子である。HIF1AとHIF2Aはともに、グルコース輸送、脂質代謝、pH恒常性、血管新生を制御する。エリスロポエチンに加えて、HIF1AおよびHIF2Aを介して制御されることが知られている他の因子には、血管内皮増殖因子(VEGF)、血小板由来増殖因子(PDGF)β、トランスフォーミング増殖因子(TGF)αがある。HIF1AとHIF2Aの比率がHIF2A側に偏ることで、細胞シグナル伝達が変化し、細胞内のMyc活性がアップレギュレートされる可能性がある [14] 。この比率の入れ替わりは、いくつかの要因によるものと考えられる。低酸素関連因子(HAF)はHIF2Aの転写活性化とHIF1Aの不安定化させ、より攻撃的な細胞表現型をもたらすことが示された。さらに腎細胞がん組織では、HIF1A遺伝子の遺伝子座である染色体14qの欠損により、HIF1Aのレベルが低下するが、HIF2Aには変化がない。
HIF1AおよびHIF2Aは標的タンパクが重なっていることが多いが、HIF1AおよびHIF2Aにも固有の標的がある。例えば、HIF1Aは解糖の重要な転写因子である。HIF2AはエリスロポエチンをコードするメッセンジャーRNAの転写を誘導する能力を通じて赤血球造血に関与している。
HIFによる転写活性化には、αサブユニットとβサブユニットのヘテロ二量化と核内転位が必要である。βサブユニットは酸素濃度の影響を受けず、VHLタンパク質複合体とは結合しない。対照的に、αサブユニットは酸素濃度に敏感で、VHLタンパク質複合体の基質となる。通常の酸素濃度の存在下では、HIF1AとHIF2Aは酵素的に水酸化される。水酸化されたHIFサブユニットはVHLタンパク質複合体と結合し、ユビキチンと共有結合する。これが起こると、HIFAサブユニットはプロテアソームによって速やかに分解される。
しかし低酸素条件下では、水酸化は起こらず、HIF1AとHIF2AはVHLタンパク質複合体に結合せず、ユビキチン化を受けることができない。HIF1AとHIF2Aのレベルは上昇し、その結果、様々なタンパク質のメッセンジャーRNA転写が増加し、生理的血管新生反応が誘導される。
VHL疾患患者では、体組織で唯一機能しているVHL対立遺伝子が欠損すると、正常な酸素濃度が存在するにもかかわらず、低酸素症に類似した状況が引き起こされる。VHL遺伝子の病原性変異体は、VHLがHIF1AおよびHIF2Aと結合するのに必要なタンパク質複合体を形成できない結果となる可能性があり、1型VHLの変異体の多くはナンセンス媒介性崩壊(NMD)によってVHL発現を完全に消失させるが、HIFAタンパク質を認識する複合体上の結合部位が欠損している可能性もある。いずれの場合も、HIF1AとHIF2Aはユビキチンと結合できず、プロテアソームによる分解を受けない。こうしてHIF1AとHIF2Aのレベルが上昇すると、生理的低酸素状態でもないのに、低酸素状態で産生されるのと同じ分子の産生増多を来す。
HIF1AとHIF2A以外の経路
VHLは、HIF1A系を通して制御されていないが腫瘍形成に関与する可能性のある他のいくつかの分子を標的とする。これらの標的には、MMP1などのマトリックスメタロプロテアーゼ(MMP)、MMP阻害剤、非定型プロテインキナーゼCなどが含まれる。
VHLの腫瘍形成のメカニズムはまだ証明されていないが、様々な血管新生因子と他の成長因子の複合効果により、制御不能な成長刺激を与える自己分泌ループが形成される可能性があり、このことはVHL患者に見られる高血管性の中枢神経系腫瘍と一致する。加えて、VHLは、細胞外マトリックス制御、微小管制御、繊毛中心体周期制御、細胞周期制御といった重要な細胞プロセスを制御しており、そのプロセスの破綻が悪性表現型をもたらす可能性がある。
細胞外マトリックス制御
フォン ヒッペル リンダウ (VHL) 腫瘍抑制遺伝子の不活化により、高度に血管新生した腫瘍が生じる。VHLは2つの経路に沿って作用し、1つ目はHIF-αの分解とその血管新生促進標的遺伝子である血管内皮増殖因子と血小板由来増殖因子-βの下方制御に関与し、2つ目は細胞外マトリックス(ECM)構築を促進する経路である。血管新生促進因子の分泌は、血管新生の主要な誘導因子であることが示されている。ECMアセンブリの喪失は、VHL疾患における腫瘍血管新生と相関する。VHL-ECM構築経路が不活性化されると、高度に血管新生し、ECMが破壊され、マトリックスメタロプロテイナーゼ2活性の増加を示す腫瘍が観察される。ECM の完全性が失われると、血管が腫瘍に浸潤するルートが提供されるため、腫瘍の血管新生が促進および維持される可能性がある。機能的VHLの存在は、細胞外フィブロネクチンマトリックスの適切な組み立てを維持するのに必要である。VHLはフィブロネクチンに結合し、リン酸化依存的に制御する。HIFの制御は維持されているが、コラーゲンIV結合能を持たない病原性変異体は、いくつかの実験モデルにおいて悪性挙動を示す(Cancer Res 2006; 66(3): 1313-9)
。
繊毛の中心体制御と微小管制御
一次繊毛は非運動性の小器官で、メカノセンシング、細胞シグナル伝達、有糸分裂への細胞侵入の制御に関与している。毛様体タンパク質の欠損、あるいは正統的あるいは非正統的なWntシグナル伝達経路を介したシグナル伝達の欠損は、平面的な細胞極性の制御を破壊し、嚢胞形成をもたらす。VHLとグリコーゲン合成酵素キナーゼ3β(GSK3B)の協調的不活性化は、一次繊毛の喪失を誘導するのに十分である。
VHL病患者の腎臓の嚢胞性病変でもホスファチジルイノシトール-3-キナーゼ(PI3K)経路の活性化が認められる、マウスの腎臓において、Vhlhと通常PI3Kシグナル伝達に拮抗するPten腫瘍抑制遺伝子の条件的不活化を組み合わせると、短い潜伏期間後に嚢胞形成が誘発されるが、いずれかの腫瘍抑制遺伝子の不活化だけではそのような表現型は生じなかった。
VHLは微小管に結合して安定化する。VHLの微小管への結合はグリコーゲン合成酵素3によって制御されており、この酵素はVHLをセリン68でリン酸化し、カゼインキナーゼ1によるセリン72でのプライミングリン酸化イベントを必要とする。VHLの欠損や変異VHLの細胞内発現は、不安定なアストラル微小管、紡錘体集合チェックポイントの調節障害、異数性の増加をもたらす。
細胞周期の制御
786-0 腎細胞がん細胞株は、多くの癌細胞と同様に、血清を除去しても細胞周期を終了できない。これに野生型VHL遺伝子の再導入すると、VHL陰性RCC癌細胞が細胞周期を終了し、低血清中でG0/静止状態に入る能力が回復し、それに伴ってp27サイクリン依存性キナーゼインヒビター1B(p27)が上昇する。p27の核局在と強度は、腫瘍の悪性度と逆相関する。VHLは、DNA損傷後のS期キナーゼ関連タンパク質2(SKP2)の不安定化とそれに伴うp27のアップレギュレーションに関与している。
VHLがp53も制御している可能性を示唆されている。p53は有糸分裂チェックポイントの重要な制御因子であり、p53の欠損は異数体細胞の生存を可能にすることが示されている。VHLはp53に結合し、安定化し、トランスアクティベートすることが示されており、この結合はリン酸化によって制御されている可能性がある。
-
病的変異と臨床症状の関係性
-
von Hippel-Lindau(VHL)遺伝子の特定の生殖細胞系列疾患関連病原性変異体または欠失は、VHL疾患の臨床症状に影響を及ぼす可能性がある。VHLの欠失、ナンセンス変異、フレームシフト変異はI型に多く、ミスセンス変異はII型に多いようである。
- 褐色細胞腫
- VHL疾患を有する138家族の研究において、VHL遺伝子の大きな欠失および切断蛋白になると予測される変異は、ミスセンス変化よりも褐色細胞腫のリスクがはるかに低いことと関連していた。特に、コドン167におけるミスセンス変化は、褐色細胞腫の特に高いリスクと関連していた。褐色細胞腫のリスクは、欠失または他の機能喪失型変異体によって減少するが、残存リスクは、この患者集団において褐色細胞腫のスクリーニングを継続することを正当化するのに十分高いということに注意することが重要である。
- 腎細胞がん
- 特定の生殖細胞変異体と腎細胞がんの発生との関連については、データが矛盾している。例として、上記の研究では、VHL疾患を有する138家族の腎細胞癌の累積確率は、ミスセンス変異体を有する家族と比較して、大きな欠失および遺伝子内機能喪失VHL変異体を有する家族で同程度であった。対照的に、血縁関係のない126家族の274人を対象とした別の報告では、ミスセンス変異と比較して、タンパク質の切断または欠失をもたらす遺伝子異常、または大きな再配列は腎細胞癌の発生率を増加させた。VHL遺伝子の2つの狭いクラスター領域内のミスセンス変異は、VHL遺伝子の他の場所でのミスセンス変化よりも腎細胞がんの高い発生率と関連していた。
- 網膜毛細血管芽細胞腫
- VHL遺伝子異常と網膜毛細血管芽細胞腫(RCH)の頻度との相関も観察されている。196人の患者のシリーズにおいて、RCHはミスセンス変異体を有する患者では、切断蛋白を生じる遺伝子異常を有する患者よりも2倍多かった。
VHL関連腫瘍の患者において、VHL遺伝子の病原性変異を同定する最も一般的な方法は、遺伝学的検査または遺伝性癌遺伝子パネルの結果である。American College of Medical Genetics and Genomics (ACMG)は、臨床的全エクソームまたはゲノム配列決定を行う際の二次的所見(偶発的所見と呼ばれていた)の報告に関する勧告を発表している。VHL遺伝子は、医学的に対処可能と考えられる約70の遺伝子リストに含まれている。従って、ゲノム配列決定の拡大、特に神経発達障害を有する幼児の診断に伴い、二次所見として同定されるVHL症候群の患者数が増加している。しかしながら、エクソームまたはゲノム配列決定に関するACMGの二次所見ガイドラインは、VHL遺伝子を含む記載された遺伝子が、適切な試験なしに一般集団スクリーニングの準備が整っていることを意味すると解釈すべきではない。特に、非発症者をスクリーニングする際には、一般集団をサンプリングする際の浸透率が不明であることや、重要性が不明な変異の扱いを考慮する必要がある。
-
VHL関連腫瘍
-
腎細胞がん
臨床像
VHL疾患の患者は多発性腎嚢胞および腎細胞がん(RCC)を発症するリスクがあり、患者の約3分の2に発生する。事実上、VHL関連RCCはすべて明細胞腫瘍である。
20歳以前にVHL病でRCCと診断されることはまれであるが、10代でRCCと診断される例もあるため、現在では15歳からスクリーニングを開始することが推奨されている。ケースシリーズにおける発症時の平均年齢は44歳で、60歳まで生存した患者の69%がRCCを発症すると推定されている。
RCCは多くの場合、多中心性で両側性であり、嚢胞に伴って発生することもあれば、嚢胞のない腎実質から新たに発生することもある。腎嚢胞は良性の場合もあるが、良性に見える腎嚢胞内の固形成分には、ほとんどの場合RCCが含まれるため、前悪性病変であると考えられている。腎実質の病理組織学的変化は、腎嚢胞に限定されず広範囲に及んでいる。系統的な顕微鏡分析により、明細胞RCCの前駆体と考えられる多数の明細胞異常が同定された。同様の明細胞前駆体は、散発性RCC患者やRCCのない患者の腎実質では認められなかった。
VHL患者におけるRCCの成長動態は、生殖細胞系列の病原性変異が解析された64人のVHL患者の96の腎腫瘍を平均55ヵ月追跡調査した研究で報告されている。このシリーズでは、96の腫瘍の平均成長率は4.4mm/年、平均体積倍加期間は25.7ヵ月であった。
管理
VHL疾患とRCC患者の管理は進歩している。VHL疾患と腎腫瘤を有する患者は、腎臓専門医、泌尿器科専門医、腫瘍内科専門医、インターベンショナルラジオロジストなど、VHL管理ガイドラインに精通した臨床医による集学的治療を受けるべきである。診断時には、遺伝学的診断が確実であることを確認し、他の家族のリスクを評価し、適切な場合には予測的遺伝学的検査を提供するための適切な戦略をとるために、臨床遺伝専門医も関与すべきである。これらの患者の管理に対するわれわれのアプローチを以下に概説する。
局所腫瘍で長径3cm未満の場合
- サーベイランス
- 無症状のVHL疾患および3センチ未満の固形局所性腎腫瘍の患者には、直ちに手術または内科的治療を行うのではなく、初期サーベイランスを行う。これらの腫瘍は、腹部の磁気共鳴画像法(MRI)で3~6ヵ月ごとに監視できる。少なくとも3回の連続スキャンで病変の安定性が確認されれば、監視撮像を2年ごとに延長できる。
ただし、日本のガイドラインでは、2センチがカットオフとなっている。腎温存手術を考えた場合小径で治療を開始したほうが有利なこと、近年凍結療法のような低侵襲治療が可能になったことが考慮されている。
※クライオアブレーション(Cryoablation): 腹腔鏡下または経皮的クライオアブレーションは、小さな腫瘍を凍結し破壊する低侵襲手技である。クライオプローブは、プローブ先端を通る窒素ベースの液体によって-185~-195℃まで冷却される。クライオアブレーションは、3本のアプリケータと10mmの腫瘍マージンを必要とするため、RFA(Radiofrequency Ablation ラジオ波焼灼)よりも精度が劣る。2cmの腫瘤のRFAでは約10cm3の正常組織が切除されるのに対し、クライオアブレーション治療では30cm3の正常組織が切除される。腎臓内の腫瘍の位置は治療の成功に重要な役割を果たしており、中心部に位置する腫瘍ほど効果的な腫瘍細胞の破壊に失敗することが多い。治療失敗はまた、腫瘍の大きさが4cmを超えると有意に関連する。安定している直径3cm未満の固形腎腫瘍は、一般に転移の可能性が非常に低いため、安全に監視することができる。一例として、ある研究では、VHL疾患と小さな腎腫瘍を有する患者96人に連続画像検査が実施された。腫瘍が直径3cmの閾値に達した時点で52人の患者に手術が行われた。追跡調査期間中央値60ヵ月の時点で、腎摘出術を必要とした患者は2例のみで、転移性疾患を発症した患者はいなかった。残りの44例では、この大きさの閾値は即時手術の適応とはされなかった。このグループでは、追跡期間中央値66ヵ月の時点で、12人の患者が腎摘除術を必要とし、11人が転移性病変を発症した。
- ベルズチファン
- 固形局所腎腫瘍3センチ未満で腫瘍増殖が加速している患者、またはより積極的な管理戦略を望む患者には、サーベイランスの代替としてベルズチファンが提供されている。正式な基準はないが、一部の専門家は、腫瘍増殖の加速を年間5mm以上と定義している。このような患者において、ベルズチファンは有効であり、奏効が持続し、将来の外科的介入を延期または回避できる可能性がある。
VHL病で全身療法未治療のRCC患者61人を対象とした非盲検第Ⅱ相試験(004試験)において、追跡期間中央値22ヵ月で、ベルツチファンの客観的奏効率は49%で、そのすべてが部分寛解であり、2年無増悪生存率は97%であった。奏効までの期間中央値は8ヵ月であり、患者の半数以上(56%)が1年以上持続する奏効を経験した。グレード3以上の治療関連毒性は、貧血、高血圧(各8%)、疲労(5%)、呼吸困難、筋肉痛(各2%)であった。
FDAは、関連するRCCに対する治療が必要で、かつ直ちに手術を必要としないVHL疾患の成人患者を対象に、ベルズチファンの承認を承認した。ベルズチファンは、VHL関連中枢神経系血管芽腫および膵神経内分泌腫瘍に対してもFDAの承認を受けている。(日本では未承認)
ベルズチファンは、VHL経路によって制御される重要なタンパク質である低酸素誘導因子2α(HIF2α)を特異的に阻害する。ベルズチファンは、病勢進行または許容できない毒性が現れるまで、1日120mgを経口投与する。低酸素症と貧血は治療に伴う一般的な標的上毒性であり、以下のように管理される。- 貧血の管理
- 貧血は、ヘモグロビン<9 g/dLの場合、赤血球輸血が必要な場合、または緊急の外科手術が必要な場合、ベルズチファンを中止することで管理できる。ヘモグロビンが9g/dL以上に回復したら、ベルズチファンを1日120mgで再開することができる。治療抵抗性の貧血に対しては、貧血の重症度に応じてベルズチファンを80mgに減量するか、または永久に中止することができる。
ベルズチファンで貧血を発症した患者に対しては、赤血球造血刺激因子製剤の使用も行われる。これらの薬剤は貧血治療に非常に有効であり、臨床経験では赤血球輸血の必要性を減らすことができるが、米国食品医薬品局(FDA)の添付文書とは異なっており、安全性に関するデータが限られているため、ESAの併用は推奨されていない。 - 低酸素症の管理
- 無症候性低酸素症の患者に対しては、ベルズチファンを継続し、酸素飽和度を注意深く監視する。持続性または症候性の低酸素症(パルスオキシメーターが88%未満、または安静時または運動時の酸素分圧PaO2が55mmHg未満)の患者には、ベルズチファンを80mgに減量し、適応に応じて酸素療法を行う。
3cm以上の局所腫瘍の場合
- ネフロン温存アプローチ
-
3cm以上の局所性RCCの患者には、根治的腎摘除術ではなくネフロン温存アプローチを推奨する。外科的アプローチを選択した患者には腎部分切除術を行う。非外科的療法を選択する患者には、凍結療法やラジオ波焼灼療法などの選択肢がある。
VHL疾患患者の局所RCCに対する治療アプローチは、腎実質を可能な限り温存し、慢性腎機能障害のリスクを軽減するために、根治的腎摘除術から、腎部分切除術、凍結療法、ラジオ波焼灼療法などのネフロン温存アプローチへと移行している。ネフロン温存のアプローチは、両側性腫瘍や再発腫瘍のリスクがあるVHL疾患の患者にとって望ましい。
この変化の根拠は以下が挙げられる。
- 画像診断法(CT、MRI、超音波など)の向上と定期的なサーベイランスプログラムにより、より多くのRCCが早期に発見されるようになった。
- 早期RCC(がんが小さく腎臓内に限局)に対しては、腎部分切除術は腎全摘術と同等の効果があるようである。腎実質を温存し透析を回避するために、慎重に選択された患者では、腎部分切除を繰り返すことが可能であるかもしれない。
- 他のネフロン温存アプローチ、特に凍結アブレーションと高周波アブレーションは、正常腎への損傷を最小限に抑えながら、複数の小さな腫瘍を根絶できる可能性がある。
VHL患者におけるRCCの治療後は、引き続き綿密なサーベイランスを行う。新たな腎腫瘍は5年後までに患者の約30%、10年後までに85%で検出されるが、患者を注意深く観察している限り、転移のリスクは低いと思われる。遠隔転移はネフロン温存アプローチ患者21人を対象としたある報告では、追跡期間中央値29ヵ月で2人であった。ネフロン温存による透析回避との利益衡量に耐えられる数字であると考えられる。
- ベルズチファン
- 手術や他のネフロン温存アプローチの候補とならない患者には、ベルズチファンによる全身療法を代替的に行う。この治療法の適応となる患者には、複数回の手術歴のある患者や、孤立性残存腎に病変があり、さらなる局所介入を行うと無腎状態になるような患者が含まれる。
- 腎移植の適応
- 腎移植は、RCCのために両側腎摘出術が必要であったり、末期腎臓病を発症したVHL患者に対して行われてきた。免疫抑制療法が腫瘍再発のリスクを高めるのではないかという懸念があるため、経験は限られている。しかし、腎移植を受けたVHL疾患患者32人と、VHL疾患のないマッチング移植レシピエント32人を対象とした少なくとも1件の研究では、この懸念はあたらなかった。平均4年間の追跡調査において、移植片および患者の生存期間、腎機能に両群間に差は認められなかった。しかし、もともと転移が少ないとされるWHL腎がんの場面であり、観察母数も少ないのを考慮すべきである。
転移性疾患
VHL疾患および転移性RCC患者における全身療法を評価する臨床試験は限られており、これらの患者の管理は散発性転移性RCCに使用されるアプローチから外挿される。
初期段階の臨床試験のデータから、スニチニブやパゾパニブなどの血管新生阻害剤がVHL病変を有する転移性RCC患者に有効であることが示唆されている。RCC病変を縮小させる血管内皮増殖因子(VEGF)標的治療の出現により、特定の薬剤を慢性的または断続的に使用することで、外科的介入の頻度を減らすことができる可能性がある。
- スニチニブ
- スニチニブによる治療を受けたVHL疾患患者15人を対象として、VHL患者には、毎日50mgのスニチニブを28日間4サイクル投与し、その後14日間休薬した臨床試験では、RCC患者18人中6人(33%)に部分奏効が認められた。VHL患者には、毎日50mgのスニチニブを28日間4サイクル投与し、その後14日間休薬した。主要エンドポイントは毒性でした。有効性評価には修正された RECIST が使用されました。私たちは、レーザースキャンサイトメトリー (LSC) を使用して、20 のアーカイブ腎細胞癌 (RCC) および 20 の血管芽腫 (HB) のバイオマーカー発現レベルを評価しました。グレード3 の毒性は、5人の患者で疲労が認められた。10人の患者では用量の減量が必要であった。18 のRCC 病変と21の血管芽腫HB病変が評価可能であった。HBでは治療に対する反応はなかった。
- パゾパニブ
- 1例のVHL患者を対象とした第II相臨床試験において、RCCの病変奏効率は52%であった。
パゾパニブ(毎日 800 mg 経口投与)で 24週間治療された。患者および治療医師の希望に応じて治療を継続するオプションもある。遺伝的に確認された患者またはフォン・ヒッペル・リンダウ病と一致する臨床的特徴を有する患者37名をスクリーニングし、そのうち適格な患者31名がパゾパニブによる治療を受けた。客観的な反応を達成した患者の割合は 42% (患者 31 人中 13 人) でした。病変部位別では、腎細胞癌 59 件中 31 件(52%)、膵臓病変17件中9件(53%)、CNS血管芽腫49件中2件(4%)で反応が得られた。31人の患者のうち7人 (23%) が、24 週間後も治療を続けることを選択しました。患者31人中4人(13%)がグレード3または4の高トランスアミナーゼ血症のため試験を中止し、3人(10%)がグレード1〜2の併発毒性を伴う治療不耐症のため試験治療を中止した。治療に関連した重篤な有害事象には、虫垂炎と胃炎が各1例、致命的な中枢神経系出血が1例含まれていた。 - ベルズチファン
- HIF-2α阻害薬であるベルズチファンは、転移性RCC患者に対する規制当局の承認を得ていない。
血管芽腫
臨床像
血管芽腫は、限局性で毛細血管が豊富な良性新生物であり、局所浸潤や転移はみられない。しかしながら、血管芽腫自体または病変周囲の嚢胞形成により、隣接構造物への圧迫および出血を介して症状を引き起こすことがある。
血管芽腫はVHL疾患に伴う最も一般的な病変であり、患者の60~84%が罹患し、典型的には小脳、脊髄、または網膜に発生する。VHL関連血管芽腫の患者は散発性血管芽腫の患者よりも若い傾向があり、1つのシリーズにおける診断時の平均年齢は29歳で、9~78歳の範囲であった。散発性血管芽腫は通常孤立性で、一般に手術後に再発しないが、VHL疾患患者の病変は潜在性で多発性の傾向がある。VHL疾患と血管芽腫を有する患者160人の詳細な分析では、655個の個別の腫瘍が同定され、そのうち51%が脊髄に、38%が小脳に、10%が脳幹に、2%が上脳幹にあった。
一見散発性の血管芽細胞腫を呈し、VHLの家族歴がなく、他の疾患の証拠もない連続した患者188人のコホートにおいて、VHLの生殖細胞系列病原性変異体が症例の5%に存在した。陰性と判定された患者のうち、5%がその後数年間にVHLに関連した病変を発症した。この事実は体細胞モザイクをうかがわせる。
したがって、網膜血管芽腫または中枢神経系(CNS)血管芽腫を有するすべての患者に対し、たとえ病変が1つであっても、VHL生殖細胞系列病原性バリアントについて検査することが推奨される。遺伝学的検査へのアクセスが限られている場合、生殖細胞系列のVHL病原変異が同定される可能性は患者の年齢と逆相関するため、50 歳未満で発症した病変を有する患者に検査を絞ることは妥当であろう。
中枢神経系血管芽腫は多くの場合、最初に10歳代で発症するため、VHL疾患患者では11歳からの脳および脊髄の磁気共鳴画像法(MRI)によるルーチンのスクリーニングが推奨される。
管理
VHL患者は、脳幹、小脳、および脊髄内の深部および重要な部位に中枢神経系血管芽腫が発生するリスクがある。緩徐で無症状の進行だけでなく、出血または嚢胞の拡大による突然の悪化のリスクもある。VHL疾患の最初の徴候として症候性血管芽腫を呈する患者もいれば、監視画像や新たな神経学的症状の発現によって後に診断される患者もいる。
患者はしばしば多発性病変を発症するため、治療努力は外科的介入の頻度を最小限にすることによって治療に関連した罹患率を回避することに重点を置くべきである。手術は通常、脊髄、脳幹、および小脳の病変をうまく取り除くことができるが、病変が症候性を示すようになるか、または増殖が加速するまでは介入を控える。CNS画像で進行が確認された患者は、臨床症状の証拠がないか、より頻繁な間隔で経過観察する必要がある。
サーベイランス
1つ以上の血管芽腫の画像所見があり、無症状および/または腫瘍の増殖が緩徐な患者には、外科的または内科的治療ではなく、連続画像診断によるサーベイランスを推奨する。これらの患者に対しては、MRIによるサーベイランス画像診断を年1回、または必要に応じてより頻繁に行う。サーベイランスにより、腫瘍に関連した症状または増殖の加速など、より説得力のある疾患の進行が発現するまで、治療およびそれに伴う毒性を延期することができる。
低酸素誘導因子-2α(HIF-2α)阻害薬であるベルズチファンは、進行を認めると症状が出現する可能性のある腫瘍を有する患者、または将来の手術を遅延または延期したい患者にとって、サーベイランスに代わる妥当な選択肢である。小さくて無症状の腫瘍は、放射線療法(RT)で先制治療すべきではない。
中枢神経系血管芽腫は、予測不可能な期間休眠していることもあれば、増殖が加速して現れることもある。特定の病変の自然史を予測できる決定的なマーカーは存在しない。したがって、画像診断と臨床症状や徴候の観察による定期的な経過観察が必要である。
CNS血管芽腫患者225人(男性 111 人、女性 114 人)の1921個のレビューによると51%は増大せず、1,227 個の血管芽腫 (49%) は階段状 (886個)、線形パターン (76個)、または指数関数的パターン (264個) で増大した。より速い腫瘍増殖は、男性、症候性腫瘍、および嚢胞を伴う腫瘍と関連していた。部分的な生殖細胞系列欠失も腫瘍の増大と関連していた。血管芽腫の増殖は予測不可能であることから、これらの患者では継続的なサーベイランスの必要性が強調される。
症候性または進行性疾患
VHLを有し、症候性および/または進行性に増大するCNS血管芽腫の患者に対する治療の選択肢には、手術、放射線療法、および投薬がある。VHL関連血管芽腫は、脳神経外科医、インターベンショナル神経放射線科医、放射線腫瘍医、および中枢神経系悪性腫瘍の専門知識を有する神経腫瘍医の意見を取り入れた集学的な方法で管理するのが最善である。
手術と放射線療法は伝統的に進行性中枢神経系疾患に対する第一選択療法であったが、中枢神経系活性を有する有効な全身療法の開発により、進化している。
- 手術適応
- 手術は通常、重大な神経学的症状を引き起こしているか、腫瘤効果または出血により危険にさらされている血管芽腫の患者に必要である。増大した手術可能な腫瘍を有する患者であって、ただちに悪化する危険性がない患者は、手術を遅らせるか回避するためのベルズチファンのよい候補である。
- ベルズチファン
- 症候性または急速に増大した中枢神経系血管芽腫で切除不能または術後障害のリスクが高いほとんどの患者には、初回RTまたはリスクの高い外科的デバルキングの試みではなく、HIF-2α阻害薬ベルズチファンによる全身療法の試行を推奨する。ベルズチファンは、手術またはRT後の再発/難治性腫瘍患者にも適切である。
ベルズチファンはCNSにおいて有効かつ持続的な奏効のエビデンスを示している。全身療法未治療のVHL関連腎細胞がん患者61人を対象とした第II相試験(004試験)には、測定可能なCNS血管芽腫患者50人のサブセットが含まれていた。追跡期間中央値22ヵ月の時点で、このサブセットのうち15人の患者(30%)に客観的奏効が認められ、その内訳は完全奏効3人(6%)および部分奏効12人(24%)であった。奏効までの期間中央値は3ヵ月で、患者の約4分の3(73%)が1年以上持続する奏効を経験した。この試験結果を受け、米国食品医薬品局(FDA)は、関連する中枢神経系血管芽腫に対する治療が必要で、かつ即時手術を必要としないVHL疾患の成人患者に対するベルズチファンの承認を承認した。ベルズチファンはまた、VHL関連RCCおよび膵神経内分泌腫瘍に対してもFDAから承認を受けている。(日本未承認) - 放射線治療
- 定位放射線手術(SRS)および従来の分割RTは、手術が困難な再発/難治性病変および/またはベルズチファンが無効な病変の治療に選択的な役割を果たしている。
血管芽腫に対するSRSと従来のRTの長期的な有効性および安全性を比較したランダム化プロスペクティブ研究は限られている。米国国立衛生研究所で実施されたプロスペクティブ観察研究では、SRSで治療された病変部において経時的な腫瘍制御が観察された 。20人のVHL患者(男性10人、女性10人)が44個のCNS血管芽腫(小脳39個、脳幹5個)のSRS治療を受けた。SRS治療後2年、5年、10年、15年後の局所制御率はそれぞれ91%、83%、61%、51%であった。単変量解析では、最後の追跡調査では腫瘍制御の悪化に関連する変数は特定されなかった。SRS 治療を受けた小型 (直径 1.0 cm 未満) の無症候性腫瘍の33% が長期追跡調査中に進行した。長期にわたる放射線の悪影響はなかった。VHLにおける血管芽腫のSRS治療は放射線の悪影響のリスクは低いが、長期の追跡調査ではコントロールが低下する。これらの結果は、SRSは無症候性腫瘍の予防的治療に使用すべきではなく、外科的に切除できない腫瘍の治療のために保留すべきであることを示している。 - 血管新生阻害剤
- パゾパニブやスニチニブなどの血管新生阻害剤は、これらの新生物に対する有効性が限られているため、あまり好ましくない選択肢である。
- パゾパニブ
- パゾパニブは中枢神経系血管芽腫の患者に臨床的有用性をもたらすが、慎重に使用すべきである。治療抵抗性のVHL関連CNS血管芽腫患者において、小分子多受容体チロシンキナーゼ阻害剤であるパゾパニブを使用した臨床的および放射線学的抗腫瘍反応を実証した最初の報告では、毎日の経口パゾパニブ(800 mg/日)による治療の開始により、神経学的に顕著な改善と放射線学的腫瘍体積の減少がもたらされた。VHL疾患患者31人を対象とした第II相試験では、パゾパニブは血管芽腫患者の4%で部分奏効を示し、大半の患者で病勢が安定したが、2人の患者で中枢神経系出血を引き起こした。
- スニチニブ
- 血管新生阻害薬であるスニチニブを用いたプロスペクティブ臨床試験(VHL患者には、毎日50mgのスニチニブを28日間4サイクル投与し、その後14日間休薬)では、RCCには効果を認めたが、血管芽腫に奏効を示すことができなかった。
網膜毛細血管芽細胞腫
臨床症状
網膜毛細血管芽細胞腫は一般的に、網膜周辺部や傍乳頭部にみられる。網膜毛細血管芽細胞腫による視力低下は一般的に、腫瘍からの滲出液が網膜浮腫を引き起こすか、または腫瘍表面のグリア増殖が網膜線条および歪曲を誘発する牽引作用によって引き起こされる。網膜毛細血管芽細胞腫は出血することがあり、網膜剥離、緑内障、および視力喪失を引き起こす。
網膜毛細血管芽細胞腫は、60歳までにVHL患者の最大70%に認められ、しばしば多巣性で両側性である。散発性網膜血管芽腫の患者と比較して、VHL患者ははるかに若く、多発性病変を有する可能性が高い。VHL患者31人とVHL疾患のない患者37人を対象としたケースシリーズでは、VHL患者は疾患のない患者よりも若く(それぞれ18歳 vs 36歳)、平均4個の腫瘍を有し、新たな腫瘍を発生しやすかった。
網膜毛細血管芽細胞腫における遺伝子型と表現型の関係の評価では、VHLタンパク質を完全に欠損する変異体を有する個体の15%が血管芽細胞腫を発症したのに対し、患者集団における全有病率は37%であった。視力喪失のリスクは年齢とともに増加するが、腫瘍の数は年齢の関数として有意に増加することはなかった。
一見散発性の中枢神経系(CNS)血管芽腫の場合と同様に、網膜毛細血管芽腫を呈する患者(特に40歳以前の場合)は、VHL遺伝子の病原性変異体について生殖細胞系列遺伝子検査を受けるべきである。
網膜毛細血管芽細胞腫は頻度が高いため、VHL疾患患者には定期的なサーベイランスが推奨される。このような病変は小児期に発症することが多いため、小児集団では診断がついた時点で眼科的サーベイランスを開始することが重要であり、小児におけるVHL遺伝子変異の遺伝子検査が推奨される理由の一つである。
管理
網膜毛細血管芽細胞腫の治療では、治療の有益性と治療に関連しうる合併症とのバランスをとる必要がある。小さな病変は、増殖または症状の証拠が認められるまで、特別な治療を行わずに注意深く観察してよいかどうかについては、データが分かれている。網膜毛細血管芽細胞腫を発見したら直ちに治療することを推奨する意見もあれば、ある程度の大きさの変化を待ってから治療を開始する意見もある。治療を開始する場合は、他の治療法よりもレーザー光凝固療法を推奨する。他の選択肢としては、光線力学的療法や放射線療法(RT;特に救済療法)がある。ベルズチファンによる全身療法は、腫瘍が視神経に近接している、または進行性の病変が多発するなどの理由で局所療法が不適格な患者には、許容可能な選択肢であるが、可能であれば、臨床試験が推奨される。
レーザー光凝固療法は、一般に1回の治療で70%以上の症例に有効であり、好ましい治療法である。例外として、視神経の血管芽腫は正常な網膜に有害な副作用を及ぼすため、これらの方法で治療すべきではない。光線力学的療法も網膜毛細血管芽細胞腫の治療の選択肢として考慮できるが、その有効性に関するデータは限られている。外部照射RTは、他の治療法が無効であった場合の救済療法の役割を果たす可能性がある。
低酸素誘導因子-2α(HIF-2α)阻害薬であるベルズチファンは、局所療法に不適格である視神経に近い網膜毛細血管芽細胞腫患者または多発性進行性血管芽細胞腫患者に対する選択肢である。第II相試験では、ベルズチファンは評価可能な網膜血管芽腫患者12人の16眼すべて(100%)で疾患を改善した。
血管芽腫の発生細胞およびその内皮の生物学的性質をよりよく理解し、積極的な全身療法を開発するためには、さらなる治験的研究が必要である。血管新生を阻害するいくつかの血管内皮増殖因子(VEGF)受容体阻害薬は、網膜血管芽腫に限定的な有効性を示している。
褐色細胞腫
臨床的特徴
褐色細胞腫は散発的にみられるほか、VHL病、多発性内分泌腫瘍2型、コハク酸デヒドロゲナーゼ(SDH)サブユニットA(SDHA)、B(SDHB)、C(SDHC)、D(SDHD)の病原性バリアント、神経線維腫症1型、および他のまれな疾患など、多くの遺伝的症候群に関連してみられる。
褐色細胞腫の患者はすべて、基礎となる症候群を同定するために遺伝学的評価を受けるべきであり、これにより患者がリスクを有する他の腫瘍に対して適切なサーベイランスを開始することができる。これらの腫瘍に関連する遺伝子の数が増加していることから、遺伝子検査は一般的に、適切な遺伝子診断を行うための多遺伝子次世代シーケンシング(NGS)パネルに依存している。褐色細胞腫の存在は、2A-C型VHL疾患の定義に用いられる。
散発性の褐色細胞腫患者271人(他の腫瘍や家族歴はなし)を対象に、VHLと、家族性褐色細胞腫に関与している他の3つの遺伝子(RET、SDHB、SDHD)の生殖細胞系列病原性変異について検査した研究報告では、生殖細胞系列のVHL病原性変異体は、患者全体では30人(11%)、18歳以下で発症した患者の42%で同定された。30例中12例では最終フォローアップ時に家族歴が陽性であり、他の少なくとも4例では両親とも陰性であったため、de novoの生殖細胞系列VHL病原性変異体と考えられる。
VHL疾患における褐色細胞腫は、VHLを発症していない患者に発生するものと比較して、若年患者にみられる傾向があり、多発性であることが多く、副腎外に発生することがあり、症状またはカテコールアミン産生の生化学的証拠を伴うことが少ない。
カテコールアミンを産生する腫瘍は、高血圧、発汗、頻脈、および明らかな気分変化などの褐色細胞腫の典型的な臨床徴候および症状と関連することがある。VHL疾患および褐色細胞腫によるカテコールアミン産生の患者は、ほとんどノルメタネフリンのみを産生する。
交感神経の過活動や重篤な高血圧などの麻酔合併症の潜在的リスクがあるため、VHL疾患の患者が手術を必要とする場合は常に、潜伏性褐色細胞腫の可能性を考慮する必要がある。
診断
褐色細胞腫はX線画像検査、血漿メタネフリン/ノルメタネフリン検査、およびあまり一般的ではないが尿メタネフリン/ノルメタネフリン検査で検出できる。
傍神経節腫と呼ばれる副腎外病変の可能性があるため、従来の画像診断では不十分な場合がある。18-F-ジヒドロキシ-フェニル-アラニン(18F-DOPA)陽電子放射断層撮影法(PET)を用いた研究はいくつかの背景を示し、イオベングアン(メタヨードベンジルグアニジンMIBGともいう)スキャンはVHL患者の褐色細胞腫の発見に有効ではない。
VHL患者7人を対象とした18F-DOPA PETのパイロット研究では、コンピュータ断層撮影(CT)検査と同様に高い検出率(7人中7人)が示された。一方、[(123/131)I]-MIBGシンチグラフィでは7病変中4病変を検出できなかった。
VHL患者52人の副腎画像診断を評価した前向き研究では、CT(n=139)、MRI(n=117)、18F-フルオロデオキシグルコース(18F-FDG)PET(n=94)、18F-DOPA PET(n=40)で390病変が同定された。18F-DOPA PETでは、副腎(11)、腎臓(3)、肝臓(4)、肺(1)、および頸部傍神経節腫(1)の病変を含む20の膵腫瘍と20の膵外腫瘍が同定された。これらの腫瘍部位は、従来の画像検査では患者の9.6%、病変の4.4%で描出されなかった。
血漿メタネフリンとノルメタネフリンの測定は、重要な診断情報を提供する。VHL疾患と多発性内分泌腫瘍2型(MEN-2)患者を対象とした研究では、血漿中のノルメタネフリンとメタネフリンを測定したところ、感度は97%、特異度は96%であった。ノルメタネフリン-メタネフリン比が高いのは、VHL疾患の患者がほとんどノルメタネフリンのみを産生するためと予想される。
管理
症候性褐色細胞腫の治療法として選択されるのは、適切なαアドレナリン遮断薬および必要に応じてその他の支持療法を行った後の外科的摘出である。
膵腫瘍
膵臓の異常の種類-膵臓の異常はVHL疾患患者によくみられる。観察研究では、青年および成人の最大77.2%に膵病変が確認された。
最も頻繁に遭遇する病変は以下の通りである。
- 膵嚢胞(70パーセント)
- 漿液性嚢胞腺腫(9パーセント)
- 神経内分泌腫瘍(9~17%)
膵嚢胞および漿液性嚢胞腺腫
単純性膵嚢胞および漿液性嚢胞腺腫は、X線所見が劇的であっても無症状のことがある。心窩部痛および不快感または胆道閉塞を引き起こす病変が発生することがあり、評価および適切な治療が必要である。
膵炎および膵不全はきわめてまれな合併症であるが、ある程度の膵外分泌機能障害が報告されている。便の特徴や消化パターンの変化について尋ねることは、VHL疾患と膵嚢胞を有する患者の全身状態の評価の一部であるべきである。
膵の粘液性嚢胞はVHL疾患との関連ではみられないし、膵腺癌のリスクも増加しない。
神経内分泌腫瘍
膵の神経内分泌新生物はしばしば多巣性である。大部分は高分化型(悪性度1~2)の神経内分泌腫瘍であるが、高悪性度の高分化型腫瘍(pNET、G3)および高悪性度の低分化型腫瘍(神経内分泌がん)も報告されている。
pNETは良性または悪性(局所リンパ節および/または肝臓への転移の存在によって示される)である。神経内分泌腫瘍患者108人の報告では、9人(8%)に転移がみられた。最も転移しやすいpNETは、直径が3cmを超え、腫瘍倍加時間が早く(500日未満)、VHLのミスセンスおよび/またはエクソン3の病原性変異体または病原性変異体の可能性が高いものである。
これらの新生物のほとんどは非機能性であり、ペプチド過剰産生の症状を起こすことなく、長期間ゆっくりと成長する。血管作動性腸管ペプチドによる下痢やインスリンによる低血糖エピソードなどといった分泌ペプチドによる機能性症候群の報告がある。
管理
膵固形病変およびpNETに対する手術
pNETの管理は主に外科的であるが、外科的切除の基準は散発性pNETの患者とは異なる。外科的治療を受けるVHL関連pNETS患者は、術前に画像診断を受けるべきであるが、通常はガリウムGA-68 DOTATATE PET-CTを用いる。
膵体部または膵尾部に直径3cmを超える、または膵頭部に直径2cmを超える切除可能な病変を有する患者には、他の介入または全身療法よりも外科的切除を推奨する。手術が不可能な場合や腫瘍が切除不能と考えられる場合は、他の全身療法ではなくベルズチファンが推奨される。
小さな原発性病変(3cm以下)に対しては、VHL病原変異体のタイプや部位、腫瘍増殖率などの他の臨床因子を考慮した非手術的アプローチ(例えば、サーベイランス、ベルズチファン)が適切である。
2~3cm未満のpNETのリスク層別化を、大きさとVHL遺伝子型分類の結果の両方に従って支持するデータがある。
- 腫瘍の最大径が1.2cm未満の患者は、追跡期間中に転移を発症し外科的介入を必要としなかった。
- 腫瘍径が3cmを超える患者は、転移を発症するリスクが高かった。
- 腫瘍が1.2cm以上3cm以下の患者80人のうち、VHLのミスセンス遺伝子変異を有する患者のみが、時間の経過とともに転移を発症した(他のタイプの遺伝子変異を有する患者では0人であったのに対し、5人)。外科的介入を必要とする頻度は、他のタイプの分子変化(40%対16%)およびエクソン3(エクソン1または2と比較)の病原性変異を有する患者と比較して、ミスセンスVHL病原性変異を有する患者で高かった(多変量解析でHR 8.8、95%CI 1.2-66.3)。
手術の原則は散発性pNETと同様であるが、腫瘍の多巣性と将来的な膵切除の可能性を考慮すると、膵温存手術が重視される。切除されたVHL関連pNETの長期転帰は、散発性pNETの転帰よりも一般に良好であるようである。
サーベイランス
ベルツチファンの役割-pNETが3cm以下で腫瘍の増殖が緩徐な患者には、切除よりも連続画像診断によるサーベイランスが推奨される。
低酸素誘導因子-2α(HIF-2α)阻害薬ベルズチファンによる初回治療は、急速な腫瘍増殖(すなわち、加速倍加時間<500日)を示す病変を有する患者、または将来の外科的介入を遅延または延期したい切除可能な腫瘍を有する患者に対するサーベイランスの代替療法である。
限られたデータではあるが、3cmを超える限局性腫瘍で手術が不可能な場合、または腫瘍が切除不能な場合にも、他の全身療法よりもベルツチファンが推奨される。
ベルズチファンは、局所進行性または転移性の高分化型pNETに使用される他の全身療法と直接比較されておらず、この集団での使用にはさらなる調査が必要である。
全身療法未治療のVHL関連腎細胞がん(RCC)患者61人を対象とした第II相試験(004試験)には、測定可能なpNETを有する患者22人のサブセットが含まれていた。追跡調査期間中央値22ヵ月の時点で、このサブセットのうち、3例の完全奏効(14%)および17例の部分奏効(77%)を含む20例(91%)に客観的奏効が認められた。奏効までの期間中央値は約8ヵ月で、進行性の症例は報告されなかった。組織学的分化や有糸分裂率、VHL遺伝子型、pNET患者の前治療に関するデータは提供されなかった。
この結果に基づき、米国食品医薬品局(FDA)は、VHL関連pNETに対する治療が必要で、かつ即時手術を必要としないVHL疾患の成人患者に対するベルズチファンの承認を承認した。
中耳の内リンパ嚢腫瘍
症状
内リンパ嚢の乳頭状嚢胞腺腫は、側頭骨の後方部に発生する高血管性病変である。一般的な臨床症状には、難聴、耳鳴り、めまい、およびあまりみられないが顔面筋力低下がある。内リンパ嚢腫瘍(ELST)に伴う難聴およびその他の症状の原因として、3つの機序が報告されている。
- 腫瘍が耳嚢に浸潤し、膜性迷路が破壊され、内リンパの流れが阻害
- 迷路内出血:突然の不可逆的な難聴
- 内リンパ嚢液の吸収阻害(水腫):徐々に難聴、耳鳴り、めまいが発現
これらの腫瘍は散発的にも発生するが、VHL患者では若年で発生し、両側性であることが多い。ある報告では、両側性の腫瘍がVHL患者の28%にみられたのに対し、VHL疾患のない患者では1%であった。
ELSTはVHL疾患患者では一般的であり、発生率は約15%である。
診断
ELSTは、単一の方法で検出することが困難な場合がある。VHL疾患の患者は、サーベイランスのために定期的に聴力検査を行い、聴覚または前庭症状について毎年質問すべきである。聴覚検査に異常がある患者はすべて、頭蓋底のコンピュータ断層撮影(CT)または側頭骨のファインカットを伴う磁気共鳴画像法(MRI)により、これらの腫瘍の有無をスクリーニングすべきである。思春期に内耳道のMRIを1回だけスクリーニングすることもできる。これらの病変は、X線写真で確認することが非常に困難である。無症候性腫瘍を有する患者に手術が適応となるかどうかは議論の余地がある。
放射線学的所見としては、後迷路所在、CTスキャンでの腫瘍内石灰化、T1強調(非造影)MRIスキャンでの高強度局所信号、T2強調MRIスキャンでの不均一信号などがある。これらの病変の可視化には専用の画像が必要であり、小脳血管芽腫のサーベイランスのためにオーダーされた脳MRI検査では、ELSTはしばしば見逃される。
管理
ELSTの管理は、症状の存在と重症度、一般に成長速度が遅いこと、および手術に伴う合併症の可能性を考慮する必要がある。ELSTの治療は主に外科的であり、病変を完全に切除できれば、手術は治癒的である。再発病変に対しては、定位放射線手術が有効である。
両側ELSTによる難聴患者には、人工内耳が選択肢となりうる。
精巣上体および広靭帯の乳頭状嚢胞腺腫
乳頭状膀胱腺腫は、男性では精巣上体、女性では広靭帯の両方に発生する。両側の乳頭状膀胱腺腫は、VHL疾患においてよくみられるが、単一の精巣上体嚢胞は一般集団によくみられる。
乳頭状嚢胞腺腫は良性で一般的に無症状であり、治療の必要はない。
-
診断
-
遺伝子検査
VHL疾患の診断は、通常、VHL遺伝子の生殖細胞系列病原性(典型的には機能喪失)バリアントの検出によって確定される。これは、VHL疾患の単発症状と診断された後に遺伝子検査を受ける患者、または近親者にVHL疾患と診断された患者がいるために検査を受ける患者に最もよくみられる。VHL病と診断されるのは、別の理由で遺伝子検査を受けたところ、予期せずVHLの二次的な病因変異が発見された場合にも起こりうる。まれに、遺伝子検査を受けることができない患者において、VHL疾患の診断は臨床的基準に基づいて行われることがある。
遺伝学的検査の実施方法と解釈、モザイク
遺伝学的検査は通常、主にリンパ球から採取される新鮮な血液検体から単離されたDNAに対して実施される。多くの検査施設は、唾液又は頬検体から分離したDNAからこの検査を行うこともできる。ほとんどのDNA診断検査施設は、単一遺伝子の評価であれ、遺伝性がん遺伝子のパネルの評価であれ、次世代シークエンシング(NGS)技術に依存している。大欠失(遺伝子内または全遺伝子)は、NGSデータからのread-depthを用いて評価されるか、あるいは標的染色体マイクロアレイおよび/またはmultiplex ligation-dependent probe amplification (MLPA) を用いて直接確認される。現在では、多くの患者がNGS解析による大規模なマルチジーンパネルを用いた遺伝子検査を受けており、その中にはVHL遺伝子を研究対象の癌感受性遺伝子の一つとして含む癌患者も含まれている。
VHL疾患の分子診断は、American College of Medical Genetics and Genomics (ACMG)の分類スキームに基づくVHL遺伝子の病原性または病原性の可能性の高いバリアントの同定に基づいている。VHL遺伝子の病原性変異体は、遺伝することもあれば、de novoで生じることもある。de-novoの病原性変異体の頻度は、VHL患者の20%にものぼると報告されている。まれに、VHLの病原性変異体に対するモザイクのために、血液サンプルの分析から病原性変異体が検出されずにVHLの臨床的特徴を有する患者がいる。
体細胞モザイクの患者では、受精後の胚発生の過程で病原性変異が生じる。この状況では、正常な細胞もあれば病原性変異を持つ細胞もある。生殖細胞系列の病原性変異体を検出するのとは対照的に、臨床症状がこのモザイク状のVHL病原性変異体を持つ細胞の割合に依存するため、診断が困難になる可能性が高い。体細胞モザイクを持つ個体は古典的なVHL疾患を呈するが、血液幹細胞が病原性変異体を持たないため、疾患関連変異体が末梢血で検出されないことがある。
したがって、VHL関連腫瘍を呈し、末梢血細胞を用いたVHL遺伝子検査が陰性であった患者では、モザイクの可能性を考慮すべきである。このような患者における疾患の発現は、de novo病原性変異がいつ発生したかに依存する。新たな病原性変異が発生した時期が早ければ早いほど、より多くの組織型が影響を受ける可能性が高い。VHL病原性バリアント解析にNGS技術を用いることで、旧来のサンガー配列決定法と比較して、血液サンプル中にごく低レベルで存在するVHLバリアントを検出する感度が向上する。モザイクの追加検査法としては、皮膚線維芽細胞や頬粘膜細胞の遺伝子解析がある。
体細胞モザイクのまれな患者では、子孫のリスクは生殖細胞系列の組織が病原性変異体を保持しているか否かによって決まるが、一般にそれは臨床的には決定されない。したがって、モザイクが証明された患者には、罹患児を持つリスクは50%にも達する可能性があること、罹患児はその細胞の100%に病原性変異体を受け継ぐことになり、モザイクの親よりも重篤な症状を示す可能性があることを説明すべきである。
罹患していない両親の子供にVHLの診断が下された場合、非常に憂慮すべきことであり、de novo病原性変異体や発現変動の概念について注意深く説明する必要がある。直接的な遺伝子検査なしに、健康な親がVHL変異体陰性であると決めつけてはならない。両親を安心させ、de novoの病原性変異体が妊娠の直前または妊娠中に起こった何らかの行為の結果である可能性は低いことを説明することによって、潜在的な罪悪感を和らげるべきである。









