目次
自閉症スペクトラム障害(発達障害)遺伝子パネル検査参照論文2
自閉症スペクトラム障害の病因同定における臨床遺伝学的評価 : 2013年度ガイドライン改訂版
www.nature.com/articles/gim201332/
抄録
自閉症スペクトラム障害は、常同行動に関連して社会化およびコミュニケーションが一般的に障害されている状態の集合体である。報告されている自閉症スペクトラム障害の発生率は、過去20年間で劇的に増加している。加えて、市民および職業集団の両者によってこれらの条件に対する関心が高まっている。これらの傾向から、自閉症スペクトラム障害者の評価のための臨床遺伝医への紹介数が増加している。この過程における遺伝学者の主な役割は、可能であれば病因を明らかにし、遺伝カウンセリングを提供し、症例管理に寄与することである。特定の患者に対する適切な評価を決定するにあたり、遺伝学者は以下の多くの因子を考慮する: (i)あらゆる調査を進める前に自閉症の正確な診断を確保すること; (ii)検査の選択肢、診断の収量、および評価を進める前に家族の投資について話し合うこと; (iii)患者中心の医療ホーム(PCMH)とのコミュニケーションおよび調整; (iv)公表された文献に照らして利用可能な臨床検査法のリストを継続的に拡大および進化させて評価すること; (v)自閉症スペクトラム障害と重複するよく記述された症候群および代謝状態の拡大した表現型を認識すること;(vi)特定の患者の独特の病歴および臨床的特徴に基づいて個別化評価計画を定義すること。本論文のガイドラインは、臨床医がこれらの因子を考慮するのを補助するために開発された。それは2008年から原著を更新する。
Genet Med 2013:15(5):399-407
メイン
広汎性発達障害としても知られる自閉症スペクトラム障害(ASD)は、通常幼児期に診断される行動学的に定義された神経発達障害のグループである。コミュニケーションおよび社会的相互作用における様々な程度の制限、ならびに3歳以前に発症した非定型的で反復性の行動によって特徴づけられる。ASDの表現型は極めて不均一であり、ASDの様々な亜型(特に明記されていない自閉性障害、アスペルガー症候群、広汎性発達障害など)の違いと同様に、広範囲の症状や重症度においてヒトごとに違いがある。
複数の伝達されるというエビデンスは、ASDの病態学における遺伝の強力な役割を支持している。1, 2, 3 集団を対象として選別せずに行った自閉症事例の母集団研究の結果は、最も多因子遺伝と整合的であった。近年まで、自閉症の小児の同胞が完全に再発する危険性は3~10%と試算されていた。4,5, 6 全体では、罹患した子供が2人以上いる家族はわずか2~3%である(おそらく子供が診断された後に妊娠を自発的に避けるため)。ほとんどの研究では、「多因子性」の遺伝様式(罹患者があまり罹患していない性別の場合はリスクが高い)の推定に沿って、再発リスクに性差があることが報告されている。そのため、最初に罹患した子供が女性の場合は別の罹患児の7%、最初に罹患した子供が男性の場合は4%と報告されている。7複数の小児(2人以上)に自閉症がある場合、将来のどの妊娠でも再発リスクは33~50%程度である。7
最近の2件の研究8 , 9では、単一同胞病変を有する11%および19%の再発危険率がさらに高いことが報告されている。最初の8は、対話型ウェブサイトを用いたレトロスペクティブな自己登録/自己同定研究であった。診断は確定したが、二人目の同胞の同定が確認バイアスの源である可能性がある。2つ目の報告9は664家系を対象とした国際的な多施設プロスペクティブ研究であり、再発リスクは19%と算出された。興味深いことに、これらの研究の1件では、典型的に報告された性偏りは認められなかった。8どちらも出産を考慮するための単一の研究であった。現時点では、これらの数値が遺伝カウンセリングの再発リスクガイドラインの修正に使用されることは示唆されていない。
臨床遺伝学者の役割は、可能であれば自閉症の病因を明らかにし、ケアと管理を改善し、家族に遺伝カウンセリングを提供することである。近年、臨床医が利用できる新たな診断の選択肢が増加している。10,11,12,13,14,15 遺伝的および代謝的病態に関連した自閉症スペクトラムの「表現型の拡大」も数多く発表されている。これらの因子は、臨床遺伝学者への紹介件数の増加および診断率の増加につながっている。
評価計画を決定するにあたり、臨床遺伝学者は、利用可能な検査および可能な診断のリストを、コスト、実用性、および期待される収率の問題と、絶えず拡大しているものとのバランスをとる作業を担っている。これらの考慮事項は、治療の機会、転帰の改善、および家族に対する特異的な再発リスク情報などの診断の潜在的な利益とさらに均衡をとる必要がある。ここに示したガイドラインは、最新のエビデンスに基づいた自閉症スペクトラムの病因の段階的評価を概説するものである。引用される証拠のほとんどは中規模から大規模のケースシリーズによるものであるが、一部はより大規模な集団ベースの研究によるものである。
評価の根拠
遺伝学的評価の理論的根拠は、患者の統一診断を同定するという目標に基づいている。臨床遺伝学者は、病因を確定する上で必要に応じて患者、両親、兄弟姉妹を診察し評価することにより、そのプロセスに貢献できる。確定診断は必要なサービスの獲得を容易にし、家族にとって他の多くの方法で役立つ。多くの家族は、近親者の障害の根本的な原因を知ることによって、大きな力を得ている。病因によっては、スクリーニングおよび罹病予防の可能性につながる関連する医学的リスクが同定されることがある。特異的な再発リスクカウンセリング(一般的な多因子情報を超える)を提供することができ、リスクのある家系員の標的検査を提供できる。最後に、確立された診断は、不必要な診断検査を排除するのに役立つであろう。こうした予想される有益性に照らして、遺伝学的評価は自閉症スペクトラム患者(またはその家族)全員に提供されるべきである。
報告されたアプローチと収率
自閉症スペクトラム患者における特異的な病因診断の成功率は、6~15%として報告されている16, 17, 18 , 19 , 20 他に特定されない広汎性発達障害、非定型自閉症、アスペルガー症候群、自閉症の特徴を有し、必ずしも広汎性発達障害の精神障害診断・統計マニュアル第4版基準を満たさない症例の評価にも適用可能である。21
診断率には多くの因子が影響しているようである。当然のことながら、医学遺伝学者の臨床技能および経験は、原因を定義する可能性に関与している。明らかに、検査法の進歩は診断率を向上させる。22より新しい検査法(以下に提示する)の潜在的寄与のレビューは、30~40%であると期待できる。以下のパラグラフでは、特定の種類の検査に対する診断率の結果を示す。このような研究を経時的に解釈するには注意を払わなければならない。報告されている自閉症の発生率は増加しているため、特定の病因に起因する症例の相対的割合が変化している可能性がある。23同様に、検査技術の急速な変化の速度も、比較を複雑にする可能性がある。例えば、さまざまなタイプの染色体マイクロアレイ(CMA)-大腸菌人工染色体、オリゴヌクレオチド、または一塩基多型アレイ-は、それらの診断収率のタイプおよび量において、必ずしも同等ではない。
染色体異常
染色体異常は自閉症スペクトラム患者で一貫して報告されていて、解像度の高い研究を含む細胞遺伝学的手法の継続的な改善により、従来の細胞遺伝学的研究の診断率は約3%に上昇している 。25 , 24 ,26 細胞遺伝学的に検出可能な多数の欠失および重複が自閉症スペクトラム疾患表現型と関連している。27一般に、最も一般的に報告されている遺伝子座は報告されている連鎖データを反映している。最も頻繁に報告されている地域のいくつかを表1に示す。染色体マイクロアレイなどの分子細胞遺伝学的検査法の登場により、遺伝学的評価の診断力が向上している(後述参照)。この進歩は非常に効果的であったため、第1段階の検査として従来の細胞遺伝学にほぼ取って代わった。28,29 このため、自閉症スペクトラム疾患患者の評価における染色体分析は、現在では、臨床的に疑われる染色体異数性(例えば、Turner症候群、Klinefelter症候群、およびDown症候群)または染色体再構成を示唆する家族歴または生殖歴などの特定の例外にのみ適用されるべきである。第三者の保険者が細胞遺伝学的検査をカバーするが、染色体マイクロアレイ検査をカバーしない状況は依然として存在する。このような状況(および患者が染色体マイクロアレイ研究の費用を負担できない場合)では、細胞遺伝学的検査を全く行わないよりも従来の染色体分析の方が望ましい。
表1 選択された検査法によって同定された自閉症における選択された遺伝的「ホットスポット」
フルサイズの表
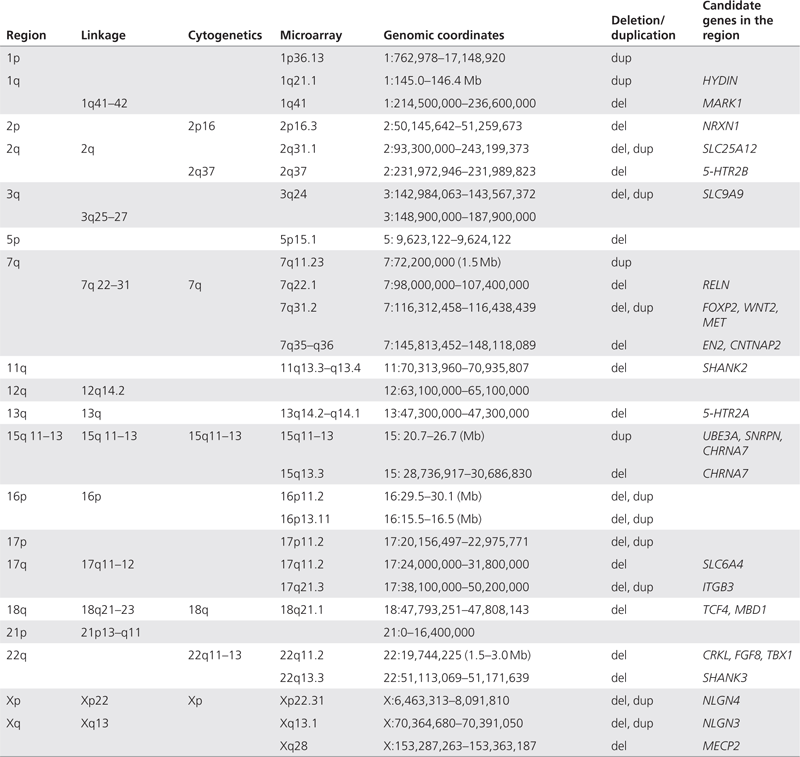
染色体マイクロアレイCMA
染色体マイクロアレイは、遺伝子検査の有力な手段として注目されている。29 ,30 現在、臨床の場では2つの染色体マイクロアレイ法が用いられている。アレイ比較ゲノムハイブリダイゼーションおよび一塩基多型アレイは、コピー数変異体(CNV)についてゲノムをスキャンするために異なる技術を用いる。染色体マイクロアレイ研究の増加に伴い、自閉症スペクトラム疾患におけるゲノムCNVの寄与に関する新たな情報が出現している。自閉症スペクトラム疾患を有する個人の非選択集団におけるCNV頻度の推定値は8~21%である。これらの研究のうち1件は2007年に報告されており31、他の5件は最近の研究(2010年および2011年)であり、高密度アレイを用いていた。自閉症スペクトラム疾患患者2805例を対象としたこれら6件の独立した試験を累計すると、臨床的に重要なCNVが274例(10%)認められた。31,32,33,34,35,36
自閉症スペクトラム疾患患者では100以上の異なるゲノム変化が報告されている37。このうち、いくつかは特に強い関連性を有することが示されている。当然ながら、これらの「自閉症スペクトラム疾患ホットスポット」のいくつかは、以前の連鎖および細胞遺伝学的研究によって強調された領域と相関している。染色体マイクロアレイ検査で最も多く認められた自閉症スペクトラム疾患遺伝子座を表1に示す。これらの遺伝子座のいくつかは自閉症スペクトラム疾患集団ではきわめて一般的である。16p11.2というローカスは、実際には、すべての自閉症スペクトラム障害患者の0.5~1%でCNVが発生していることが報告されている。38,39,40,41この診断結果を考慮すると、染色体マイクロアレイを各型検査の第一段階とすべきであり、2008年の指針でそのように示唆することとなった。これは、CMAが発達障害または先天異常を有する個人に対する第一段階の検査であるという最近のコンセンサスと合致している。29
自閉症スペクトラム障害患者を対象としたCMA試験の診断率は、選択基準を用いて高めることができる。自閉症スペクトラム障害および小頭症、痙攣、先天異常、または形態異常の特徴(いわゆる「複雑自閉症スペクトラム障害」)などの追加所見を有する個人では、CNVの割合が高いことが認められる。複雑な自閉症スペクトラム疾患患者のみを対象にCMA試験を実施すると、診断率がほぼ30%に上昇することが示されている。33,42 自閉症スペクトラム疾患患者を対象としたCMA研究の収量を増加させうる別の選択要因は、発達障害または精神医学的問題の家族歴である。
自閉症患者においてCMAによりCNVが同定されると、その情報を解釈し、意味のある形式で家族に伝える上で、いくつかの重要な考慮事項がある。コピー数の変化は、それらの臨床症状における著しい家族内および家族間変動を示す。可変的な表現の範囲には、認知能力および社会的能力が正常範囲内にある個人を含めることができる。したがって、このような変化がde novoであるか、潜在的に遺伝性であるかを判断する際には、親に明らかな神経行動障害が認められなくても、親の研究を提供すべきである。さらに、他の神経発達障害や神経行動障害に重点を置いて、家族歴に注意を払う必要がある。自閉症スペクトラム疾患患者にみられる同一のCNVは、神経症状(けいれんなど)、注意欠陥多動性障害、知的障害、近親者の重大な感情障害などを呈することがある。変化する技術、動的に拡大する文献、および大規模なアクセス可能な情報データベースの複雑さの全ては、そのような病因診断がなされた場合でさえ、遺伝カウンセリングを困難にする。遺伝学者は、使用するアレイ技術の種類(例えば、BAC対オリゴヌクレオチド対一塩基多型アレイ)に注意し、細胞ゲノムアレイの国際標準コンソーシアム43、UCSCヒトゲノムブラウザー44、DECIPHER(Ensembl資源を用いたヒトにおける染色体不均衡および表現型のデータベース)、45およびゲノムバリアント46のデータベースなどの主要なデータベースにアクセスして、家族に可能な限り最善の情報を提供しなければならない。
単一遺伝子障害
自閉症スペクトラム疾患がその遺伝子の変化に関連する拡大した表現型の一部としてみられることが、よく報告されている単一遺伝子疾患がいくつか報告されている(表1)。このような病態の選択された少数については、他に同定可能な病因がない自閉症スペクトラム疾患患者におけるこれらの遺伝子の変化の検査を示唆する十分な証拠が存在する。これらには脆弱X症候群、メチル‐CPG結合蛋白質2(MECP2)スペクトラム障害、ホスファターゼおよびテンシンホモログ(PTEN)関連状態が含まれる。
自閉症スペクトラム疾患と脆弱X症候群との長期にわたる関連性が存在する。脆弱X症候群の男児の約20%は、客観的基準で評価した場合、自閉症スペクトラム疾患の診断基準を満たしている。11,47 2件の初期の研究では、自閉症スペクトラム疾患の男児の非選択コホートにおける異常脆弱X研究では6%の発生率が明らかにされた。これらの研究では、陽性率が75例中4例(5.3%)48例および210例中17例(8%)49例であった。最近の調査では脆弱X検査の収率が低いことが報告されている。最近の3件の研究では、自閉症スペクトラム疾患の小児1,215人中6人(0.5%)のみに脆弱Xが同定されたが、これらの差異のいくつかは、脆弱X症候群のより良好な認知および早期診断によって説明できるようである。22,34,36 いったんこの診断が下されると、多くの施設がこれらの小児を自閉症スペクトラム疾患クリニックに割り付けないため、これらの小児は全体的な「非選択的」研究には含まれない可能性がある。原因不明の自閉症の男性は全て脆弱X症候群の検査を受けることが推奨される。
文献の我々のレビューでは、自閉症スペクトラム疾患患者の非選択コホートから、脆弱Xの異常な結果が得られた女性患者は同定されなかった。したがって、脆弱Xに対する自閉症スペクトラム疾患を有する女性の「ルーチンの」検査は、エビデンスに基づく基準を満たしていない。しかしながら、(i)脆弱Xに適合する表現型、(ii)X連鎖性神経発達障害陽性の家族歴、または(iii)近親者における早発性卵巣機能不全、運動失調、または振戦などの臨床パラメータによって促された場合には、自閉症スペクトラム疾患の女性を対象とした脆弱X研究の順序付けに重大な配慮を払うことを推奨する。
MECP2の突然変異は当初、Rett症候群の主要な病因として報告された。広範な他の表現型がMECP2突然変異と併せて記述されるまでは長くなかった。特発性自閉症スペクトラム疾患はそのような表現型の1つであった。50, 非症候性自閉症スペクトラム疾患 を持つ女児でMECP2 テストを実施した9 つの研究21,22,51,52,53,54,55,56,57から、病的変異(レンジ: 0 ~20%)を400 のうち16人(4%)が持つことが判明した。興味深いことに、これらの研究の1件では、突然変異が同定された患者は、Rett症候群の「preserved speech variant」サブタイプ(軽症の言葉を発し、運動機能も軽い)の表現型を有する患者に限られていた。54MECP2突然変異を有する女児313例の主訴を評価するために、2つの大規模データベースから別の研究58が導き出された。著者らは、自閉症と初期診断された患者は古典的レット症候群の症状が少なく、機能的転帰が良好であることを明らかにした。自閉症スペクトラム障害と診断され、かつMECP2の変異を持つ女子は、R306CとT158Mという2つの変異と関連していた。当初のガイドラインが書かれた2008年には、MECP2異常と自閉症の男性は報告されていなかった。それ以来、2件の発表59, 60で、MECP2重複と自閉症スペクトラム疾患表現型を有する男児が同定されている。4件の研究の中で、既知のMECP2突然変異を有する22人の男性を評価した。このうち9例が自閉症と診断され、1例が「自閉症の特徴」を有することが指摘された。明らかに、これらは小規模な研究であり、非選択自閉症スペクトラム疾患集団における有病率を評価するようにはデザインされていなかった。現在のエビデンスを考慮すると、自閉症の男性におけるルーチンのMECP2検査は推奨されない。しかしながら、遺伝学者はMECP2重複の特徴(流涎、反復性呼吸器感染症、低緊張性顔貌など)に注意し、自閉症の男児におけるMECP2重複検査およびそのような特徴を考慮すべきである。
2001年に、母親とその息子が同一のPTEN突然変異を有することが明らかにされた。61母親の表現型はCowden症候群であった。子供もカウデン症候群であったが、自閉症スペクトラム疾患も持っていた。著者らは、関連性の可能性について疑問を提起した。数年後、大頭症(頭囲が平均を上回る2.5 SDsを超える)の自閉症スペクトラム疾患に対して選択された一連の18人の患者が報告された。10このうち3例(16%)にPTEN変異が認められた。PTEN突然変異と併せた自閉症スペクトラム疾患の他の単一症例報告が文献に現れている。これらの個体のうち少なくとも1例は女児であった。62前述した研究に加えて、自閉症スペクトラム疾患患者のコホートにおけるPTEN突然変異を検討した他の4件の報告研究では、これらの研究から得られた集団データにより、病原性PTEN突然変異を有する自閉症スペクトラム疾患患者318人中15人(5%)が同定された。 56,63,64,65これらの研究のほとんどは、大頭症を伴う自閉症スペクトラム疾患患者を選択していなかったが、レトロスペクティブ解析では、大頭症がすべての陽性例に存在することが示された。したがって、PTEN検査は、頭囲が98パーセンタイルを超える自閉症スペクトラム疾患患者にのみ実施することが示唆される。頭の大きさが本当に過剰であるかどうか、親が軽度に罹患している可能性があるかどうかを判断する際には、親の頭の大きさのほか、頭の成長パターンを考慮することが重要である。また、これらの研究によって強調されているように、自閉症スペクトラム疾患および平均値を超える4SDsを超える巨頭症の患者では、収率が例外的に高い可能性がある。
家族歴がX連鎖遺伝と一致し、患者に認知障害がある場合、「X連鎖知的障害遺伝子パネル」が検討事項となる。いくつかのX連鎖遺伝子は自閉症スペクトラム疾患または知的障害のいずれかとして存在することが知られている。37考慮すべき別の疾患は、X連鎖クレアチントランスポーター欠損(SCL6A8遺伝子)である。この病態の患者は、筋緊張低下および痙攣とともに、自閉症スペクトラム疾患スペクトラムの神経行動学的変化が報告されている。現在のところ、自閉症スペクトラム疾患患者におけるこのようなパネルの診断率に関する研究は報告されていない。
代謝障害
自閉症スペクトラム疾患の表現型との関連で、多数の代謝異常が報告されている(表2)。
自閉症スペクトラム疾患表現型に関連する代謝障害は比較的まれであり、典型的には自然界で常染色体劣性であり、幼少期に存在する。66ほとんどの代謝性疾患は、痙攣、錐体外路徴候(運動障害、ジストニア、パーキンソニズム)、発育不全、または自閉症患者に非典型的な神経退行などの他の臨床症状と関連している。我々の知る限り自閉症スペクトラム疾患患者の非選択コホートにおける代謝検査の診断率を検討した系統的研究はない。2009年の米国医学遺伝学会と遺伝性代謝障害学会の合同プレナリーセッションで、この問題に取り組んだ。自閉症スペクトラム疾患における代謝障害は実際に「発生率は低いものの影響が大きい」との一般的な意見が表明され、どのようなレベルの検査を推奨すべきかについてのコンセンサスは得られていないものの、いくつかの重要なテーマが浮き彫りにされた。症候学的特徴について自閉症スペクトラム疾患患者を評価する臨床医の責任と同様に、遺伝医もさらなる代謝評価または紹介が必要となる徴候および症状について患者の病歴を検討すべきである(表3)。真の発達的退行(神経変性)、神経症状の悪化、嗜眠、身体持久力の低下、または痙攣発作の注意深い病歴聴取が極めて重要である。アシドーシスなどの生理的異常を積極的に追求すべきである。本ガイドラインでは、臨床指標がない場合にはルーチンの代謝検査を推奨していないが、先天性代謝異常を疑う指標は依然として高くなければならない。代謝性疾患によっては、臨床的な指標がない場合もある。例えば、未治療のフェニルケトン尿症患者の5%が自閉症の診断基準を満たすことが報告されている。67同様に、Sanfilippo症候群の臨床指標は、自閉症と診断されてから数十年間は明らかにならないことがある。68このような状況で、検査がそもそも行われていない場合、遺伝学者はアシドーシスが存在するかどうかをどのように知るかという手続き上の問題が提起されている。したがって、多くの代謝専門医は、自閉症スペクトラム疾患患者のルーチンの代謝スクリーニングを第一段階の評価として実施することを提案している。このような評価には、全血球計算、血清代謝プロファイル、およびグリコサミノグリカンに対する血清アミノ酸および尿スクリーニングが含まれる。これらの未解決の問題の多くについては、このような提案されたスクリーニングの実際の収率を同定するために前向き研究が必要である。
表2 自閉症スペクトラム疾患表現型に関連する最近記述された代謝状態

表3 自閉症スペクトラム疾患患者における代謝またはミトコンドリア検査を促す臨床症状

ミトコンドリア異常
新たな文献では、ミトコンドリア機能不全と自閉症スペクトラム疾患との関連が示唆されている。69この関連性は、発熱性疾患後の自閉的行動および発話の喪失、またはその後の脳症を伴う予防接種を受けた人において認識されている。70全身症状、筋緊張低下、3歳以降の回帰の繰り返し、多臓器不全がミトコンドリア病を考える手がかりとなる(表3)。自閉症スペクトラム疾患の初期診断を呈した既知のミトコンドリア障害を有する患者25人のレビューでは、全てが神経学的検査の異常および/または血漿乳酸濃度の上昇を有することが明らかにされた。70代謝障害の場合と同様に、自閉症スペクトラム疾患患者におけるミトコンドリア障害の検査は、支持症状または臨床検査値異常が認められる場合にのみ推奨される。
神経画像診断
発達障害者の評価における神経画像診断の役割は、何十年にもわたって強く議論されてきた。ある人にとっては、罹患臓器を「診察」すべきであることは直感的である。コストと鎮静のロジスティックスのため、このような研究を収量とリスクがアンバランスだと主張する人もいる。また、若年での多重鎮静は有害な神経発達転帰と関連することが示唆されている。71 ,72 かなり最近の公表文献73では、自閉症スペクトラム疾患患者の非選択コホートにおいて、同定可能な脳奇形の発生が48%(69例中33例)報告された。しかしながら、同定された異常のほとんどは特定の病態の診断ではなかった。現在のところ、自閉症スペクトラム障害の全患者に対してルーチンの磁気共鳴画像法スキャンを推奨するにはエビデンスが不十分である。神経退行または他の主要な神経学的異常のような重要な併存疾患の場合、磁気共鳴画像法は有用な診断ツールとなりうる。一つの特別な状況も言及する必要がある。大頭症とは対照的に、小頭症と自閉症はほとんど関連しない。鑑別診断が異なるため、小頭症が先天性か後天性かに注意することも重要である。自閉症スペクトラム疾患や小頭症の患者では、神経画像検査を考慮すべきである。代謝性の病因が疑われる患者には、磁気共鳴スペクトロスコピーと標準的な神経画像法との併用を考慮すべきである。
要約
要約すると、文献は、自閉症スペクトラム疾患の遺伝学的評価において以下の近似診断収率が期待されることを示している:
• CMA (10%)
• 脆弱X(1~5%)
• MECP2(女児の4%)
• PTEN (検査対象の頭囲が2.5SDを超える患者の5%)
• 核型(3%)
• その他(10%)。
現在のところ、自閉症の他の同定可能な病因に関する成果を照合した研究は発表されていない。上述のように、同定可能な脳の異常、遺伝的症候群、代謝障害、および他の診断可能な状態は、自閉症スペクトラム疾患患者の遺伝的評価において同定されるであろう。経験的推定値および臨床経験を用いて、これは10%と推定されている。74
したがって、現在の知識および技術を用いて、自閉症スペクトラム疾患患者の徹底的な臨床遺伝学的評価は、30~40%の個人で同定された病因をもたらすと推定される。
評価
臨床遺伝学者の主要な貢献は、形態異常の特徴の同定および家族歴情報の分析であり続けている。臨床的に認識可能な症候群で、わずかである可能性があるものは、同定可能な自閉症スペクトラム疾患の原因の別のカテゴリーである。75したがって、自閉症スペクトラム疾患患者が孤立性または複雑性/症候性自閉症スペクトラム疾患であるかどうかを判定するための臨床遺伝学者/形態異常学者による評価は、依然として高収率、低コストの評価の一部である。
全ての臨床評価と同様に、病因学的評価は個々の患者に合わせて行われなければならない。評価のデザインは、病歴および身体診察ならびに臨床経験からの焦点を当てた情報を考慮に入れなければならない。すべての症例に適用できる単一のアプローチやアルゴリズムは存在しない。実際的な理由から、本報告書では段階的または段階的な評価が推奨される(表4)。段階的評価は、より高い(より早い)段階で実施される検査が、より期待される診断率が高く、検査の侵襲性が低く、介入の可能性がより良好であり、より容易に採用されるようにデザインすることができる。76
表4 自閉症スペクトラム障害の臨床遺伝学的診断評価のためのテンプレート

このアプローチは、診断検査の継続的な進歩および自閉症スペクトラム疾患表現型の理解の改善とともに進化するであろう。自閉症スペクトラム疾患の表現型に関連して複数の追加条件が報告されているが、いずれも大規模なプロスペクティブコホートでは評価されていない。したがって、将来の第3段階の評価は明確な可能性である。エビデンスを推奨される検査のポイントまで高めるためには、さらなる研究が必要であろう。あるいは、技術の進歩により、個々の試験を拡張された、より容易にアクセス可能な、より安価なプラットフォームに一括することが可能になるかもしれない。
診断プロセス
• 正確な診断:遺伝学的評価を開始する前に自閉症スペクトラム疾患の正確な診断を行うことが重要である。自閉症スペクトラム疾患患者は全員、重大な難聴を除外するために正式なオージオグラムを有するべきである。
• PCMHの役割:自閉症スペクトラム疾患を有する全ての個人は、指定されたプライマリケア医療施設を持つべきである。しばしば、プライマリケア医が、自閉症スペクトラム疾患の疑問を可能な診断として提起する最初の専門家になるであろう。臨床遺伝学協議の後、プライマリケア医および臨床遺伝学者は、推奨される診断検査のオーダリング、スケジューリング、および調整においてパートナーに準備すべきである。
• 臨床遺伝学的評価のための紹介:自閉症スペクトラム疾患の全ての人/家族に遺伝相談を提供すべきである。評価は、自閉症スペクトラム疾患の全スペクトルに沿ったあらゆる個人について考慮されるべきである。紹介元の専門家は、紹介を行う前に、そのような評価の期待と考えられる結果について話し合うべきである。紹介する専門家は、そのような診察に何が関与しているのか、潜在的な診断結果を知っておくべきであり、この情報を患者/家族と共有すべきである。
• 段階的評価:自閉症スペクトラム疾患患者の臨床遺伝学的評価は、臨床状況に合わせてカスタマイズしなければならない。患者は、考慮されている特定の診断を確認する目的で遺伝学者に紹介されることがある。代わりに、初診時に遺伝学者に症候学的診断が明らかになることもある。いずれの場合も、診断は受け入れられている臨床基準および/または臨床検査(利用可能な場合)を用いて確定すべきである。認識可能な症候群の多くは、自閉症スペクトラム疾患との関連がしっかりと立証されている。これらの病態については、自閉症スペクトラム疾患の病因に関するさらなる調査は不要である(表5)。
表5 自閉症スペクトラム障害の既知の病因である特定の遺伝性症候群
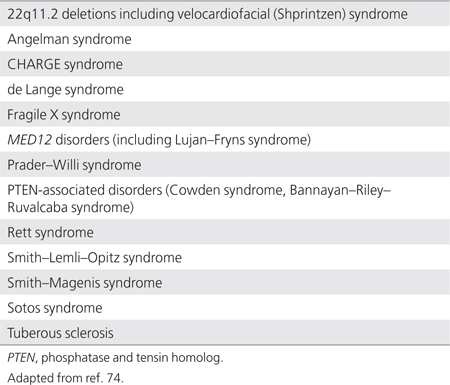
しかしながら、報告された関連性が説得力のない自閉症スペクトラム疾患に関連して報告されている遺伝的状態がある。これらの病態を有する患者に対しては、自閉症スペクトラム疾患の病因学的評価を独立したプロセスとして行うことが推奨される(表6)。臨床遺伝学者が初期評価で特定の疾患を同定しない場合、表4に概説されているように、さらなる検査を実施することができる。
表6 自閉症スペクトラム疾患の病因評価で示唆されているが、現在のところルーチン検査を推奨するにはエビデンスが不十分である遺伝学的検査

• 遺伝カウンセリング:臨床遺伝学的評価の完了により、2つのグループの個人が同定される:同定可能な病因の有無。両群に遺伝カウンセリングを実施すべきである。同定可能な病因のない患者については、経験的な再発リスクデータを用いてカウンセリングを行うべきである。同胞全員に対する公表されている再発リスクは約3~10%であるが、より新しい研究では、このリスクはより高い可能性が示唆されている。8,9 性別で修正すると、罹患した小児が女性の場合は7%、罹患した小児が男性の場合は4%のリスクとなる。自閉症スペクトラム疾患の小児が多発(2人以上)している場合、公表されている報告では少なくとも30%の再発リスクが予測される7, 9。
• 治療と経過観察:臨床遺伝学者は、診断相談終了後の患者との関わりについて、その実践が大きく異なる。管理および治療計画は、特定の病因診断に依存する。このような症例はしばしば、臨床遺伝学者とプライマリケア医の同意によって管理される。技術および表現型の変化は、診断が最初に確立されていない患者において最終的に診断を得るのに役立つことが多い。したがって、確定的な病因が最初に発見されなかった患者に対しては、定期的な再評価を考慮すべきである。患者/家族、PCMH、および遺伝医の間で、インターバルフォローアップ相談のタイミングについて交渉すべきである。
要約
自閉症の遺伝的基礎は、多数の文献によって強く支持されている。臨床検査技術の進歩により、診断率は数年前の6~10%から30~40%に上昇している。したがって、遺伝子検査は自閉症スペクトラム疾患の全ての患者および家族と話し合うべきである。この文書は、このような調査の進め方に関する勧告を提供している。エキソームまたは全ゲノム配列決定アプローチのような「次世代」配列決定法を適用するより新しい検査法は、今後数年間でさらに診断率を高めるであろうというエビデンスの蓄積に注目することも重要である。
References
- 1
El-Fishawy P, State MW . The genetics of autism: key issues, recent findings, and clinical implications. Psychiatr Clin North Am 2010;33:83–105.
- 2
Geschwind DH . Genetics of autism spectrum disorders. Trends Cogn Sci (Regul Ed) 2011;15:409–416.
- 3
Caglayan AO . Genetic causes of syndromic and non-syndromic autism. Dev Med Child Neurol 2010;52:130–138.
- 4
Chakrabarti S, Fombonne E . Pervasive developmental disorders in preschool children. JAMA 2001;285:3093–3099.
- 5
Icasiano F, Hewson P, Machet P, Cooper C, Marshall A . Childhood autism spectrum disorder in the Barwon region: a community based study. J Paediatr Child Health 2004;40:696–701.
- 6
Lauritsen MB, Pedersen CB, Mortensen PB . Effects of familial risk factors and place of birth on the risk of autism: a nationwide register-based study. J Child Psychol Psychiatry 2005;46:963–971.
- 7
Simonoff E . Genetic counseling in autism and pervasive developmental disorders. J Autism Dev Disord 1998;28:447–456.
- 8
Constantino JN, Zhang Y, Frazier T, Abbacchi AM, Law P . Sibling recurrence and the genetic epidemiology of autism. Am J Psychiatry 2010;167:1349–1356.
- 9
Ozonoff S, Young GS, Carter A, et al. Recurrence risk for autism spectrum disorders: a Baby Siblings Research Consortium study. Pediatrics 2011;128:e488–e495.
PubMed PubMed Central Google Scholar
- 10
Butler MG, Dasouki MJ, Zhou XP, et al. Subset of individuals with autism spectrum disorders and extreme macrocephaly associated with germline PTEN tumour suppressor gene mutations. J Med Genet 2005;42:318–321.
- 11
Clifford S, Dissanayake C, Bui QM, Huggins R, Taylor AK, Loesch DZ . Autism spectrum phenotype in males and females with fragile X full mutation and premutation. J Autism Dev Disord 2007;37:738–747.
- 12
Erlandson A, Hagberg B . MECP2 abnormality phenotypes: clinicopathologic area with broad variability. J Child Neurol 2005;20:727–732.
- 13
Morrow JD, Whitman BY, Accardo PJ . Autistic disorder in Sotos syndrome: a case report. Eur J Pediatr 1990;149:567–569.
- 14
Park JP, Moeschler JB, Davies WS, Patel PI, Mohandas TK . Smith-Magenis syndrome resulting from a de novo direct insertion of proximal 17q into 17p11.2. Am J Med Genet 1998;77:23–27.
- 15
Pearl PL, Gibson KM, Acosta MT, et al. Clinical spectrum of succinic semialdehyde dehydrogenase deficiency. Neurology 2003;60:1413–1417.
- 16
Chudley AE, Gutierrez E, Jocelyn LJ, Chodirker BN . Outcomes of genetic evaluation in children with pervasive developmental disorder. J Dev Behav Pediatr 1998;19:321–325.
- 17
Steiner CE, Guerreiro MM, Marques-de-Faria AP . Genetic and neurological evaluation in a sample of individuals with pervasive developmental disorders. Arq Neuropsiquiatr 2003;61(2A):176–180.
- 18
Challman TD, Barbaresi WJ, Katusic SK, Weaver A . The yield of the medical evaluation of children with pervasive developmental disorders. J Autism Dev Disord 2003;33:187–192.
- 19
Kosinovsky B, Hermon S, Yoran-Hegesh R, et al. The yield of laboratory investigations in children with infantile autism. J Neural Transm 2005;112:587–596.
- 20
Battaglia A, Carey JC . Etiologic yield of autistic spectrum disorders: a prospective study. Am J Med Genet C Semin Med Genet 2006;142C:3–7.
- 21
Abdul-Rahman OA, Hudgins L . The diagnostic utility of a genetics evaluation in children with pervasive developmental disorders. Genet Med 2006;8:50–54.
- 22
Roesser J . Diagnostic yield of genetic testing in children diagnosed with autism spectrum disorders at a regional referral center. Clin Pediatr (Phila) 2011;50:834–843.
- 23
Lathe R . Fragile X and autism. Autism 2009;13:194–197.
- 24
Reddy KS . Cytogenetic abnormalities and fragile-X syndrome in autism spectrum disorder. BMC Med Genet 2005;6:3.
- 25
Shevell MI, Majnemer A, Rosenbaum P, Abrahamowicz M . Etiologic yield of autistic spectrum disorders: a prospective study. J Child Neurol 2001;16:509–512.
- 26
Weidmer-Mikhail E, Sheldon S, Ghaziuddin M . Chromosomes in autism and related pervasive developmental disorders: a cytogenetic study. J Intellect Disabil Res 1998;42(Pt 1):8–12.
- 27
Vorstman JA, Staal WG, van Daalen E, van Engeland H, Hochstenbach PF, Franke L . Identification of novel autism candidate regions through analysis of reported cytogenetic abnormalities associated with autism. Mol Psychiatry 2006;11:1,18–28.
- 28
Manning M, Hudgins L ; Professional Practice and Guidelines Committee. Array-based technology and recommendations for utilization in medical genetics practice for detection of chromosomal abnormalities. Genet Med 2010;12:742–745.
- 29
Miller DT, Adam MP, Aradhya S, et al. Consensus statement: chromosomal microarray is a first-tier clinical diagnostic test for individuals with developmental disabilities or congenital anomalies. Am J Hum Genet 2010;86:749–764.
- 30
Coulter ME, Miller DT, Harris DJ, et al. Chromosomal microarray testing influences medical management. Genet Med 2011;13:770–776.
- 31
Sebat J, Lakshmi B, Malhotra D, et al. Strong association of de novo copy number mutations with autism. Science 2007;316:445–449.
- 32
Rosenfeld JA, Ballif BC, Torchia BS, et al. Copy number variations associated with autism spectrum disorders contribute to a spectrum of neurodevelopmental disorders. Genet Med 2010;12:694–702.
- 33
Schaefer GB, Starr L, Pickering D, Skar G, Dehaai K, Sanger WG . Array comparative genomic hybridization findings in a cohort referred for an autism evaluation. J Child Neurol 2010;25:1498–1503.
- 34
Shen Y, Dies KA, Holm IA, et al.; Autism Consortium Clinical Genetics/DNA Diagnostics Collaboration. Clinical genetic testing for patients with autism spectrum disorders. Pediatrics 2010;125:e727–e735.
- 35
Bremer A, Giacobini M, Eriksson M, et al. Copy number variation characteristics in subpopulations of patients with autism spectrum disorders. Am J Med Genet B Neuropsychiatr Genet 2011;156:115–124.
- 36
McGrew SG, Peters BR, Crittendon JA, Veenstra-Vanderweele J . Diagnostic yield of chromosomal microarray analysis in an autism primary care practice: which guidelines to implement? J Autism Dev Disord 2012;42:1582–1591.
- 37
Betancur C . Etiological heterogeneity in autism spectrum disorders: more than 100 genetic and genomic disorders and still counting. Brain Res 2011;1380:42–77.
- 38
Eichler EE, Zimmerman AW . A hot spot of genetic instability in autism. N Engl J Med 2008;359(16):1685–1699.
- 39
Kumar RA, KaraMohamed S, Sudi J, et al. Recurrent 16p11.2 microdeletions in autism. Hum Mol Genet 2008;17:628–638.
- 40
Weiss LA, Shen Y, Korn JM, et al.; Autism Consortium. Association between microdeletion and microduplication at 16p11.2 and autism. N Engl J Med 2008;358:667–675.
- 41
Walsh KM, Bracken MB . Copy number variation in the dosage-sensitive 16p11.2 interval accounts for only a small proportion of autism incidence: a systematic review and meta-analysis. Genet Med 2011;13:377–384.
- 42
Jacquemont ML, Sanlaville D, Redon R, et al. Array-based comparative genomic hybridisation identifies high frequency of cryptic chromosomal rearrangements in patients with syndromic autism spectrum disorders. J Med Genet 2006;43:843–849.
- 43
International Standards for Cytogenomics Arrays Consortium. www.iscaconsortium.org.
- 44
UCSC Genome Bioinformatics. genome.ucsc.edu.
- 45
DECIPHER v5.1. decipher.sanger.ac.uk.
- 46
Database of Genomic Variants. projects.tcag.ca/variation.
- 47
Hatton DD, Sideris J, Skinner M, et al. Autistic behavior in children with fragile X syndrome: prevalence, stability, and the impact of FMRP. Am J Med Genet A 2006;140A:1804–1813.
- 48
Watson MS, Leckman JF, Annex B, et al. Fragile X in a survey of 75 autistic males. N Engl J Med 1984;310:1462.
- 49
Cohen IL, Sudhalter V, Pfadt A, Jenkins EC, Brown WT, Vietze PM . Why are autism and the fragile-X syndrome associated? Conceptual and methodological issues. Am J Hum Genet 1991;48:195–202.
- 50
Hammer S, Dorrani N, Dragich J, Kudo S, Schanen C . The phenotypic consequences of MECP2 mutations extend beyond Rett syndrome. Ment Retard Dev Disabil Res Rev 2002;8:94–98.
- 51
Vourc’h P, Bienvenu T, Beldjord C, et al. No mutations in the coding region of the Rett syndrome gene MECP2 in 59 autistic patients. Eur J Hum Genet 2001;9:556–558.
- 52
Beyer KS, Blasi F, Bacchelli E, Klauck SM, Maestrini E, Poustka A ; International Molecular Genetic Study of Autism Consortium (IMGSAC). Mutation analysis of the coding sequence of the MECP2 gene in infantile autism. Hum Genet 2002;111:305–309.
- 53
Carney RM, Wolpert CM, Ravan SA, et al. Identification of MeCP2 mutations in a series of females with autistic disorder. Pediatr Neurol 2003;28:205–211.
- 54
Zappella M, Meloni I, Longo I, et al. Study of MECP2 gene in Rett syndrome variants and autistic girls. Am J Med Genet B Neuropsychiatr Genet 2003;119B:102–107.
- 55
Lam CW, Yeung WL, Ko CH, et al. Spectrum of mutations in the MECP2 gene in patients with infantile autism and Rett syndrome. J Med Genet 2000;37:E41.
- 56
Herman GE, Henninger N, Ratliff-Schaub K, Pastore M, Fitzgerald S, McBride KL . Genetic testing in autism: how much is enough? Genet Med 2007;9:268–274.
- 57
Schaefer GB, Lutz RE . Diagnostic yield in the clinical genetic evaluation of autism spectrum disorders. Genet Med 2006;8:549–556.
- 58
Young DJ, Bebbington A, Anderson A, et al. The diagnosis of autism in a female: could it be Rett syndrome? Eur J Pediatr 2008;167:661–669.
- 59
Psoni S, Sofocleous C, Traeger-Synodinos J, Kitsiou-Tzeli S, Kanavakis E, Fryssira-Kanioura H . Phenotypic and genotypic variability in four males with MECP2 gene sequence aberrations including a novel deletion. Pediatr Res 2010;67:551–556.
- 60
Ramocki MB, Peters SU, Tavyev YJ, et al. Autism and other neuropsychiatric symptoms are prevalent in individuals with MeCP2 duplication syndrome. Ann Neurol 2009;66:771–782.
- 61
Goffin A, Hoefsloot LH, Bosgoed E, Swillen A, Fryns JP . PTEN mutation in a family with Cowden syndrome and autism. Am J Med Genet 2001;105:521–524.
- 62
Stein MT, Elias ER, Saenz M, Pickler L, Reynolds A . Autistic spectrum disorder in a 9-year-old girl with macrocephaly. J Dev Behav Pediatr 2010;31:632–634.
- 63
Varga EA, Pastore M, Prior T, Herman GE, McBride KL . The prevalence of PTEN mutations in a clinical pediatric cohort with autism spectrum disorders, developmental delay, and macrocephaly. Genet Med 2009;11:111–117.
- 64
McBride KL, Varga EA, Pastore MT, et al. Confirmation study of PTEN mutations among individuals with autism or developmental delays/mental retardation and macrocephaly. Autism Res 2010;3:137–141.
- 65
Buxbaum JD, Cai G, Chaste P, et al. Mutation screening of the PTEN gene in patients with autism spectrum disorders and macrocephaly. Am J Med Genet B Neuropsychiatr Genet 2007;144B:484–491.
- 66
Zecavati N, Spence SJ . Neurometabolic disorders and dysfunction in autism spectrum disorders. Curr Neurol Neurosci Rep 2009;9:129–136.
- 67
Baieli S, Pavone L, Meli C, Fiumara A, Coleman M . Autism and phenylketonuria. J Autism Dev Disord 2003;33:201–204.
- 68
Wraith JE, Danks DM, Rogers JG . Mild Sanfilippo syndrome: a further cause of hyperactivity and behavioural disturbance. Med J Aust 1987;147:450–451.
- 69
Haas RH . Autism and mitochondrial disease. Dev Disabil Res Rev 2010;16:144–153.
- 70
Weissman JR, Kelley RI, Bauman ML, et al. Mitochondrial disease in autism spectrum disorder patients: a cohort analysis. PLoS ONE 2008;3:e3815.
- 71
Wilder RT, Flick RP, Sprung J, et al. Early exposure to anesthesia and learning disabilities in a population-based birth cohort. Anesthesiology 2009;110:796–804.
- 72
Sprung J, Flick RP, Katusic SK, et al. Attention-deficit/hyperactivity disorder after early exposure to procedures requiring general anesthesia. Mayo Clin Proc 2012;87:120–129.
- 73
Boddaert N, Zilbovicius M, Philipe A, et al. MRI findings in 77 children with non-syndromic autistic disorder. PLoS ONE 2009;4:e4415.
- 74
Schaefer GB, Mendelsohn NJ . Genetics evaluation for the etiologic diagnosis of autism spectrum disorders. Genet Med 2008;10:4–12.
- 75
Mefford HC, Batshaw ML, Hoffman EP . Genomics, intellectual disability, and autism. N Engl J Med 2012;366:733–743.
- 76
Schaefer GB, Mendelsohn NJ ; Professional Practice and Guidelines Committee. Clinical genetics evaluation in identifying the etiology of autism spectrum disorders. Genet Med 2008;10:301–305.






