目次
1. 導入
遺伝子バリアントの基本概念の紹介
遺伝子バリアントの定義をより正確に述べると、参照配列と異なるDNA配列を持つ遺伝子のバージョンを指します。参照配列とは、ある集団内で最も一般的に見られる遺伝子の配列であり、標準として用いられます。遺伝子バリアントは、この参照配列からの単一塩基の置換、挿入、欠失、またはより大きな構造的変化など、さまざまな形で現れることがあります。
遺伝子バリアントは、個体間の遺伝的多様性の源であり、生物の表現型に影響を与えることがあります。これにより、個体の特性、疾病への感受性、薬物への反応性などが決定されることがあります。したがって、遺伝子バリアントの同定と解析は、遺伝学、分子生物学、医学研究において重要な役割を果たしています。
突然変異はヌクレオチド配列の恒久的変化と定義され、多型は1%を超える頻度をもつ変異体と定義されてきました。
しかし、広く使われている「突然変異」や「多型」という言葉は、しばしばそれぞれ病原性および良性作用の誤った仮定により混乱を招くため用語の変更が提唱されました。
2015年の米国人類遺伝学会での決定は、遺伝子バリアントに関する用語の使い方を明確化し、科学的コミュニケーションを改善するための重要なステップでした。従来、「突然変異」という言葉は、疾患や異常を引き起こす遺伝子の変化を指すのに使われ、「多型」という言葉は、個体群内で広く見られる、一般的には健康に影響を与えない遺伝子の変化を指すのに使われていました。しかし、これらの用語はしばしば誤解を招きやすく、特に遺伝子の変化が具体的にどのような影響を持つのか未だ明確でない場合に混乱を引き起こすことがありました。
このため、用語の使用を「バリアント」という一般的な言葉に統一し、バリアントの機能的影響や疾患との関連性をより正確に表現するために以下の5つの修飾語を用いることが推奨されました。
●病原性pathogenic:このバリアントは既知の疾患を引き起こすことが明らかであり、臨床的に重要な影響を持つことが確認されています。
●病原性の可能性が高いlikely pathogenic:このバリアントは疾患を引き起こす可能性が高いとされますが、その関連性についてはまだ完全には確立されていません。
●意義不明 variant of unknown significance(VUS):このバリアントが健康や疾患にどのような影響を与えるのか不明であり、現時点ではその機能的意義を判断することができません。
●良性の可能性が高いlikely benign:このバリアントは健康に有害な影響を及ぼす可能性が低いと考えられますが、完全には確認されていません。
●良性benign:このバリアントは健康に影響を与えないと広く認識されています。
このアプローチにより、遺伝子バリアントの報告と解釈がより精密になり、臨床医や研究者が患者の遺伝子情報を基にした意思決定を行う際の明確性が向上します。特に、遺伝子診断やパーソナライズドメディシンの分野では、遺伝子バリアントの正確な分類が治療選択やリスク評価に直接影響を与えるため、このような用語の標準化は非常に重要です。
関連記事:
- バリアントの分類方法について:2015年5月発表の米国分子病理学会と米国ゲノム・遺伝医学学会のガイドライン:長いので分割:ページ1
- バリアントの分類方法2
- バリアントの分類方法3
- バリアントの分類方法について/表3
遺伝子バリアントが生物学的多様性にどのように貢献しているのか
遺伝子バリアントは、生物学的多様性の核心をなし、種の進化と適応に不可欠です。これらの遺伝的変異により、生物は環境の変化に適応し、生存と繁栄の機会を増やします。遺伝子バリアントは、病原体への抵抗力や気候条件への耐性など、有利な形質を提供することがあります。また、生態系の健全性と安定性を支え、種の生存能力を高めることにも寄与します。遺伝的多様性の高い個体群は、変化する環境に柔軟に対応でき、絶滅リスクが低くなります。このため、遺伝子バリアントの研究と生物多様性の保全は、地球上の生命の繁栄にとって極めて重要です。
2. 遺伝子バリアントの定義
遺伝子バリアントの科学的定義
遺伝子バリアントとは、生物のDNA配列における個別の違いを指し、これらは個体間の遺伝的多様性の根底にあります。科学的には、遺伝子バリアントは参照配列と比較した際のDNA配列の変化として定義されます。
参照配列(リファレンスゲノム)は、ゲノム解読プロジェクトを通じて読み解かれた大量の塩基配列を組み立てて作られた、特定の生物種の理想的な個体の遺伝子セットを代表するデータベースです。これは国際ヒトゲノム計画で構築されたもので、現代のゲノム解析には不可欠であり、遺伝性疾患の原因を探る際やバリアントを検出するのに使われます。参照配列は様々な民族集団の検体から作られており、日本人から構築されたJG1のように、特定の民族集団向けの基準ゲノム配列も存在します。これにより、ゲノム解析の際の民族集団の違いによる見落としや誤検出を減らすことが可能になります。さらに、各国で構築された基準ゲノム配列を用いることで、多様性をより包括的に捉え、精度の高い解析が行えるようになると期待されています。今後は、個々のゲノム解読にもこれらの手法が応用され、例えばがん解析において正常組織から抽出したDNAを基にした基準ゲノム配列を構築し、がん組織のバリアント検出に利用することで、より精度の高い解析が可能になる見込みです。 DNA解読技術や情報解析技術の進展により、このようなアプローチが近い将来実現する可能性があります。
遺伝子バリアントは、単一塩基の置換(一塩基多型、SNP)、挿入、欠失、複製、または配列の再配列など、多様な形態をとります。これらの違いは、個体の外見、病気への感受性、薬物反応性など、多岐にわたる遺伝的特徴に影響を及ぼすことがあります。
参照配列に対するバリアントの同定は、ゲノムの比較解析に不可欠です。科学者たちは参照配列を使用して、特定の個体または集団のDNA配列を調べ、遺伝的変異を特定します。このプロセスは、特定の遺伝子バリアントが疾患のリスクを高めるか、または特定の薬物に対する感受性を変えるかどうかを理解するのに役立ちます。
遺伝子バリアントの科学的研究は、参照配列との比較を通じて行われることが多いです。この比較により、遺伝子の特定の変異がどのように通常の生理的プロセスや疾患の発生に関与しているかを明らかにすることができます。たとえば、特定のSNPが疾患の感受性を変えることが知られている場合、そのSNPを持つ人々は疾患のリスクが高いかもしれません。
遺伝子バリアントの分類と解析は、ゲノミクス、生物情報学、遺伝学などの分野で進められています。これらの技術の進歩により、疾患関連遺伝子の同定、個別化医療への応用、さらには人間の遺伝的多様性の深い理解が可能になっています。参照配列との比較分析は、遺伝子バリアントの研究において中心的な役割を果たし、医学的研究と臨床応用の両方で価値があります。
遺伝子バリアントが生じるメカニズム(突然変異、遺伝的組み換え等)
遺伝子バリアントは、個体のDNA配列に生じる変化を指し、これらの変化は主に突然変異、遺伝的組み換え、そして遺伝子の複製や移動などのプロセスによって引き起こされます。これらのメカニズムは、遺伝的多様性の源として機能し、種の進化と適応のための原動力となります。
●突然変異
突然変異は、DNA配列のランダムな変更であり、最も一般的な遺伝子バリアントの発生源です。これらは主に以下のような形で生じます:
点突然変異: 単一の塩基対が別の塩基対に置き換わる。これには、遺伝子の機能に影響を与える可能性がある同義突然変異と非同義突然変異が含まれる。
挿入および欠失: DNA配列に塩基対が追加されたり(挿入)、除去されたり(欠失)することで、遺伝子の読み枠が変化することがあります。
複製: DNA配列の一部が複製され、遺伝子のコピー数が増加します。
これらの変更は、細胞分裂の過程でDNAが複製される際の複写エラー、化学物質や放射線などの外部因子によるDNA損傷、または細胞のDNA修復メカニズムの失敗によって生じることがあります。
●遺伝的組み換え
遺伝的組み換えは、異なるDNA断片間で遺伝情報が交換されるプロセスです。このプロセスは主に、生物の生殖過程における減数分裂時に起こる。特に、同じ染色体上の対立遺伝子間での交差(クロスオーバー)により、遺伝子の新しい組み合わせが生成され、遺伝的多様性が増大します。
●遺伝子の複製と移動
遺伝子の複製: DNA配列の特定の部分が複製され、同じゲノム内、あるいは異なる位置に挿入されることがあります。これにより、遺伝子のコピー数が増加し、遺伝子発現の変化や新しい遺伝的特徴の出現につながることがあります。
遺伝子の移動: 転移因子やレトロトランスポゾンなどの移動遺伝子要素が、遺伝子または遺伝子の断片を一つの位置から別の位置へ移動させることがあります。これにより、遺伝子の発現パターンの変化や新たな遺伝子バリアントの生成が起こることがあります。
これらのメカニズムによって生じる遺伝子バリアントは、生物の遺伝的多様性を高め、環境変化への適応や新たな生理的特徴の進化を促進します。また、これらの変異は疾患の原因となることもあり、遺伝学や分子生物学の研究において重要な研究対象となっています。
突然変異のホットスポット
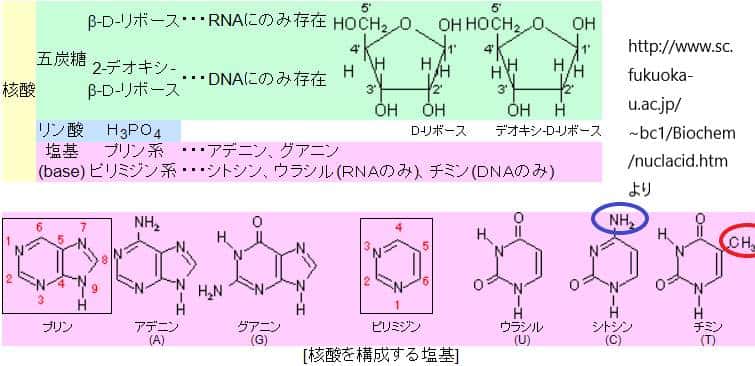
DNA配列の変更が起こる際、その変更はDNAの共通骨格ではなく、塩基の違いによって生じます。塩基置換には大きく分けて二つのタイプがあります:トランジションとトランスバージョンです。トランジションはプリン塩基(アデニン[A]とグアニン[G])同士、またはピリミジン塩基(シトシン[C]とチミン[T])同士の置換です。トランスバージョンはプリン塩基からピリミジン塩基への置換、またはその逆の置換を指します。
理論的には、塩基置換が完全にランダムに起こる場合、トランスバージョンがトランジションの2倍発生すると予測されます。なぜなら、各塩基には2通りのトランスバージョンの可能性があり、トランジションの可能性は1通りしかないためです。しかし、実際には、DNAの修正や生物学的な選択メカニズムによって、特定のタイプの塩基置換が選択的に起こります。例えば、トランジションは遺伝性疾患の原因となる一塩基置換の中で非常に一般的です。
ヒトゲノムDNAにおいて、特に注目される修正の一つがシトシン残基のメチル化です。これは主にシトシンがグアニン残基の直前(5′-CG-3’)に位置する場合に起こります。メチル化されたシトシンが脱アミノ化されると、チミンに変換されることがあります。この過程はC>TまたはG>Aのトランジション置換を引き起こします。具体的には、CGのジヌクレオチドがTGに置換され、相補的なDNA鎖ではGCがACに変わります。この変異は、DNAの一塩基置換の中で特に頻度が高く、他の一塩基変異に比べて約25倍の頻度で発生するとされています。この事実は、CGのジヌクレオチド部位がヒトゲノムにおける変異のホットスポットであることを示しています。
この現象は、特定のDNA領域が変異により影響を受けやすい理由を理解する上で重要です。CGのジヌクレオチドがメチル化されやすく、それが脱アミノ化を経てトランジション置換に至る過程は、遺伝子発現の調節やエピジェネティクスの研究においても大きな関心を集めています。さらに、これらの変異が高頻度で発生するメカニズムの理解は、遺伝性疾患の原因を探る上での重要な手がかりとなります。
3. 遺伝子バリアントの主なタイプ
遺伝子バリアントは、DNA配列の差異によって定義され、個体間の遺伝的多様性の基礎を形成します。これらのバリアントは、遺伝的特徴、疾患の感受性、薬物反応性などに影響を与えることがあります。以下に、遺伝子バリアントの主なタイプとその特徴を紹介します。
1. 単一塩基多型(Single Nucleotide Polymorphisms, SNPs)
定義: DNA配列中の単一の塩基が異なる場合の変異。
特徴: 最も一般的な遺伝子バリアントのタイプで、人間のゲノム内に広く分布しています。多くは遺伝子の機能に影響を与えないが、一部は疾患の感受性や薬物の代謝に関与することがあります。
2. インデル(Insertions and Deletions)
定義: DNA配列における小さな塩基の挿入や欠失。
特徴: インデルは、遺伝子のコーディング領域内で発生した場合、タンパク質の構造や機能に重大な影響を与えることがあります。挿入または欠失のサイズによって、フレームシフト変異を引き起こすことがあります。
3. コピー数変動(Copy Number Variations, CNVs)
定義: ゲノム内のDNAセグメントのコピー数が個体間で変化する現象。
特徴: CNVsは数キロベースから数メガベースに及ぶことがあり、遺伝子の発現に大きな影響を与えることがあります。疾患の感受性や多様な表現型に関連することが知られています。
4. 構造変異
転座: ゲノム内のDNAセグメントが異なる位置に移動すること。
逆位: DNAセグメントが逆向きになって再挿入されること。
特徴: 構造変異は、遺伝子の機能を変更したり、新しい遺伝子融合を作り出すことがあります。これは、がんを含む多くの疾患と関連しています。
5. フレームシフト変異
定義: インデルによって読み枠がずれ、タンパク質のアミノ酸配列が大きく変化する変異。
特徴: フレームシフト変異は、タンパク質の機能不全を引き起こしたり、早期終止コドンによって短縮されたタンパク質を生産することがあります。これは遺伝性疾患の原因となることがあります。
これらのバリアントは、生物学的および医学的研究において重要な役割を果たします。個体差、疾患のメカニズム、治療法の開発に関する理解を深めるために、これらの遺伝子バリアントの研究が進められています。
4. 遺伝子バリアントの生物学的重要性
種の進化と遺伝的多様性への寄与
遺伝子バリアントは生物学的多様性と種の進化において中心的な役割を果たします。これらの遺伝的変異は、生物が変化する環境に適応し、生存と繁殖の成功を高めるための基礎を提供します。以下に、遺伝子バリアントの生物学的重要性と、種の進化および遺伝的多様性への寄与について説明します。
●適応進化
遺伝子バリアントは、自然選択の原材料を提供します。自然選択は、特定の環境条件下で有利な遺伝的特性を持つ個体が生存しやすく、より多くの子孫を残す過程です。遺伝子バリアントによって生じる表現型の多様性は、種が変化する環境に適応する能力を高め、結果として種の進化を促進します。
●遺伝的多様性の増加
遺伝子バリアントは、個体間の遺伝的差異を生み出し、遺伝的多様性を増加させます。この多様性は、病気、気候変動、食料資源の変化など、さまざまな環境ストレスに対する種の抵抗力を高める重要な要因です。遺伝的多様性が高い集団は、厳しい環境条件下でも生き残りやすく、進化の可能性が高まります。
●新しい生態的ニッチの開拓
遺伝子バリアントは、新しい生理的特性や行動を引き起こすことがあり、これによって種が新しい生態的ニッチを開拓し、異なる環境に適応する機会を得ることができます。例えば、ある遺伝子バリアントによって、特定の食料源を利用する能力や、特定の気候条件で生存する能力が向上することがあります。
●疾病への抵抗力
遺伝子バリアントは、疾病に対する抵抗力の源となることがあります。特定の遺伝子バリアントが病原体に対する免疫応答を強化することで、そのバリアントを持つ個体は疾病からの保護を受けることができます。このようにして、遺伝的多様性は、疾病の流行に対する集団全体の脆弱性を減少させることができます。
●長期的な種の生存
遺伝的多様性は、長期的な視点で種の生存に不可欠です。環境が変化し続ける中で、遺伝的に多様な集団は、新しい挑戦に対応し、進化し続ける能力を持っています。遺伝子バリアントによって提供される遺伝的柔軟性は、種の絶滅リスクを減少させ、生物多様性の維持に寄与します。
遺伝子バリアントは、生物の適応、多様性、そして最終的には進化の鍵を握っています。これらの遺伝的変異は、生物が環境の変化に効果的に対応し、長期的に生存するための基盤を提供します。遺伝子バリアントの研究は、生命の進化の理解を深め、生物多様性の保全戦略の策定にも貢献しています。
疾患の発症メカニズムとの関連
疾患の発症メカニズム
遺伝性疾患: 特定の遺伝子バリアントは、遺伝性疾患の直接的な原因となることがあります。例えば、シストリック線維症やサルコイドーシスなどの疾患は、特定の遺伝子の変異によって引き起こされます。
多因子性疾患: 多くの疾患は、遺伝子バリアントと環境要因との相互作用によって発症します。例えば、心血管疾患や糖尿病、がんなどは、複数の遺伝子バリアントとライフスタイルの選択が組み合わさって発症リスクが変動します。
個別化医療: 個々の遺伝子バリアントを理解することで、より効果的な個別化医療が可能になります。例えば、特定の遺伝子バリアントを持つ患者に対して、より効果的な薬剤を選択したり、副作用のリスクを減らしたりすることができます。
個体差(薬物反応性、疾患感受性等)の根拠
遺伝子バリアントは、個体差の根拠となる重要な要素であり、薬物反応性や疾患感受性などに大きく影響します。これらの遺伝子の違いにより、個々の人間が疾患に対してどのように反応するか、または特定の薬物治療にどのように応答するかが異なります。
●薬物反応性
遺伝子バリアントは、薬物代謝酵素、薬物輸送体、薬物標的受容体の機能に影響を与えることで、薬物治療に対する個人の応答を変えることがあります。例えば、特定の遺伝子バリアントを持つ人は、ある薬物を代謝する能力が低いために、標準的な用量で副作用を経験するリスクが高くなることがあります。逆に、別のバリアントを持つ人は、薬物を迅速に代謝してしまうために、通常の用量では十分な治療効果が得られないかもしれません。
●疾患感受性
遺伝子バリアントは、個体が特定の疾患に対してどれだけ脆弱か、または抵抗力を持っているかに大きく影響します。これは、免疫系の機能、細胞成長や分化の制御、および炎症反応など、疾患の発症に関連する多くの生物学的経路に関係しています。たとえば、BRCA1やBRCA2遺伝子の変異は、乳がんや卵巣がんのリスクが高いことが知られています。同様に、CFTR遺伝子の特定のバリアントは、シストリック線維症の原因となります。
●個体差の理解による利点
遺伝子バリアントに基づく個体差の理解は、個別化医療の推進に寄与します。遺伝的スクリーニングにより、特定の疾患に対するリスクの評価、薬物療法の選択と用量の調整、そして予防戦略の最適化が可能になります。これにより、治療の有効性を高め、副作用のリスクを低減し、全体として患者の健康アウトカムを改善することが期待されます。
遺伝子バリアントの研究は、人間の健康と疾患に対する理解を深め、よりパーソナライズされた医療アプローチの実現に向けた基礎を築いています。
5. 遺伝子バリアントの検出と分析
現代の遺伝子解析技術(次世代シーケンシングなど)
遺伝子バリアントの検出と分析には、次世代シーケンシング(NGS)が広く利用されています。NGSは、数百万ものDNAフラグメントを同時に配列決定することができるため、大規模なデータを迅速かつ効率的に取得することが可能です[12][15][16][19]。この技術により、全ゲノムや特定のターゲット領域の詳細な解析が可能となり、遺伝子バリアントの同定やその機能的影響の評価が行えます[7][10][11][13][14][17][18][20]。
NGSによる遺伝子バリアントの検出には、いくつかの基本的なステップがあります。まず、DNAサンプルからライブラリーを調製し、シーケンサーによって配列を読み取ります。その後、得られた配列データ(リード)を参照ゲノムと比較して、バリアントを同定します[16]。このプロセスには、リードの平均長さ(MRL)やアライメント品質(AQ)などの指標が関連しており、データの品質を評価するために用いられます[18]。
バリアントの種類には、一塩基多型(SNP)、一塩基変異(SNV)、挿入・欠失変異(Indel)、コピー数変異(CNV)などがあり、それぞれ特定の疾患や表現型と関連していることが知られています[20]。NGSを用いることで、これらのバリアントを高感度で検出し、新しいバリアントの発見を加速することができます。
また、NGSデータの解析にはバイオインフォマティクスのツールが必要であり、リードのアセンブリ、バリアントのコール、アノテーションなどの処理が行われます[12][15][19]。これにより、遺伝子発現解析や網羅的なゲノム解析が可能となり、個別化医療や遺伝性疾患の研究に貢献しています。
NGS以外にも、リアルタイムPCRやマイクロアレイなどの技術がSNPやSNVのジェノタイピングに利用されています[20]。これらの手法は、特定の既知のバリアントを効率的に検出するために用いられ、疾患関連バリアントのスクリーニングやファーマコゲノミクス研究に有用です。
総合すると、NGSは遺伝子バリアントの検出と分析において中心的な役割を果たしており、その高スループットな特性とバイオインフォマティクスの進歩により、遺伝学研究の可能性を大きく広げています。
- 参考文献・出典
-
[12] www.genewiz.com/ja-JP/Public/Services/Next-Generation-Sequencing?sc_device=Mobile
[13] www.kantei.go.jp/jp/singi/kenkouiryou/genome/genome_dai9/siryou2.pdf
[14] www.ncc.go.jp/jp/ri/division/molecular_oncology/project/010/index.html
[15] www.cosmobio.co.jp/support/technology/a/next-generation-sequencing-introduction-apb.asp
[16] jp.illumina.com/science/technology/next-generation-sequencing/beginners.html
[17] horizondiscovery.com/ja/blog/2021/strategies-to-detect-and-validate-your-crispr-gene-edit
[18] www.thermofisher.com/blog/learning-at-the-bench/basic_ngs_gsd_ts_2/
[19] www.nippongene.com/siyaku/product/service-instruments/bits/bits.html
[20] jp.illumina.com/techniques/popular-applications/genotyping/snp-snv-genotyping.html
バリアントの同定とその解釈の方法
遺伝子バリアントの同定とその解釈は、個人の遺伝的特徴を理解し、疾患の診断や治療戦略の開発に役立つ重要なプロセスです。このプロセスは主に、遺伝子配列の解析とバリアントの生物学的影響の評価に分けられます。
バリアントの同定
ゲノムシーケンシング: 高スループットな次世代シーケンシング技術(NGS)により、個人の全ゲノムまたは特定の遺伝子領域のDNA配列を迅速に決定します。この方法は、多数の遺伝子バリアントを一度に検出できるため、遺伝子診断に広く用いられています。
ターゲットシーケンシング: 特定の遺伝子や遺伝子領域を対象としたシーケンシングで、疾患関連遺伝子のバリアントを特定するのに使われます。このアプローチは、関連する遺伝子が既知の場合に効率的です。
バイオインフォマティクス解析: シーケンシングデータは、バイオインフォマティクスツールを用いて解析され、既知および未知の遺伝子バリアントが特定されます。このステップでは、参照ゲノムとの比較により、SNP(単一塩基多型)、インデル(挿入・欠失)、コピー数変動などのバリアントが同定されます。
バリアントの解釈
●機能的影響の評価: 同定されたバリアントが遺伝子やタンパク質の機能にどのような影響を与えるかを評価します。バリアントがタンパク質コーディング領域に位置する場合、アミノ酸配列の変化やタンパク質の構造・機能への影響が予測されます。
●疾患関連性の確認: 遺伝子バリアントの臨床的意義を理解するプロセスは、遺伝子検査の中核をなすものであり、特に医療の現場ではその解釈が患者の治療方針を決定する上で重要な役割を果たします。この解釈過程は、公開データベースの活用から始まり、必要に応じて科学文献の深掘りによる研究が行われます。以下にそのプロセスを詳述します。
▼公開データベースの活用
ClinVarやGenome Aggregation Database (gnomAD)、Online Mendelian Inheritance in Man (OMIM) などのデータベースは、遺伝子バリアントと疾患の関連性に関する包括的な情報を提供しています。これらのデータベースは、特定の遺伝子バリアントが関連する疾患、そのバリアントの臨床的意義、およびバリアントの頻度についてのデータを集約しています。
データベースによっては、バリアントがどのように機能的にタンパク質に影響を与えるか、または遺伝的疾患のリスクにどのように寄与するかについての情報も提供されています。
▼データベースに登録がない新規バリアントの解釈
データベースにない新規のバリアントを解釈する場合、研究者や医師は生物情報学的ツールやアルゴリズムを使用してバリアントの潜在的な影響を予測します。これには、バリアントがタンパク質の構造や機能にどのように影響を与えるか、または遺伝的疾患の発症にどのように関連するかを評価するものが含まれます。
さらに、科学文献を検索して、類似のバリアントや関連する生物学的パスウェイに関する研究を参照することもあります。このような研究は、新規バリアントの機能的影響や疾患との関連性を理解する上で貴重な洞察を提供することができます。
▼専門的スキルの必要性
遺伝子検査の結果を正確に解釈するためには、遺伝学、分子生物学、生物情報学の知識が必要です。また、特定のバリアントが患者の健康にどのように影響を与える可能性があるかを理解するためには、臨床医学の専門知識も不可欠です。
現代医療では、個別化医療の提供に向けて、遺伝子バリアントの正確な解釈がますます重要になっています。このため、遺伝子情報の解釈を専門とする臨床遺伝子専門家や遺伝カウンセラーなどの役割が強調されています。
▼結論
遺伝子検査とその解釈は、現代医療における重要な進歩を表していますが、このプロセスの複雑さと専門性は高度な知識と技術を要求します。公開データベースや科学文献を用いた遺伝子バリアントの詳細な解析は、患者にとって最適な診断と治療戦略を決定するための基盤となります。
●遺伝カウンセリング: 遺伝子バリアントの臨床的意義を患者やその家族に伝える際は、遺伝カウンセリングが重要です。バリアントの健康への影響、疾患のリスク、遺伝的検査結果に基づく行動の選択肢などが説明されます。
遺伝子バリアントの同定と解釈は、個人の遺伝的リスクを評価し、遺伝性疾患の早期発見、予防、およびカスタマイズされた治療計画の策定に貢献するため、分子生物学と遺伝学の分野で急速に進化しています。
6. 遺伝子バリアントと疾患
遺伝性疾患と遺伝子バリアントの関係
遺伝性疾患は、遺伝子バリアントによって引き起こされる病気です。これらのバリアントは、遺伝子の正常な機能を妨げ、特定の疾患の発症リスクを高めることがあります。遺伝性疾患は一般に、親から子へと遺伝するパターンに従いますが、新たな遺伝子変異によって初めて発生する場合もあります。
遺伝性疾患は大きく二つのカテゴリーに分けられます。単一遺伝子疾患と多因子遺伝疾患です。単一遺伝子疾患は、一つの遺伝子の変異によって直接引き起こされる病気であり、嚢胞性繊維症やハンチントン病などが例として挙げられます。一方、多因子遺伝疾患は、複数の遺伝子の変異と環境要因が組み合わさって発症する病気で、心臓病や糖尿病などがこれに該当します。
複雑な疾患における遺伝子バリアントの役割
複雑な疾患とは、多因子遺伝疾患とも呼ばれ、遺伝と環境の相互作用によって発症する疾患を指します。これには、心血管疾患、糖尿病、がん、精神障害などが含まれます。遺伝子バリアントは、これらの疾患の発症において、直接的あるいは間接的な役割を果たすことがあります。
例えば、BRCA1やBRCA2の変異は、乳がんや卵巣がんのリスクを顕著に高めます。これらの遺伝子は、DNA修復に関与しており、その機能不全はがん細胞の成長を促進する可能性があります。一方で、心血管疾患においては、APOE遺伝子の特定のバリアントが、心臓病のリスクを高めることが知られています。
パーソナライズドメディシンと遺伝子バリアント
パーソナライズドメディシンは、個々の患者の遺伝子情報、ライフスタイル、環境因子を考慮に入れた医療提供のアプローチです。このアプローチは、特に遺伝子バリアントという個人の遺伝的差異を理解することに重きを置いています。遺伝子バリアントは、DNAの配列における変異であり、人々が病気になるリスク、病気の進行速度、治療薬への反応性などに大きな影響を与えます。ここでは、パーソナライズドメディシンの概念と、遺伝子バリアントがどのようにしてこの先進的な医療アプローチに貢献しているのかを掘り下げていきます。
●パーソナライズドメディシンの基本
パーソナライズドメディシンは、”一人一人に最適な治療”を目指す医療の形態です。これは、伝統的な「ワンサイズフィットオール」のアプローチからの大きな転換を意味します。従来の方法では、同じ病状に対して、全ての患者に同じ治療法が適用されていました。しかし、パーソナライズドメディシンでは、遺伝子検査などの技術を使用して、個々の患者の遺伝的プロファイルを分析し、最も効果的な治療法を選択します。
●遺伝子バリアントの役割
遺伝子バリアントの分析は、パーソナライズドメディシンの中核をなす要素です。遺伝子バリアントによって、薬物の代謝速度や、特定の治療法に対する感受性が変わることがあります。例えば、BRCA1やBRCA2といった遺伝子の変異は、乳がんや卵巣がんのリスクを高めることが知られています。これらの遺伝子バリアントを特定することで、高リスクな個人に対して早期の介入や予防策を講じることが可能になります。
また、薬剤応答性に関する遺伝子バリアントの研究は、薬物療法の最適化に貢献しています。特定の遺伝子バリアントを持つ患者は、ある薬剤に対して異常な反応を示すことがあり、これを予め知ることで、副作用のリスクを減少させたり、治療効果を最大化することが可能です。
●チャレンジと展望
パーソナライズドメディシンと遺伝子バリアントの研究は、医療に革命をもたらす可能性を秘めていますが、実装にはいくつかの課題があります。個人の遺伝子情報の収集と分析には、プライバシーの保護、倫理的な考慮、データ解釈の精度など、多くの注意を払う必要があります。また、この新しいアプローチを広く普及させるためには、医療提供者の教育や、コストの問題も解決しなければなりません。
未来に向けて、遺伝子バリアントの綿密な研究と、それを活用した治療法の開発は続けられるでしょう。これにより、より効果的で副作用の少ないパーソナライズドな治療が可能になり、個々の患者にとって最適な医療の提供が実現されることが期待されます。パーソナライズドメディシンは、遺伝子バリアントの理解を深めることで、医療の未来を形作る鍵となるでしょう。
7. 研究と未来展望
遺伝子バリアント研究の最新動向
遺伝子バリアント研究の最新動向は、迅速な技術革新とデータ解析能力の向上に支えられ、遺伝学の多くの分野において前進しています。この進展は、遺伝子編集技術の発展、全ゲノムシークエンシングのコスト削減、バイオインフォマティクスと機械学習の応用など、多方面にわたります。以下に、遺伝子バリアント研究のいくつかの重要な最新動向を紹介します。
●遺伝子編集技術
CRISPR-Cas9などの遺伝子編集技術は、遺伝子バリアントに起因する疾患の研究と治療に革命をもたらしています。これらの技術を使用することで、科学者は特定の遺伝子バリアントを精密に編集し、疾患の原因となる変異を修正または無効化することができます。最近では、遺伝子編集技術を用いた臨床試験が、遺伝性疾患の治療法としての可能性を探るために開始されています。
●全ゲノムシークエンシング
全ゲノムシークエンシングのコストが大幅に低下したことで、遺伝子バリアントの研究が加速しています。これにより、個人の遺伝子全体を迅速かつ経済的に解析し、遺伝性疾患のリスクを評価することが可能になりました。また、未知の遺伝子バリアントを発見し、その機能や疾患との関連を解明するための研究が進行中です。
●バイオインフォマティクスと機械学習
バイオインフォマティクスと機械学習の技術は、膨大な遺伝子データから有意義な情報を抽出するために不可欠です。これらの技術を使用して、遺伝子バリアントと特定の疾患との間の関連性を特定し、疾患の発症機序を理解するための新しい洞察を得ることができます。さらに、個別化医療における遺伝子バリアントの影響を評価し、患者に最適な治療戦略を提案するためにも活用されています。
●パーソナライズドメディシン
遺伝子バリアントの研究は、パーソナライズドメディシンの実現に向けた重要なステップです。遺伝子プロファイリングを通じて、患者ごとにカスタマイズされた治療計画を立てることが可能になり、疾患の予防、診断、治療がより効果的かつ効率的に行えるようになります。特にがん治療において、遺伝子バリアントの分析は治療の選択と予後の評価において重要な役割を果たしています。
●まとめ
遺伝子バリアント研究の最新動向は、遺伝学の理解を深め、遺伝性疾患の診断と治療において新たな可能性を開くことを約束しています。技術革新の継続的な進展により、将来的にはより多くの疾患に対する根本的な治療法が開発され、遺伝性疾患を持つ人々の生活の質が向上することが期待されます。
遺伝子編集技術とバリアント
遺伝子編集技術は、生物のDNAに特定の変更を加えることを可能にする革新的な手段です。この技術によって、遺伝子の機能を改善したり、病気を引き起こす遺伝子バリアントを修正したりすることが可能になります。遺伝子編集の応用は、医療、農業、生物学研究など多岐にわたりますが、ここでは特に医療における遺伝子バリアントの修正に焦点を当てて解説します。
●遺伝子編集技術の概要
遺伝子編集技術には、CRISPR-Cas9、TALENs(Transcription Activator-Like Effector Nucleases)、ZFNs(Zinc Finger Nucleases)などがあります。これらの技術は、DNAの特定の位置を認識して切断し、自然なDNA修復プロセスを利用して特定の変更を導入することができます。中でもCRISPR-Cas9は、その簡便さ、高効率、低コストで最も注目されている遺伝子編集ツールの一つです。
●遺伝子バリアントの修正
遺伝性疾患は、遺伝子バリアントによって引き起こされることが多く、これらの疾患にはシクルセル貧血、ハンチントン病、一部の形式の遺伝性がんなどがあります。遺伝子編集技術を用いることで、これらの病気を引き起こす遺伝子バリアントを直接修正し、疾患の根本的な原因を取り除くことが可能になります。
●治療への応用
遺伝子編集は、疾患治療において大きな希望を提供します。例えば、CRISPR-Cas9を用いた臨床試験が、シクルセル貧血やβサラセミアの患者を対象に行われており、病気を引き起こす遺伝子バリアントを修正することで、症状の軽減や治癒を目指しています。また、遺伝性視覚障害や筋ジストロフィーなど、他の多くの遺伝性疾患に対する治療法の開発も進行中です。
●倫理的、社会的考察
遺伝子編集技術の応用は、倫理的および社会的な論争を引き起こすことがあります。特に、生殖細胞(精子、卵子、胚)の編集は、修正された遺伝子が次世代に引き継がれるため、深刻な倫理的懸念を引き起こします。このため、多くの国では生殖細胞の編集に厳格な規制が設けられています。研究者や政策立案者は、遺伝子編集技術の利益を最大化し、潜在的なリスクを最小限に抑えるためのガイドラインや法規制の策定に努めています。
●結論
遺伝子編集技術は、遺伝子バリアントを修正し、遺伝性疾患の治療に革命をもたらす可能性を秘めています。この技術の進歩は、個別化医療の新たな地平を開き、多くの人々の健康と生活の質を向上させることが期待されます。しかし、その応用は倫理的および社会的な配慮を必要とし、科学者、医療専門家、政策立案者、そして社会全体の協力が求められます。
未来の遺伝学とバリアント研究の方向性
未来の遺伝学とバリアント研究は、個々の遺伝的特徴をより深く理解し、それを医療、予防、そしてパーソナライズドメディシンへと繋げることに重点を置く方向に進んでいます。この進展には、技術革新、データ解析手法の進化、そして倫理的・社会的課題への対応が含まれます。ここでは、そのような未来の遺伝学とバリアント研究の方向性について探ります。
高度なシークエンシング技術
次世代シークエンシング技術の発展は、遺伝子バリアントの同定をより迅速かつコスト効率良く行うことを可能にします。これにより、大規模な遺伝子バリアントデータベースの構築が進み、さまざまな人種、民族、地理的背景を持つ個人群の遺伝的多様性がより広範に研究されるようになります。
統合オミクス分析
遺伝子バリアント研究は、ゲノミクスだけでなく、トランスクリプトミクス(RNAの研究)、プロテオミクス(タンパク質の研究)、メタボロミクス(代謝物の研究)など、他のオミクスデータとの統合へと進むでしょう。これらの多角的な分析により、遺伝子バリアントが個人の健康や病気にどのように影響を及ぼすかの理解が深まります。
AIと機械学習の応用
人工知能(AI)と機械学習は、膨大な遺伝データから有意義なパターンを抽出し、未知の遺伝子バリアントと病気との関連を予測するのに不可欠なツールになります。これらの技術は、遺伝子バリアントの機能的影響を解明し、新たな治療標的を特定するためにも活用されるでしょう。
倫理的、社会的課題への取り組み
遺伝情報のプライバシー保護、データの共有と利用に関する倫理的問題は、遺伝学研究の進展とともにより重要になります。未来の遺伝学では、これらの課題に対する明確なガイドラインと、患者と研究参加者の権利を保護するための枠組みの強化が求められます。
予防医学とパーソナライズドメディシンへの応用
最終的に、未来の遺伝学とバリアント研究の目標は、個々の遺伝的リスクの評価を通じて、予防的措置を講じることや、パーソナライズドメディシンによる治療の精度を高めることにあります。個々の遺伝的特性に基づく予防策や治療法の開発は、より健康な社会の実現に貢献するでしょう。
このように、未来の遺伝学とバリアント研究は、医療のパーソナライズ化を推進し、病気の予防と治療に革命をもたらす可能性を秘めています。技術革新と倫理的な検討を進めることで、この分野は人類の健康に対する理解を新たなレベルへと引き上げることが期待されます。









