目次
神経系に関わる様々な疾患の中で、CACNA1A遺伝子は特に重要な役割を果たしています。この遺伝子は脳内のカルシウムチャネルをコードしており、神経伝達に必須の機能を持ちます。CACNA1A遺伝子の変異は、片頭痛、てんかん、運動失調症など多様な神経症状を引き起こすことが知られています。
この記事では、CACNA1A遺伝子の基本情報から関連疾患、遺伝子検査の意義まで詳しく解説します。神経発達に関わる症状や家族歴のある方々にとって、理解を深める一助となれば幸いです。
CACNA1A遺伝子の基本情報
CACNA1A遺伝子(Calcium Channel, Voltage-Dependent, P/Q Type, Alpha-1A Subunit)は、19番染色体(19p13.13)に位置し、P/Q型電位依存性カルシウムチャネル(CaV2.1)のα1Aサブユニットをコードしています。このチャネルは主に脳内、特に小脳のプルキンエ細胞に多く発現しており、神経伝達物質の放出に重要な役割を果たしています。
CACNA1A遺伝子(Calcium Channel, Voltage-Dependent, P/Q Type, Alpha-1A Subunit)は、19番染色体(19p13.13)に位置し、P/Q型電位依存性カルシウムチャネル(CaV2.1)のα1Aサブユニットをコードしています。このチャネルは主に脳内、特に小脳のプルキンエ細胞に多く発現しており、神経伝達物質の放出に重要な役割を果たしています。
プルキンエ細胞とは:
プルキンエ細胞は、小脳皮質に存在する大型の神経細胞で、複雑に分岐した樹状突起と特徴的な構造を持ちます。小脳回路における唯一の出力細胞であり、運動の協調性や姿勢制御、バランス維持、運動学習など、小脳の重要な機能を担っています。これらの細胞は特にCACNA1A遺伝子が豊富に発現しており、その機能障害は運動失調や不随意運動などの症状と関連しています。脊髄小脳失調症6型(SCA6)などのCACNA1A遺伝子関連疾患では、このプルキンエ細胞の変性や脱落が観察されます。
CACNA1A遺伝子の特徴:
- 遺伝子座位:19p13.13
- 遺伝子サイズ:約300kb
- エクソン数:47個
- コードするタンパク質:P/Q型カルシウムチャネルのα1Aサブユニット
- 発現部位:主に脳(小脳、大脳皮質、視床、視床下部)
電位依存性カルシウムチャネルは、興奮性細胞へのカルシウムイオンの流入を媒介するだけでなく、筋収縮、ホルモンや神経伝達物質の放出、遺伝子発現などのカルシウム依存性プロセスにも関与しています。CACNA1A遺伝子から生成されるタンパク質は、神経細胞間の情報伝達において中心的な役割を担っているのです。
CACNA1A遺伝子の構造と機能ドメイン
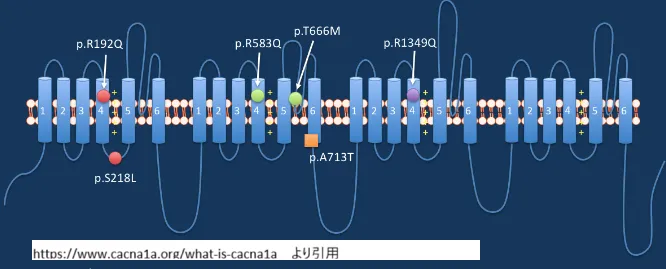
CACNA1A遺伝子は、約300キロベースの長さを持ち、47個のエクソンから構成される大型の遺伝子です。この遺伝子からコードされるP/Q型カルシウムチャネルタンパク質は、複雑な構造を持つ膜貫通タンパク質で、その構造は機能と密接に関連しています。
CACNA1A遺伝子がコードするCaV2.1チャネルの基本構造:
- 4つの反復ドメイン(I-IV):各ドメインは類似した構造を持ち、膜を貫通する部分を形成
- 各ドメインの6つの膜貫通セグメント(S1-S6):特にS4セグメントは電位センサーとして機能
- P-ループ領域:S5とS6の間に存在し、イオン選択性フィルターを形成
- 細胞内N末端とC末端:調節タンパク質との相互作用や翻訳後修飾の部位
- ドメイン間リンカー:ドメイン間を結ぶ細胞内ループで、チャネルの調節に関与
この複雑な構造により、CACNA1A遺伝子がコードするCaV2.1チャネルは、神経細胞の活動電位に応じて開閉し、カルシウムイオンの細胞内流入を精密に制御することができます。特にC末端領域には、カルモジュリン結合部位やポリグルタミン領域などの重要な機能部位が含まれています。
CACNA1A遺伝子のスプライシングバリアント
CACNA1A遺伝子は選択的スプライシングにより複数のアイソフォームを生成します。特にエクソン37には2つの選択的バリアント(37aと37b)が存在し、これらは神経伝達物質放出に異なる影響を与えることが知られています。また、エクソン47内のCAGリピート長の違いもタンパク質の特性に影響を与えます。
CACNA1A遺伝子変異と構造-機能連関:
CACNA1A遺伝子変異の位置は、症状の表現型に大きく影響します。例えば:
- 電位センサー領域(S4セグメント)の変異:FHM1に関連し、チャネルの活性化電位を変化させる
- ポア領域(P-ループ)の変異:イオン選択性や透過性に影響し、FHM1やEA2を引き起こす
- C末端のCAGリピート伸長:ポリグルタミン鎖の蓄積によりSCA6を引き起こす
- フレームシフト/ナンセンス変異:機能喪失型変異としてEA2に関連する
CACNA1A遺伝子の構造解析は、関連疾患の病態メカニズム理解や標的治療法開発において重要な役割を果たしています。特に、特定のドメインを標的とした薬剤開発や遺伝子治療は、将来の治療戦略として期待されています。
CACNA1A遺伝子の機能と働き
CACNA1A遺伝子がコードするP/Q型カルシウムチャネルは、神経シナプスにおいて特に重要な働きをしています。このチャネルは、活動電位が神経終末に到達すると開口し、カルシウムイオンの流入を促進します。この流入が神経伝達物質の放出を引き起こし、神経間の情報伝達が行われるのです。
また、CACNA1A遺伝子からは、完全長のカルシウムチャネルタンパク質だけでなく、CACNA1A C末端ポリペプチド(α-1ACT)も生成されます。このタンパク質は転写因子として機能し、小脳の発達に関わっています。これは内部リボソーム進入部位(IRES)の使用によって生成され、特に小脳の正常な発達において重要な役割を果たしていることが研究で明らかになっています。
カルシウムチャネルの分類と主な機能:
- L型:筋収縮、ホルモン分泌、遺伝子発現
- N型:神経伝達物質の放出
- P/Q型(CACNA1A):シナプス伝達、小脳機能
- T型:神経細胞の興奮性調節
- R型:様々な神経機能
CACNA1A遺伝子の機能異常は、カルシウムシグナリングの乱れを引き起こし、神経細胞の興奮性に変化をもたらします。これが様々な神経疾患の基盤となるメカニズムと考えられています。
CACNA1A遺伝子関連疾患
CACNA1A遺伝子の変異は、いくつかの特徴的な神経疾患と関連しています。これらの疾患は「カルシウムチャネル病」とも呼ばれ、同一の遺伝子変異が様々な臨床症状を引き起こす「表現型の多様性」が特徴です。
1. 家族性片麻痺性片頭痛1型(FHM1)
家族性片麻痺性片頭痛1型(FHM1、OMIM: 141500)は、CACNA1A遺伝子のミスセンス変異によって引き起こされる常染色体優性遺伝疾患です。主な特徴として、片側の麻痺を伴う前兆(視覚障害、感覚障害など)と激しい頭痛発作が挙げられます。
FHM1の特徴的な症状:
- 片側の一時的な麻痺(通常30分から数時間持続)
- 視覚前兆(閃輝暗点など)
- 激しい頭痛(数時間から数日間持続)
- 嘔吐、光過敏、音過敏などを伴うことがある
- 軽度の頭部外傷後に症状が誘発されることがある
多くの場合、FHM1は小児期から青年期に発症し、家族内での浸透率は高いものの、発作の頻度や重症度には個人差があります。一部の患者さんでは、発作時に意識障害や昏睡を伴う重症例も報告されています。
2. 発作性失調症2型(EA2)
発作性失調症2型(EA2、OMIM: 108500)は、CACNA1A遺伝子の機能喪失型変異(ナンセンス変異、フレームシフト変異、スプライシング変異など)によって引き起こされる常染色体優性遺伝疾患です。主な特徴は、数時間から数日間持続する一過性の小脳性運動失調発作です。
EA2の特徴的な症状:
- 突然発症する一過性の失調(歩行障害、協調運動障害)
- 眼振(眼球の不随意運動)
- 構音障害(ろれつが回らない)
- めまい、吐き気、嘔吐
- 発作間欠期にも軽度の小脳症状が残存することがある
- アセタゾラミドによる治療が有効なことがある
EA2の発作は、ストレス、運動、アルコール摂取、カフェイン摂取などによって誘発されることがあります。患者さんの約半数では、加齢に伴い小脳萎縮が進行し、発作間欠期にも持続的な小脳症状が見られるようになります。
3. 脊髄小脳失調症6型(SCA6)
脊髄小脳失調症6型(SCA6、OMIM: 183086)は、CACNA1A遺伝子のエクソン47に存在するCAGリピートの異常伸長(通常21-30リピート)によって引き起こされる常染色体優性遺伝性疾患です。この疾患は、緩徐進行性の小脳性運動失調を主徴とします。
SCA6の特徴的な症状:
- 緩徐進行性の歩行失調
- 四肢の協調運動障害
- 構音障害
- 眼振
- 通常40-50歳代で発症
- MRIでの小脳萎縮
SCA6は比較的遅い発症年齢と緩やかな進行が特徴で、生命予後への影響は他のSCAタイプと比較して小さいとされています。しかし、症状の進行により日常生活動作に大きな支障をきたすことがあります。
4. 発達性てんかん性脳症42型(DEE42)
発達性てんかん性脳症42型(DEE42、OMIM: 617106)は、CACNA1A遺伝子の特定の変異によって引き起こされる重篤な神経発達障害です。新生児期や乳児期早期からのてんかん発作と発達遅滞が特徴です。
DEE42の特徴的な症状:
- 生後早期からの難治性てんかん発作
- 重度の発達遅滞
- 筋緊張低下または亢進
- 脳波異常
- 進行性の神経学的症状
DEE42は稀な疾患であり、現在も研究が進行中です。適切な診断と早期介入が重要とされています。
遺伝子型と表現型の関係
CACNA1A遺伝子関連疾患では、変異の種類と臨床症状(表現型)との間に一定の関連性が認められています。
CACNA1A遺伝子変異の種類と疾患の関係:
- ミスセンス変異:主にFHM1を引き起こす。特にチャネルポア領域やセンサー領域の変異が多い。
- ナンセンス変異・フレームシフト変異:主にEA2を引き起こす。タンパク質の切断や機能喪失をもたらす。
- CAGリピート伸長:SCA6を引き起こす。ポリグルタミンの蓄積による毒性作用が考えられている。
- 特定のミスセンス変異(S218Lなど):DEE42や重症型FHM1と関連する。
しかし、同じ変異であっても、個人間や家族間で症状の重症度や表現型に違いがあることも多く、他の遺伝的要因や環境要因の影響も考慮する必要があります。また、一部の患者さんでは、複数の症状(例:FHM1とSCA6の併発)がみられることもあります。
これらの複雑な遺伝子型-表現型相関は、CACNA1A遺伝子が神経系の発達と機能において多面的な役割を担っていることを示唆しています。
CACNA1A遺伝子検査の重要性
CACNA1A遺伝子検査は、関連する神経疾患の診断を確定するために重要な役割を果たします。特に、家族歴のある片頭痛、原因不明の運動失調症、発作性神経症状、乳幼児期発症のてんかんなどの症状がある場合に考慮されます。
遺伝子検査が有用な状況:
- 家族性片麻痺性片頭痛が疑われる場合
- 発作性または進行性の小脳症状がある場合
- 原因不明のてんかん(特に早発性)がある場合
- 家族内に複数の神経疾患患者がいる場合
- 治療法の選択や予後予測に役立てたい場合
当クリニックでは、CACNA1A遺伝子を含む様々な神経疾患関連遺伝子の検査を提供しています。特に、片頭痛NGSパネル、晩発性失調症NGSパネル、GABA代謝障害NGSパネル、神経伝達物質代謝障害NGSパネル、てんかん包括的NGSパネルなどにCACNA1A遺伝子が含まれています。
CACNA1A遺伝子検査が含まれる主な検査パネル:
- 片頭痛NGSパネル
- 晩発性失調症NGSパネル
- GABA代謝障害NGSパネル
- 神経伝達物質代謝障害NGSパネル
- てんかん包括的NGSパネル
- シングル遺伝子検査(CACNA1A単独検査)
遺伝子検査の結果は、疾患のメカニズム理解、治療方針の決定、家族計画、予防措置の実施などに役立ちます。また、家族の他のメンバーが同様の症状を発症するリスクの評価にも有用です。
遺伝学的検査の推奨事項と最新技術
神経発達障害や神経症状の診断において、遺伝学的検査は重要な役割を果たします。CACNA1A遺伝子関連疾患の診断も、適切な遺伝学的検査によって確定することができます。
各専門機関の遺伝学的検査に関する推奨事項:
- 米国医学遺伝学会(ACMG)は、発達遅延、知的障害、先天異常に対して、ゲノムまたはエクソーム解析を第一選択の検査とすることを推奨しています。
- 米国遺伝カウンセラー協会(NSGC)も、原因不明のてんかんを有するすべての患者に対して、ゲノムまたはエクソーム解析を第一選択検査とすることを推奨しており、このガイドラインは米国てんかん学会(AES)にも支持されています。
通常のエクソーム解析やゲノム解析で診断がつかなかった場合でも、最新の検査技術によって原因を特定できる可能性があります。特にCACNA1A遺伝子のようなスプライシングバリアントを持つ遺伝子の解析には、RNA解析が有効な場合があります。
最新技術:RNA統合シークエンス解析(RNA-ISE)検査
RNA統合シークエンス解析(RNA-ISE)検査は、通常のwhole exomeやwhole genome解析で診断がつかなかった方の約20%程度が、疾患原因を特定できるようになる革新的な技術です。この検査は、DNAレベルでは検出が難しいスプライシング異常や発現量の変化を検出できるため、CACNA1A遺伝子関連疾患を含む様々な遺伝性疾患の診断に役立ちます。
神経発達障害や神経症状が疑われる場合、まずは遺伝カウンセリングを受けて、適切な検査方法について相談することをお勧めします。CACNA1A遺伝子関連疾患が疑われる症状がある場合は、当クリニックの専門医にご相談ください。
CACNA1A遺伝子関連疾患の治療アプローチ
CACNA1A遺伝子関連疾患の治療は、現在のところ対症療法が中心となります。疾患特異的な治療法と一般的な支援策について解説します。
薬物療法
家族性片麻痺性片頭痛(FHM1):
- 発作予防:カルシウムチャネル遮断薬(ベラパミルなど)、トピラメート、ラモトリギンなど
- 急性期治療:NSAIDs、トリプタン系薬剤(一部患者に有効)
- 重症発作時:抗てんかん薬、ステロイド薬
発作性失調症(EA2):
- アセタゾラミド(発作頻度や重症度を減少させる効果がある)
- 4-アミノピリジン(カリウムチャネル遮断薬、発作予防に有効との報告がある)
- 抗てんかん薬(ラモトリギン、レベチラセタムなど)
脊髄小脳失調症6型(SCA6):
- 現時点で病気の進行を止める特異的治療はない
- アセタゾラミド(一部患者での症状改善報告あり)
- リハビリテーション(理学療法、作業療法、言語療法など)
発達性てんかん性脳症(DEE42):
- 抗てんかん薬(個別に有効性を評価)
- ケトン食療法(一部患者で有効との報告あり)
- 早期介入療法(理学療法、作業療法、言語療法など)
支援と管理
これらの疾患は慢性的な経過をたどることが多いため、適切な支援と管理が重要です:
- 定期的な神経学的評価と経過観察
- 症状に応じたリハビリテーション
- 日常生活の適応支援(補助具の使用など)
- 心理的サポート
- 発作誘発因子の回避(ストレス管理、適切な睡眠習慣など)
- 家族への教育と支援
CACNA1A関連疾患の管理において重要なポイント:
- 個々の症状に合わせた治療計画の立案
- 多職種による包括的アプローチ(神経内科医、小児神経科医、リハビリ専門家など)
- 定期的な評価と治療計画の見直し
- 発作誘発因子の特定と回避
- 生活の質(QOL)の維持・向上を目指した支援
将来的には、CACNA1A遺伝子の機能や変異の影響をより深く理解することで、より効果的な治療法や予防法の開発が期待されています。
CACNA1A遺伝子研究の最新動向
CACNA1A遺伝子に関する研究は現在も活発に行われており、病態メカニズムの解明や新たな治療法の開発が進められています。
動物モデルを用いた研究
マウスモデルを用いた研究では、CACNA1A遺伝子変異が神経細胞の機能や小脳の発達に与える影響が詳細に調べられています。特に、皮質拡延性抑制(CSD)という現象(片頭痛の前兆の原因と考えられている)との関連や、神経伝達物質放出の異常などが明らかになってきています。
遺伝子治療・薬物開発
カルシウムチャネルの機能を特異的に調節する薬剤の開発や、遺伝子治療の可能性についても研究が進んでいます。特に、SCA6に対するポリグルタミン凝集抑制剤や、FHM1に対する新規カルシウムチャネル調節薬などが注目されています。
精密医療への応用
患者さん個々のCACNA1A遺伝子変異タイプに基づいた治療選択(精密医療)も研究されています。例えば、特定の変異タイプに特化した薬剤の効果予測や、個別化された予防戦略の開発などが進められています。
今後の研究課題:
- 変異タイプと表現型の多様性を説明するメカニズムの解明
- カルシウムチャネル機能調節による神経保護効果の検証
- 遺伝子治療や RNA 治療法の開発
- バイオマーカーの同定と治療反応性の予測
- 他の遺伝子との相互作用の解明
これらの研究の進展により、将来的にはCACNA1A遺伝子関連疾患に対するより効果的な治療法や予防法が開発されることが期待されています。
まとめ
CACNA1A遺伝子は、様々な神経疾患(家族性片麻痺性片頭痛、発作性失調症、脊髄小脳失調症6型、発達性てんかん性脳症など)と関連しており、神経系の正常な機能において重要な役割を果たしています。
遺伝子検査は、これらの疾患の正確な診断、適切な治療選択、家族計画などにおいて重要な役割を果たします。また、研究の進展により、将来的にはより効果的な治療法や予防法の開発が期待されています。
片頭痛、運動失調、てんかんなどの症状がある方、特に家族歴がある場合は、CACNA1A遺伝子を含む遺伝子検査について医療機関にご相談ください。適切な診断と管理が、症状の軽減と生活の質の向上に役立つ可能性があります。
ミネルバクリニックでの遺伝子検査について:
ミネルバクリニックでは、臨床遺伝専門医が常駐し、様々な神経疾患に対する遺伝子検査を提供しています。CACNA1A遺伝子を含む検査パネルについてのご質問や相談は、お気軽にお問い合わせください。検査前後のサポートも充実しており、検査結果の解釈や今後の対応についても丁寧に説明いたします。