目次
マイクロサテライト STR short tandem repeat タンデムリピート 縦列反復配列
マイクロサテライトとは、特定のDNAモチーフ(長さ1~6塩基対以上)が通常5~50回繰り返されている反復性DNAを言います。マイクロサテライトは、DNAの他の領域に比べて変異率が高く、遺伝的多様性が高くなっています。マイクロサテライトは、法医学の遺伝学者や遺伝学の系譜学の分野ではSTR(short tandem repeat)ショートタンデムリピートと呼ばれます。
2つのヌクレオチドが繰り返されているものをジヌクレオチドリピートと呼びます。(例:ATATATAT…)。遺伝性非ポリポーシス大腸がんにおけるマイクロサテライトの不安定性は、最も一般的にこのような領域に影響を与えているものです。
3つのヌクレオチドが繰り返されている場合は、3塩基反復(例:ATCATCATC…)と呼ばれ、このような領域の異常は3塩基反復障害(トリプレットリピート病)を引き起こす可能性があります。
マイクロサテライトと、それよりも長いミニサテライトを合わせて、VNTR(variable number of tandem repeats)DNAと呼びます。サテライトという名称は、試験管内のゲノムDNAを遠心分離すると、バルクDNAの顕著な層とそれに付随する反復DNAの「サテライト」層が分離するという昔の観察結果から来ています。
サテライトDNAは、がん診断におけるDNAプロファイリング、血縁関係の分析(特に父子鑑定)、法医学上の身元確認などに広く利用されています。また、ある形質や疾患の原因となる遺伝子や変異を特定するための遺伝子連鎖解析にも使用されています。マイクロサテライトは、集団遺伝学において、亜種、グループ、個体間の血縁関係のレベルを測定するためにも使用されます。
マイクロサテライトの構造・位置・機能
マイクロサテライトとは、タンデムに繰り返される(隣接する)DNAモチーフの集合体で、その長さは1~6または最大10ヌクレオチド(より長いミニサテライトに対する正確な定義ははっきりしていません)であり、通常5~50回繰り返されます。
例えば、GCGCGCGCGCGCGCGCという配列は、2ヌクレオチドのマイクロサテライトであり、GTAGTAGTAGTAGTAGTAGTAGTAは3ヌクレオチドのマイクロサテライトです(Aはアデニン、Gはグアニン、Cはシトシン、Tはチミン)。4塩基と5塩基の繰り返し単位は、それぞれテトラヌクレオチドモチーフ、ペンタヌクレオチドモチーフと呼ばれています。
ほとんどの真核生物はマイクロサテライトを持っています。マイクロサテライトはゲノム全体に分布しています。ヒトゲノムには、5万~10万個のジヌクレオチドマイクロサテライトと、それよりも少ない数のトリ、テトラ、ペンタヌクレオチドマイクロサテライトがあります。
マイクロサテライトの位置は多くはヒトゲノムの非コード部分(タンパクをコードしていない部分)に位置し、タンパク質を生成しないが、制御領域やコード領域にも存在しています。
非コード領域に存在するマイクロサテライトは、特定の機能を持たないため、選択されないと考えられています。『この変異があると機能がよくなるので子孫に伝えよう』とか『この変異は耐えられないので重い病気になりその変異を持つ子孫はあまり増えないようになる』ということを選択されると言います。
そのため、マイクロサテライトは世代を超えて支障なく変異を蓄積することができ、指紋以上の正確さで個人の識別にDNAを利用できるという多様性を生むこととなります。このようなマイクロサテライトの変異は、特に脆弱性X症候群やハンチントン病などのトリプレットリピート病において、表現型の変化や疾患を引き起こす可能性があります。
染色体末端のテロメアは、老化に関与していると考えられており、脊椎動物ではTTAGGGという6塩基の繰り返しモチーフを持つ反復DNAで構成されています。これはミニサテライトと呼ばれています。
マイクロサテライトの突然変異のメカニズムと突然変異率
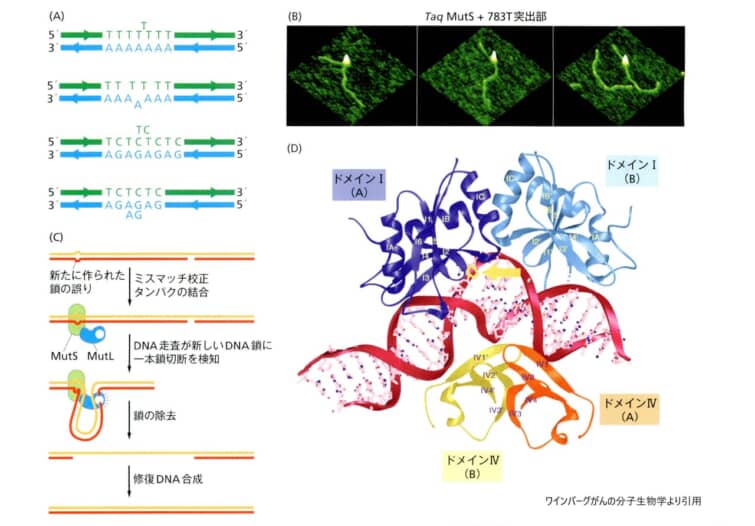
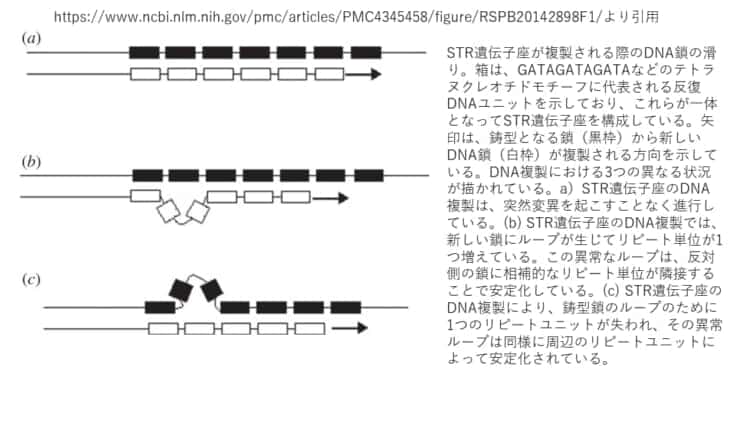
STR遺伝子座が複製される際のDNA鎖がずれたり滑ったりすることが原因と考えられています。
マイクロサテライトの突然変異は、1塩基のみに影響を与える点変異とは異なり、リピートユニット全体の獲得または喪失につながり、場合によっては2つ以上のリピートを同時に獲得することもあるなど多彩です。そのため、マイクロサテライト遺伝子座の突然変異率は、塩基置換率などの他の突然変異率とは異なることが予想されています。
マイクロサテライトの突然変異のメカニズム1.スリッページ
繰り返し配列の長さの変化の原因として提案されているのが、減数分裂の際に複製される際のDNA鎖間のミスマッチによる複製スリップです。複製の際にDNAを読む役割を果たす酵素であるDNAポリメラーゼは、鋳型となる鎖に沿って移動する際にスリップし、誤ったヌクレオチドで継続することがあり、このDNAポリメラーゼのスリップは、繰り返し配列が複製されるときに起こりやすいといわれています。マイクロサテライトはこのような反復配列で構成されているため、DNAポリメラーゼはこれらの配列領域でより高い確率でエラーを起こす可能性がある、とうことなのです。いくつかの研究では、マイクロサテライトの突然変異の原因がスリッページであることを示す証拠が見つかっています(文献)。
マイクロサテライトの突然変異のメカニズム2.誤ったヌクレオチドの挿入
次に、マイクロサテライトの突然変異の原因として、複製時に1つのヌクレオチドだけが誤ってコピーされる点突然変異が考えられます。ヒトとほかの霊長類のゲノムを比較した研究では、短いマイクロサテライトのリピート数の変化のほとんどが、スリップではなく点変異によるものであることが報告されています(文献)。
マイクロサテライトの突然変異率
マイクロサテライトの変異率は、マイクロサテライトに対する塩基の位置、リピートタイプ、塩基の同一性によって変化します。 変異率はリピート数に応じて特異的に上昇し、リピート数が6~8回の頃にピークを迎え、その後再び減少します。これは、腕の長さが不揃いの相同染色体が減数分裂の際に不安定になるのと似ています。
マイクロサテライトの突然変異率の直接的な推定は、昆虫から人間まで、多くの生物で行われている。ヒトの男性生殖細胞におけるマイクロサテライトの突然変異率は、女性生殖細胞に比べて5~6倍高く、1世代あたりの配偶子の1遺伝子座あたり0~7×10-3とされています。テトラヌクレオチドSTRPの平均突然変異率は、ジヌクレオチドSTRPの平均突然変異率の約4倍、男性の方が女性の生殖細胞よりより変異を起こしやすいと報告されています(文献)。
マイクロサテライト変異が個体に生物学的に及ぼす影響
多くのマイクロサテライトはノンコーディングDNAに位置し、生物学的には機能しないと考えられています。一部のマイクロサテライトは、制御DNAやコーディングDNAにも位置しており、そのような場合のマイクロサテライトの変異は、表現型の変化や病気を引き起こす可能性があります。ゲノム全体を対象とした研究では、マイクロサテライトの変異は、ヒトにおける遺伝性遺伝子発現変動の10~15%に寄与すると推定されています。
マイクロサテライト変異がタンパクに与える影響
哺乳類では、タンパク質の20%から40%が、短い反復配列によってコードされるアミノ酸の繰り返し配列を含んでいます。ゲノムのタンパク質をコードする部分に含まれる短鎖状反復配列の多くは、その長さが変異してもフレームシフトを起こさないことから、3ヌクレオチドの繰り返し単位を持っています。各3ヌクレオチドの繰り返し配列は、同じアミノ酸の繰り返し配列に転写されます。酵母では、グルタミン、グルタミン酸、アスパラギン、アスパラギン酸、セリンが最もよく繰り返されるアミノ酸です。
これらの繰り返し配列の変異は、タンパク質の物理的・化学的特性に影響を与え、タンパク質の作用に段階的かつ予測可能な変化をもたらす可能性があります。 HoxA13遺伝子のポリアラニン配列の長さの変化は、ヒトの発達障害であるHand-Foot-Genital Syndromeと関連しています。他のトリプレットリピートの長さの変化は、ヒトの40以上の神経疾患と関連しており、特に脆弱X症候群やハンチントン病などのトリプレットリピート病と関連しています。
マイクロサテライト変異が遺伝子制御に与える影響
プロモーターなどのシス制御領域に存在するマイクロサテライトの長さが変化すると、遺伝子の発現が世代を超えて速やかに変化することが知られています。ヒトゲノムには16,000を超える多くの短い配列の繰り返しが調節領域に含まれていて、これが多くの遺伝子の発現の「調整ツマミ」となっています。
ヒトゲノムのシス制御領域では、二塩基性マイクロサテライトが豊富なバリエーションにつながっています。
ユーイング肉腫(若年者に発生する痛みを伴う骨癌の一種)では、点変異により拡張したGGAAマイクロサテライトが転写因子と結合し、癌の原因となるEGR2遺伝子を活性化しています。
マイクロサテライト変異がイントロン内に及ぼす影響
イントロン内のマイクロサテライトもまた、表現型に影響を与えるのですがその機序はまだ解明されていません。
例えば、X25遺伝子の第1イントロンに存在するGAAトリプレットは、転写を阻害すると考えられ、フリードライヒ失調症の原因となります。EGFR遺伝子のリピート長の減少が骨肉腫と関連しています。
マイクロサテライト変異がトランスポゾン内に及ぼす影響
ヒトゲノムの約50%は様々な種類のトランスポゾン(または「ジャンピング・ジーン」とも呼ばれる)であり、その多くは繰り返しDNAを含んでいます。それらの場所にある短い配列の繰り返しも、遺伝子発現の制御に関与している可能性が高いと考えられる。
マイクロサテライトの応用
STR分析とは、核DNAに存在する特定のSTR領域を評価する法医学的分析手法です。ショートタンデムリピート(STR)分析は、2つ以上のサンプル間でDNAの特定の遺伝子座における対立遺伝子の繰り返しを比較するために用いられる一般的な分子生物学的手法です、この方法は、制限酵素でDNAを切断しないため、制限断片長多型分析(RFLP)とは異なります。その代わり、ポリメラーゼ連鎖反応(PCR)を用いて、PCR産物の長さから短いタンデムリピートの長さを検出します。
マイクロサテライトは、がん診断における染色体DNAの欠失の評価に用いられます。また、マイクロサテライトは,法医学における犯罪の痕跡や、移植患者の組織のDNAプロファイリングに広く利用されていて、「遺伝子指紋」としても知られているものです。また、血縁関係の分析(一般的には父子鑑定)にも広く使われています。
さらにマイクロサテライトは、ゲノム内の位置をマッピングするために使用されており、特に遺伝的連鎖分析では、特定の形質や疾患の原因となる遺伝子や変異を特定するために使用されています。マッピングの特殊なケースとして、遺伝子の重複や欠失の研究にも使用される。
癌の診断
複製の制御が損なわれた腫瘍細胞では、分裂のたびにマイクロサテライトが特に高い頻度で獲得または喪失する可能性があります。そのため、腫瘍細胞株は宿主組織のものとは異なる遺伝子指紋を示す可能性があり、特に大腸がんではヘテロ接合性の喪失が見られることがあります。マイクロサテライトはがんの診断において腫瘍の進行を評価するために日常的に使用されています。
法医学的用途
法医学検査で分析されるSTR領域の多形性は、1つのDNAプロファイルと他のDNAプロファイルの識別を強化します。FBIが承認したSTRmixなどの科学的ツールには、この研究技術が組み込まれています。現在使用されているDNAプロファイリングのシステムはPCRに基づいており、STR(short tandem repeats)を使用しています。この方法では、DNAの短い繰り返し配列(最も多いのは4塩基の繰り返しですが、3塩基や5塩基など他の長さのものも使用されています)を持つ多形性の高い領域を使用します。血縁関係のない人は、ほぼ確実に繰り返し単位の数が異なるので、STRを用いて血縁関係のない人を識別することができます。これらのSTR遺伝子座(染色体上の位置)は、配列特異的なプライマーで標的化され、PCRで増幅されます。その後、増幅されたDNA断片を電気泳動で分離・検出する。
各STRは多形性を持つのですが、対立遺伝子の数は非常に少なくなっています。通常、各STR対立遺伝子は、約5~20%の人で同じなのですがSTR分析の威力は、複数のSTR遺伝子座を同時に調べることで発揮されます。対立遺伝子のパターンは、個人を極めて正確に特定することができます。このように、STR分析は優れた識別ツールとなります。個人の検査対象となるSTR領域が多ければ多いほど、検査の識別性は高まります。
国ごとに、異なるSTRベースのDNAプロファイリング・システムが使用されています。
北米では、CODIS 13コア遺伝子座を増幅するシステムがほぼ共通して使用されていますが、英国では、DNA-17 17遺伝子座システム(The National DNA Databaseと互換性があります)が使用されています。いずれのシステムであっても、使用されるSTR領域の多くは同じである。これらのDNAプロファイリングシステムは、マルチプレックス反応に基づいており、多くのSTR領域が同時に検査されます。
STR分析の真の力は、その統計的な識別力にあります。現在、CODISで判別に使用されている13の遺伝子座は独立しているので(ある遺伝子座にある数の繰り返しがあっても、他の遺伝子座にある数の繰り返しがある可能性は変わらない)、確率の積の法則を適用することができます。つまり、10個の遺伝子座が独立しているABCDEFGHIJというDNA型を持つ人がいれば、そのDNA型を持つ確率は、A型からJ型までを持つ確率を掛け合わせた確率となります。
実際には、近くにある物体からのサンプルの汚染や、以前の検査で転送された残りの細胞からの汚染など、汚染されたマッチングのリスクは、遠い親戚とのマッチングよりもはるかに大きい。サンプルの中で最も一般的な人物と一致する場合、そのリスクは大きくなります。被害者から採取したもの、あるいは被害者と接触したものはすべて、実験室に持ち込まれた他のサンプルの主要な汚染源となります。そのため、実際の検査サンプルと同じ期間に採取された複数の対照サンプルを検査して、サンプルが汚染されていないことを確認するのが一般的です。複数のコントロールサンプルで予期せぬ一致(または変化)が見られた場合、実際のテストサンプルが汚染されている可能性が高いことを示します。