目次
この記事では、タンパク質のフォールディングに関する科学的な基礎知識から、その生物学的な重要性、疾患との関連、最新の研究動向までを解説します。タンパク質が正しく折りたたまれるプロセスと、そのプロセスが乱れた際の生物体への影響について詳しく探ります。
第1章: タンパク質フォールディングの基礎
タンパク質フォールディングとは何か
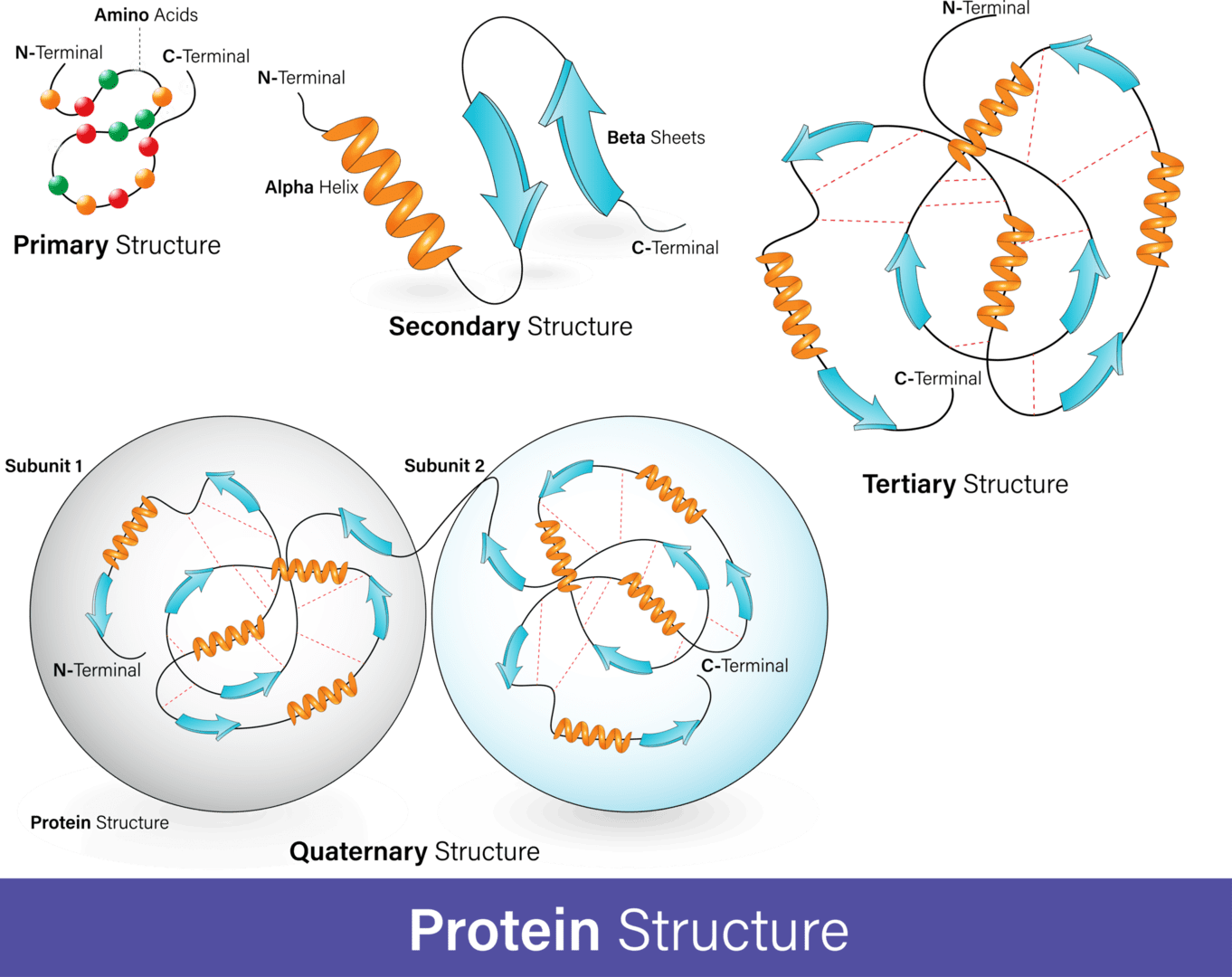
タンパク質フォールディングは、直鎖状のポリペプチド鎖が特定の三次元構造に自己組織化するプロセスです。このプロセスは、タンパク質がその生物学的機能を果たすために不可欠です。タンパク質の機能はその立体構造に依存しており、フォールディングが不適切に行われると、タンパク質は機能しないか、病気を引き起こす可能性があります。
● タンパク質フォールディングのプロセス
タンパク質フォールディングのプロセスは、アミノ酸の直鎖が特定の立体構造に折りたたまれる物理的な過程です。このプロセスは、ポリペプチド鎖がリボソームで合成される過程で始まります。アミノ酸は互いに相互作用し、明確に定義された三次元構造、つまり天然状態として知られる折りたたまれたタンパク質を生成します。この結果として生じる三次元構造は、アミノ酸配列、または一次構造によって決定されます[11]。
● 生物学的な意義
タンパク質フォールディングは、タンパク質がその生物学的機能を果たすために必要なプロセスです。タンパク質は、酵素としての触媒作用、細胞内外の物質輸送、細胞の構造と動きの調節、シグナル伝達など、生命活動において多岐にわたる役割を担っています。これらの機能は、タンパク質が特定の立体構造を持つことによってのみ達成されます。不適切なフォールディングは、タンパク質の機能不全や疾患の原因となることがあります。例えば、アルツハイマー病やパーキンソン病などの神経変性疾患は、タンパク質のミスフォールディングと凝集に関連しています[11][19]。
● 分子シャペロンの役割
細胞内では、分子シャペロンと呼ばれる特殊なタンパク質がフォールディングプロセスを補助します。これらのシャペロンは、新しく合成されたポリペプチド鎖が適切に折りたたまれるのを助けることで、ミスフォールディングや凝集を防ぎます。分子シャペロンは、タンパク質がその正しい立体構造を獲得し、生物学的機能を果たすことができるようにするために重要な役割を果たします[1][5]。
● 結論
タンパク質フォールディングは、生命現象を理解する上で中心的なプロセスです。このプロセスは、タンパク質がその多様な機能を果たすために必要な特定の三次元構造を獲得するために不可欠です。分子シャペロンのようなシステムがフォールディングプロセスを支援し、タンパク質の正しい機能を保証することで、細胞の健康と生物の生存が維持されます。
- 参考文献・出典
-
[1] www.biophys.jp/highschool/A-09.html
[5] www.taguchi.bio.titech.ac.jp/research/chaperone/
[11] www.weblio.jp/content/%E3%82%BF%E3%83%B3%E3%83%91%E3%82%AF%E8%B3%AA%E3%83%95%E3%82%A9%E3%83%BC%E3%83%AB%E3%83%87%E3%82%A3%E3%83%B3%E3%82%B0
[19] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2015.870194/index.html
フォールディングの生化学的プロセス
タンパク質のフォールディングは、その機能を果たすために必要不可欠な生化学的プロセスです。このプロセスは、アミノ酸が連なったポリペプチド鎖が特定の三次元構造、すなわち天然構造に折りたたまれる過程を指します。タンパク質のフォールディングは、生命活動において中心的な役割を果たし、そのメカニズムの解明は生化学および分子生物学の重要な課題の一つです。
● フォールディングの基本的なプロセス
タンパク質のフォールディングプロセスは、以下のステップで概説されます:
1. 初期構造の形成:ポリペプチド鎖がリボソームで合成されると、初期的な構造が形成されます。この段階では、ポリペプチド鎖はまだ完全には折りたたまれておらず、部分的に折りたたまれた状態やランダムコイル状態にあります。
2. 中間体の形成:初期構造から、より安定した中間体が形成されます。この過程では、疎水性相互作用や水素結合などの非共有結合力が重要な役割を果たします。中間体は、最終的な天然構造への折りたたみの途中段階として機能します。
3. 天然構造への折りたたみ:中間体から、最終的な天然構造へと折りたたまれます。この段階で、タンパク質はその生物学的機能を果たすために必要な特定の三次元構造を獲得します。このプロセスは、アミノ酸配列によって決定されるとされています(アンフィンセンのドグマ)。
● フォールディングを助ける分子
タンパク質のフォールディングは、細胞内で自発的に起こるプロセスですが、分子シャペロンなどの補助分子がこのプロセスを助けることが知られています。分子シャペロンは、タンパク質が正しい構造に折りたたまれるのを助けるタンパク質ファミリーであり、フォールディング途中の不安定な中間体や熱で変性したタンパク質が凝集にならないように働きます[2]。
● フォールディングの研究の重要性
タンパク質のフォールディングの研究は、構造異常タンパク質が引き起こすパーキンソン病やアルツハイマー病、ヤコブ病、筋萎縮性側索硬化症(ALS)、2型糖尿病などのミスフォールディング病の理解と治療薬の開発につながる重要な知見を提供します[4][5]。また、タンパク質フォールディングの促進分子の開発は、インスリンや抗体医薬品などのタンパク質製剤の合成効率向上にも貢献すると期待されています[4][5]。
このように、タンパク質のフォールディングプロセスは、生命現象を理解する上で基礎的かつ重要なプロセスであり、その詳細なメカニズムの解明は、生命科学のみならず医学や薬学においても大きな意義を持ちます。
第2章: タンパク質フォールディングの生理的役割
細胞内でのフォールディングの役割
♦ 細胞内でのタンパク質フォールディングの生理的役割
タンパク質フォールディングは、細胞内でのタンパク質の機能発現に不可欠なプロセスです。タンパク質は、リボソームで合成された後、特定の三次元構造に折りたたまれる必要があります。この三次元構造がタンパク質の機能を決定し、細胞内での多様な生理的役割を果たすことを可能にします。
● 機能的な立体構造の獲得
タンパク質は、アミノ酸の直鎖ポリペプチドとして合成されますが、この状態では機能を持ちません。フォールディングによって、タンパク質は疎水性相互作用、水素結合、イオン結合、およびジスルフィド結合などの非共有結合的な相互作用を介して、特定の立体構造に折りたたまれます[5]。このプロセスを通じて、タンパク質はその機能を発揮するための正しい立体構造、すなわちネイティブ状態を獲得します。
● 生化学的反応の触媒
多くのタンパク質は酵素として機能し、生化学的反応を触媒します。酵素の活性部位は、フォールディングによって正確に形成され、基質特異性と反応速度を決定します。フォールディングが不適切な場合、酵素はその触媒機能を果たせなくなります[5]。
● 細胞内シグナリングと運搬
タンパク質は細胞内シグナリングにおいて重要な役割を果たします。受容体タンパク質は、外部のシグナルを受け取り、細胞内の応答を引き起こすために正確なフォールディングが必要です。また、タンパク質は分子を細胞内外に運搬するための輸送体としても機能し、これも適切なフォールディングに依存します[5]。
● 細胞の構造と機械的サポート
構造タンパク質は細胞の形状と整合性を維持するために必要です。これらのタンパク質は、細胞骨格や細胞外マトリックスの構成要素として機能し、適切なフォールディングによってのみその役割を果たすことができます[5]。
● 細胞内品質管理とミスフォールディングの防止
細胞内では、分子シャペロンと呼ばれるタンパク質がフォールディングを補助し、ミスフォールディングや凝集を防ぎます。これにより、タンパク質が正しいフォールディングに導かれ、機能不全や病気の原因となる異常なタンパク質の蓄積を防ぐことができます[4][10][12][14][20]。
● 疾患の予防と治療
ミスフォールディングしたタンパク質は、神経変性疾患や糖尿病などの疾患の原因となることがあります。フォールディングの過程を理解することは、これらの疾患の予防と治療につながる可能性があります[1][2][6][7][8][11][13][15][16][17][18][19]。
細胞内でのタンパク質フォールディングは、生命活動を支える基本的なプロセスであり、その正確な制御は細胞の健康と生存にとって極めて重要です。フォールディングの研究は、基礎生物学だけでなく、医学やバイオテクノロジーにおいても重要な意味を持ちます。
- 参考文献・出典
-
[1] www.tohoku.ac.jp/japanese/newimg/pressimg/tohokuuniv_press20210402_02web_protein.pdf
[2] www.jst.go.jp/pr/announce/20230630/pdf/20230630.pdf
[3] www.titech.ac.jp/public-relations/research/stories/faces10-taguchi
[4] www.biophys.jp/highschool/A-09.html
[5] www10.showa-u.ac.jp/~biolchem/H21-P2protein.pdf
[6] www.tohoku.ac.jp/japanese/newimg/pressimg/tohokuuniv_press0129_01web_protein.pdf
[7] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2015.870194/data/index.html
[8] www.bri.niigata-u.ac.jp/research/column/001704.html
[10] www.titech.ac.jp/news/2012/025586
[11] www.f.waseda.jp/wako/introduction/Abe-Wako/01_%E7%AC%AC1%E7%AB%A0_%E3%82%BF%E3%83%B3%E3%83%91%E3%82%AF%E8%B3%AA%E5%88%86%E5%AD%90%E3%81%AE%E7%A0%94%E7%A9%B6%E3%81%AF%E4%BD%95%E6%95%85%E9%87%8D%E8%A6%81%E3%81%AA%E3%81%AE%E3%81%8B%EF%BC%9F.pdf
[12] yone.repo.nii.ac.jp/record/556/files/P29-34_%E6%88%90%E7%94%B0%E6%96%B0%E4%B8%80%E9%83%8E.pdf
[13] www.jst.go.jp/kisoken/presto/complete/soshiki/theme/first_r/01akiyoshi/link01.htm
[14] www.jstage.jst.go.jp/article/biophys/46/3/46_3_144/_pdf
[15] www.etprotein.com/ja/%E3%83%8D%E3%82%A4%E3%83%86%E3%82%A3%E3%83%96%E3%82%BF%E3%83%B3%E3%83%91%E3%82%AF%E8%B3%AA%E3%81%AE%E9%87%8D%E8%A6%81%E6%80%A7%E3%82%92%E7%90%86%E8%A7%A3%E3%81%99%E3%82%8B/
[16] www.jstage.jst.go.jp/article/fpj/121/1/121_1_27/_pdf
[17] www.kyoto-u.ac.jp/ja/archive/prev/news_data/h/h1/2008/news6/080725_1
[18] kaken.nii.ac.jp/ja/grant/KAKENHI-PROJECT-05044131/
[19] www.jstage.jst.go.jp/article/kagakutoseibutsu1962/43/9/43_9_600/_pdf
[20] takayanagi.clinic/out-enter/theory02/
タンパク質のミスフォールディングと細胞応答
タンパク質のミスフォールディングは、細胞内で正しい立体構造を獲得できない状態を指します。この状態は、遺伝的変異や細胞にかかるストレスなどによって引き起こされることがあります。ミスフォールディングしたタンパク質は、細胞内で凝集体やアミロイド線維を形成しやすく、細胞の生存に危機をもたらす可能性があります[9]。
● 細胞の応答メカニズム
細胞はミスフォールディングしたタンパク質に対して複数の応答メカニズムを持っています。これらのメカニズムは、細胞内の品質管理システムとして機能し、細胞の生存と機能の維持に寄与しています。
1. 分子シャペロンの誘導: 分子シャペロンは、タンパク質の正しいフォールディングを助けるタンパク質であり、ミスフォールディングしたタンパク質の修復を試みます[9]。
2. 小胞体関連分解 (ERAD): ミスフォールディングしたタンパク質が小胞体で認識され、分解されるプロセスです。ERdj5という還元酵素が、ミスフォールディングしたタンパク質のジスルフィド結合を還元し、分解を促進します[9]。
3. オートファジー: 細胞内の凝集体や不要なオルガネラをリソソームで分解するプロセスです。
4. アポトーシス: 細胞死の一形態であり、修復不能なタンパク質の凝集が細胞の生存に重大な脅威をもたらす場合に起こります。
● 病理学的な影響
ミスフォールディングしたタンパク質の蓄積は、多くの神経変性疾患の原因となります。これらの疾患は、タンパク質が凝集し、アミロイド線維を形成するという共通の病態機序を示します[6]。
– アルツハイマー病: Aβプラークの形成と神経原線維変化が特徴です[8]。
– パーキンソン病: α-シヌクレインのミスフォールディングとレビー小体の形成が関与します[5]。
– ハンチントン病: ポリグルタミンを含むタンパク質の凝集が特徴です[8]。
– 筋萎縮性側索硬化症 (ALS): TDP-43やSOD1のミスフォールディングが関与すると考えられています[8][11]。
これらの疾患では、ミスフォールディングしたタンパク質が細胞内外に蓄積し、細胞死や臓器障害を引き起こすことが病態の本質です。細胞の品質管理システムが破綻すると、これらの疾患が発症すると考えられています[8][9]。
● 研究の進展
最近の研究では、タンパク質フォールディングの速度論的制御分子の開発が進んでおり、ミスフォールディング病の予防と治療に有効である可能性が示されています[7]。また、細胞はプロテオスタシス容量を遺伝子発現により調節する仕組みを備えており、これによってミスフォールディングタンパク質に対処できるようになっています[12]。
ミスフォールディングしたタンパク質に対する細胞の応答と病理学的な影響についての理解は、神経変性疾患の治療戦略の開発において重要な役割を果たしています。
- 参考文献・出典
-
[5] www.abcam.co.jp/neuroscience/parkinsons-disease-an-overview-1
[6] www.bri.niigata-u.ac.jp/research/column/001704.html
[7] www.tohoku.ac.jp/japanese/2024/01/press20240129-01-protein.html
[8] www.jstage.jst.go.jp/article/shinshumedj/56/3/56_3_115/_pdf
[9] www.kyoto-u.ac.jp/ja/archive/prev/news_data/h/h1/2008/news6/080725_1
[10] www.youtube.com/watch?v=o_ot8o9UhE0
[11] www.jstage.jst.go.jp/article/biophys/60/6/60_338/_pdf
[12] ds22.cc.yamaguchi-u.ac.jp/~seika2/Takii%202019%20EMBO%20J/Study%20detail.html
[13] www.cosmobio.co.jp/aaas_signal/archive/pp_20040629.asp
第3章: タンパク質フォールディング病
タンパク質フォールディング異常による疾患
タンパク質フォールディング異常による疾患は、タンパク質が正しく折りたたまれないことによって生じる一連の病態を指します。これらの疾患は、タンパク質のミスフォールディング、凝集、および細胞内外での不適切な蓄積によって特徴づけられます。以下に、これらの疾患の種類とそのメカニズムを紹介します。
♦ 神経変性疾患
● アルツハイマー病
アルツハイマー病は、β-アミロイドペプチドの異常な蓄積によって引き起こされる最も一般的な神経変性疾患の一つです。これらのペプチドは、脳内でプラークを形成し、神経細胞の機能障害や死を引き起こします[3][4]。
● パーキンソン病
パーキンソン病では、α-シヌクレインというタンパク質が不適切に折りたたまれ、神経細胞内にレビー小体と呼ばれる凝集体を形成します。これが神経細胞の損傷や死につながり、運動機能の障害を引き起こします[4]。
● ハンチントン病
ハンチントン病は、ハンチントンタンパク質内のポリグルタミン鎖の異常伸長によって特徴づけられます。この異常伸長により、タンパク質が不適切に折りたたまれ、神経細胞内に凝集体を形成し、神経細胞の機能障害や死を引き起こします[6]。
♦ 代謝性疾患
● 2型糖尿病
2型糖尿病では、インスリン分泌細胞内でのアミロイドポリペプチドのミスフォールディングと凝集が見られます。これにより、インスリン分泌細胞の機能障害が引き起こされ、インスリンの分泌不足につながります[8]。
♦ アミロイドーシス
アミロイドーシスは、様々なタンパク質が異常に折りたたまれ、不溶性の線維を形成し、体内の多様な組織や臓器に沈着する疾患群です。これにより、組織の機能障害や器官の障害が引き起こされます。例えば、家族性アミロイドポリニューロパチーは、トランスサイレチンタンパク質のミスフォールディングによって引き起こされます[13]。
これらの疾患は、タンパク質のミスフォールディングが共通の原因となっていますが、影響を受けるタンパク質や組織、臓器が異なるため、症状や治療法もそれぞれ異なります。タンパク質の正しい折りたたみを促進することや、ミスフォールディングタンパク質の凝集や蓄積を防ぐことが、これらの疾患の治療戦略の重要な方向性となっています。
- 参考文献・出典
-
[3] www.amed.go.jp/news/release_20190613-02.html
[4] www.jstage.jst.go.jp/article/shinshumedj/56/3/56_3_115/_pdf
[5] kaken.nii.ac.jp/ja/grant/KAKENHI-PROJECT-16659076/
[6] www.jst.go.jp/pr/info/info340/
[7] www.msdmanuals.com/ja-jp/%E3%83%97%E3%83%AD%E3%83%95%E3%82%A7%E3%83%83%E3%82%B7%E3%83%A7%E3%83%8A%E3%83%AB/10-%E5%86%85%E5%88%86%E6%B3%8C%E7%96%BE%E6%82%A3%E3%81%A8%E4%BB%A3%E8%AC%9D%E6%80%A7%E7%96%BE%E6%82%A3/%E3%82%A2%E3%83%9F%E3%83%AD%E3%82%A4%E3%83%89%E3%83%BC%E3%82%B7%E3%82%B9/%E3%82%A2%E3%83%9F%E3%83%AD%E3%82%A4%E3%83%89%E3%83%BC%E3%82%B7%E3%82%B9
[8] www.tohoku.ac.jp/japanese/2024/01/press20240129-01-protein.html
[9] www.bri.niigata-u.ac.jp/research/column/001704.html
[10] www.kyoto-u.ac.jp/ja/archive/prev/news_data/h/h1/2008/news6/080725_1
[11] www.igakuken.or.jp/public/seminar/h28/semi0130.html
[12] www.jst.go.jp/pr/announce/20170505/index.html
[13] hattramyloidosis.jp/disease-background/amyloidosis/what-is-amyloidosis
代表的なフォールディング病の事例
タンパク質フォールディング異常が関与する疾患は、タンパク質が正しく折り畳まれないことによって生じる病態であり、これらは一般に「プロテインミスフォールディング病」と呼ばれます。以下に、その代表的な疾患について解説します。
● アルツハイマー病
アルツハイマー病は、記憶や思考能力が徐々に損なわれる進行性の脳疾患で、認知症の原因として最も多い疾患です。この病気の特徴的な病理学的変化は、脳内にアミロイドβと呼ばれるタンパク質の沈着(老人斑)と、タウタンパク質の異常なリン酸化による神経原線維変化です。これらのタンパク質の異常な蓄積は、神経細胞の機能障害や細胞死を引き起こし、最終的には認知機能の低下につながります[5][7][13][15].
● パーキンソン病
パーキンソン病は、運動機能に障害をきたす神経変性疾患で、特に中脳の黒質にあるドーパミン神経細胞の減少が特徴です。この病気の病理学的特徴は、α-シヌクレインというタンパク質が異常に凝集してレビー小体と呼ばれる封入体を形成することです。α-シヌクレインのミスフォールディングと凝集は、神経細胞の機能障害や細胞死を引き起こし、パーキンソン病の症状を引き起こします[1][4][6][8].
● ハンチントン病
ハンチントン病は、遺伝性の神経変性疾患で、特定のタンパク質であるハンチンチンに異常なポリグルタミン鎖が伸長することによって発症します。この変異タンパク質はミスフォールディングを起こし、神経細胞内に凝集体を形成します。これにより、神経細胞が損傷し、運動、認知、情緒の障害が進行します[6][10][11].
● 筋萎縮性側索硬化症(ALS)
筋萎縮性側索硬化症(ALS)は、運動神経細胞が徐々に機能を失い、筋肉の萎縮と硬化を引き起こす疾患です。この病気では、TDP-43やSOD1などのタンパク質がミスフォールディングを起こし、神経細胞内で凝集します。これにより、神経細胞が死滅し、筋力の低下や筋肉の萎縮が進行します[6][11].
これらの疾患に共通するのは、タンパク質のミスフォールディングと凝集が神経細胞の機能障害や細胞死を引き起こすという点です。現在、これらの疾患の治療法の開発に向けて、ミスフォールディング蛋白質の凝集を防ぐ化合物や、ミスフォールディング蛋白質を正しい立体構造に戻す化合物、ミスフォールディング蛋白質を分解する化合物など、様々なアプローチが研究されています[9][13][14].
- 参考文献・出典
-
[1] www.riken.jp/medialibrary/riken/pr/press/2002/20020719_1/20020719_1.pdf
[2] www.pharm.kumamoto-u.ac.jp/monogatari/research/research03.html
[3] www.mitsui.com/mgssi/ja/report/detail/__icsFiles/afieldfile/2020/11/10/2011pm_abe.pdf
[4] www.qst.go.jp/site/press/30700.html
[5] kaken.nii.ac.jp/ja/grant/KAKENHI-PROJECT-16659076/
[6] www.jstage.jst.go.jp/article/shinshumedj/56/3/56_3_115/_pdf
[7] www.bri.niigata-u.ac.jp/research/column/001704.html
[8] www.jst.go.jp/pr/info/info340/
[9] www.jst.go.jp/pr/announce/20230630/index.html
[10] www.igakuken.or.jp/public/seminar/h28/semi0130.html
[11] katosei.jsbba.or.jp/view_html.php?aid=1164
[12] www.pref.toyama.jp/120101/kurashi/kyouiku/kosodate/shusanki/topics-column/nicu.html
[13] bio.nikkeibp.co.jp/atcl/report/16/011900001/19/02/07/00232/
[14] www.kyoto-u.ac.jp/ja/archive/prev/news_data/h/h1/2008/news6/080725_1
第4章: 研究と治療の進展
タンパク質フォールディングの研究最前線
タンパク質フォールディングの研究は、生命科学の基礎研究から医療応用に至るまで幅広い分野に影響を及ぼしています。最新の研究手法や進展について、特に新しい治療アプローチの開発に焦点を当てて紹介します。
● 新しい治療アプローチの開発
1. 分子シャペロンと酸化還元酵素の作用メカニズムの解明
タンパク質フォールディングの促進には、分子シャペロンや酸化還元酵素が重要な役割を果たしています。これらの作用メカニズムの解明は、ミスフォールディング病の理解と治療薬の開発につながる重要な知見を提供しています[6][8][10]。
2. 人工分子によるフォールディング促進
タンパク質フォールディングを効率的に進める人工ジスルフィド分子pMePySSの開発が成功しました。この分子は、酵素に準ずる機能を保有し、タンパク質の立体構造形成に重要なジスルフィド結合の形成を促進します。添加量も、タンパク質のジスルフィド結合に対して、理論上要する最小量で十分な効果を発揮することが確認されています[12][13][20]。
3. ミスフォールディング病の治療戦略
構造異常タンパク質が引き起こすミスフォールディング病に対する治療戦略として、蛋白質のネイティブ構造を安定化させる低分子化合物の開発が進められています。これにより、タンパク質ミスフォールディング病を治療する全く新しい薬物治療が開発中です[17]。
4. 物理学理論によるタンパク質フォールディングの予測
タンパク質が特定の構造を作る仕組みを正確に予測する物理学理論の開発が成功しました。この理論は、タンパク質が特定の形へと折りたたまれていく経路を示す「地図」を効率的に描くことができ、医療用・産業用タンパク質の新規設計に利用可能です[16][18]。
● 研究手法の進展
1. 分子イメージング技術
シャペロニン1分子内で起こるタンパク質のフォールディングを可視化する研究が行われています。この技術は、タンパク質のフォールディング過程を1分子レベルで研究することにより、シャペロン研究に新たな方法論を導入しています[2]。
2. 統計物理学の理論
タンパク質フォールディングの理論モデルであるWako–Saitô–Muñoz–Eaton(WSME)モデルが提唱され、タンパク質が最終的に作る形を指定し、自由エネルギー地形を描くことができます。このモデルは、小型のタンパク質の構造しか予測できなかったが、新たなWSME-Lモデルの構築により、大型タンパク質の自由エネルギー地形の予測に成功しています[16]。
これらの進展は、タンパク質フォールディングの基礎理解を深めるだけでなく、医薬品開発や産業応用においても重要な影響を与えています。特に、新しい治療アプローチの開発は、ミスフォールディング病の予防と治療に大きな希望をもたらしています。
- 参考文献・出典
-
[2] www.biophys.jp/highschool/A-09.html
[3] www.titech.ac.jp/public-relations/research/stories/faces10-taguchi
[4] www.ims.u-tokyo.ac.jp/imsut/jp/about/press/page_00253.html
[5] spc.jst.go.jp/hottopics/1006genome_biofunctional_analysis/r1006_shimizu.html
[6] www.tuat.ac.jp/outline/disclosure/pressrelease/2023/20240129_02.html
[7] www.jstage.jst.go.jp/article/kagakutoseibutsu1962/36/5/36_5_290/_pdf/-char/ja
[8] www.tohoku.ac.jp/japanese/2024/01/press20240129-01-protein.html
[9] www.kyoto-su.ac.jp/protein/about.html
[10] www.tohoku.ac.jp/japanese/newimg/pressimg/tohokuuniv_press0129_01web_protein.pdf
[11] www.nitech.ac.jp/news/press/2023/10653.html
[12] www.tuat.ac.jp/outline/disclosure/pressrelease/2023/20230630_02.html
[13] www.tohoku.ac.jp/japanese/2023/07/press20230703-01-pmepyss.html
[14] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2015.870194/data/index.html
[15] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2015.870194/index.html
[16] www.todaishimbun.org/wsmelmodel_20231029/
[17] www.jstage.jst.go.jp/article/shinshumedj/56/3/56_3_115/_pdf
[18] www.u-tokyo.ac.jp/focus/ja/press/z0109_00097.html
疾患治療への応用
フォールディング病は、タンパク質が正しく折り畳まれないことによって引き起こされる疾患群を指します。これにはアルツハイマー病、パーキンソン病、ハンチントン病などの神経変性疾患が含まれます。これらの疾患に共通する特徴は、ミスフォールディングしたタンパク質が細胞内外で凝集し、細胞の機能障害や細胞死を引き起こすことです。フォールディング病の治療に向けた研究は、主に以下のアプローチに分けられます。
1. ミスフォールディングの阻害
ミスフォールディング蛋白質が形成されるのを阻害する化合物の開発が進められています。これには、ミスフォールディング蛋白質が正しい立体構造を取るように構造を補う化合物や、ミスフォールディング蛋白質を分解する化合物などが含まれます[16]。
2. フォールディング促進分子の開発
フォールディング促進効果を持つ人工分子の開発が進められています。これらの分子は、ミスフォールディング病の予防と治療に有効と考えられ、またインスリンや抗体医薬品などのタンパク質製剤の合成効率向上にも大きく貢献すると期待されています[8][19]。
3. 分子シャペロンの活用
分子シャペロンは、タンパク質の正しい折り畳みを助けるタンパク質であり、ミスフォールディング蛋白質の凝集を防ぐことにより、神経変性疾患の進行を遅らせる可能性があります。分子シャペロンによる蛋白質ミスフォールディング抑制が、治療法開発研究の一つのアプローチとして行われています[15]。
♦ 今後の展望
フォールディング病の治療に向けた研究は、まだ初期段階にありますが、これらのアプローチによって、疾患の根本的な治療法の開発が期待されています。特に、フォールディング促進分子や分子シャペロンの活用による治療法の開発は、疾患の進行を遅らせるだけでなく、疾患の予防にも寄与する可能性があります。また、これらの研究は、タンパク質の折り畳みメカニズムの理解を深めることにも繋がり、生命科学全般における基礎研究の進展にも貢献すると期待されています。
今後の研究では、これらのアプローチをさらに発展させ、より効果的で安全な治療法の開発に向けた研究が進められることが期待されます。また、疾患特異的な治療法の開発に加えて、フォールディング病全般に適用可能な治療法の開発も重要な課題となります。
- 参考文献・出典
-
[8] www.tohoku.ac.jp/japanese/2024/01/press20240129-01-protein.html
[9] www.tuat.ac.jp/outline/disclosure/pressrelease/2023/20230630_02.html
[10] www.jst.go.jp/pr/announce/20230630/index.html
[11] www.ritsumei.ac.jp/research/r-giro/projects/medical/protein.html/
[12] www.bri.niigata-u.ac.jp/research/column/001704.html
[13] www.nitech.ac.jp/news/press/2023/10653.html
[14] www.yodosha.co.jp/yodobook/book/9784758104128/10.html
[15] www.igakuken.or.jp/public/seminar/h28/semi0130.html
[16] bio.nikkeibp.co.jp/atcl/report/16/011900001/19/02/07/00232/
第5章: 実験技術と方法論
フォールディング解析の実験手法
タンパク質フォールディングの研究には、その過程や機構を理解するために多様な実験手法が用いられます。これらの手法は、タンパク質がどのようにしてその機能的な立体構造を獲得するか、または特定の条件下でどのように振る舞うかを明らかにすることを目的としています。以下に、主要な実験手法を紹介します。
● 核磁気共鳴(NMR)分光法
NMR分光法は、タンパク質の動的な構造やフォールディング過程を原子レベルで観察するのに有用な手法です。タンパク質の各原子核が磁場中でどのように振る舞うかを測定することで、タンパク質の立体構造や動き、相互作用を詳細に解析できます[3][4]。
● X線結晶構造解析
X線結晶構造解析は、タンパク質の精密な立体構造を決定するために広く用いられる手法です。タンパク質結晶にX線を照射し、回折パターンを分析することで、タンパク質の原子配列を高解像度で明らかにします。この手法は、フォールディング後のタンパク質の最終構造を理解するのに役立ちます[4][5]。
● 分子動力学シミュレーション
分子動力学シミュレーションは、コンピュータ上でタンパク質の動的な振る舞いを時間とともにシミュレートする手法です。原子間の相互作用を基に計算を行い、タンパク質のフォールディング過程や構造的変化を観察できます。実験データと組み合わせることで、フォールディング機構の理解を深めることができます[9]。
● Φ値解析
Φ値解析は、タンパク質フォールディングの遷移状態の構造を推定するために用いられる手法です。特定のアミノ酸残基を変異させることでフォールディング速度と安定性にどのような影響があるかを調べ、遷移状態での各残基の重要性を評価します。この手法は、フォールディング過程における重要な中間体の特定に役立ちます[20]。
● 蛍光分光法
蛍光分光法は、タンパク質に特定の蛍光プローブを結合させ、その蛍光特性の変化を測定することで、フォールディング過程やタンパク質の構造的変化を観察する手法です。蛍光強度や寿命の変化から、タンパク質の環境変化や動的な振る舞いを推定できます。
これらの手法は、それぞれ異なる側面からタンパク質フォールディングを研究するために用いられ、相補的な情報を提供します。組み合わせて使用することで、タンパク質フォールディングの複雑な過程をより深く理解することが可能になります。
- 参考文献・出典
-
[3] www.jstage.jst.go.jp/article/biophys/45/3/45_3_140/_pdf
[4] www.cosmobio.co.jp/support/technology/milk-protein/milk-protein-14.asp
[5] www.iu.a.u-tokyo.ac.jp/textbook/chapter4.html
[9] gigazine.net/news/20201202-what-is-protein-folding/
[20] www.f.waseda.jp/wako/introduction/Abe-Wako/08_%E7%AC%AC8%E7%AB%A0_%E3%82%BF%E3%83%B3%E3%83%91%E3%82%AF%E8%B3%AA%E3%83%95%E3%82%A9%E3%83%BC%E3%83%AB%E3%83%87%E3%82%A3%E3%83%B3%E3%82%B0%E3%81%AE%E9%81%B7%E7%A7%BB%E7%8A%B6%E6%85%8B%E3%81%AE%E6%A7%8B%E9%80%A0%E3%82%92%E6%8E%A8%E5%AE%9A%E3%81%99%E3%82%8B%CE%A6%E5%80%A4%E8%A7%A3%E6%9E%90%E3%81%A8%E3%81%AF%EF%BC%9F.pdf
シミュレーションと計算モデル
タンパク質フォールディングのシミュレーションは、タンパク質がどのようにしてその機能的な三次元構造を取るかを理解するための重要な手段です。このプロセスをシミュレートすることで、タンパク質の構造、機能、および病気との関連を解明する手がかりを得ることができます。以下では、コンピュータを用いたタンパク質フォールディングのシミュレーション技術に関するいくつかのアプローチを紹介します。
分子動力学シミュレーション
分子動力学シミュレーションは、タンパク質フォールディングのシミュレーションに広く用いられる手法です。この手法では、ニュートンの運動方程式を用いて、タンパク質を構成する原子の運動を時間とともに追跡します。埼玉大学松永研究室では、コンピュータの仮想空間でタンパク質を構築し、自然法則を模倣して詳細に観察するシミュレーション手法を開発し応用しています[2]。分子動力学シミュレーションは、タンパク質が構造を変えて機能する時間スケールであるミリ秒レベルの動きを、フェムト秒レベルでシミュレートすることが可能ですが、計算には大量の時間とリソースが必要とされることが欠点です[2]。
● 拡張アンサンブル法
拡張アンサンブル法は、分子動力学シミュレーションの計算効率を向上させるための手法です。レプリカ交換法はその一例で、複数のレプリカ(系のコピー)を用意し、シミュレーションの途中でレプリカ間で温度を交換します。これにより、エネルギーの局所最小値に陥ることなく、より広範な構造空間を探索することが可能になります[10]。
● AlphaFold
AlphaFoldは、DeepMindによって開発されたタンパク質の構造予測モデルで、タンパク質フォールディングの問題に対する革新的なアプローチを提供しています。AlphaFoldは、遺伝子配列からタンパク質の立体構造を高精度で予測することができ、これまでにない速度と精度でタンパク質の構造を解明することが可能です[4][7]。
● まとめ
コンピュータを用いたタンパク質フォールディングのシミュレーション技術は、分子動力学シミュレーション、拡張アンサンブル法、そしてAlphaFoldのような機械学習モデルを含む多様なアプローチを取り入れています。これらの技術は、タンパク質の構造と機能の理解を深めるだけでなく、新しい薬剤の設計や病気の治療法の開発にも貢献しています。






