目次
この記事では、プレmRNAの形成とスプライシングの過程を詳細に解説します。プレmRNAがどのように成熟mRNAへと変換されるか、その生化学的メカニズムと生物学的重要性について掘り下げます。
第1章: プレmRNAの基本概念
プレmRNAとは何か
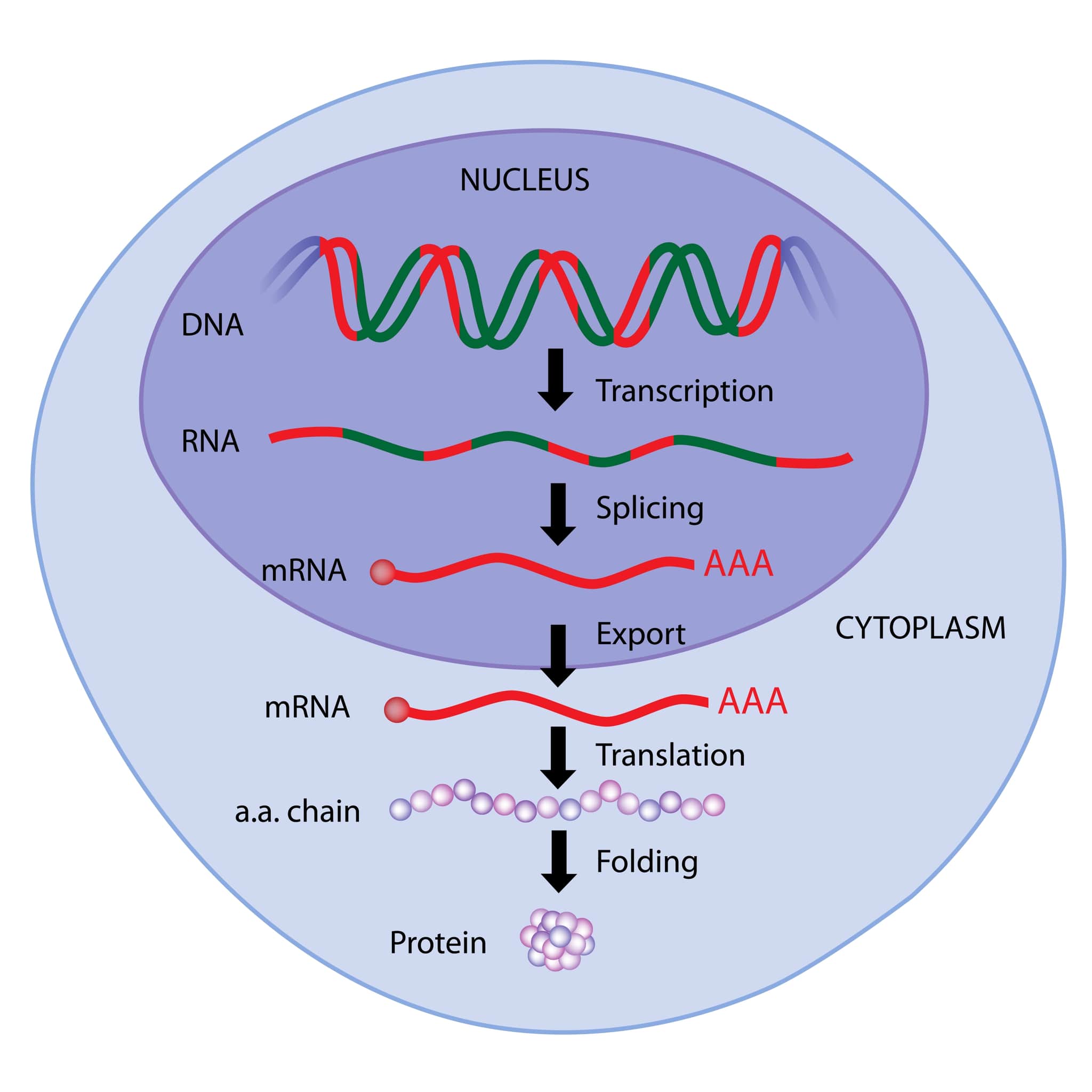
プレmRNA、または前駆体mRNA(pre-messenger RNA)は、真核生物の細胞核内でDNAから転写された初期のmRNA分子です。この分子は、最終的なmRNA分子になる前の、未加工または未成熟の形態を指します。プレmRNAは、タンパク質をコードする遺伝情報を含むエクソン(exons)と、非コーディング領域であるイントロン(introns)の両方を含んでいます[5]。
プレmRNAの主な役割は、DNAに保持されている遺伝情報をタンパク質合成の場であるリボソームへと伝達することです。しかし、プレmRNAはそのままではタンパク質合成に使用できません。まず、細胞核内で一連の加工プロセスを受ける必要があります。このプロセスには、キャッピング、ポリアデニル化、そしてスプライシングが含まれます[13]。
– キャッピングは、プレmRNAの5’末端に特殊なキャップ構造を付加することで、mRNAの安定性を高め、核外への輸送を助け、翻訳の開始を促進します。
– ポリアデニル化は、3’末端にポリAテールを付加することで、mRNAの安定性と翻訳効率を向上させます。
– スプライシングは、イントロンを除去し、エクソンを連結するプロセスで、これにより最終的なmRNAが生成されます。このステップは、スプライセオソームと呼ばれる複合体によって触媒されます[13]。
これらのプロセスを経て、プレmRNAは成熟したmRNAに変換され、細胞質へと輸送されます。細胞質において、mRNAはリボソームによって読み取られ、その遺伝情報に基づいてタンパク質が合成されます。プレmRNAの加工は、タンパク質の多様性を生み出す重要な機構でもあります。特に、スプライシングによって異なるエクソンが組み合わされることで、1つの遺伝子から複数のタンパク質が生成されることがあります。これをオルタナティブスプライシングと呼びます[13]。
プレmRNAの加工と調節は、細胞の機能と遺伝子発現の精密な制御に不可欠であり、これらのプロセスの異常は多くの疾患の原因となり得ます。
プレmRNAの生産プロセス
RNAスプライシングは、真核生物の遺伝子発現における重要なステップであり、プレmRNA(前駆体mRNA)から不要なセグメント(イントロン)を取り除き、必要なセグメント(エキソン)をつなぎ合わせて成熟したmRNAを生成する過程です。この過程は、細胞質でのタンパク質合成のための正確なmRNAテンプレートを提供するために不可欠です[15]。
● スプライシングの基本的な過程
1. イントロンの認識と切断:
– スプライシングは、プレmRNA上の特定の配列、すなわちスプライス部位によって開始されます。ほとんどのイントロンは、5’末端にGU配列を持ち、3’末端にAG配列を持っています(GU-AG則)[13]。
– スプライシングの初期段階で、スプライソソームと呼ばれる大きなRNA-タンパク質複合体がプレmRNAに結合します。スプライソソームは、snRNA(小さな核RNA)と多数のタンパク質から構成され、スプライシング反応の触媒として機能します[13]。
2. ラリアット構造の形成:
– スプライシングの第一段階で、イントロンの5’末端が切断され、イントロン内の特定のアデニン残基(分枝点)に結合して、ループ状のラリアット構造を形成します[13]。
3. エキソンの連結:
– 第二段階では、イントロンの3’末端が切断され、隣接するエキソン同士が連結されます。この過程で、イントロンはラリアット構造として除去され、エキソンだけがつながったmRNAが生成されます[13]。
4. スプライソソームの解離とmRNAの成熟:
– エキソンが連結された後、スプライソソームは解離し、成熟したmRNAはさらなる加工(例:5’キャップの追加、3’末端のポリアデニル化)を受けた後、核から細胞質へと輸送されます。細胞質で、mRNAはリボソームによってタンパク質へと翻訳されます[15]。
● スプライシングの重要性
スプライシングは、遺伝子の多様性と複雑性を高める重要なメカニズムです。異なるスプライシングパターンによって、同じ遺伝子から複数の異なるmRNA(およびタンパク質)が生成されることがあります。この現象は、オルタナティブスプライシングと呼ばれ、細胞の種類、発達段階、外部環境に応じて異なるタンパク質を生産することを可能にします[15]。
スプライシングの異常は、多くの疾患の原因となり得ます。正確なスプライシングが行われない場合、機能しないタンパク質が生成されたり、必要なタンパク質が全く生成されなかったりすることがあります。したがって、スプライシングの正確な制御は、細胞の正常な機能維持にとって極めて重要です[15]。
第2章: スプライシングの概要
スプライシングの基本メカニズム
RNAスプライシングは、真核生物の遺伝子発現における重要なステップであり、プレmRNA(前駆体mRNA)から不要なセグメント(イントロン)を取り除き、必要なセグメント(エキソン)をつなぎ合わせて成熟したmRNAを生成する過程です。この過程は、細胞質でのタンパク質合成のための正確なmRNAテンプレートを提供するために不可欠です[15]。
● スプライシングの基本的な過程
1. イントロンの認識と切断:
– スプライシングは、プレmRNA上の特定の配列、すなわちスプライス部位によって開始されます。ほとんどのイントロンは、5’末端にGU配列を持ち、3’末端にAG配列を持っています(GU-AG則)[13]。
– スプライシングの初期段階で、スプライソソームと呼ばれる大きなRNA-タンパク質複合体がプレmRNAに結合します。スプライソソームは、snRNA(小さな核RNA)と多数のタンパク質から構成され、スプライシング反応の触媒として機能します[13]。
2. ラリアット構造の形成:
– スプライシングの第一段階で、イントロンの5’末端が切断され、イントロン内の特定のアデニン残基(分枝点)に結合して、ループ状のラリアット構造を形成します[13]。
3. エキソンの連結:
– 第二段階では、イントロンの3’末端が切断され、隣接するエキソン同士が連結されます。この過程で、イントロンはラリアット構造として除去され、エキソンだけがつながったmRNAが生成されます[13]。
4. スプライソソームの解離とmRNAの成熟:
– エキソンが連結された後、スプライソソームは解離し、成熟したmRNAはさらなる加工(例:5’キャップの追加、3’末端のポリアデニル化)を受けた後、核から細胞質へと輸送されます。細胞質で、mRNAはリボソームによってタンパク質へと翻訳されます[15]。
● スプライシングの重要性
スプライシングは、遺伝子の多様性と複雑性を高める重要なメカニズムです。異なるスプライシングパターンによって、同じ遺伝子から複数の異なるmRNA(およびタンパク質)が生成されることがあります。この現象は、オルタナティブスプライシングと呼ばれ、細胞の種類、発達段階、外部環境に応じて異なるタンパク質を生産することを可能にします[15]。
スプライシングの異常は、多くの疾患の原因となり得ます。正確なスプライシングが行われない場合、機能しないタンパク質が生成されたり、必要なタンパク質が全く生成されなかったりすることがあります。したがって、スプライシングの正確な制御は、細胞の正常な機能維持にとって極めて重要です[15]。
スプライソソームの役割
● スプライソソームの機能
スプライソソームは、真核生物の細胞核内で行われるpre-mRNAスプライシングという過程において中心的な役割を果たす分子機構です。このプロセスでは、転写されたmRNA前駆体から不要なイントロンが除去され、必要なエキソンが結合して成熟mRNAが形成されます[1][3][6][7][9][11][13][14][16][18][19]。スプライシングは、遺伝子発現の調節において重要な役割を担い、選択的スプライシングによって同一の遺伝子から複数の異なるタンパク質が生成されることで、生物の多様性と複雑性が高まります[18]。
● スプライソソームの構造
スプライソソームは、タンパク質とRNAの複合体で構成されており、特に5種類の核内低分子リボ核タンパク質(snRNP)と呼ばれるU1、U2、U4、U5、U6 snRNAとそれに結合するタンパク質から成り立っています[9][11][17]。これらのsnRNPは、pre-mRNA上の特定の配列に結合し、スプライシングの反応を触媒するために必要な複合体を形成します[7][9][11][17]。
スプライシングの過程は、2段階のエステル交換反応によって行われ、最初にイントロンの5’末端が切断され、ラリアット構造が形成されます。次に、3’末端が切断され、イントロンが除去され、エキソン同士が連結されて成熟mRNAが形成されます[7][11][17]。
スプライソソームは非常に動的な構造であり、スプライシングの各段階でサブユニットの付加や除去が行われます[8]。この複雑な分子機械は、タンパク質鎖といくつかの小さなRNA鎖が含まれており、スプライシングの各反応段階ごとに異なる構造を取ります[8]。
クライオ電子顕微鏡を用いた研究により、スプライソソームの構造が詳細に解明されつつあります。これにより、スプライシングの反応機構や活性部位の構造に関する理解が深まっています[10][15]。
スプライソソームの活性部位には、2つのマグネシウムイオンが配位し、リボザイムとしての機能を果たします。これは、RNA分子が自己スプライシングを行う能力を持つことと関連しており、スプライソソームの活性部位が形成されることで、エステル転移反応が実行されます[9][17]。
スプライソソームの研究は、がんを含む多くの疾患における異常なスプライシングの理解や治療法の開発に寄与する可能性があります。また、植物におけるpre-mRNAスプライシングの特徴や生理的役割に関する研究も進められており、スプライソソームのコア因子が植物の成長や応答に重要な役割を果たしていることが示されています[19]。
- 参考文献・出典
-
[1] www.riken.jp/press/2021/20210330_1/index.html
[2] www.tmd.ac.jp/end/research/SplicingCode/
[3] www.setsurotech.com/glossary/splicing/
[4] kotobank.jp/word/%E3%82%B9%E3%83%97%E3%83%A9%E3%82%A4%E3%82%B7%E3%83%B3%E3%82%B0-157698
[5] www.k.u-tokyo.ac.jp/information/category/press/10416.html
[6] www.ncc.go.jp/jp/ri/division/cancer_rna/20211227164725.html
[7] nsgene-lab.jp/expression/rna_splicing/
[8] numon.pdbj.org/mom/245?l=ja
[9] www.weblio.jp/content/%E3%82%B9%E3%83%97%E3%83%A9%E3%82%A4%E3%82%BD%E3%82%BD%E3%83%BC%E3%83%A0
[10] www.natureasia.com/ja-jp/nature/highlights/41722
[11] www.toho-u.ac.jp/sci/biomol/glossary/bio/RNA_splicing.html
[12] www.fujita-hu.ac.jp/~mayeda/research.html
[13] www.try-it.jp/chapters-15090/sections-15091/lessons-15110/
[14] ja.wikipedia.org/wiki/%E3%82%B9%E3%83%97%E3%83%A9%E3%82%A4%E3%82%BB%E3%82%AA%E3%82%BD%E3%83%BC%E3%83%A0
[15] www.rnaj.org/notice/official-info/791-10-3-2019-rnaj
[16] ja.wikipedia.org/wiki/%E3%82%B9%E3%83%97%E3%83%A9%E3%82%A4%E3%82%B7%E3%83%B3%E3%82%B0
[17] www.jstage.jst.go.jp/article/faruawpsj/51/1/51_22/_pdf/-char/en
[18] www.try-it.jp/chapters-15090/sections-15091/lessons-15110/point-2/
[19] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2022.940861/data/index.html
第3章: スプライシングの生物学的重要性
遺伝情報の多様化に寄与するスプライシング
スプライシングは、遺伝情報の多様化に重要な役割を果たす遺伝子発現の調節機構です。このプロセスは、pre-mRNA(前駆体メッセンジャーRNA)からイントロン(非コーディング領域)を除去し、エクソン(コーディング領域)をつなぎ合わせることにより、成熟したmRNAを生成します。この成熟したmRNAはその後、タンパク質へと翻訳されます。スプライシングによって、一つの遺伝子から複数の異なるmRNAが生成されることがあり、これによりタンパク質の多様性が生まれます。
● スプライシングの基本メカニズム
スプライシングは、スプライソソームと呼ばれる大きなRNA-タンパク質複合体によって触媒されます。スプライソソームは、pre-mRNA上の特定の配列を認識し、イントロンを切り出してエクソンをつなぎ合わせます。このプロセスは、細胞の種類、発達段階、外部からのシグナルに応じて異なるパターンで行われることがあります。
● 選択的スプライシングと遺伝情報の多様化
選択的スプライシングは、スプライシングの過程で異なるエクソンが選択されることにより、同じ遺伝子から異なるmRNAバリアントが生成される現象です。これにより、一つの遺伝子から複数の機能的に異なるタンパク質が生産されることが可能になります。選択的スプライシングは、生物の複雑性と適応性を高める重要な機構とされています。
● スプライシング異常と疾患
スプライシングの異常は、多くの遺伝性疾患やがんなどの病態に関連しています。例えば、特定のスプライシング因子の変異は、骨髄異形成症候群(MDS)などの疾患の原因となることが知られています。このような異常スプライシングは、遺伝子の機能を損ない、病態を引き起こす可能性があります。
● スプライシングの研究と応用
スプライシングの研究は、遺伝子発現の理解を深めるだけでなく、新たな治療標的の同定や創薬への応用にもつながります。スプライシング調節化合物やアンチセンス核酸を用いた治療法の開発は、特定のスプライシング異常を標的とした遺伝性疾患の治療に貢献する可能性があります。
スプライシングは、遺伝情報の多様化に寄与し、生物の複雑性と適応性を高める重要な遺伝子発現の調節機構です。選択的スプライシングにより、一つの遺伝子から複数のタンパク質が生成されることが、生物の多様性と機能の拡張に貢献しています[9][13]。
疾患とスプライシングの関連性
スプライシングは、前駆体メッセンジャーRNA(pre-mRNA)から不要なイントロンを除去し、必要なエクソンを結合させることで成熟したmRNAを生成する過程です。この過程は、細胞が遺伝子の情報を正確にタンパク質に翻訳するために不可欠です。スプライシングには、代替スプライシングという形態もあり、これにより一つの遺伝子から複数の異なるmRNAバリアントが生成され、タンパク質の多様性が生まれます。しかし、この精密なプロセスに異常が生じると、特定の疾患が引き起こされる可能性があります。
● スプライシング異常が疾患を引き起こすメカニズム
1. スプライスサイトの変異: スプライスサイトは、イントロンとエクソンの境界に位置する配列で、スプライシングにおいて重要な役割を果たします。これらのサイトに変異が生じると、スプライシングが不適切に行われ、異常なmRNAが生成されることがあります。このような異常なmRNAから翻訳されるタンパク質は機能不全を引き起こし、疾患の原因となることがあります[1][3][4][5][6][7][8][9][10][11][12][13][14][15][16][17][18][19][20]。
2. 代替スプライシングの誤調節: 代替スプライシングは、細胞の種類や発達段階に応じて調節されます。しかし、この調節が不適切になると、疾患関連のタンパク質バリアントが過剰に生成されたり、必要なバリアントが不足したりすることがあります。例えば、神経変性疾患では、特定のタンパク質のスプライシングバリアントの異常な蓄積が見られることがあります[9][14][16][17]。
3. スプライシング因子の変異: スプライシング因子は、スプライシングプロセスを調節するタンパク質です。これらの因子に変異が生じると、広範囲にわたるスプライシング異常が引き起こされ、多くの場合、遺伝性疾患につながります[3][4][5][6][7][8][10][11][12][13][15][16][17][18][19][20]。
● スプライシング異常に関連する疾患の例
– 神経変性疾患: スピナル筋萎縮症(SMA)や筋萎縮性側索硬化症(ALS)などの神経変性疾患は、スプライシング異常によって引き起こされることがあります。これらの疾患では、特定のスプライシング因子の異常や、特定のタンパク質の代替スプライシングパターンの変化が関与しています[9][14][16][17]。
– がん: がん細胞では、代替スプライシングのパターンが変化し、がんの進行や転移に関与するタンパク質が異常に生成されることがあります。これにより、がん細胞の増殖や生存が促進されることがあります[2][6][7][8][11][12][13][15][18][19][20]。
スプライシング異常は、多くの疾患の根底にある重要なメカニズムです。これらの異常を理解し、修正することは、新たな治療法の開発につながる可能性があります。
- 参考文献・出典
-
[1] www.frontiersin.org/journals/genetics/articles/10.3389/fgene.2021.689892/full
[2] www.nature.com/articles/s41392-021-00486-7
[3] www.ncbi.nlm.nih.gov/pmc/articles/PMC6060985/
[4] pubmed.ncbi.nlm.nih.gov/29680930/
[5] link.springer.com/article/10.1007/s13353-018-0444-7
[6] www.ncbi.nlm.nih.gov/pmc/articles/PMC6002934/
[7] www.cell.com/molecular-therapy-family/molecular-therapy/pdf/S1525-0016%2821%2900581-5.pdf
[8] www.ncbi.nlm.nih.gov/pmc/articles/PMC10019363/
[9] insideucr.ucr.edu/stories/2023/06/20/what-role-does-alternative-splicing-play-neurodegenerative-disease
[10] www.nature.com/articles/s41525-022-00294-0
[11] cancerci.biomedcentral.com/articles/10.1186/s12935-023-03094-3
[12] genomemedicine.biomedcentral.com/articles/10.1186/s13073-020-00737-2
[13] www.ucsf.edu/news/2021/05/420546/spread-breast-cancer-linked-newly-discovered-rna-splicing-mechanism
[14] www.ncbi.nlm.nih.gov/pmc/articles/PMC8136212/
[15] academic.oup.com/bib/article/24/5/bbad284/7242261
[16] pubmed.ncbi.nlm.nih.gov/34016162/
[17] www.cell-stress.com/researcharticles/the-emerging-role-of-minor-intron-splicing-in-neurological-disorders/
[18] www.ncbi.nlm.nih.gov/pmc/articles/PMC1351063/
[19] journals.plos.org/plosgenetics/article?id=10.1371%2Fjournal.pgen.1010342
[20] www.frontiersin.org/journals/immunology/articles/10.3389/fimmu.2021.713540/full
第4章: スプライシングの研究進展
スプライシングの研究手法
スプライシングの研究には、遺伝子発現の調節機構を理解する上で重要な役割を果たすため、多様な技術とアプローチが用いられています。以下に、スプライシングを研究するための主な現代の技術とアプローチを紹介します。
1. リポーターシステムを用いたスプライシングの可視化
選択的スプライシングのパターンを生体内で可視化するために、複数の蛍光タンパク質を用いたレポーターシステムが開発されています。この手法では、選択的スプライシングによって異なる蛍光タンパク質が発現するように設計されたミニ遺伝子を用いて、スプライシングイベントを個々の細胞レベルで観察することが可能です[18]。
2. RNAシークエンシング
次世代シークエンシング技術を利用したRNAシークエンシング(RNA-seq)は、スプライシングバリアントの同定や発現量の定量化に広く用いられています。この技術により、大規模な遺伝子発現プロファイルを高精度に取得し、スプライシングイベントの包括的な解析が可能になります[2]。
3. リボソームプロファイリング
リボソームプロファイリングは、リボソームに結合しているmRNA断片をシークエンシングすることで、翻訳されているmRNAの特定と定量化を行う技術です。この方法により、スプライシングバリアントがどの程度翻訳されているかを調べることができます[2]。
4. クロスリンキング免疫沈降法(CLIP)
CLIP技術は、RNA結合タンパク質(RBP)とその結合RNAを同定するために用いられます。紫外線によるクロスリンキングを利用してRBPとRNAの複合体を安定化させ、免疫沈降法によって特定のRBPに結合しているRNAを抽出し、シークエンシングによってその配列を特定します。この技術により、スプライシングに関与するRBPの標的RNAや結合部位を特定することができます[2]。
これらの技術とアプローチは、スプライシングの機構や調節に関する深い理解を可能にし、遺伝病やがんなどの疾患の研究に貢献しています。
スプライシング研究の最新成果
スプライシング研究の分野では、RNAスプライシングの制御ががん治療における新たなアプローチとして注目されています。特に、RNAスプライシング制御による新規がん免疫療法の開発が進んでおり、その最新の研究成果が2022年11月30日に国際学術誌「Science Translational Medicine」に掲載されました[20]。
この研究では、低分子化合物RECTASを用いてがん細胞のmRNAスプライシングパターンを変化させることで、ネオ抗原の発現を亢進させることができることが示されました。これらのネオ抗原は「スプライスネオ抗原」と名付けられ、PD-1阻害療剤の治療効果を高めるだけでなく、RECTASによるがんワクチン療法も可能であることが示されました。RECTASは元々遺伝病治療のために開発されたため、毒性もほとんどなく、RNAスプライシング制御薬による次世代がん免疫療法への道を拓く研究成果であると言えます。
この研究成果の科学的な意義は大きく、以下の点で特に重要です。
1. 新たながん治療戦略の提案: RNAスプライシングの制御を通じてがん細胞特有のネオ抗原を増やすことで、免疫システムによるがん細胞の認識と攻撃を促進する新たな治療戦略を提案しています。これは、従来の免疫チェックポイント阻害剤に反応しないがん患者に対しても有効な可能性があります。
2. がん免疫療法の効果の向上: RECTASによるスプライスネオ抗原の誘導は、PD-1阻害療剤の効果を高めることが示されており、がん免疫療法の効果をさらに向上させることが期待されます。
3. 安全性の高い治療薬の開発: RECTASは元々遺伝病治療のために開発されたため、毒性が低く、安全性の高い治療薬としての開発が期待されます。
この研究は、RNAスプライシングの制御が持つがん治療における潜在的な可能性を示しており、今後のがん治療研究において重要な役割を果たすことが期待されます。
- 参考文献・出典
- [20] www.kyoto-u.ac.jp/ja/research-news/2022-12-12-0
第5章: スプライシングの治療への応用
遺伝子治療におけるスプライシング
遺伝子治療におけるスプライシングは、疾患の原因となるmRNAの異常なスプライシングパターンを修正することを目的とした治療戦略です。スプライシングは、mRNA前駆体から不要なイントロンを除去し、必要なエクソンを連結する過程であり、このプロセスの異常は多くの遺伝病やがんなどの疾患に関連しています。スプライシングを標的とした治療戦略は、特定の疾患関連スプライシングバリアントを修正することで、病態の改善を目指します。
● スプライシング調節化合物の開発
京都大学の萩原正敏教授らの研究グループは、mRNAスプライシングパターンを変える低分子化合物の研究開発を行っており、その一つであるRECTASは、遺伝病治療のために開発されました。RECTASは、がん細胞のmRNAスプライシングパターンを変化させ、ネオ抗原の発現を亢進することが見出され、これらを「スプライスネオ抗原」と名付けました。さらに、RECTASはPD-1阻害療剤の治療効果を高めるだけでなく、がんワクチン療法も可能であることが示されています[5][9]。
● スプライシング異常を標的としたがん治療
がんにおけるRNAスプライシング異常は、スプライシング因子の変異によるものであり、これを標的とした治療法の開発が進められています。国立がん研究センターでは、スプライシング因子の変異を治療標的として同定する研究が行われており、がん治療における新たな可能性を探っています[7]。
● スプライシングを操作する遺伝子治療戦略
スプライシングを操作する遺伝子治療戦略には、オルタナティブスプライシングの調節を目的とした小分子化合物の開発や、特定の疾患関連スプライシングバリアントを標的とするアプローチが含まれます。これらの戦略は、スプライシングを正常化することで疾患の治療に寄与することが期待されています[8]。
● まとめ
スプライシングを標的とした治療戦略は、遺伝病やがんなどの疾患に対する新たな治療法の開発に大きな可能性を持っています。低分子化合物によるスプライシングパターンの変更や、スプライシング異常を直接標的とするアプローチは、病態の根本的な改善を目指すものであり、今後の臨床応用に向けた研究が進められています。特に、RECTASのような化合物は、がん免疫療法の効果を高めるとともに、がんワクチン療法の可能性を示しており、遺伝子治療の分野における重要な進展となっています。
- 参考文献・出典
-
[5] www.kyoto-u.ac.jp/sites/default/files/2022-12/221212_Ajiro-09e70ca085df4ba5d39c4956292361fa.pdf
[6] www.yodosha.co.jp/jikkenigaku/book/9784758125703/2076.html
[7] www.ncc.go.jp/jp/ri/division/cancer_rna/project/010/index.html
[8] www.setsurotech.com/glossary/splicing/
[9] www.kyoto-u.ac.jp/ja/research-news/2022-12-12-0
疾患治療におけるスプライシング調節
RNAスプライシングは、前駆体メッセンジャーRNA(pre-mRNA)から不要なイントロンを除去し、必要なエクソンを結合させる過程です。この過程は、遺伝子の情報を正確にタンパク質へと翻訳するために不可欠です。異常なスプライシングは、多くの遺伝病やがんなどの疾患の原因となります。そのため、スプライシングの調節を通じた疾患治療の研究が進められています。
● スプライシング調節による疾患治療の方法
1. アンチセンスオリゴヌクレオチド(ASO): アンチセンスオリゴヌクレオチドは、特定のpre-mRNAに結合し、スプライシングの過程を変更する短いDNAまたはRNAの断片です。これにより、異常なスプライシングを正常化し、疾患の原因となるタンパク質の産生を抑制または修正します[1][5][6][14]。
2. 低分子化合物: 特定のスプライシング因子に結合し、スプライシング過程を調節する小分子化合物の開発が進んでいます。これらの化合物は、異常なスプライシングパターンを修正し、疾患関連タンパク質の正常な産生を促進することが期待されています[1][2][3][5]。
● 臨床的な応用
1. デュシェンヌ型筋ジストロフィー(DMD): DMDは、エクソンスキッピングによる異常なディストロフィンタンパク質の産生が原因で発症します。アンチセンスオリゴヌクレオチドを用いたスプライシング調節により、エクソンスキッピングを抑制し、部分的に機能するディストロフィンの産生を促進する治療が開発されています[5][14]。
2. 脊髄性筋萎縮症(SMA): SMAの治療には、SMN2遺伝子のスプライシングを調節し、機能的なSMNタンパク質の産生を増加させるアンチセンスオリゴヌクレオチドが用いられています。この治療法は、SMAの進行を遅らせ、患者の生活の質を改善することが示されています[6][14]。
3. がん: がん細胞は、スプライシングの異常により、がんの成長や進行を促進するタンパク質を産生することがあります。低分子化合物によるスプライシングの調節は、がん細胞特有の異常なスプライシングパターンを標的とし、がん治療の新たなアプローチとして期待されています[2][3][8]。
● まとめ
スプライシング調節による疾患治療は、遺伝病やがんなどの多くの疾患に対して有効な治療法を提供する可能性を秘めています。アンチセンスオリゴヌクレオチドや低分子化合物を用いたスプライシングの調節は、特定の疾患の原因となる異常なスプライシングパターンを修正することにより、疾患の進行を遅らせるか、逆転させることができるかもしれません。これらの治療法の開発と臨床応用は、個別化医療の進展に貢献し、多くの患者に希望をもたらすことが期待されます。
- 参考文献・出典
-
[1] www.jstage.jst.go.jp/article/ciqs/2018/0/2018_1S01/_pdf
[2] www.kyoto-u.ac.jp/sites/default/files/2022-12/221212_Ajiro-09e70ca085df4ba5d39c4956292361fa.pdf
[3] www.riken.jp/press/2021/20210330_1/index.html
[4] www.a.u-tokyo.ac.jp/topics/topics_20210914-1.html
[5] genome-sohatsu.jp/pdf/abstract-s13.pdf
[6] bio.nikkeibp.co.jp/atcl/report/16/011900001/18/07/19/00192/
[7] www.ncc.go.jp/jp/ri/division/cancer_rna/project/010/index.html
[8] www.kyoto-u.ac.jp/ja/research-news/2022-12-12-0
[9] cir.nii.ac.jp/crid/1390857445988940160
[10] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2022.940837/data/index.html
[11] www.jstage.jst.go.jp/article/ojjscn/56/1/56_24/_pdf/-char/ja
[12] cir.nii.ac.jp/crid/1040000782085793152
[13] kaken.nii.ac.jp/ja/grant/KAKENHI-PROJECT-20K07659/
[14] www.jstage.jst.go.jp/article/jsnt/37/3/37_247/_pdf/-char/ja
[15] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2022.940837/data/index.pdf








