目次
この記事では、ポリペプチドの基本概念、その合成プロセス、および生物学的な役割について詳しく説明します。ポリペプチドが持つ生化学的特性と医学、特に抗菌薬としての応用についても掘り下げます。
第1章: ポリペプチドの基本
ポリペプチドとは何か

ポリペプチドは、複数のアミノ酸がペプチド結合(-CO-NH-)を介して連結した長鎖分子です。アミノ酸は生物の基本的な構成単位であり、その配列によってポリペプチドの性質が決定されます。ポリペプチドは、タンパク質の基本構成要素であり、生物学的機能を持つタンパク質へと折りたたまれる前段階の分子です。
● 化学的定義
ポリペプチドの化学的定義は、アミノ酸が特定の結合、すなわちペプチド結合によって連結された分子のことを指します。ペプチド結合は、一方のアミノ酸のカルボキシル基(-COOH)と、別のアミノ酸のアミノ基(-NH2)が脱水縮合反応を起こすことによって形成されます。この反応により、水分子が一つ取り除かれ、新たな結合が形成されます。ポリペプチドは、このようなペプチド結合が繰り返し連なることによって構成されます[6]。
● 基本的な性質
ポリペプチドの性質は、構成するアミノ酸の種類、数、および配列によって大きく異なります。アミノ酸の側鎖(R基)の化学的性質によって、ポリペプチド全体の物理化学的性質が決定されます。例えば、側鎖が親水性であればポリペプチドは水に溶けやすく、疎水性であれば水に溶けにくい性質を示します。また、ポリペプチドはその配列に応じて特定の三次元構造を取り、この構造が生物学的機能を決定する重要な要素となります[6][12]。
ポリペプチドは、その長さや構造によってさらに細分化されることがあります。アミノ酸が数個から数十個連結したものはオリゴペプチドと呼ばれ、それ以上の長さを持つものがポリペプチドとされます。ただし、この区分は厳密なものではなく、一般的にはアミノ酸が10残基(個)以下のものをオリゴペプチド、それ以上をポリペプチドと呼ぶことが多いです[8]。
ポリペプチドは、生物学的プロセスにおいて重要な役割を果たします。酵素、ホルモン、抗体など、多くのタンパク質がポリペプチドから構成されており、これらは生命活動を支える基本的な分子です。ポリペプチドの研究は、生命科学や医学、薬学など多岐にわたる分野で重要な意味を持ちます[6][12]。
- 参考文献・出典
-
[6] www.toho-u.ac.jp/sci/chem/column/amino_acids/amino_acids_3.html
[7] www.thermofisher.com/us/en/home/life-science/protein-biology/protein-biology-learning-center/protein-biology-resource-library/pierce-protein-methods/peptide-synthesis.html
[8] kotobank.jp/word/%E3%83%9D%E3%83%AA%E3%83%9A%E3%83%97%E3%83%81%E3%83%89-134410
[9] www.aist.go.jp/aist_j/new_research/2008/nr20081027/nr20081027.html
[10] www.aist.go.jp/aist_j/press_release/pr2004/pr20040810/pr20040810.html
[11] www10.showa-u.ac.jp/~biolchem/H20-P2protein-1.pdf
[12] nsgene-lab.jp/technology/polypeptide/
ポリペプチドとペプチドの違い
ポリペプチドとペプチドは、アミノ酸がペプチド結合によって連結された化合物の総称ですが、その構成するアミノ酸の数によって区別されます。
● ペプチド
ペプチドは、2つ以上のアミノ酸がペプチド結合によって連なった化合物の総称です。アミノ酸のアミノ基と隣のアミノ酸のカルボキシル基から1分子の水が除かれて、共有結合するとペプチド結合が生じます。ペプチドが2つのアミノ酸からなる場合をジペプチド、3つのアミノ酸からなる場合をトリペプチドといい、多数のアミノ酸からなる場合をポリペプチドと呼びます[17]。
● ポリペプチド
ポリペプチドは、多数のアミノ酸がペプチド結合で連結された長い鎖状の分子です。一般的に、アミノ酸の数が10個以上の場合にポリペプチドと呼ばれることが多いですが、明確な定義はなく、文献や文脈によってその境界は異なることがあります。ポリペプチドは、その構造や機能によって、さらにタンパク質として分類されることもあります[20]。
● 用語の使い分け
– ペプチド: 一般的に短いアミノ酸の鎖を指し、具体的な機能を持つ生理活性ペプチドや、抗菌ペプチドなどがこのカテゴリーに含まれます。
– ポリペプチド: 長いアミノ酸の鎖を指し、タンパク質の前駆体や、単独で特定の生物学的機能を持つ場合もあります。タンパク質としての機能を果たす前段階の分子としても言及されることがあります。
ポリペプチドとペプチドの主な違いは、構成するアミノ酸の数にありますが、その機能や生物学的役割においても差異が見られます。ペプチドは比較的短く、特定の生理活性を持つことが多いのに対し、ポリペプチドはより長く、タンパク質へと発展する可能性を持つ分子です。
- 参考文献・出典
-
[1] www.clearnotebooks.com/ja/questions/1280135
[2] minerva-clinic.or.jp/academic/terminololgyofmedicalgenetics/tagyou/ptotein/
[17] kotobank.jp/word/%E3%83%9A%E3%83%97%E3%83%81%E3%83%89-130060
[18] www.try-it.jp/chapters-10394/sections-10433/lessons-10438/point-2/
[19] www.nihs.go.jp/edc/question/q3.htm
[20] www.tanaka-cl.or.jp/aging-topics/topics-094/
第2章: ポリペプチドの合成
アミノ酸の連結とポリペプチド鎖の形成
アミノ酸が連結し、ポリペプチド鎖を形成するプロセスは、生化学において基本的かつ重要なメカニズムの一つです。このプロセスは、アミノ酸のアミノ基(-NH2)と別のアミノ酸のカルボキシル基(-COOH)が反応し、ペプチド結合を形成することによって行われます。この反応は脱水縮合反応と呼ばれ、1分子の水(H2O)が取り除かれることでペプチド結合が形成されます。
具体的には、アミノ酸のカルボキシル基のカルボニル炭素(C)と、別のアミノ酸のアミノ基の窒素(N)が結合し、-CO-NH-の結合、すなわちペプチド結合が形成されます。このプロセスを繰り返すことで、複数のアミノ酸が連結し、ポリペプチド鎖が形成されます[13]。
ポリペプチド鎖の形成において、アミノ酸の連結順序は遺伝情報によって決定され、この順序がタンパク質の機能と直接関連しています。アミノ酸の配列、すなわちポリペプチド鎖の一次構造は、タンパク質の特異的な機能を決定する基礎となります。
また、ポリペプチド鎖は、その後さらに折りたたまれ、二次構造(例えばαヘリックスやβシート)、三次構造、そして場合によっては複数のポリペプチド鎖が組み合わさって四次構造を形成します。これらの高次構造は、水素結合、疎水相互作用、イオン結合、およびジスルフィド結合などの非共有結合的な相互作用によって安定化されます[13][16]。
ポリペプチド鎖の形成とその後の折りたたみは、タンパク質分子シャペロンと呼ばれる特殊なタンパク質によって補助されることがあります。これらのシャペロンは、ポリペプチド鎖が正しい構造を取るのを助け、誤った折りたたみや凝集を防ぐ役割を果たします[6]。
このように、アミノ酸の連結からポリペプチド鎖の形成、さらにはタンパク質の高次構造の形成に至るまでのプロセスは、生命現象を理解する上で中心的な役割を担っています。
生体内でのポリペプチドの合成
生体内でのポリペプチドの合成は、遺伝情報の流れに従って行われる複雑なプロセスです。このプロセスは、DNAからRNAへの転写、そしてRNAからポリペプチドへの翻訳という二段階に分けられます。以下では、細胞内でのポリペプチド合成メカニズムとその調節について詳しく紹介します。
● 転写:DNAからmRNAへの情報転写
転写は、DNAの遺伝情報をmRNA(メッセンジャーRNA)に転写する過程です。このプロセスは、RNAポリメラーゼという酵素によって触媒されます。RNAポリメラーゼは、DNAのプロモーター領域に結合し、DNAの二重らせんを開きながら、鋳型鎖の塩基配列に従って相補的なRNA鎖を合成します[10]。
● 翻訳:mRNAからポリペプチドへの情報翻訳
翻訳は、mRNA上の遺伝情報をポリペプチド鎖に翻訳する過程です。このプロセスはリボソームで行われ、mRNA上のコドン(3つの塩基からなる単位)が、対応するアミノ酸に翻訳されます。アミノ酸は、tRNA(トランスファーRNA)によって運ばれ、リボソーム上でペプチド結合を形成しながらポリペプチド鎖を伸長させます[2][10]。
● ポリペプチド鎖の伸長
ポリペプチド鎖の伸長は、リボソーム上で行われます。リボソームは、小サブユニットと大サブユニットから構成され、mRNAとtRNAの結合部位を持ちます。翻訳の過程で、アミノアシルtRNAがリボソームのA部位に結合し、ペプチジルtRNAがP部位に結合します。次に、ペプチジル転移反応が起こり、アミノ酸がポリペプチド鎖に追加されます。この過程は、終止コドンが現れるまで繰り返されます[2][10]。
● ポリペプチド鎖の調節
ポリペプチド合成の調節は、転写と翻訳の両段階で行われます。転写レベルでは、転写因子によるプロモーター領域の活性化や抑制が重要な役割を果たします。翻訳レベルでは、リボソームの結合効率や翻訳開始因子の活性が調節されます。また、特定のアミノ酸配列がリボソームの活動に直接影響を与えることもあります[7]。
● 結論
生体内でのポリペプチド合成は、転写と翻訳という二つの主要なステップを通じて行われます。このプロセスは、遺伝情報の正確な伝達とタンパク質の合成を可能にし、細胞の機能と生命活動を支えています。ポリペプチド合成の調節は、生体の応答性と適応性を保つために不可欠です。
第3章: ポリペプチドの生物学的機能
構造と機能
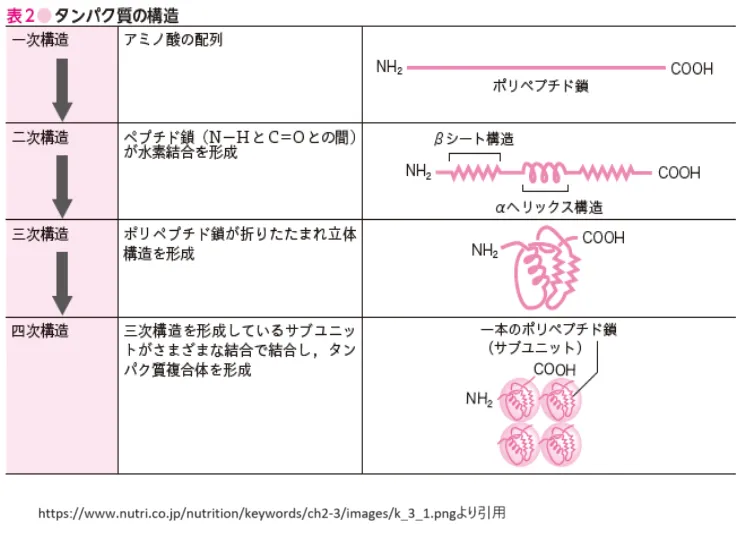
タンパク質は生命現象を担う重要な分子であり、その多様な生物学的機能は、ポリペプチドの構造によって決定されます。ポリペプチドはアミノ酸がペプチド結合によって連結したもので、その一次構造から四次構造までの階層的な構造が、特定の生物学的機能を果たすために必要な立体構造を形成します。
● 一次構造
一次構造は、ポリペプチド鎖を構成するアミノ酸の配列です。この配列は遺伝情報によって決定され、タンパク質の基本的な特性と機能を決める基礎となります。アミノ酸の側鎖(R基)の化学的性質によって、タンパク質の立体構造や機能が影響を受けます[16]。
● 二次構造
二次構造は、ポリペプチド鎖が取りうる規則的な構造で、主にαヘリックスとβシートがあります。これらの構造は、ポリペプチド鎖内の水素結合によって安定化されます。αヘリックスは右巻きのらせん構造で、βシートは平行または逆平行に並んだポリペプチド鎖が水素結合で結合した構造です。これらの構造は、タンパク質の安定性や機能的なドメイン形成に寄与します[12]。
● 三次構造
三次構造は、ポリペプチド鎖が空間的に折りたたまれて形成する立体構造です。この構造は、水素結合、疎水相互作用、イオン結合、ジスルフィド結合などの非共有結合的な相互作用によって安定化されます。三次構造は、タンパク質の機能的なサイトの形成や、特定の分子との相互作用に重要な役割を果たします[16]。
● 四次構造
四次構造は、複数のポリペプチド鎖(サブユニット)が特定の配列で組み合わさって形成される構造です。この構造によって、タンパク質はより複雑な機能を果たすことができます。例えば、ヘモグロビンは四つのポリペプチド鎖からなる四次構造を持ち、酸素の運搬という生物学的機能を担います[16]。
タンパク質の構造と機能の関係は、その構造が特定の生物学的プロセスにおいてどのように機能するかを決定します。例えば、酵素はその活性部位の三次構造によって基質特異性を持ち、化学反応を触媒します。また、抗体は病原体を認識するための特定の三次構造を持ち、免疫応答に関与します。このように、タンパク質の構造はその機能を直接的に決定し、生命現象の多様性と複雑性を支える基盤となっています。
ポリペプチドと疾患
ポリペプチドは、生体内で多様な生理的および病理的プロセスに関与しています。これらのプロセスは、健康状態の維持から疾患の発生に至るまで、生命活動の基本的な機能を担っています。
♦ 生理的プロセス
● タンパク質のフォールディング
ポリペプチド鎖が特定の立体構造を形成するプロセスは、タンパク質の機能を決定します。このプロセスは、細胞内で作られたばかりのポリペプチド鎖が折りたたまれて特定の立体構造を形成することにより、タンパク質がその機能を発揮できるようになります[11]。
● ホルモンとしての機能
ポリペプチドは、ホルモンとしても機能します。ホルモンは、成長、発育、代謝、生殖などの生理的プロセスを制御や調節する際に重要な役割を果たします[14]。
♦ 病理的プロセス
● 神経変性疾患
ポリペプチドの異常な凝集は、アルツハイマー病、パーキンソン病、ハンチントン病、筋委縮性側索硬化症(ALS)などの神経変性疾患に関与しています。これらの疾患では、特定のポリペプチドが変性し、凝集して細胞に悪影響を及ぼし、病気が引き起こされることがあります[11]。
● 抗菌薬としてのポリペプチド
ポリペプチド系抗菌薬は、細菌の細胞壁や細胞膜を破壊することで、細菌の増殖を阻害し、細菌感染症を治療します。これらの薬剤は、特に耐性菌に対する治療オプションとして重要です[4]。
● タンパク質の品質管理
細胞内では、間違った構造のポリペプチドを正しい構造にフォールディングし直す品質管理機構や、バラバラに分解して無毒化する分解機構が備わっています。これらの機構が弱くなると、間違った構造のポリペプチドは細胞内で凝集・蓄積し、病気が引き起こされることがあります[11]。
ポリペプチドは、生体内での正常な機能の維持から疾患の発生に至るまで、多岐にわたる生理的および病理的プロセスに深く関与しています。これらのプロセスの理解は、新たな治療法の開発や疾患の予防につながる可能性があります。
- 参考文献・出典
-
[4] www.msdmanuals.com/ja-jp/%E3%83%97%E3%83%AD%E3%83%95%E3%82%A7%E3%83%83%E3%82%B7%E3%83%A7%E3%83%8A%E3%83%AB/13-%E6%84%9F%E6%9F%93%E6%80%A7%E7%96%BE%E6%82%A3/%E7%B4%B0%E8%8F%8C%E3%81%8A%E3%82%88%E3%81%B3%E6%8A%97%E8%8F%8C%E8%96%AC/%E3%83%9D%E3%83%AA%E3%83%9A%E3%83%97%E3%83%81%E3%83%89%E7%B3%BB%E6%8A%97%E8%8F%8C%E8%96%AC-%E3%83%90%E3%82%B7%E3%83%88%E3%83%A9%E3%82%B7%E3%83%B3-%E3%82%B3%E3%83%AA%E3%82%B9%E3%83%81%E3%83%B3-%E3%83%9D%E3%83%AA%E3%83%9F%E3%82%AD%E3%82%B7%E3%83%B3b
[11] katosei.jsbba.or.jp/view_html.php?aid=1164
[14] www.labxchange.org/library/items/lx-pb:e644a341-61a7-44eb-8791-b05e1a4828f8:html:19a8c048
第4章: ポリペプチドの医学的応用
抗菌薬としてのポリペプチド
ポリペプチド系抗菌薬は、細菌の細胞壁や細胞膜に作用することで、細菌の増殖を阻害または細菌を殺菌する薬剤です。このクラスの代表的な薬剤にはバシトラシン、コリスチン(ポリミキシンE)、ポリミキシンBなどがあります。
● ポリペプチド系抗菌薬の作用機序
ポリペプチド系抗菌薬は、細菌の細胞壁合成を阻害するか、細胞膜の透過性を変化させることにより、細菌を殺菌的に作用します。例えば、バシトラシンは細胞壁合成を阻害し、グラム陽性細菌に対して活性を示します[3]。一方、コリスチン(ポリミキシンE)およびポリミキシンBは、カチオン性のポリペプチド系抗菌薬であり、負に帯電した細菌外膜に結合し、外膜を破壊することで細菌の毒性を中和し、細菌細胞を死滅させます[3][4]。
● ポリペプチド系抗菌薬の臨床用途
ポリペプチド系抗菌薬は、特定の感染症に対して使用されます。バシトラシンは主に皮膚感染症に対して外用で使用され、黄色ブドウ球菌(Staphylococcus aureus)による表在性の皮膚感染症の治療に用いられます[4]。コリスチンとポリミキシンBは、他の抗菌薬に耐性を持つ細菌による重篤な感染症に対して使用されることがあります。これらの薬剤は、特に緑膿菌(Pseudomonas aeruginosa)やAcinetobacter属細菌に対して効果があり、これらのグラム陰性桿菌が引き起こす感染症に対して使用されることがあります[3][4]。
● 耐性問題
ポリペプチド系抗菌薬に対する耐性は、細菌の外膜リポ多糖のリピドA部分への修飾を介して獲得されることが多く、これにより細菌表面がさらに正に帯電し、ポリミキシン系薬剤への親和性が喪失します[3]。コリスチンとポリミキシンBの交差耐性はほぼ100%であり、耐性菌の出現には注意が必要です。
● 副作用と注意点
ポリペプチド系抗菌薬は、特にコリスチンとポリミキシンBは腎障害を引き起こす可能性があるため、他の安全な代替薬がない場合にのみ使用されることが推奨されます[4]。また、ポリミキシンBは強い細胞毒性を示し、重篤な副作用として腎障害や神経毒性を引き起こすことがありますが、多剤耐性緑膿菌に対して効果を示すことが判明しており、臨床的重要性が高まっています[5]。
以上の情報は、ポリペプチド系抗菌薬の作用機序と臨床用途についての概要を示しています。これらの薬剤は、特定の感染症に対して有効な治療選択肢を提供する一方で、耐性の問題や副作用のリスクに注意を払う必要があります。
- 参考文献・出典
-
[3] www.msdmanuals.com/ja-jp/%E3%83%97%E3%83%AD%E3%83%95%E3%82%A7%E3%83%83%E3%82%B7%E3%83%A7%E3%83%8A%E3%83%AB/13-%E6%84%9F%E6%9F%93%E6%80%A7%E7%96%BE%E6%82%A3/%E7%B4%B0%E8%8F%8C%E3%81%8A%E3%82%88%E3%81%B3%E6%8A%97%E8%8F%8C%E8%96%AC/%E3%83%9D%E3%83%AA%E3%83%9A%E3%83%97%E3%83%81%E3%83%89%E7%B3%BB%E6%8A%97%E8%8F%8C%E8%96%AC-%E3%83%90%E3%82%B7%E3%83%88%E3%83%A9%E3%82%B7%E3%83%B3-%E3%82%B3%E3%83%AA%E3%82%B9%E3%83%81%E3%83%B3-%E3%83%9D%E3%83%AA%E3%83%9F%E3%82%AD%E3%82%B7%E3%83%B3b
[4] www.msdmanuals.com/ja-jp/%E3%83%9B%E3%83%BC%E3%83%A0/16-%E6%84%9F%E6%9F%93%E7%97%87/%E6%8A%97%E8%8F%8C%E8%96%AC/%E3%83%9D%E3%83%AA%E3%83%9A%E3%83%97%E3%83%81%E3%83%89%E7%B3%BB
[5] www.jstage.jst.go.jp/article/toxpt/48.1/0/48.1_P-114S/_article/-char/ja/
治療薬としてのポリペプチドの展望
ポリペプチドは、その多様な生物学的活性と生体内での高い特異性により、治療薬としての可能性が広く認識されています。近年の研究開発により、ポリペプチドはさまざまな疾患の治療に応用されることが期待されており、その展望は以下のようにまとめられます。
● 再生医療と組織工学
ポリペプチドは、細胞の増殖や分化を促進する生物活性を持つため、再生医療や組織工学において重要な役割を果たすことが期待されています。例えば、コラーゲン様ポリペプチドは、網膜疾患の治療に焦点を当てた研究で注目されており、臓器の再生を促す治療法の開発が進められています[12]。また、ペプチドハイドロゲルは、細胞の足場材料として使用され、組織の再生を支援する可能性があります[3]。
● 抗体医薬品との組み合わせ
抗体医薬品の開発においても、ポリペプチドは重要な役割を担っています。ポリペプチドは、抗体の特定の部位に結合し、その機能を変化させることで、新たな治療薬の開発に寄与することができます[14]。また、ペプチドを用いて金ナノ粒子を合成し、がん細胞の光温熱療法に利用する研究も進行中です[10]。
● 神経系への応用
ポリペプチドは、神経系への応用においても有望です。細胞膜透過ペプチドは、神経細胞への薬剤の送達を改善するために利用される可能性があります[17]。さらに、筋萎縮性側索硬化症(ALS)や前頭側頭型認知症(FTD)の治療において、異常なポリペプチドの合成を制御するメカニズムが発見され、新たな治療戦略への期待が高まっています[16]。
● バイオ医薬品としての応用
ポリペプチドは、インスリンや抗体医薬品などのバイオ医薬品の合成効率を向上させるためにも利用されます。タンパク質の立体構造形成を促進する化合物の開発により、バイオ医薬品の製造プロセスが改善されることが期待されています[20]。
● 市場の成長と展望
ペプチド治療薬市場は、2020年に約285億1060万米ドルの規模であり、予測期間中に9.66%のCAGRで成長すると予想されています[19]。この成長は、ペプチド治療薬の新たな応用領域の開拓と、既存の治療薬に対する需要の増加によるものです。
● まとめ
ポリペプチドは、その多様な機能と生体適合性により、医療分野での応用が広がっています。再生医療、抗体医薬品、神経系治療、バイオ医薬品の製造など、多岐にわたる分野での研究開発が進められており、今後もその活用範囲は拡大していくことが期待されます。ポリペプチド治療薬市場の成長は、これらの研究成果が臨床応用に移行するにつれて、さらに加速すると予想されます。
- 参考文献・出典
-
[3] www.kansai-u.ac.jp/ku-smart/newsletter/2024/02/kump.html
[4] www.medicaldo.co.jp/gene/peptide_tanpaku.html
[5] www.jst.go.jp/pr/announce/20230630/pdf/20230630.pdf
[6] www.dbj.jp/upload/investigate/docs/ae68750b353bd3b96ca97bccdfcf12d2.pdf
[7] webmagazine.nedo.go.jp/images/201804peptide/201804peptide.pdf
[8] www.riken.jp/press/2022/20220621_2/index.html
[9] www.amed.go.jp/news/seika/2023_seika_index.html
[10] www.titech.ac.jp/news/2021/061177
[11] www.tohoku.ac.jp/japanese/newimg/pressimg/tohokuuniv_press0129_01web_protein.pdf
[12] bio.nikkeibp.co.jp/atcl/column/16/021500017/070400288/
[13] www.tuat.ac.jp/outline/disclosure/pressrelease/2022/20230213_01.html
[14] www.jstage.jst.go.jp/article/dds/37/5/37_378/_pdf
[15] www.tohoku.ac.jp/japanese/2024/01/press20240129-01-protein.html
[16] www.titech.ac.jp/news/2023/067178
[17] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2017.890021/data/index.html
[18] www.riken.jp/press/2018/20180226_1/index.html
[19] www.gii.co.jp/report/moi1197920-peptide-therapeutics-market-growth-trends-covid.html
[20] www.fris.tohoku.ac.jp/feature/topics/detail—id-1301.html
第5章: ポリペプチドの研究と開発
研究の最前線
● ポリペプチドの医薬品としての応用
ポリペプチドは、その生物学的活性と多様性により、医薬品開発の重要な分野となっています。東京大学教授でペプチドリーム社外取締役の菅裕明氏によると、ペプチド医薬品は医療を変える可能性を秘めていますが、実用化されたペプチド医薬品の数はまだ少ないです[1]。ペプチドリームは、RAPIDシステムの実用化に向けた改良を経て、独自の創薬開発プラットフォームシステム「PDPS」を構築しました。これにより、製薬企業が特殊ペプチドを探索する際に、標的タンパク質に対するペプチドのスクリーニングが可能になりました[1]。
● 抗がんペプチドの研究進展
抗がんペプチドは、腫瘍細胞膜の構造を破壊するか、がん細胞の増殖と移動、腫瘍血管の形成を抑制することができるとされています。これらのペプチドは、細菌に対して広範囲かつ効率的な殺菌活性を持ち、抗がんペプチドの研究は臨床実験段階にあるものも含めて進展しています[2]。
● タンパク質の立体構造形成を促進する化合物の開発
東京農工大学大学院工学府と東北大学学際科学フロンティア研究所の研究では、タンパク質の立体構造形成を促進する化合物が開発されました。この化合物は、ジスルフィド結合形成を伴う酸化的タンパク質フォールディングを促進する効果を持ち、バイオ医薬品の合成効率向上やミスフォールディング病の予防・治療薬の開発に貢献することが期待されています[3]。
● ポリペプチドの合成とその性質に関する研究
神戸大学の研究では、ポリペプチド原料を光オン・デマンド合成する技術が開発されました。この技術により、ポリペプチド原料を安全に、オン・サイト、オン・デマンドで合成できるようになり、バイオ由来の機能性ポリペプチドの開発を加速させることができます[12]。
● 科学的課題
ポリペプチド研究の科学的課題は多岐にわたります。ペプチド医薬品の実用化には、体内での安定性や生物学的活性の向上、製造コストの削減などが挙げられます[1]。また、抗がんペプチドの研究では、臨床実験段階にあるペプチドの有効性や安全性を確認し、治療薬としての応用を目指す必要があります[2]。タンパク質の立体構造形成を促進する化合物の開発では、その効率と特異性をさらに高めることが求められます[3]。ポリペプチドの合成技術においては、環境負荷を低減しつつ、効率的かつ経済的に合成する方法の開発が課題です[12]。
これらの課題に対処するためには、分子生物学、化学、生物物理学などの異なる分野の専門知識を統合し、新しい技術や方法論の開発が不可欠です。また、ポリペプチドの生体内での挙動を理解し、その知見を医薬品開発に応用するための基礎研究も重要です。
新たなポリペプチドの合成と応用
ポリペプチドは、複数のアミノ酸がペプチド結合によって連結された化合物であり、その構造と機能の多様性により、医薬品、材料科学、生物学など多岐にわたる分野での応用が期待されています。近年、新たな合成技術の開発により、これまでにない特性を持つポリペプチドの合成が可能になり、その応用範囲はさらに広がりつつあります。
♦ 合成ポリペプチドの新たな合成技術
● 光オン・デマンド合成法
神戸大学の研究グループは、光オン・デマンドホスゲン化反応を用いて、汎用有機溶媒のクロロホルムとアミノ酸から、安全・安価・簡単にNCA(α-アミノ酸 *N*-カルボン酸無水物)の合成に成功しました。この方法は、従来のホスゲン法や代替法と比較して、原料が安価で、作業がシンプルで簡単、廃棄物が少ないという特徴があります[8]。
● 低コスト・低廃棄物の大量合成法
産業技術総合研究所と東京大学の共同研究により、保護基の使用を最小限に抑え、ブロックをつなげるようにペプチドを合成する新しい方法が開発されました。この技術は、廃棄物の低減と安価な原料の活用により、ペプチドの大量供給へ貢献するとともに、食品・農薬・化粧品・材料などの新たな用途開拓にも貢献します[3]。
♦ ポリペプチドの新しい応用
● 医薬品開発
ペプチド医薬品は、標的のタンパク質に特異的に作用することができ、開発費を低く抑えられるなどの利点があります。ペプチドリーム社は、独自の創薬開発プラットフォームシステム「PDPS」を構築し、特殊ペプチドの探索・合成を行っています。この技術は、多くの製薬企業で薬の探索に使われるようになり、創薬のパラダイムシフトが起きることが期待されています[1]。
● 材料科学
ポリペプチドは、その構造により特定の物理的・化学的性質を持ち、生体材料や機能性材料としての応用が期待されています。例えば、光応答性ポリペプチドドメインを有する高分子膜の合成と応用に関する研究が行われており、これらの材料は環境や健康に関連する多くの応用に利用される可能性があります[17]。
● 生物学・バイオテクノロジー
合成ポリペプチドは、エピトープ特異的抗体の調製、抗体エピトープや酵素結合部位のマッピング、新規の酵素・薬剤・ワクチンなどの設計に利用されています。これらの応用は、疾患の診断や治療、バイオテクノロジーの進歩に貢献しています[9]。
新たな合成技術の開発と応用の拡大により、ポリペプチドは今後も多くの分野で重要な役割を果たすことが期待されます。
- 参考文献・出典
-
[1] webmagazine.nedo.go.jp/practical-realization/articles/201804peptide/
[2] patents.google.com/patent/JP4535670B2/ja
[3] prtimes.jp/main/html/rd/p/000000055.000113674.html
[4] www3.chubu.ac.jp/documents/research/news/25200/25200_79876a816e3608b24cf0cd245a77b4d1.pdf
[5] resou.osaka-u.ac.jp/ja/research/2019/20190517_2
[6] labchem-wako.fujifilm.com/jp/siyaku-blog/010987.html
[7] kaken.nii.ac.jp/ja/grant/KAKENHI-PROJECT-61490008/
[8] www.kobe-u.ac.jp/ja/news/article/2022_10_19_01/
[9] www.thermofisher.com/us/en/home/life-science/protein-biology/protein-biology-learning-center/protein-biology-resource-library/pierce-protein-methods/peptide-synthesis.html
[10] www.thermofisher.com/us/en/home/life-science/protein-biology/protein-biology-learning-center/protein-biology-resource-library/pierce-protein-methods/peptide-design.html
[11] www.jstage.jst.go.jp/article/adhesion/44/4/44_4-1/_pdf
[12] www.jstage.jst.go.jp/article/adhesion/44/6/44_6-1/_pdf
[13] www.youtube.com/watch?v=lcvp42AQsTg
[14] jglobal.jst.go.jp/detail?JGLOBAL_ID=202202276858509845
[15] patents.google.com/patent/JP2023540541A/ja
[16] www.jstage.jst.go.jp/article/adhesion/45/3/45_3-1/_pdf
[17] kaken.nii.ac.jp/ja/grant/KAKENHI-PROJECT-62213009/
[18] www.youtube.com/watch?v=KnWim17mA9M
[19] patents.google.com/patent/JP5162363B2/ja
[20] www.jstage.jst.go.jp/article/fiber1944/30/4/30_4_P232/_article/-char/ja/