疾患に関係する遺伝子/染色体領域
疾患概要
Cerebrotendinous xanthomatosis 脳腱黄色腫症 213700 AR 3
脳腱性黄色腫症(CTX)は、染色体2q35に位置するステロール27-水酸化酵素をコードするCYP27A1遺伝子のホモ接合体または複合ヘテロ接合体変異によって引き起こされるまれな常染色体劣性遺伝病です。この疾患は、進行性の神経機能障害、早発性のアテローム性動脈硬化症、白内障を特徴とし、コレステロールとその5-α-ジヒドロ誘導体であるコレスタノールの体内蓄積がみられます。特に、コレスタノールはコレステロールに比べてすべての組織で豊富に見られ、診断には血清や腱における異常なコレスタノール量の確認が重要です。CTX患者の血漿コレステロール濃度は通常、正常値より低いことが特徴です。
Dottiら(2001年)は、CTX患者の眼科所見について研究し、全症例に白内障が確認されたほか、一部の患者では視神経乳頭蒼白や網膜の早期老化が観察されました。これらの所見は、CTXによる視覚系への影響の理解を深めるものです。
Moghadasianら(2002年)は、CTXを家族性高コレステロール血症や座位ステロール血症と比較し、これら脂質異常症の間に一定の類似性と臨床経過が存在することを示しました。これらの研究は、CTXの病態生理と臨床的特徴のより深い理解に寄与し、診断と治療の戦略に影響を与える可能性があります。
脳腱性黄色腫症は、特定の脂質、特にコレステロールの異常な蓄積を特徴とする遺伝性疾患です。この病状により、脳や腱など体の多くの部位に黄色腫と呼ばれる脂肪性の黄色い小結節が形成されます。これらの黄色腫は、特に神経組織や結合組織に影響を及ぼし、多様な臨床症状を引き起こします。
成人期早期には、神経学的問題が主な症状として現れ、てんかん、運動障害、言語障害、末梢神経障害、認知症、幻覚、うつ病などが含まれます。これらの神経学的障害は、黄色腫が神経絶縁物質であるミエリンに蓄積し、ミエリンを破壊することによるものです。さらに、脳組織の変性や萎縮も神経学的症状に寄与します。
腱の黄色腫は、主に手、肘、膝、首、足のかかととふくらはぎに接続するアキレス腱に発生します。これらは不快感を引き起こす可能性があり、腱の柔軟性を阻害することがあります。
小児期には白内障の発症が見られることがあり、慢性的な下痢や胆汁うっ滞などの消化器系の問題、黄疸、骨粗鬆症なども報告されています。心臓や肺への脂質の蓄積により、心血管系疾患や呼吸不全のリスクも高まります。
脳腱性黄色腫症は個人によって症状の程度が大きく異なり、未治療の場合は症状が時間とともに進行する可能性があります。この疾患の管理と治療は、患者の症状に応じて行われる必要があります。
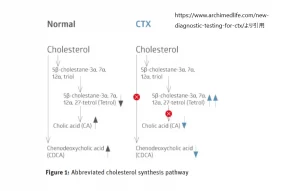
脳腱黄色腫症(Cerebrotendinous Xanthomatosis, CTX)は、CYP27A1遺伝子の変異によって引き起こされる遺伝性疾患です。CYP27A1遺伝子はステロール27-ヒドロキシラーゼをコードしており、この酵素はコレステロールから胆汁酸への変換に重要な役割を果たします。この遺伝子の変異は、少なくとも90個同定されており、その多くがタンパク質構成アミノ酸の変化を引き起こします。
最も一般的な変異の一つはArg362Cys(R362C)であり、これはタンパク質の362番目のアルギニンがシステインに変化するものです。このようなアミノ酸の変化は、ステロール27-ヒドロキシラーゼの正常な機能を破壊し、結果としてチェノデオキシコール酸の形成が阻害されます。機能的な酵素が産生されないことで、コレステロール代謝経路が乱れ、コレステロールに似たコレスタノールが生成され、これが血液や組織に蓄積します。血液中のコレステロール濃度は通常正常であるにもかかわらず、組織にはコレステロールも蓄積します。
脳腱黄色腫症は、体内のさまざまな部位における脂質の異常蓄積を特徴とし、特に腱や脳に黄色腫(脂肪の塊)が形成されます。この疾患は、発達遅延、進行性の神経障害、運動障害、認知障害、そして心血管疾患のリスクの増加など、多様な臨床的徴候や症状を引き起こします。
CTXの診断は、遺伝子検査によって確定され、CYP27A1遺伝子の特定の変異を同定することで行われます。早期診断と適切な治療により、CTXの進行を遅らせることが可能であり、コレステロールとコレスタノールの蓄積を減少させる薬物治療が効果的です。
臨床的特徴
特に、神経障害の発症が後期になる可能性があることや、治療が開始されない限り、塩類消耗症や女性の重度の男性化が見られることが報告されています。また、慢性下痢や若年性白内障がCTXの初期症状である可能性があることが示唆されています。
MRIやCTの所見からは、大脳および/または小脳の萎縮、大脳基底核に分布する局所病変などが観察され、これらの病変の一部は黄色腫であると思われます。
遺伝子解析を通じて、この疾患の背後にある分子メカニズムが明らかになりつつあります。特に、CYP27A1遺伝子の変異が確認されており、この酵素の欠損がコレステロールとコレスタノールの蓄積、そしてそれに伴う黄色腫、神経変性、白内障、動脈硬化を引き起こすことが示唆されています。
さらに、コレステロール27-水酸化酵素の欠損活性が新生児期の胆汁うっ滞性黄疸を引き起こす可能性があり、この状態は自己限定的である可能性があるとも考えられています。
前頭側頭型痴呆の発症や、進行性の精神神経疾患の発症が報告されている例もあり、CTXの臨床的表現は非常に多様であることがわかります。これらの報告は、CTXの早期発見と治療の重要性を強調しています。
生化学的特徴
Setoguchiら(1974年): CTX1患者では胆汁酸産生が低下しているが、コレステロール7-α-ヒドロキシラーゼ活性は上昇していると報告しました。これは胆汁酸合成経路における調整の失敗を示唆しています。
Oftebroら(1980年): CTX患者の肝臓ミトコンドリアにおいて、26-ヒドロキシラーゼ活性が欠如していることを発見しました。この酵素は、チェノデオキシコール酸の生成に重要な役割を果たします。
Shoreら(1981年): CTX患者では、胆汁酸合成欠陥に加えて、高密度リポ蛋白(HDL)の異常があることを発見しました。HDLのコレステロール含有量が低いことが観察されました。
Bjorkhemら(1983年): CTXは、肝ミトコンドリアのC27-ステロイド26-ヒドロキシラーゼの欠如によるものであるという結論を支持しました。
Skredeら(1986年): CTX患者の培養皮膚線維芽細胞では、26-ヒドロキシル化活性が著しく低下していることを証明しました。
Koopmanら(1988年): ガスクロマトグラフィーを用いて尿中の特定の胆汁アルコールを測定することで、CTXの診断に有効であることを報告しました。また、コレスチラミンの経口投与により胆汁酸プールが減少し、ヘテロ接合体で異常な胆汁酸の産生が誘発されることを発見しました。
これらの研究成果は、CTXの生化学的特徴や診断法の開発、さらには治療戦略の策定に貢献しています。特に、胆汁酸合成経路の異常がCTXの主要な特徴であることや、異常な胆汁酸の蓄積が疾患の進行に関与していることを示しています。これらの知見は、CTXのより良い理解と管理に向けた基盤を提供します。
遺伝
頻度
常染色体劣性遺伝病の場合、病気の発生率(q^2)と保因者頻度(2pq)はハーディ・ワインベルグの法則に従います。ここで、qは劣性対立遺伝子の頻度、pは優性対立遺伝子の頻度です(p + q = 1)。
病気の発生率が100万人に1人の場合、q^2 = 1/1,000,000 です。したがって、q = √(1/1,000,000) = 1/1,000 となります。
p = 1 – q なので、p = 1 – 1/1,000 = 999/1,000 です。
保因者頻度(2pq)を求めると、2pq = 2 * (999/1,000) * (1/1,000) = 1,998/1,000,000 ≈ 2/1,000 となります。
したがって、この常染色体劣性疾患の保因者頻度は約1000人に2人、つまり約500人に1人と計算できます。
原因
CYP27A1遺伝子の変異により、ステロール27-ヒドロキシラーゼが適切に機能しないか、または異常な形で産生されると、コレステロールの代謝経路が乱れ、チェノデオキシコール酸の形成が阻害されます。この障害により、コレステロールと類似した構造を持つコレスタノールや胆汁アルコールなどの異常な脂質が生成され、これらが血中で増加します。
脳腱性黄色腫症では、コレスタノールと胆汁アルコールの増加により、脳、腱、心臓を含む体内のさまざまな組織にこれらの脂質が蓄積します。特に、腱や脳に形成される黄色腫はこの病気の特徴的な徴候であり、神経系の障害や身体機能の低下を引き起こします。血中のコレステロール濃度は通常正常であるため、脳腱性黄色腫症は血中コレステロール値だけでは診断できません。
脳腱性黄色腫症の徴候や症状には、発作、神経障害、身体機能の低下、腱の異常な腫瘤(特にアキレス腱やその他の腱に形成される黄色腫)、早期の心臓病変などがあります。早期診断と治療が重要であり、胆汁酸の補充療法や脂質異常を改善する薬剤が症状の管理に用いられることがあります。
治療・臨床管理
Berginerら(1984年)の研究では、CDCAによる治療がCTXの多様な症状に対して有効であることが示されました。治療前はすべての患者が症候性でありましたが、治療後には認知症、錐体・小脳徴候、末梢神経障害、脳波、CTスキャンの異常など多くの症状が改善または消失しました。特に、平均血漿中コレスタノール濃度が3倍低下したことは、CDCAによる治療がコレスタノール合成を大幅に減少させることを示しています。
Salenら(1987)は、CDCAによる治療が脳脊髄液中の高レベルのコレステロールとコレスタノールを減少させることを見出しました。これは、CDCA治療によって血液脳関門の選択的透過性が再確立されることを示唆しています。
栗山ら(1994)は、CDCA単独、プラバスタチン単独、またはその併用による治療がCTX患者に与える影響を検討しました。CDCA単独治療は血清コレスタノールを減少させましたが、リポ蛋白代謝における「アテローム性」変化を引き起こしました。プラバスタチンは顕著な抗アテローム性を示しましたが、コレスタノールとシトステロール濃度の低下はわずかでした。CDCAとプラバスタチンの併用治療は、血清リポ蛋白代謝の改善とコレスタノール及び植物ステロールレベルの低下をもたらし、疾患の進行を阻止しましたが、臨床症状の劇的な逆転は見られませんでした。
これらの研究結果から、CTXの臨床管理においては、血清コレスタノール検査による早期診断と、CDCAおよびプラバスタチンを含む治療戦略が重要であることが示されています。治療による症状の改善や疾患進行の阻止が期待されますが、個々の患者に合わせた治療の選択と管理が必要です。
分子遺伝学
Caliら(1991年)による研究では、脳腱性黄色腫症の原因としてCYP27A1遺伝子に存在する変異が初めて同定されました。彼らは、血縁関係のない2人の患者でCYP27A1のホモ接合体変異を特定し、これがCTXの分子遺伝学的基盤を明らかにした重要な発見でした。
一方、Guyant-Marechalら(2005年)は、44歳から進行性の精神神経障害を伴う珍しいCTX表現型を持つ53歳の男性において、CYP27A1遺伝子の複合ヘテロ接合体変異を同定しました。この研究では、CTXが有する多様な臨床的表現と、精神発達障害がない場合でも進行性の精神神経障害を示すことがあることが示されました。
これらの研究は、脳腱性黄色腫症の分子遺伝学的診断と理解に貢献し、特定の遺伝子変異が疾患の特定の臨床的表現にどのように関連しているかを明らかにしています。CYP27A1遺伝子の変異を特定することは、正確な診断、治療計画の策定、および患者とその家族への遺伝相談において重要な役割を果たします。
集団遺伝学
この研究例からわかるように、特定の集団における遺伝子の頻度は、その集団のメンバーに影響を及ぼす特定の疾患のリスクを示すことができます。また、集団内での遺伝子の頻度は、遺伝子ドリフト、創始者効果、またはボトルネック効果などの遺伝的現象によっても影響を受けることがあります。これらの現象は、小さな集団が新しい地域に移住する際に、特定の遺伝子変異が偶然にもより高い頻度で集団内に残ることを引き起こすことがあります。
この研究がどの疾患を対象としていたかの詳細は示されていませんが、特定の遺伝的リスクが集団内で高頻度で見られる場合、それに対する意識の高まりや適切な予防措置の導入が特に重要になります。
疾患の別名
Cerebrotendinous cholesterinosis
Cholestanol storage disease
Cholestanolosis
CTX
Van Bogaert-Scherer-Epstein disease
脳コレステロール症
脳腱性コレステロール症
コレスタノール貯蔵症
コレスタノーシス
ヴァン・ボガート・シェーラー・エプスタイン病