承認済シンボル:EMD
遺伝子名:emerin
参照:
HGNC: 3331
AllianceGenome : HGNC : 3331
NCBI:2010
Ensembl :
UCSC : EMD (ENST00000369842.9) from GENCODE V47
遺伝子OMIM番号300384
●遺伝子のlocus type :タンパク質をコードする
●遺伝子のグループ:LEM domain containing
●遺伝子座: Xq28
●ゲノム座標: X:154,379,295-154,381,523
遺伝子の別名
emerin (Emery-Dreifuss muscular dystrophy)
STA
遺伝子の概要
EMD遺伝子に突然変異が生じると、エメリンの機能が失われ、核膜の安定性が崩れるために筋細胞の損傷や劣化を引き起こします。この遺伝子変異はエメリ・ドリーフス型筋ジストロフィー(EDMD)という疾患の原因となります。EDMDは、骨格筋の筋力低下や関節の硬直、心臓の異常などを特徴とする遺伝性の筋疾患で、主に骨格筋と心筋に影響を及ぼします。
EMD遺伝子が生成するエメリンというタンパク質は、特に筋肉(骨格筋と心筋)の正常な機能に重要な役割を果たしています。エメリンは、細胞内で核膜の内側に位置しており、核膜の安定性と構造を維持する役割を持っています。核膜は細胞の核を囲み、核と細胞質(核の外側の液体部分)を分けるバリアとして機能し、分子の出入りを調節するなどの重要な役割を担っています。
エメリンは核膜内表面で他のタンパク質と相互作用し、以下のような細胞機能を支えています。
1. 遺伝子活性の制御
– エメリンと結びつくタンパク質群は、特定の遺伝子の発現を調整するために働き、細胞の特定の機能が正常に遂行されるようにしています。
2. 細胞分裂のサポート
– 細胞が分裂する際に、核膜の再構築を促し、分裂後の核の安定性を維持します。
3. 化学シグナル伝達の調整
– 細胞内外の情報の伝達に関わり、細胞の応答や適応を助けます。
エメリンの機能が失われると、筋肉や心筋の細胞に特に影響を及ぼし、筋ジストロフィーなどの疾患に関連することがあります。
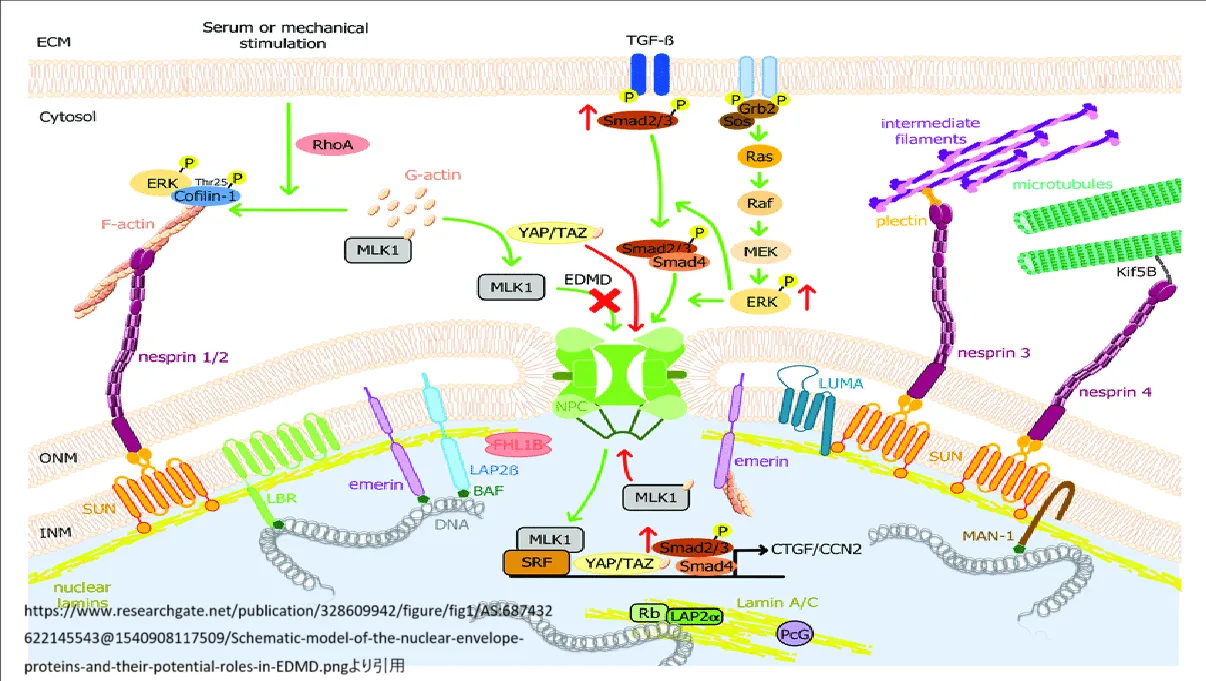
www.researchgate.net/figure/Schematic-model-of-the-nuclear-envelope-proteins-and-their-potential-roles-in-EDMD_fig1_328609942
より引用
核膜タンパク質の模式図とEMDの生理病理における潜在的役割。 核ラミンはINMの下で細胞質と連結した網目構造を形成している。 核ラミンは核膜のTMタンパク質、すなわちエメリン、LBR、LAP2、SUN1/2、MAN1、およびRbなどのいくつかの転写因子と相互作用する。 LINC複合体を介して、A型ラミンはアクチン微小フィラメント、微小管、細胞質中間フィラメントと相互作用し、核膜と細胞外マトリックスをつないでいる。 MAPK経路は、細胞表面の細胞外マイトジェン、成長因子、サイトカインによって開始され、遺伝子発現を制御するために核に最終的に到達する重要な伝達カスケードであり、細胞の増殖と分化、生存とアポトーシスを制御する。 EDMDの原因となるLMNA変異は、ERK、JNK、p38αカスケードの活性化に関連しており、TGF-β/Smadシグナル伝達経路を介したCTGF/CCN2の後方活性化、およびコフィリン-1の活性化につながり、後者はアクチンの脱重合につながる。 血清または機械的刺激後、RhoAは細胞質アクチンの重合を促進し、細胞質G-アクチンからMKL1の遊離を引き起こす。 MKL1は核内に移動し、SRFとともに遺伝子発現を誘導する。 さらに、エメリンは核アクチンの重合を促進し、MKL1の核から細胞質への輸送を減少させる。 EDMD細胞では、エメリンは局在を誤り、核内アクチンの重合を調節できない。 G-アクチンはMKL1に結合し、MKL1は核から排出され、遺伝子発現を障害する。 YAPとTAZは細胞増殖の鍵となる転写因子である。 YAP/TAZの活性化はそれらの核内蓄積を引き起こし、細胞増殖を促進し、分化を阻害する。 YAP/TAZの核局在は、LMNA変異を持つ患者の筋芽細胞で増加している。 緑の矢印は報告された経路を、赤の矢印はEDMDで報告された経路の変化を示す。 BAF、バリアー自己接着因子、ECM、細胞外マトリックス、EMD、エメリー・ドライフス筋ジストロフィー、ERK、細胞外シグナル制御キナーゼ、F-アクチン、アクチンフィラメント、G-アクチン、球状アクチン; Grb2、成長因子受容体結合タンパク質2;INM、核内膜;Kif5B、キネシンファミリーメンバー5B;LAP、ラミン関連タンパク質;LBR、ラミンB受容体;MAPK、マイトジェン活性化タンパク質キナーゼ; MKL1、巨核芽球性白血病1;NPC、核膜孔複合体;ONM、外核膜;Raf、がん原性セリン・スレオニン・プロテインキナーゼ;Rb、網膜芽細胞腫タンパク質;RhoA、ラスホモログファミリーメンバーA; Sos、son of sevenless homolog 1、SRF、血清反応因子、TGF-β、トランスフォーミング増殖因子β、YAP、yes-associated protein 1、TAZ、PDZ結合モチーフを持つ転写コアクチベーター。
遺伝子と関係のある疾患
遺伝子の発現とクローニング
その後、Manilalら(1996年)はエメリンcDNAの大部分を大腸菌で発現させ、12種類のモノクローナル抗体を作成しました。この抗体は、エメリンに存在する4つの異なるエピトープを認識し、すべての組織で34kDのタンパク質を確認しました。免疫蛍光および細胞分画の実験により、エメリンが核膜に局在していることが確認され、エメリンは核ラミナ関連タンパク質ファミリーに属することが示唆されました。
さらに、Smallら(1997年)はマウスのエメリン遺伝子を単離し解析しました。2.9 kbのこの遺伝子は6つのエクソンからなり、ヒトエメリンタンパク質と73%の同一性を持っています。マウスエメリンもまたラミナ関連タンパク質であるLAP2(188380)に類似しており、セリンが豊富でリン酸化部位を含む点でヒトエメリンと共通しています。
遺伝子の構造
マッピング
遺伝子の機能
依藤ら(1997年)の研究も、エメリンが核膜の内側に局在することを示し、エメリンが核膜の内側核膜に沿って固定され、親水性の部分が核質へ突出し、核ラミナと相互作用することが分かりました。特に、収縮と弛緩を繰り返す骨格筋や心筋などの組織で、核の構造と安定性を維持し、核機能に重要な役割を果たしていると考察されました。
さらに、Leeら(2001年)は、エメリンの疾患関連変異がラミンAとの結合ドメインに位置するものがあることを確認し、これがラミンAとの相互作用を破壊する可能性があることを示しました。また、エメリンはDNA架橋タンパク質であるBAFと直接結合し、この結合にはエメリンのN末端LEMドメインにある保存残基が必要であることが明らかにされました。エメリンが疾患に関連する変異を持っている場合でも、BAFとの結合活性はin vitroおよびin vivoの両方で保持されていました。
Haraguchiら(2001年)は、HeLa細胞における終期に染色体の「コア」領域でエメリンとBAF(BANF1)が共局在する様子を観察しました。エメリンがBAFと結合できない変異体では、核質や再形成された核膜に局在できませんでした。さらに、BAFが正常に局在しない変異体をHeLa細胞で発現させると、エメリンも核質と核膜に適切に局在できず、これによりLAP2-betaやラミンAも局在異常を引き起こしました。これらの結果から、BAFは核膜の再形成におけるエメリンとラミンAの安定性の維持に重要であると考えられました。
Libotteら(2005年)は、核膜足場タンパク質であるネスプリン-2(SYNE2)のC末端がエメリンに直接結合することを発見しました。COS-7細胞でネスプリン-2をノックダウンすると、エメリンが核膜から他の部位に再分布することが確認され、ネスプリン-2がエメリンの適切な配置に重要であることが示唆されました。
JacqueとStevenson(2006年)の研究では、エメリンおよびBAFのサイレンシング(抑制)がHIV-1の感染を阻止することが確認されました。エメリンとBAFのいずれもウイルスの宿主DNAへの統合を妨げるため、HIV-1感染には欠かせない役割を果たしていることがわかりました。HIV-1が核に侵入した際に、クロマチンと接触するためにエメリンが必要であり、この相互作用を妨げることで感染の失敗が促進される可能性があると結論づけられました。
Huberら(2009年)は、マウス筋芽細胞でのエメリンまたはNet25(LEMD2)のノックダウンが筋分化を阻害することを発見しました。これによりErk1の活性化が上昇し、筋分化が阻害されることが示されましたが、Erk活性を阻害することで筋分化が回復しました。
Hoら(2013年)は、ラミンA/C(Lmna)を欠損した細胞および特定のラミンA変異(N195K)を持つ細胞において、エメリンの異所性発現により、機械感受性転写因子であるMKL1の核内移行が回復し、アクチンの動的平衡も回復することを示しました。この結果から、エメリンはアクチン重合の重要な調節因子であり、エメリンの欠失がアクチン動態を乱し、MKL1シグナル伝達を阻害することが示唆されました。Hoらは、ラミンA/Cとエメリンが核および細胞骨格のアクチン重合を通じて遺伝子発現を調整する仕組みが、ラミノパチーにおける心臓病の発症メカニズムに関わる可能性を示唆しました。
Shinら(2013年)は、質量分析法を用いて、エピトープタグを付けたヒトLAP1(TOR1AIP1)がエメリンおよびラミンAと相互作用することを発見しました。共免疫沈降解析により、内在性LAP1とエメリンが相互作用することが確認され、ドメインマッピングでは、この相互作用が核質ドメインを介して行われることが明らかになりました。さらに、ノックアウトマウスの線維芽細胞を用いた実験から、LAP1がエメリンの核内膜への固定化に重要な役割を果たしていることが示されました。
分子遺伝学
– Bioneら(1994年):EDMD1の患者5名において、EMD遺伝子(エメリン遺伝子)の変異を特定しました。これらの変異により、エメリンタンパク質が部分的または完全に欠損し、筋ジストロフィーの原因となっていることが示唆されました。
– Ellisら(1999年):EMD遺伝子において70種類以上の異なる変異が確認され、その中にはプロリン183を含むミスセンス変異P183HおよびP183Tが含まれます。これらの変異型エメリンは、通常のエメリンと同様の移動度と発現レベルを示すものの、核ラミナ構成要素との結合が弱まることが判明しました。
– Ben Yaouら(2007年):アルジェリアの大家族において、EMD遺伝子のリジン37欠失(delK37)が特定されました。この変異を持つ男性2名がEDMDを発症しており、彼らはLMNA遺伝子にホモ接合型の変異も有していました。さらに、同じ変異を持つ他の男性は40代で孤立性心房伝導障害を発症しており、女性キャリアの一部も心疾患を発症していることが確認されました。これは、EMD変異が孤立性心疾患の原因となる初の報告です。
– Brownら(2011年):北米の255名のEDMD患者のうち23名(9.0%)でEMD遺伝子の病的変異が確認されました。新規変異は8例、既知の変異が10例ありました。これらの変異の90.5%は、エメリンタンパク質の著しい欠損や欠如を引き起こすと予測されています。130のEMD変異の解析により、エクソン2がホットスポットであり、GC含量の多さが原因である可能性が指摘されています。
これらの研究は、EMD遺伝子変異がエメリンの欠如や機能不全を引き起こし、筋肉や心臓への影響を通じてEDMDや関連する心疾患を発症する仕組みの理解を深めました。
動物モデル
一方、Shin ら(2013年)は、マウス骨格筋におけるエメリンの発現がヒトよりも低い一方で、LAP1の発現は逆にマウスで高いことを発見しました。また、Lap1の欠失はマウスで周産期に致死となり、横紋筋におけるLap1の条件付き欠失マウスでは、進行性の筋症と早期死亡が見られました。この変異マウスでは筋線維内でエメリンの局在異常も観察されましたが、肝臓のLap1欠失では目立った異常は見られませんでした。さらに、エメリン欠失のみでは寿命に影響がありませんでしたが、筋特異的Lap1ノックアウトと組み合わせるとミオパシーが悪化しました。左心室の短縮率も対照群と比べて有意に減少しており、LAP1とエメリンは骨格筋の維持において相互作用し、ヒトとマウスでの役割の違いを示唆しています。
Shinらは、LAP1とエメリンの物理的および機能的な相互作用が、骨格筋の維持において重要である一方、ヒトとマウスにおける筋疾患への寄与には種間で大きな違いがあると結論づけています。
アレリックバリアント
EMD、2-BP欠失、NT564
Bione ら (1994) は、エメリー・ドリーフュス型筋ジストロフィー (310300) の家族に属する患者の EMD 遺伝子におけるヌクレオチド 564 および 565 の欠失について報告しています。これにより、アミノ酸207の後にフレームシフトと終止コドンが生じました。
0.0002 エメリー・ドリーフス型筋ジストロフィー、X連鎖
EMD、MET1VAL
エメリー・ドリーフュス型筋ジストロフィー(310300)の家族に属する患者において、Bione ら(1994)は、EMD 遺伝子のヌクレオチド59におけるA-to-G転位により、ATGメチオニン開始コドンが消失していることを報告しています。.
0003 エメリー・ドリーフュス型筋ジストロフィー、X連鎖
EMD、29-BP欠失、NT113
エメリー・ドリーフュス型筋ジストロフィー(310300)の家族の患者において、Bione ら(1994年)はEMD遺伝子のヌクレオチド113から141の欠失を発見しました。その結果、アミノ酸21の後にフレームシフトと終止コドンが生じました。
0.0004 エメリー・ドリーフュス型筋ジストロフィー、X連鎖
EMD, 2-BP INS, NT198
エメリー・ドリーフュス型筋ジストロフィー(310300)の家族に属する患者において、Bione ら(1994年)はEMD遺伝子のヌクレオチド198番目の後に2塩基対の挿入を発見しました。その結果、アミノ酸64番目の後にフレームシフトと終止コドンが生じます。
0.0005 エメリー・ドリーフュス型筋ジストロフィー、X連鎖
EMD、IVSAS、A-G、-3、214-BP INS
エメリ・ドレフュス型筋ジストロフィー(310300)の家族の患部において、Bione ら(1994年)は、EMD 遺伝子の 3′-スプライス接合部における -3 位置での A-to-G 転位を発見しました。 この突然変異は、RT-PCR 産物の配列における異常として初めて検出され、ヌクレオチド 324 における 214 bp の挿入が示されました。ゲノム断片のヌクレオチド配列により、214bpの挿入がスプライシングされなかったイントロンであることが確認されました。変異が存在すると、同じイントロンの-87の位置と次のエクソンの365の位置で、代替の3プライムスプライス結合が使用され、通常のバンドと214bpの挿入を反映するバンドの中間サイズのバンドが2つ追加されます。
0.0006 エメリー・ドリーフュス型筋ジストロフィー、X染色体遺伝
EMD、GLN43TER
Klauck ら (1995) は、エメリー・ドリーフュス型筋ジストロフィーの3家族において新規変異を特定しました(310300)。 そのうちの1つは、ヌクレオチド188におけるCからTへの転位であり、コドン43がCAG(クイーン)から終止コドンに変化しました。
0.0007 エメリ・ドレフュス型筋ジストロフィー、X連鎖
EMD、1-BP欠失、FS236TER
エメリ・ドレフュス型筋ジストロフィー(310300)患者において、山田と小林(1996)はエメリン遺伝子にヌクレオチド672または673における1塩基対のCの欠失があることを発見しました。この欠失はアミノ酸配列(アミノ酸206-235)の変化につながるフレームシフトを引き起こし、早期終止コドンを生成しました。
0.0008 エメリ・ドリーフュス型筋ジストロフィー、X連鎖
EMD、PRO183HIS
エメリ・ドリーフュス型筋ジストロフィーの男性(310300)において、Ellisら(1999)はEMD遺伝子におけるプロ183ヒスチジンへの変異を同定し、この遺伝子をSTA遺伝子と名付けました。患者は、31歳の時に腰痛、腕よりも脚の筋力低下、脚のしびれを訴え、神経科医の診察を受けました。子供の頃は、学校の運動会への参加が制限されていました。幼少期に上肢の筋力低下が認められましたが、下肢の筋力低下は25歳まで認められませんでした。27歳で焼けるような腰痛を発症し、両脚の後面に放散しました。ペースメーカーを必要とする第3度房室ブロックを発症していました。両足首に軽度の拘縮がありましたが、肘の拘縮はありませんでした。
0009 エメリ・ドレフュス型筋ジストロフィー、X連鎖
EMD、PRO183THR
エメリ・ドレフュス型筋ジストロフィー(310300)の患者である兄弟4人と母方の従兄弟1人を持つ家族において、Ellisら(1999年)は、彼らがSTA遺伝子と呼ぶEMD遺伝子におけるpro183-to-thr突然変異を特定しました。Yates ら (1999) は、EDMDの表現型が非常に軽度でエメリン量が正常な家族において、P183T変異を同定しました。
0.0010 エメリー・ドリーフス型筋ジストロフィー、X染色体連鎖
EMD、5bp欠失、NT631
エメリー・ドリーフュス型筋ジストロフィー(310300)の2人の兄弟において、Manilal ら(1998年)は、EMD遺伝子のヌクレオチド631-635にまたがる5塩基対の欠失(TCTAC)を特定しました。









