承認済シンボル:CYP19A1
遺伝子名:cytochrome P450 family 19 subfamily A member 1
参照:
HGNC: 2594
AllianceGenome : HGNC : 2594
NCBI:1588
Ensembl :ENSG00000137869
UCSC : uc001zza.5
遺伝子OMIM番号107910
●遺伝子のlocus type :タンパク質をコードする
●遺伝子のグループ:Cytochrome P450 family 19
MicroRNA protein coding host genes
●遺伝子座: 15q21.2
●ゲノム座標:(GRCh38): 15:51,208,057-51,338,596
遺伝子の別名
ARO1
aromatase
CP19A_HUMAN
CPV1
CYAR
CYP19
CYPXIX
cytochrome P-450AROM
cytochrome P450 19A1
cytochrome P450, family 19, subfamily A, polypeptide 1
cytochrome P450, subfamily XIX (aromatization of androgens)
estrogen synthase
estrogen synthetase
flavoprotein-linked monooxygenase
microsomal monooxygenase
P-450AROM
遺伝子の概要
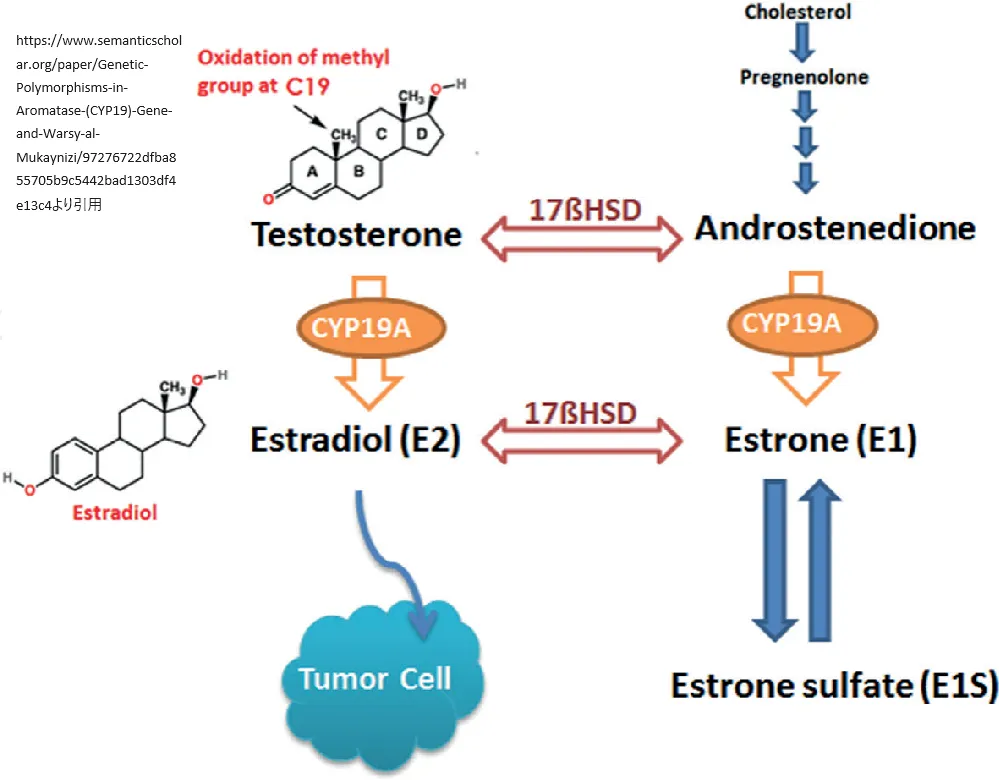
CYP19A1遺伝子はアロマターゼという酵素の産生をコントロールします。この酵素は、男性ホルモンであるアンドロゲンを女性ホルモンのエストロゲンに変換する役割を担っています。この変換プロセスは、生物学的に男性と女性の性的発達や維持、さらには健康状態において重要な機能を果たしています。
細胞内でアロマターゼは小胞体という構造体に存在し、タンパク質の生産、処理、そして輸送に関わる重要な場所です。アロマターゼの活性は、細胞がエストロゲンを必要とするかどうか、また細胞の種類によって変わります。
女性では、アロマターゼは主に卵巣で活性化され、性的発達を促進します。男性では、この酵素は特に脂肪組織で活性が高く、エストロゲンの生成に寄与します。エストロゲンは、男性と女性の両方で、骨の成長や血糖値の調節に重要な役割を果たしています。
胎児発育期においては、アロマターゼが胎盤でアンドロゲンをエストロゲンに変換することにより、母体からのアンドロゲンが女性胎児の性的発達に影響を与えることを防ぎます。このプロセスは、胎児が適切な性的発達を遂げるために重要です。
出生後も、アンドロゲンからエストロゲンへの変換は体の複数の組織で継続し、生物学的機能の正常な維持に寄与します。エストロゲンの適切なバランスは、心血管系の健康、骨密度の維持、さらには神経系の機能など、広範な生理的プロセスに影響を及ぼします。
したがって、CYP19A1遺伝子とアロマターゼ酵素の機能は、性ホルモンのバランスと体の健康維持にとって非常に重要です。
遺伝子と関係のある疾患
遺伝子の発現とクローニング
Chenら(1986年)とEvansら(1986年)は、ヒト胎盤からアロマターゼ遺伝子に対応する部分的なcDNAをクローニングし、その塩基配列を決定しました。Evansらは、放射性標識されたアロマターゼcDNAが胎盤と脂肪間質細胞RNAの両方で複数のサイズのmRNAとハイブリダイズすることを発見し、アロマターゼの広範な組織分布を示唆しました。
Harada(1988年)は、胎盤cDNAライブラリーからヒトアロマターゼをコードする完全なcDNAクローンを単離しました。推定される503アミノ酸配列の解析から、この酵素がチトクロームP450スーパーファミリーのユニークなメンバーであることが明らかになりました。
また、Corbinら(1988年)は、503アミノ酸からなるタンパク質をコードするP450-アロマターゼの完全長ヒトcDNAをクローニングしました。この研究では、COS-1サル腎臓腫瘍細胞でこのcDNAを発現させ、発現されたタンパク質がヒト胎盤アロマターゼと類似しており、アンドロステンジオン、テストステロン、16-α-ヒドロキシアンドロステンジオンといった主要な生理学的基質のアロマターゼ化を触媒することが確認されました。さらに、この活性は既知のアロマターゼ阻害剤によって阻害されることが示されました。
これらの研究は、アロマターゼの転写と発現調節メカニズム、およびその生理学的役割の理解に貢献し、性ホルモン代謝におけるこの酵素の重要性を強調しています。
遺伝子の構造
SebastianとBulun(2001)による後続の研究では、CYP19遺伝子全体が123kb以上にわたっていることが判明しました。特に注目すべきは、遺伝子の大部分が制御領域として機能する93kbの大きな5-プライム領域であり、30kbの3-プライム領域がアロマターゼのコーディング領域を構成しています。この研究では、翻訳開始点から1kb以内に位置する複数のプロモーターが同定され、それぞれが異なる組織特異的なアロマターゼの発現を誘導することが示されました。これらには、卵巣特異的プロモーターII、脂肪組織と乳癌で発現するプロモーターI.3、および骨で発現するプロモーターI.6が含まれます。
さらに、Sebastianら(2002)の研究では、CYP19遺伝子に9つの代替非翻訳第一エクソンが存在し、それぞれが個別のプロモーターを持つことが明らかにされました。彼らは、これらの代替エクソンの中に10番目のエクソン、エクソンI.7を同定しました。エクソンI.7にはTATAボックスやCAATボックスは存在しませんが、2つのコンセンサスGATAモチーフと他のシス作用モチーフがあり、これらが遺伝子発現の調節に関与していることが示唆されています。
これらの研究成果は、CYP19遺伝子の複雑な構造と、エストロゲン生合成におけるその重要性を示しています。また、遺伝子発現の組織特異性が、プロモーター領域の多様性によってどのように実現されるかを理解するための基礎を提供しています。
マッピング
Shozu et al.による2003年の研究は、ヒトゲノムプロジェクトのデータとBAC(Bacterial Artificial Chromosome)プラスミドライブラリーのスクリーニングを活用して、アロマターゼ遺伝子を含む他の遺伝子(CGNL1遺伝子とトロポモジュリン-3遺伝子(TMOD3))を15q21.1-q21.3にマッピングしました。これらの遺伝子はテロメアからセントロメアへ向かって順に配置されており、アロマターゼ遺伝子はTMOD3やCGNL1遺伝子とは逆方向に転写されることが示されました。
アロマターゼ遺伝子は、アンドロゲンをエストロゲンに変換する酵素であるアロマターゼのコード遺伝子です。この遺伝子の正確な位置の同定は、性ホルモンの生物学的な役割とその生産に関連する疾患(例えば、多嚢胞性卵巣症候群やエストロゲン依存性がんなど)の理解を深める上で重要です。これらの研究により、アロマターゼ遺伝子の正確なクロモソーム上の位置とその遺伝的コンテキストが明らかにされ、これが今後の遺伝学的研究や治療戦略の開発に貢献することが期待されます。
遺伝子の機能
Zhouら(1991年)の研究では、ヒト胎盤アロマターゼcDNAを含むプラスミドを用いたCHO細胞での安定発現系と部位特異的突然変異誘発を用いて、ヒトアロマターゼの構造-機能相関が研究されました。特定の変異体が酵素活性にどのように影響するかを通じて、基質結合や触媒活性に関わる重要なアミノ酸残基が同定されました。
アロマターゼの組織特異的発現は、異なるプロモーターの選択的使用によって決定される部分があります。胎盤では遠位プロモーター、生殖腺では近位プロモーターが利用され、乳房脂肪組織ではプロモーターI.4が重要です。このプロモーターの使用は、グルココルチコイドやインターフェロン-γなどの因子によって調節されます。
Agarwalら(1997年)の研究では、女性の脂肪組織におけるアロマターゼの発現パターンが詳細に調べられ、年齢や体位による発現の差異が明らかにされました。特に、エクソンI.4特異的な転写産物が女性の脂肪組織で優勢であり、そのレベルは年齢と共に上昇することが示されました。
McTernanら(2002年)の研究は、脂肪組織におけるアロマターゼの発現がグルココルチコイドによって制御されており、性差および部位差が存在することを示しました。これらの差異は、脂肪分布の性別および閉経期特異的パターンに寄与している可能性があります。
CYP19遺伝子はアロマターゼをコードし、エストロゲンの生合成に欠かせない酵素です。この遺伝子の大きさは50kbを超える非常に大きなもので、そのサイズの大きさは異なる細胞型での転写と、異なるプロモーターの制御に関連していると思われます。Simpsonら(1997)は、組織特異的プロモーターの使用によるスプライシングの違いが、アロマターゼ転写産物に多数の非翻訳第一エキソンを組織特異的にもたらすことを要約しました。このことは、アロマターゼの発現が組織によって異なるプロモーターを使用して制御されることを示しています。例えば、卵巣ではcAMPによって制御される近位プロモーターが、胎盤ではレチノイドによって制御される遠位プロモーターが使用されます。脳や脂肪組織ではさらに異なるプロモーターが利用されます。
Wangら(2001)は、ライディッヒ細胞においてDAX1がアロマターゼの生理的標的であり、Dax1欠損マウスで見られる不妊症とライディッヒ細胞の過形成の一因としてアロマターゼ発現の増加が挙げられることを示しました。
一方で、Aquilaら(2002)は、CYP19がヒト精子に存在し、特に精子の尾部と中部に局在していることを発見し、ヒト精子がエストロゲン生合成の潜在的部位であることを示しました。これは、CYP19遺伝子の表現が体細胞だけでなく生殖細胞にも及ぶことを示す重要な発見です。
さらに、Sebastianら(2002)は、一部の皮下脂肪組織で高発現しているエクソンI.7を含むCYP19バリアントを発見しました。このバリアントは、乳がん組織やがんに隣接する乳房脂肪組織で特に高発現していました。
Sebastianら(2002年)の研究では、ヒト微小血管内皮細胞における基底CYP19(アロマターゼ)プロモーター活性において、代替エクソンI.7のプロモーター領域内の2つのコンセンサスGATA部位が重要であることを発見しました。これらのGATA部位にはGATA2が結合し、濃度依存的にレポーター遺伝子の発現を活性化します。これは、GATA2がアロマターゼ遺伝子の発現調節における重要な役割を果たしていることを示しています。
Yangら(2002年)は、子宮内膜間質細胞における高レベルのCYP19 mRNAとプロモーターII活性に注目しました。彼らは、プロスタグランジン-E2によるcAMP依存性経路が、これらの細胞におけるエストロゲン生合成を強力に促進することを発見しました。また、彼らはC/EBPアイソフォームがP450-アロマターゼ発現の制御において重要な役割を果たしていることを示しました。特に、プロモーターIIの特定の部位の変異が、プロモーター活性の喪失を引き起こすことから、これらの部位が子宮内膜症におけるcAMP依存性誘導に重要であると結論づけました。
Shozuら(2002年)は、アロマターゼP450が組織特異的に制御されており、CYP19遺伝子の異なるプロモーターとそれに対応するエクソン1の代替使用によって達成されていることを指摘しました。平滑筋腫におけるアロマターゼP450の過剰発現メカニズムを解明するため、彼らは平滑筋腫に使用されるプロモーターを特定しました。その結果、プロモーターI.4が主要な役割を果たしており、その中のグルココルチコイド応答性エレメントが重要であることが示されました。
Imirら(2007年)は、アロマターゼの発現が複数の組織において代替的に使用されるプロモーターによって制御されていることを報告しました。プロスタグランジンE2/cAMP依存性経路が近位プロモーターI.3/IIを制御し、グルココルチコイドとサイトカインが遠位プロモーターI.4を制御することが示されました。
Ishikawaら(2008年)は、CEBP-βのCYP19プロモーターI.3/II領域へのcAMPによる結合が、平滑筋腫細胞におけるアロマターゼ発現を制御する重要なメカニズムであることを示しました。これは、平滑筋腫に特異的なアロマターゼ阻害剤の設計に役立つ可能性があります。
Parakhら(2006年)は、β-カテニンの分解に関連する特定の発現が、FSHによるCYP19A1およびCYP11A1 mRNAの誘導を増強することを見出しました。β-カテニンが卵巣におけるFSH/cAMP制御遺伝子発現に不可欠であり、エストロゲン生合成に関与していることが示されました。
これらの研究は、アロマターゼP450の発現調節に関わる複雑なメカニズムと、それがヒト健康と疾患にどのように影響を及ぼすかについての理解を深めます。特に、エストロゲン生合成におけるアロマターゼの役割と、その発現を制御する多様な遺伝的要因に光を当てています。
生化学的特徴
アロマターゼ遺伝子の発現に関するリアルタイムPCR解析では、処理されたすべての薬剤において、コントロール群と比較してmRNAレベルが有意に減少することが確認されました。これらの発見は酵素活性の低下と一致しており、COX阻害剤がアロマターゼに対して転写レベルで作用することを示唆しています。さらに、エクソン特異的リアルタイムPCRの研究を通じて、この調節過程にプロモーターI.3、I.4、IIが関与していることが示唆されました。
この研究は、乳癌治療における新たな治療標的の探索や、アロマターゼの活性制御に関する理解を深める上で重要な意味を持ちます。COX阻害剤がアロマターゼ活性を低下させるメカニズムの解明は、エストロゲン依存性のがんの治療戦略を改善するための新たなアプローチを提供する可能性があります。
Ghoshらによる2009年の研究では、ヒト胎盤アロマターゼの結晶構造が明らかにされました。ヒト胎盤アロマターゼは、天然の哺乳類の中で唯一の全長P450であり、ホルモンの生合成経路に関与するP450酵素としては初めて結晶化されました。この酵素は、アンドロステンジオンというアンドロゲン(男性ホルモンの一種)分子を特異的に結合させるための特別な裂け目を持ち、これは多くのミクロソームP450酵素が薬物や有害物質を代謝するための活性部位とは異なります。アロマターゼの活性部位は疎水性残基と極性残基によってステロイド骨格を巧妙に補完し、触媒的に重要な残基の配置は反応メカニズムの理解に貢献します。親油性の基質が活性部位にアクセスするために膜への固定が必要な理由は、疎水性のアミノ末端領域と触媒裂け目の開口部が隣接して配置されていることから明らかになります。この研究により、酵素のアンドロゲン特異性と独特な触媒機構の分子的基礎が明らかになり、これが次世代のアロマターゼ阻害剤の開発に役立つことが示唆されました。
分子遺伝学
アロマターゼ欠損症
– Itoら(1993)の報告: 18歳の46,XXの女性でCYP19A1遺伝子の2つの変異(107910.0001-107910.0002)が複合ヘテロ接合体であることを発見。これは、報告された成人アロマターゼ欠損症の最初の確定症例とされています。
– 原田ら(1992)の研究: 庄洲ら(1991)によって報告された症例をさらに調査し、胎児の遺伝的欠損が異常なアロマターゼタンパク質の発現につながることを証明。CYP19A1遺伝子には、終止コドンを持たないインフレームで29アミノ酸をコードする87bpのインサートが存在します(107910.0003)。両親は「5親等」の血族であり、この遺伝子型は遺伝的であることが示唆されました。
– Morishimaら(1995)の研究: アロマターゼ欠損症の兄妹でアロマターゼ遺伝子の突然変異のホモ接合性を同定(107910.0004)。
アロマターゼ過剰症候群
– Shozuら(2003)の報告: アロマターゼ活性の亢進により女性化乳房を示した3人の患者について、15q21.2-q21.3における2つの異なるヘテロ接合性の逆位を同定。これらの逆位は、それぞれTMOD3またはCGNL1プロモーターの一部を含むアロマターゼ遺伝子のクリプティックプロモーターを形成し、エストロゲン過剰を引き起こす(107910.0010および107910.0011)。
これらの研究は、アロマターゼの遺伝的変異がヒトの性ホルモンの平衡にどのように影響を与えるかについての理解を深めるものです。アロマターゼ欠損症はエストロゲンの欠如に関連し、アロマターゼ過剰症候群はエストロゲンの過剰生産に関連しています。これらの状態は、性的発達、骨密度、生殖機能などに影響を及ぼす可能性があります。
乳癌の感受性
乳癌の感受性と関連する研究を通じて、CYP19遺伝子およびその変異がエストロゲンの代謝に及ぼす影響と乳癌リスクとの関連性についての理解が深まりました。CYP19遺伝子はアロマターゼをコードしており、アロマターゼはアンドロゲンをエストロゲンに変換する酵素です。この変換過程は、乳癌の成長と発展において重要な役割を果たすことが知られています。
Siegelmann-DanieliとBuetow(1999)の研究では、CYP19遺伝子のイントロン4に存在する4塩基反復多型に注目しました。171bpの対立遺伝子が患者群でより頻繁に見られ、この対立遺伝子のホモ接合体はほとんどが患者であることが示されました。これは、特定の遺伝子変異が乳癌のリスクを増加させる可能性があることを示唆していますが、その機序はまだ完全には解明されていません。
Haimanら(2003)によるMultiethnic Cohort Studyでは、CYP19バリアントと乳癌リスクとの関連をハプロタイプに基づくアプローチで探索しました。彼らは特定の長距離ハプロタイプが乳癌リスクの上昇と関連していることを発見し、これらのハプロタイプが乳癌感受性に関わる可能性があることを示唆しました。
さらに、Haimanら(2007)は、CYP19A1遺伝子の特定のハプロタイプが閉経後の女性における内因性エストロゲン濃度の上昇と有意に関連していることを見出しました。この研究は、遺伝的変異がエストロゲン濃度に影響を与えることを示していますが、その影響の大きさは乳癌リスクに直接寄与するには不十分であると結論付けています。
これらの研究は、CYP19遺伝子の変異がエストロゲン代謝と乳癌リスクに影響を及ぼす可能性があることを示しています。しかし、乳癌感受性と関連する遺伝的要因の理解はまだ発展途上であり、これらの関連性を完全に解明するためにはさらなる研究が必要です。遺伝的要因と環境要因の相互作用も乳癌リスクに重要な役割を果たすため、これらの要素を考慮に入れた包括的なアプローチが求められます。
身長
Ellisら(2001)による研究では、CYP19遺伝子やY染色体の遺伝子座が成人の身長の変動にどのように関連しているかを調べました。この研究では、413人の成人男性と335人の成人女性からなる大規模なサンプルを無作為に選んで、CYP19とY染色体の一般的な2アレル性多型を使って関連性を分析しました。研究の結果、CYP19遺伝子と身長との間には関連があることがわかり、この関連は女性よりも男性で顕著でした。また、Y染色体と身長との関連も見つかりました。男性をCYP19とY染色体の多型のハプロタイプに基づいてグループ分けすると、平均で4.2cmの身長差がありました。これにより、成人男性の身長においてCYP19遺伝子とY染色体の遺伝的変異が重要な役割を果たしており、これらの遺伝子座が相加的に相互作用する可能性があることが示唆されました。
骨密度
骨密度は、特に高齢者において重要な健康指標です。骨密度の減少は骨粗鬆症のリスクを高め、骨折の可能性を増加させます。最近の研究では、エストロゲンや遺伝的要因が骨密度に及ぼす影響が注目されています。
Van Pottelberghらによる2003年の研究では、70〜86歳の健康な男性214人を対象に、生物学的に利用可能なエストラジオールとCYP19のTTTA(n)反復多型が骨量減少にどのような影響を与えるかを調査しました。この研究は、生物学的に利用可能なエストロゲンが骨密度の変化と一貫して関連していること、およびCYP19のTTTA(n)反復多型が前腕遠位部の骨密度変化に影響を与える独立した要因であることを明らかにしました。
Gennariらの2004年の研究では、高齢男性におけるCYP19遺伝子のTTTAリピート多型が骨密度に与える影響を調査しました。この研究は、リピート数が9以上の高リピート遺伝子型の男性は、リピート数が9未満の低リピート遺伝子型の男性に比べて、腰椎の骨密度が高く、骨代謝マーカーが低く、エストラジオール値が高く、骨密度の変化率が低いことを示しました。これは、アロマターゼの遺伝子型が骨密度に影響を及ぼすことを示唆しています。
Somnerらによる2004年の研究では、閉経後女性252人を対象に、CYP17とCYP19遺伝子の多型と骨密度や血清アンドロゲン/エストラジオールレベルとの関連を調査しました。この研究は、CYP19遺伝子型が血清エストラジオールレベルと関連しており、特定の遺伝子型を持つ女性は、骨粗鬆症や骨折のリスクが高いことを示しました。
Rianchoらによる2007年の研究では、閉経後骨粗鬆症による椎体骨折を有する女性と健康な対照群を対象に、CYP19A1遺伝子の特定のSNPと骨折リスクとの関連を調査しました。この研究は、特定のハプロタイプが骨折リスクの上昇と関連していることを示しました。
これらの研究は、エストロゲンレベルと遺伝的要因が骨密度と骨粗鬆症リスクに重要な影響を与えることを示しており、これらの要因のさらなる理解が、高齢者における骨健康の維持と改善のための戦略の開発に役立つ可能性があります。
動物モデル
Sebright Bantam鶏およびゴールデン・キャンピーヌ鶏: LeshinらとGeorgeらの研究は、アロマターゼ活性が鳥類の雌鶏羽毛形質に重要な役割を果たしていることを示しています。これらの研究では、鶏の特定の品種で見られる雌鶏羽毛形質がアロマターゼ活性に関連する調節変異に起因することが明らかにされました。この形質は不完全優性であり、ヘテロ接合体ではホモ接合体の半分のレベルの腺外アロマターゼが発現されると報告されています。
アロマターゼ欠損マウスモデル: FisherらとRobertsonらの研究は、アロマターゼ(cyp19遺伝子)を標的とした遺伝子破壊により作製されたマウスモデルを用いて、アロマターゼの生理的役割を探求しています。これらのノックアウトマウスは、雌雄ともに成体まで成長しましたが、雌マウスでは外性器と子宮の未発達、豊富な顆粒膜細胞を含む多数の卵胞が観察されました。乳腺の発達も思春期前の女性とほぼ同じレベルであり、男性ノックアウトマウスでは、精巣は正常であるものの、雄性付性腺の肥大が見られました。さらに、アロマターゼ欠損マウスは生殖可能であったものの、時間が経つにつれて不妊症が進行し、精子形成障害が発生しました。
Jonesら(2000年)による研究では、アロマターゼノックアウト(ArKO)マウスが内因性エストロゲンを合成できず、その結果として野生型の同腹子よりも腹腔内脂肪組織を有意に多く蓄積することが観察されました。この脂肪蓄積は、過食や安静時エネルギー消費の減少ではなく、身体活動レベルの低下、グルコース酸化の減少、および除脂肪体重の減少に関連していることが示されました。ArKO動物では、肝臓においても脂質滴の顕著な蓄積が見られ、これはエストロゲンが男性と女性の両方において脂質ホメオスタシスの維持に重要であることを示唆しています。
Heineら(2000年)の研究は、エストロゲン受容体1(Esr1)ノックアウトマウスにおけるシグナル伝達が、男性および女性の白色脂肪組織において重要であることを見出しました。特に男性の肥満には、エネルギー摂取量の増加よりもエネルギー消費量の減少が関与していることが示されました。
Yueら(2005年)は、アルツハイマー病(AD)モデルマウスであるAPP23マウスにおいて、アロマターゼ遺伝子のヘテロ接合体破壊によるエストロゲン欠損が、脳内エストロゲンの減少、アミロイド斑の早期発症、および脳内βアミロイド沈着の増加につながることを明らかにしました。これらのマウスから培養されたミクログリアは、βアミロイドのクリアランスに障害を示しました。対照的に、卵巣摘出されたAPP23マウスは脳内エストロゲンレベルが正常であり、通常のAPP23マウスと同様のプラーク病態を示しました。さらに、AD患者の死後脳組織では、総エストロゲンレベルと遊離エストロゲンレベルが低下しており、アロマターゼmRNAレベルも低下していることが示されましたが、血清エストロゲンレベルには差がなかった。これらの結果から、脳内エストロゲン産生の低下がADの神経病理学的発症の危険因子である可能性があると結論付けられました。
これらの研究は、エストロゲンが生理学的プロセスおよび疾患の進行において重要な役割を果たしていることを示し、特に脂肪代謝や神経病理学的状態のコンテキストでのエストロゲンの役割に新たな光を当てています。
アレリックバリアント
.0001 アロマターゼ欠損症
CYP19A1, ARG435CYS
Itoら(1993)は、臨床的および生化学的証拠に基づいてアロマターゼ欠損症(613546)が疑われた患者において、CYP19遺伝子の2つの変異の複合ヘテロ接合性を報告した。この患者は18歳の46,XXの女性で、性的幼児性、原発性無月経、出生時の曖昧な外性器、多嚢胞性卵巣を有していた。CYP19遺伝子のコードするエクソン2〜10をゲノムDNAからPCRで増幅し、直接塩基配列を決定した。エクソン10では、1303bpのC-T転移により、アルギニン435がシステインに変化していた(R435C)。患者の母親から増幅されたエクソン10のDNAのRFLP解析と直接塩基配列を決定した結果、R435C変異は母親から遺伝することが示された。もう1つの変異は父親から受け継いだもので、エクソン10の1310bpでGからAに転移し、システイン437がチロシンに変化したものであった(C437Y; 107910.0002)。一過性の発現実験では、R435C変異タンパク質は野生型の約1.1%の活性を示したが、C437Yは全く不活性であった。
.0002 アロマターゼ欠損症
cyp19a1, cys437tyr
Itoら(1993)によるアロマターゼ欠損症患者(613546)に複合ヘテロ接合体で見つかったCYP19A1遺伝子のcys437-to-tyr(C437Y)変異については、107910.0001を参照。
.0003 アロマターゼ欠損症
CYP19A1、IVS6DS、T-C、+2
庄司ら(1991)は、妊娠中の初産婦の進行性女性化、およびその児の女性仮性両性具有を観察し、これらの状態が胎盤アロマターゼ活性欠損症に起因することを示した(613546)。原田ら(1992)は、胎盤由来のアロマターゼ遺伝子が87bpの挿入を持つ異常に大きなmRNAとして転写され、29個の余分なアミノ酸を持つ異常に大きなタンパク質分子として翻訳され、ほとんど不活性な酵素になることを示した。Haradaら(1992)は、コントロールではイントロン6のスプライス供与体配列(GT)が患者ではGCに変異しているのに対し、両親ではGTとGCの両方が認められ、ヘテロ接合体であることを示している。
.0004 アロマターゼ欠損症
cyp19a1, arg375cys
Morishimaら(1995)は、28歳のXXの発端者とその24歳のXYの兄弟において、CYP19遺伝子のエクソンIXの1123番目のヌクレオチドでCからTへの転移を報告した。発端者の母親は、2回の妊娠中に進行性の男性化の徴候を示し、産後にはその徴候は消失した。XXの発端者は乳児期から経過観察され、アロマターゼ欠損症(613546)の典型的な特徴を示した。彼女は出生時に非副腎性女性仮性hermaphroditismであり、クリトリス切除を含む外性器の修復を受けた。思春期に、進行性の男性化徴候、エストロゲン作用の徴候のない思春期不全、高ゴナドトロピン性性性腺機能低下症、骨盤超音波検査での多嚢胞性卵巣、および高身長を発症した。血漿中テストステロン、アンドロステンジオン、17-ヒドロキシプロゲステロンの基礎濃度は上昇していたが、血漿中エストラジオールは低かった。ホルモン補充療法により、乳房発育、月経、卵巣嚢腫の消失、FSHとLHの上昇抑制がみられた。彼女の成人身長は177.6cmであった。彼女の兄の身長は204cmで、骨格は宦官様であった。彼は性的に完全に成熟しており、大睾丸であった。骨年齢は24歳で14歳であった。手首とその他の部位に顕著な骨減少が認められた。これらの兄弟における観察結果は、森島ら(1995)による以下の解釈と一致すると考えられた: (1)エストロゲンは、女性だけでなく男性の正常な骨格の成熟とプロポーション(直線的な成長ではない)、骨密度と骨量の付加と維持、および骨回転速度の制御に不可欠である; (3)成人男性におけるエストロゲンの欠損症は、高インスリン血症および血漿脂質の異常と関連している。(4)胎盤アロマターゼは、女性胎児を胎児の男性化から守り、妊婦を男性化から守るという重要な役割を担っている。
Bilezikianら(1998)は、森島ら(1995)が報告した患者において、共役エストロゲンを3年間投与した結果、骨量が回復したことを明らかにした。
.0005 アロマターゼ欠損症
cyp19a1、1-bp欠失、c、コドン408
Mullisら(1997)は、CYP19遺伝子の2つの点突然変異の複合ヘテロ接合体であったアロマターゼ欠損症(613546)の女性を報告した。母方の対立遺伝子はコドン408(CCC)に塩基対(C)の欠失を有し、これがフレームシフトを引き起こし、欠失の3-プライムに111bp(37アミノ酸)のナンセンスコドンを生じた。父方の対立遺伝子はエクソンとイントロン3の間の5プライムスプライス部位(保存されたGTからAT)にGからAへの転移があった(IVS3+1G-A; 107910.0006)。この変異は5-プライムスプライス部位を無視するため、3bp下流の停止コドンへのリードスルーとなる。母親の分娩前女性化が顕著であったため、アロマターゼ欠損症が疑われ、出生後まもなく診断が確定した。血清中のエストロゲンは極めて低値であったが、アンドロゲンは高値であった。子供の超音波検査では、2歳の時点で、多数の大きな嚢胞を含む卵巣の持続的な腫大と、正常に見える大きな3次卵胞が認められた。基礎およびGNRH誘発FSHレベルは顕著に上昇したままであった。低用量エストラジオールを3.5歳で50日間投与した結果、血清ゴナドトロピン値は正常化し、卵巣の大きさは後退し、全身および腰椎の骨密度は増加した。FSH値と卵巣の大きさは、エストラジオール療法中止150日後に治療前のレベルに戻った。
.0006 アロマターゼ欠損症
CYP19A1、IVS3、G-A、+1
Mullisら(1997)によるアロマターゼ欠損症患者(613546)に複合ヘテロ接合体でみられたCYP19A1遺伝子のスプライス部位変異(IVS3+1G-A)については、107910.0005を参照のこと。
.0007 アロマターゼ欠損症
cyp19a1, arg365gln
両親がいとこ同士であるアロマターゼ欠損症(613546)の男性において、Caraniら(1997)はP-450アロマターゼ遺伝子のエクソン9のヌクレオチド1094でGからAへの転移を同定し、その結果コドン365でアルギニンの代わりにグルタミンが生じた。この突然変異は、制限酵素Acc651によって切断される部位を消失させた。制限酵素分析から、両親ともこの突然変異をヘテロ接合で持っていることが示された。COS-1細胞での発現試験から、変異型タンパク質のアロマターゼ活性は、同量の細胞内総タンパク質存在下で野生型タンパク質の0.4%であることが示された。患者は18歳の時点で身長170cmであったが、その後も成長を続け、31歳で187cm、38歳で190cmに達した。アンドロゲン療法は無効であったが、エストロゲン療法により脊椎骨密度が増加し、9ヵ月後には骨端が完全に閉鎖した。骨密度、アルカリホスファターゼとオステオカルシンの血清レベル、ピリジノリンの尿中排泄量の増加は、思春期の正常な骨格成熟時に起こるものと同様であった。従って、著者らは、エウヌコイド骨格の特徴は、アンドロゲンの欠損症ではなく、主にエストロゲンの欠損症に起因するのではないかと提唱した。完全なアンドロゲン不応症の患者では、エウヌコイド骨格の発達が見られないことから、この見解が支持された。骨格痛、特に膝の痛みが臨床的特徴であった。31歳時の腕の長さは204cmで、上腕と下腕の比は0.85であった。両側性半月板を認めた。女性化乳房はなく、陰茎のサイズと陰毛のパターンは正常であった。性指向は異性愛で、性欲と勃起は正常であった。
.0008 アロマターゼ欠損症
cyp19a1、1-bp欠失、c、コドン156
Deladoeyら(1999)は、出生時の臨床所見に異常のない46,XYの男性乳児において、アロマターゼ欠損症の原因となるCYP19遺伝子の点突然変異(613546)を同定した。この男児は、CYP19遺伝子のエクソン5に1bpの欠失(コドン156、C)を有するホモ接合体であった。妊娠初期に母親の処女化が著しかったため、出生前にアロマターゼ欠損症が疑われ、出生直後に診断が確定した。出生4週後、男児は血清エストロゲン濃度が極端に低かったが、血清遊離テストステロンは正常値であった。出生時の血清アンドロステンジオン濃度が高かったのに比べ、出生後4週までに顕著な低下がみられた。著者らは以前、アロマターゼ欠損症の女性乳児において、生後1年間に基礎および刺激FSH値が上昇したことを報告している。対照的に、男性の乳児では、標準的なGnRH刺激試験後の基礎FSH値とピークFSH値は正常であった。著者らは、視床下部-下垂体性ゴナドトロピン-性腺フィードバック機構に対するエストロゲンの寄与は、乳児期および幼児期の男児と女児では異なると結論した。彼らは、正常女児では血清エストラジオール濃度は循環インヒビン濃度と強い相関があり、したがってインヒビン濃度が低いことがアロマターゼ欠損症の女児におけるFSHの顕著な上昇に寄与している可能性があるという仮説を立てた。対照的に、男児ではエストラジオール濃度が女児より生理的に約7倍低く、FSH、LH、テストステロン濃度が低下しても血清インヒビン濃度は上昇したままである。
.0009 アロマターゼ欠損症
CYP19A1、IVS4AS、C-A、-3
Herrmannら(2002)は、両親が血縁関係にあるアロマターゼ欠損症(613546)の27歳男性におけるCYP19遺伝子の新規ホモ接合体変異を報告した。CYP19遺伝子のエクソン6の前のスプライシングアクセプター部位のイントロン5の-3位のCからAへの置換が、アロマターゼ活性喪失の原因と考えられる。患者のmRNAはフレームシフトを起こし、エクソン5末端の8ヌクレオチド下流に早発停止コドンを生じた。掌蹠静脈瘤、脊柱後弯症、胸骨圧迫を除けば、身体所見は正常であり、精巣の大きさも正常であった。欠損症を補うため、患者は50mgの経皮エストラジオールを週2回3ヵ月間投与され、その後25mgを週2回投与された。橈骨遠位端の骨密度は増加し、腰椎の骨密度も増加した。精液分析の結果、乏精子症が認められた。治療3ヵ月後、精子数は増加し、その後3ヵ月間に急速に減少した。著者らは、この稀なエストロゲン欠損症において、CYP19遺伝子の新規変異を有する男性において、エストロゲン補充が骨のミネラル化と成熟およびグルコース代謝に重要であることが示されたと結論した。
.0010 アロマターゼ過剰症候群
cyp19a1、inv、cgnl1プロモーター
36歳の男性とその7歳の息子で、思春期前に発症した重度の女性化乳房と、エストロゲン濃度の上昇によって引き起こされた軽度の性腺刺激ホルモン分泌不全性性腺機能低下症(139300)を有する症例において、Shozuら(2003)は、FLJ14957遺伝子(CGNL1;607856)のプロモーターがアロマターゼコード領域に対して5-プライムの位置に移動している15q21.2-q21.3上の逆位を同定した。この症例の父親には進行性の女性化乳房がみられ、5歳の時に直線的な成長スパートがみられ、その後すぐに陰毛と陰茎増大がみられた。身長が1パーセンタイル以下になった14歳で成長が止まった。16歳で両乳房切除術を受けた。息子は父親が30歳のときに生まれた。身体所見では、甲高い声、無毛、乳房切除の瘢痕、異常のない外性器が認められた。息子の女性化乳房と線状成長の加速は、同様に5歳の時に初めて起こった:身長と体重は99パーセンタイル以上、乳房の発育はタナー病期III期、思春期前の外性器は正常であった。5.5歳の時、骨年齢は13歳であった。
.0011 アロマターゼ過剰症候群
cyp19a1、inv、tmod3プロモーター
Shozuら(2003)は、17歳の少年におけるエストロゲン値の上昇(139300)に伴う思春期前に発症した重度の女性化乳房は、15q21.2-q21.3の逆位により、TMOD3遺伝子(605112)のプロモーターがアロマターゼ遺伝子のすぐ5-プライムの位置に来たことが原因であることを示した。
.0012 アロマターゼ欠損症
cyp19a1, glu210lys
アロマターゼ欠損症(613546)の29歳の男性において、Maffeiら(2004)は、CYP19A1遺伝子のエクソン5の最後のヌクレオチドで、glu210からlys(E210K)へのアミノ酸置換をもたらすホモ接合性のGからAへの転移を検出した。線状成長の継続、宦官様体型、びまん性骨痛、両側停留睾丸が観察された。この患者は、インスリン抵抗性、2型糖尿病、黒色表皮腫、肝脂肪肝炎、早期アテローム形成の徴候を特徴とする複雑な代謝異常症候群であった。男性ホルモンを高用量で投与すると、インスリン抵抗性と2型糖尿病とともに、エストラジオールと男性ホルモンの比率が著しく不均衡になった。エストロゲン治療により、黒色表皮腫、インスリン抵抗性、肝脂肪肝炎が改善し、血糖コントロールが改善し、2つの頸動脈プラークが消失した。精巣生検では、両側停留睾丸の併存によると思われる生殖細胞の完全枯渇パターンが認められた。著者らは、このアロマターゼ欠損症の症例は、骨の成熟とミネラル化に関するこれまでのデータを裏付けるものであり、若いアロマターゼ欠損男性における心血管疾患の早発性発症のリスクが高いことを明らかにしたと結論づけた。
.0013 アロマターゼ過剰症候群
cyp19a1、cyp19a1/trpm7融合体
Tiulpakovら(2005)は、5世代16人の罹患者を持つアロマターゼ過剰症候群のロシア血統(139300)において、TRPM7遺伝子(605692)のエクソン1がCYP19エクソン2の共通アクセプタースプライス部位にスプライシングされた新規キメラ転写産物のヘテロ接合性を検出した。この再配列は、TRPM7プロモーターによって駆動されるアロマターゼの異常発現をもたらすと予測された。男女ともに、この疾患は乳房肥大、成長、骨年齢の加速を伴う幼児期に発現した。Tiulpakovら(2005)は、この染色体異常の機序は、ヘテロ接合体逆転の結果であった可能性が高いShozuら(2003)(107910.0010, 107910.0011参照)の報告とは異なるようであると述べている。CYP19とTRPM7遺伝子は同じ方向に転写され、TRPM7はCYP19の3プライム(下流)に位置する。従って、CYP19をTRPM7プロモーターの制御下に置く再配列は、15q21.2部分の単純な逆位では起こりえない。本研究で発見されたキメラ転写産物を作り出すには、TRPM7制御領域をCYP19コードエキソンの前に配置した15q21.2の部分重複など、より複雑なヘテロ接合体再配列が必要であろう。Tiulpakovら(2005)は、このファミリーにおいてキメラCYP19転写産物を生じる染色体分岐点を決定することができなかった。
スーパーNIPTジーンプラスで検出可能なバリアント
c.469delC
c.1303C>T
c.1310G>A
c.1123C>T
c.1094G>A
c.629-3C>A
c.628G>A
c.452-1G>A
c.1051C>T