目次
5q35.3欠失症候群とは?
ソトス症候群との関連・症状・診断を臨床遺伝専門医が解説
Q. 5q35.3欠失症候群とはどのような病気ですか?
A. 第5染色体長腕末端(5q35領域)の一部が欠失することで生じる先天性症候群です。
欠失範囲により臨床像が大きく異なり、NSD1遺伝子を含む欠失はソトス症候群(過成長型)、NSD1を含まない遠位欠失は低身長・発育不全型を呈します。特に日本人では欠失型が50%以上と欧米より高頻度です。
-
➤
2つの臨床型 → ソトス症候群型(過成長)と遠位欠失型(低身長) -
➤
日本人の特徴 → 欧米10%に対し日本人は50%以上が欠失型(逆位多型による) -
➤
隣接遺伝子の影響 → SLC34A1/FGFR4(腎石灰化)、FLT4(リンパ浮腫) -
➤
診断方法 → 染色体マイクロアレイ検査(CMA)が確定診断のゴールドスタンダード -
➤
頻度 → ソトス症候群は約14,000出生に1例
1. 5q35.3欠失症候群とは|基本情報
【結論】 5q35.3欠失症候群は、第5染色体長腕末端(バンド5q35領域)の一部が欠失することで生じる先天性症候群です。欠失範囲により症状が大きく異なり、NSD1遺伝子を含む欠失はソトス症候群(過成長型)、NSD1を含まない遠位欠失は低身長・発育不全型を呈します。
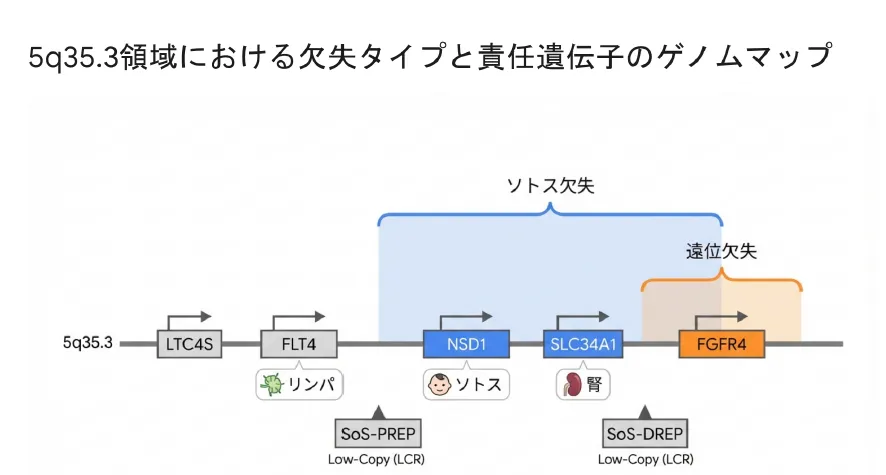
5q35.3欠失症候群は「隣接遺伝子症候群(Contiguous Gene Syndrome)」の一つです。欠失に含まれる遺伝子の種類や数によって、過成長から低身長まで対照的な臨床像を示すことが特徴です。
💡 用語解説:「隣接遺伝子症候群」とは?
染色体上で隣り合って並んでいる複数の遺伝子が、まとめて欠失または重複することで生じる症候群です。欠失に含まれる遺伝子の組み合わせにより、多彩な症状が複合的に現れるのが特徴です。5q35.3欠失症候群では、NSD1、FLT4、SLC34A1、FGFR4などの遺伝子が関与します。
5q35.3欠失症候群の概要
| 項目 | 内容 |
|---|---|
| 疾患名 | 5q35.3欠失症候群(5q35 deletion syndrome) |
| 別名 | 5q35欠失症候群、5q末端欠失症候群、モノソミー5q35 |
| 代表的な病型 | ソトス症候群(NSD1欠失型)、5q35.3サブテロメア欠失症候群(遠位型) |
| 頻度 | ソトス症候群:約14,000出生に1例、遠位欠失型:極めて稀(世界で十数例) |
| 遺伝形式 | 常染色体優性(顕性)、95%以上が新生突然変異 |
| 主要な責任遺伝子 | NSD1(ソトス)、FLT4(リンパ浮腫)、SLC34A1/FGFR4(腎石灰化)、NKX2-5(心疾患) |
2つの臨床型:ソトス症候群型 vs 遠位欠失型
5q35.3欠失症候群は、欠失範囲により対照的な2つの臨床像を示します。
ソトス症候群型(NSD1欠失)
- •
過成長(高身長・巨頭)
- •
特徴的顔貌(突出した前頭部)
- •
骨年齢の促進
- •
知的障害(軽度〜中等度が多い)
遠位欠失型(NSD1を含まない)
- •
低身長・発育不全
- •
胎児期のリンパ浮腫(NT肥厚)
- •
著明な筋緊張低下
- •
言語発達は比較的良好
⚠️ 欠失範囲と症状の関係
欠失が広範囲(5q35.1〜q35.3)に及ぶと、過成長と発育不全の両方の特徴が混在し、より重篤な表現型を呈します。特にNKX2-5遺伝子を含む場合は、ファロー四徴症やEbstein奇形などの重大な先天性心疾患を合併することがあります。
2. 5q35.3欠失症候群の臨床症状
【結論】 本症候群の症状は欠失領域により大きく異なります。ソトス症候群型では過成長・巨頭・特徴的顔貌・知的障害が主徴、遠位欠失型では低身長・筋緊張低下・胎児期浮腫が特徴です。
ソトス症候群型(NSD1欠失)の主な症状
-
•
成長:乳幼児期からの過成長、高身長、巨頭(頭囲増大)
-
•
顔貌:突出した前頭部、長く細い顔、下方斜めの眼裂、紅潮した頬
-
•
知的発達:軽度〜中等度の知的障害(約79%)、重度は5%のみ
-
•
骨格:骨年齢促進、側弯(約32%)、漏斗胸・鳩胸
ソトス症候群型 vs 遠位欠失型の比較
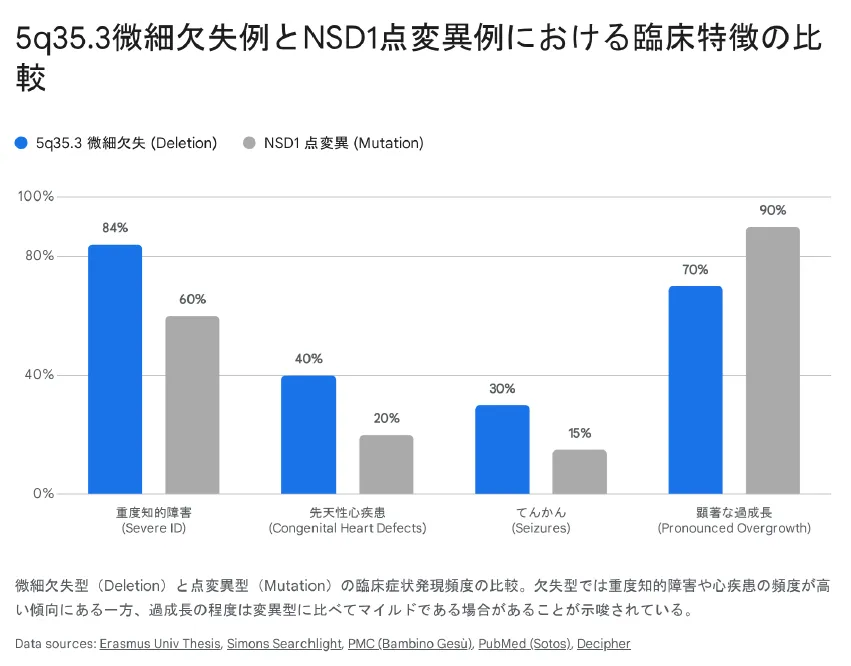
微細欠失型は点変異型と比較して、重度知的障害や心疾患の頻度が高い傾向があります
| 項目 | ソトス症候群型(NSD1欠失) | 遠位欠失型(NSD1非欠失) |
|---|---|---|
| 成長傾向 | 過成長(高身長・巨頭)、骨年齢促進 | 成長不良(低身長)、骨年齢遅延 |
| 顔貌 | 突出した前頭部、長く細い顔、尖った顎 | 特異的所見に乏しい、穏やかな印象 |
| 筋緊張 | 乳児期に筋低緊張あり | 著明な筋緊張低下、運動発達の大幅遅延 |
| 知的発達 | 軽〜中度知的障害(IQ 50〜80程度) | 境界知能〜軽度(言語発達は比較的良好) |
| 出生前所見 | 特異的所見なし、出生時体重大きめ | NT肥厚・胎児水腫が高頻度 |
| 心臓 | 心奇形約20%(ASD/VSDなど) | 軽度心疾患(NKX2-5含む場合は重篤) |
合併症と注意点
🧠 神経学的合併症
- •
てんかん:約20%
- •
側脳室拡大(MRI所見)
- •
自閉スペクトラム症:約7%
❤️ 心血管系
- •
先天性心疾患:15〜40%
- •
ASD、VSD、動脈管開存
- •
左室心筋緻密化障害(LVNC)の報告あり
🦴 骨格系
- •
側弯症:約30%
- •
漏斗胸・鳩胸
- •
関節弛緩
⚠️ 腫瘍リスク
- •
腫瘍発生率:2〜3%
- •
仙尾部奇形腫(最多)
- •
神経芽細胞腫、Wilms腫瘍、肝芽腫
🩺 院長コラム【欠失型と点変異型の違いを理解する】
ソトス症候群には「5q35.3微細欠失型」と「NSD1点変異型」の2つのタイプがあります。重要なのは、欠失型の方が点変異型より重症になりやすいという傾向があることです。
これは、欠失型ではNSD1だけでなく隣接する複数の遺伝子も同時に失われるためです。たとえば、SLC34A1やFGFR4が欠失に含まれると腎石灰化のリスクが上昇し、FLT4が含まれると胎児期のリンパ浮腫が生じやすくなります。
そのため、「ソトス症候群」と診断された場合でも、欠失型か点変異型か、欠失範囲はどこまでかを正確に把握することが、適切な管理計画を立てる上で非常に重要です。
3. 原因と遺伝的背景|日本人に多い理由
【結論】 5q35.3欠失症候群の発生には低コピー反復配列(LCR)が関与しています。特に日本人では欠失型が50%以上と欧米(約10%)より高頻度であり、これは日本人集団に多い染色体逆位多型が原因です。
欠失の発生メカニズム
💡 用語解説:非対立遺伝子間相同組換え(NAHR)とは?
染色体上には似た配列(低コピー反復配列:LCR)が複数存在します。減数分裂時に、本来ペアになるべき配列ではなく、誤って別のLCR同士がペアリングしてしまうと、その間の領域が欠失または重複します。これを「非対立遺伝子間相同組換え(NAHR)」と呼び、多くの微小欠失症候群の原因となっています。
5q35領域にはSoS-PREP(近位反復配列)とSoS-DREP(遠位反復配列)という2つのLCRが存在し、この間で不均等な組換え(NAHR)が起こることで、約1.9〜2.0Mbの共通欠失が発生します。
日本人に欠失型が多い理由
🎯 日本人集団の特異性
欧米人:ソトス症候群の原因の約90%がNSD1点変異、約10%が微細欠失
日本人:ソトス症候群の原因の約50%以上が5q35.3微細欠失
この差は、日本人集団に高頻度で存在する染色体逆位多型によるものです。SoS-PREPとSoS-DREPの方向性が逆転しているアレルが日本人に多く存在し、この逆位構造がNAHRを誘発しやすい不安定な構造を形成します。
🧬 創始者効果(Founder Effect)とは?
定義:新しい集団が少数の「創始者」から形成される際、創始者がたまたま持っていた遺伝的特徴が、子孫集団全体に不釣り合いに高い頻度で広がる現象です。
📊 日本人集団での具体例
古代の祖先集団
少数の創始者
逆位多型を持つ個体を含む
現代の日本人集団
逆位多型が高頻度
欠失型ソトス症候群が多い
💡 ポイント:逆位多型そのものは通常無害であり、保因者に症状はありません。しかし、卵子や精子を作る減数分裂の際に染色体の不安定性を引き起こし、子どもに欠失が新たに生じるリスクを高めます。これが「親は正常なのに子どもに欠失が生じる」メカニズムの背景です。
⚠️ 臨床的意義:日本人のソトス症候群疑い患者では、まず微細欠失の検索(CMAやMLPA)を行うことが、診断効率および経済的な観点から推奨されます。点変異のシーケンス解析は欠失が陰性の場合に検討します。
遺伝形式と再発リスク
| 状況 | 頻度 | 次子への再発リスク |
|---|---|---|
| 新生突然変異(両親正常) | 95%以上 | 1%未満(生殖細胞モザイクの可能性はあり) |
| 親からの遺伝 | 約5% | 50% |
4. 隣接遺伝子症候群としての病態
【結論】 5q35.3欠失症候群では、NSD1以外の隣接遺伝子(SLC34A1、FGFR4、FLT4、LTC4Sなど)の欠失が、点変異型ソトス症候群には見られない特有の合併症(腎石灰化、リンパ浮腫など)を引き起こします。
主要な責任遺伝子と関連症状
| 遺伝子 | 位置 | 機能 | 欠失時の影響 |
|---|---|---|---|
| NSD1 | 5q35.2 | ヒストンメチルトランスフェラーゼ | ソトス症候群(過成長、巨頭、知的障害) |
| NKX2-5 | 5q35.1 | 心臓発生の転写因子 | 重篤な先天性心疾患(Ebstein奇形、TOFなど) |
| FLT4 | 5q35.3 | リンパ管新生(VEGFR3) | 先天性リンパ浮腫、胎児期NT肥厚 |
| SLC34A1 | 5q35.3 | 腎リン酸再吸収 | 腎石灰化症、高カルシウム尿症 |
| FGFR4 | 5q35.2 | FGF23シグナル、リン/Ca代謝 | 乳児期一過性高カルシウム血症 |
| LTC4S | 5q35.3 | ロイコトリエン合成 | 筋緊張低下への関与が示唆 |
腎石灰化症:SLC34A1とFGFR4の役割
5q35.3欠失型ソトス症候群では、点変異型には見られない腎石灰化症(Nephrocalcinosis)が報告されています。これはSLC34A1とFGFR4のハプロ不全によるものです。
-
①
SLC34A1欠失:腎でのリン酸再吸収低下 → 低リン血症
-
②
代償反応:活性型ビタミンD合成亢進 → 腸管からのCa吸収増加
-
③
結果:高カルシウム尿症・腎石灰化
-
④
FGFR4の寄与:乳児期の一過性高カルシウム血症(発達スイッチの異常)
⚠️ 臨床上の注意点
5q35.3微細欠失型ソトス症候群と診断された場合、ビタミンDサプリメントのルーチン投与は高カルシウム血症を悪化させるリスクがあります。欠失範囲にSLC34A1やFGFR4が含まれているかを確認し、腎超音波検査や血中・尿中カルシウム測定による定期的なモニタリングが重要です。
先天性リンパ浮腫:FLT4の役割
FLT4(VEGFR3)遺伝子はリンパ管新生のマスターレギュレーターです。FLT4の点変異はミルロイ病(Milroy disease)として知られる先天性遺伝性リンパ浮腫の原因となります。
5q35.3欠失がFLT4を含む範囲まで及んでいる場合、胎児期の後頸部浮腫(NT肥厚)として超音波検査で観察されることがあります。これは出生前診断の重要な手がかりとなり、遠位欠失型の特徴的所見です。
5. 5q35.3欠失症候群の診断方法
【結論】 本症候群の確定診断には染色体マイクロアレイ検査(CMA)が不可欠です。CMAは欠失の有無だけでなく、正確な欠失範囲(どの遺伝子が含まれるか)を同定でき、予後予測や管理計画に直結する情報を提供します。
遺伝学的検査の種類と特徴
| 検査方法 | 特徴 | 5q35欠失の検出 |
|---|---|---|
| 染色体マイクロアレイ(CMA) | ゴールドスタンダード。欠失範囲と含まれる遺伝子を精密に同定可能 | ◎ 最適 |
| MLPA法 | NSD1のエキソン単位の欠失・重複を検出。比較的安価で迅速 | ◎ 検出可能 |
| FISH法 | 特定プローブで迅速確認。サブテロメアFISHパネルで網羅的検索も | △ 専用プローブで可能 |
| G分染法(核型分析) | 解像度5〜10Mb。大きな欠失のみ検出可能 | ✕ 検出困難(1.9〜2Mbの微小欠失) |
| NSD1シーケンス解析 | 点変異の検出に有用。欠失が陰性の場合に実施 | 点変異の検出(欠失は検出不可) |
💡 用語解説:染色体マイクロアレイ(CMA)とは?
CMAは、従来のG分染法では検出できない微細な染色体の重複・欠失(コピー数変異:CNV)を高解像度で検出する検査です。日本では原因不明の発達遅滞・先天異常に対する保険適用検査として実施されています。5q35.3欠失症候群では、欠失範囲を正確に同定することが予後予測に直結するため、CMAが最も有用です。
診断のフローチャート
-
①
臨床的にソトス症候群を疑う(過成長、巨頭、特徴的顔貌、発達遅滞)
-
②
まずCMAまたはMLPAで5q35.3微細欠失を検索(日本人は50%以上が欠失型)
-
③
欠失陰性の場合:NSD1シーケンス解析で点変異を検索
-
④
欠失陽性の場合:CMAで欠失範囲を精密に同定 → 含まれる遺伝子に応じた管理計画
6. 治療と長期管理
【結論】 本症候群には根本的な治療法は存在せず、症状に応じた対症療法・早期療育・継続的支援が中心となります。欠失範囲に応じた合併症への注意(腎石灰化、心疾患など)も重要です。
欠失範囲に応じた管理ポイント
| 含まれる遺伝子 | 必要な監視・管理 |
|---|---|
| NSD1 | 発達評価、早期療育(PT/OT/ST)、てんかん監視、側弯チェック、腫瘍サーベイランス |
| SLC34A1/FGFR4 | 腎超音波(腎石灰化)、血中・尿中Ca/P測定、ビタミンD投与は慎重に |
| NKX2-5 | 心エコー必須、心電図(伝導障害)、循環器専門医によるフォロー |
| FLT4 | リンパ浮腫の評価、必要に応じてリンパドレナージ |
ライフステージ別の管理
👶 乳幼児期(0〜5歳)
- •
早期療育開始(PT/OT/ST)
- •
心エコー検査
- •
腎超音波(腎石灰化のスクリーニング)
- •
腫瘍サーベイランス(腹部超音波)
🎒 学童期(6〜12歳)
- •
知能検査・学習評価
- •
特別支援教育の検討
- •
側弯症の定期チェック
- •
てんかんがあれば抗てんかん薬
🧑 成人期
- •
就労支援・生活自立支援
- •
移行期医療(小児科→成人科)
- •
遺伝カウンセリング(次世代への50%遺伝リスク)
- •
腎機能のモニタリング(石灰化既往例)
7. 出生前診断について
【結論】 5q35.3欠失症候群は出生前診断で検出可能です。胎児超音波でのNT肥厚や心奇形をきっかけに羊水検査でCMAを行い、診断されることがあります。
出生前検査での検出方法
| 検査 | 検出可能性 | 備考 |
|---|---|---|
| 胎児超音波検査 | △ 間接的 | 遠位欠失型ではNT肥厚・胎児水腫、広範囲欠失では心奇形 |
| 羊水検査+CMA | ◎ 確定診断 | Gバンド法では検出できない微小欠失を確定診断可能 ※学会指針では、原則として超音波での構造異常がある場合などが対象とされています |
| 絨毛検査+CMA | ◎ 確定診断 | 妊娠初期(11〜14週)に実施可能 |
| NIPT | ✕ 対象外 | 5q35.3欠失は当院NIPTの検出対象12種類の微小欠失に含まれていません |
⚠️ 重要:5q35.3欠失症候群は、当院のNIPTで検出可能な12種類の微小欠失(1p36, 2q33, 4p16, 5p15, 8q23q24, 9p, 11q23q25, 15q11.2-q13, 17p11.2, 18p, 18q22q23, 22q11.2)には含まれていません。胎児超音波での異常所見(NT肥厚、心奇形など)が見つかった場合に、羊水検査でCMAを行うことで診断されます。
出生前診断で見つかった場合
-
①
遺伝カウンセリング:欠失範囲、含まれる遺伝子、予想される症状を説明
-
②
両親の検査:親が同じ欠失を持つか確認(新生突然変異か遺伝性かを判定)
-
③
詳細超音波:心奇形、胎児水腫などの構造異常を精査
-
④
出生後フォロー体制:発達支援、合併症モニタリングの準備
🩺 院長コラム【出生前診断で欠失が見つかったら】
出生前診断で5q35.3欠失が見つかった場合、ご家族は大きな決断を迫られます。特にソトス症候群型(NSD1欠失)では、知的障害の程度は軽度〜中等度が多く、適切な支援があれば社会参加が可能な方も多くいらっしゃいます。
一方、遠位欠失型では超音波でNT肥厚や胎児水腫が見られることがありますが、言語発達は比較的良好という報告もあります。欠失範囲によって予後が異なるため、CMAで欠失範囲を正確に把握することが重要です。
臨床遺伝専門医として、私は中立的な立場で正確な情報を提供し、ご家族の意思決定を支援します。どのような決断をされても、その後もサポートを続けます。
8. ミネルバクリニックのサポート体制
ミネルバクリニックでは、臨床遺伝専門医の専門性を活かした診療体制を整えています。5q35.3欠失症候群を含む染色体異常の検査から、結果説明、フォローまで一貫してサポートいたします。
🔬 高精度な検査技術
COATE法採用の次世代NIPT(第3世代より新しい)。全染色体検査や微小欠失検査も対応しています。
🏥 院内で確定検査まで対応
2025年6月より産婦人科を併設し、羊水検査・絨毛検査も院内で実施可能に。転院の必要がなく、心理的負担を軽減できます。
💰 互助会制度で費用面も安心
互助会(8,000円)により、陽性時の確定検査(羊水検査)費用が全額補助されます。上限なしで安心です。
よくある質問(FAQ)
🏥 一人で悩まないでください
5q35.3欠失症候群について心配なこと、検査を受けるかどうか迷っていること、
どんなことでもお気軽にご相談ください。
臨床遺伝専門医があなたとご家族に寄り添います。
参考文献
- [1] Tatton-Brown K, et al. Sotos syndrome. Eur J Hum Genet. 2007;15(3):264-271. [PubMed]
- [2] Kurotaki N, et al. Fifty microdeletions among 112 cases of Sotos syndrome: low copy repeats possibly mediate the common deletion. Hum Mutat. 2003;22(5):378-387. [PubMed]
- [3] Rauch A, et al. A novel 5q35.3 subtelomeric deletion syndrome. Am J Med Genet A. 2003;121A(1):1-8. [PubMed]
- [4] Visser R, et al. Sotos syndrome common deletion is mediated by directly oriented subunits within inverted Sos-REP low-copy repeats. Hum Mol Genet. 2005;14(4):535-542. [PubMed]
- [5] Kenny J, et al. Sotos syndrome, infantile hypercalcemia, and nephrocalcinosis: a contiguous gene syndrome. Pediatr Nephrol. 2011;26(8):1331-1334. [PubMed]
- [6] Lane C, et al. Switch in FGFR3 and -4 expression profile during human renal development may account for transient hypercalcemia in patients with Sotos syndrome due to 5q35 microdeletions. J Clin Endocrinol Metab. 2014;99(7):E1361-E1367. [PubMed]
- [7] Iascone M, et al. Congenital Heart Defects in Patients with Molecularly Confirmed Sotos Syndrome. Diagnostics (Basel). 2024;14(6):594. [PubMed]
- [8] OMIM #117550 – Sotos Syndrome 1. [OMIM]
- [9] GeneReviews – Sotos Syndrome. [GeneReviews]
- [10] Orphanet – Sotos syndrome. [Orphanet]
関連記事