目次
Wntシグナル
Wntシグナルとは?
Wntシグナル伝達経路は、古くから進化的に保存されている経路であり、胚の発生過程において、細胞運命決定、細胞移動、細胞極性、神経パターニング、器官形成などの重要な側面を制御している。Wntsは分泌型の糖タンパク質であり、ヒトでは19のタンパク質からなる大規模なファミリーを構成している。このことは、シグナル伝達の制御、機能、生物学的出力が非常に複雑であることを示唆している。これまでに、Fz受容体の下流には、Wnt/β-カテニン依存性の正規の経路と、非正規のβ-カテニン非依存性の経路(Planar Cell Polarity経路とWnt/Ca2+経路に分けられる)を含む主要なシグナル分岐が同定されており、これらの分岐は、分子および生化学レベルで活発に解明されている。Wntシグナルが胚発生時のパターン形成に重要な役割を果たしているという事実が強く示されており、多くの研究により、数多くのシグナル成分が同定され、Wntシグナル伝達経路の多くの枝の分子的枠組みを構築するのに役立った。しかし、Wntシグナルの多様な機能、統合性、特異性はまだ明らかになっていない。さらに、このシグナル伝達の枠組みの中での生化学的な側面の多くについても、明確な理解が得られていない。Wntシグナルの異常と疾患との間に強い相関関係、時には因果関係があることが示されており、Wntシグナルの研究は、胚発生の基本的なメカニズムとヒトの病気の両方を理解するための重要な目標である。
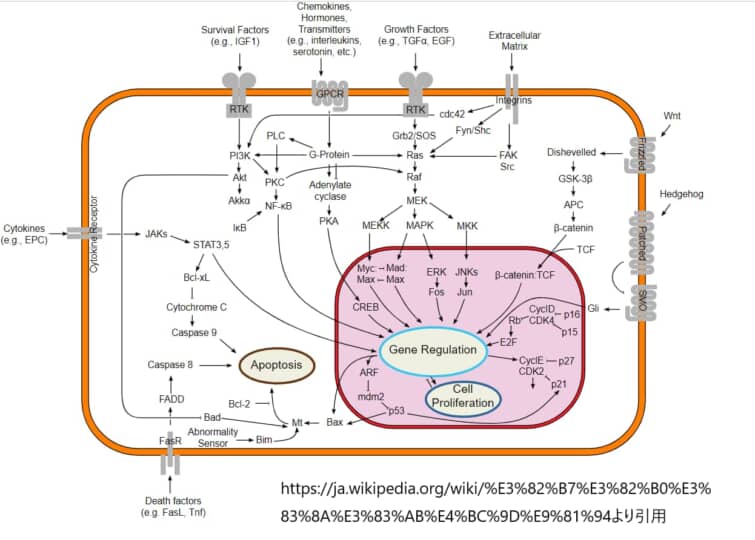
Wntシグナル伝達経路
現代の分子医学では、生物の発生を制御するシグナル伝達経路や分子メカニズムの解明に力が注がれている。正常な発生を制御するメカニズムを理解することで、これらのメカニズムに異常が生じたときに生じる多面的な病理を予防し、治療することへの期待を飛躍的に高めることができるという考えに基づいている。Wntシグナル伝達経路の解明に力が注がれている重要な経路の1つに、Wntシグナル伝達経路がある。
Wntシグナル伝達経路は、後生動物に保存されている経路である。Wntという名前は、ショウジョウバエのセグメントポラリティ遺伝子winglessと、脊椎動物のホモログであるintegratedまたはint-1の名前を融合したものである。細胞外のWntシグナルは、いくつかの細胞内のシグナル伝達カスケードを刺激する。Wntタンパク質は、細胞の運命決定、運動性、極性、一次軸形成、器官形成など、非常に多くの細胞プロセスを制御しており、最近では、この経路が幹細胞の再生に関与していることが明らかになっている。胚発生において重要な役割を果たすシグナル伝達経路は厳密に制御されており、Wntタンパク質やWntアンタゴニストの発現は、発生の過程で時間的にも空間的にも絶妙に制限されている3。Wntシグナルの異常は、発生中の胚に壊滅的な結果をもたらし、現在では、Wntシグナルの欠陥が多くの多面的なヒトの病理の原因となっていることがよく理解されている。最も顕著な例としては、乳がん、大腸がん、皮膚がん、骨格異常、そして最も一般的なヒトの神経管閉鎖障害である二分脊椎を含むヒトの先天性障害などが挙げられる。
Wntタンパク質は、Frizzled(Fz)受容体ファミリーのN末端細胞外システインリッチドメインに結合する分泌型糖タンパク質であり、ヒトには10種類のFzが存在する5。Fzタンパク質は、Gタンパク質共役型受容体と位相的に相同性のある7回膜スパンのタンパク質である。Wntシグナルの重要な調節因子の一つは、細胞外環境に存在する多様なWntアンタゴニストである。Wntシグナルは、受容体複合体に結合した後、細胞質のリン酸化タンパク質であるDishevelled (Dsh/Dvl)に伝達され、DshがFzと直接相互作用することが明らかになっている。Dshのレベルで、Wntシグナルは、少なくとも3つの主要なカスケード、すなわち、カノニカル、Planar Cell Polarity、Wnt/Ca2+に分岐する。Dshは、この伝達経路の重要な下流成分であり、Wntシグナルの3つの主要な分岐すべてに枢要に関与する最初の細胞質タンパク質である。しかし、Dshタンパク質がどのようにしてこれらの各経路へのシグナル伝達を制御し、チャネルするのかはまだ明らかになっていない。
カノニカル(標準)Wntシグナル伝達経路
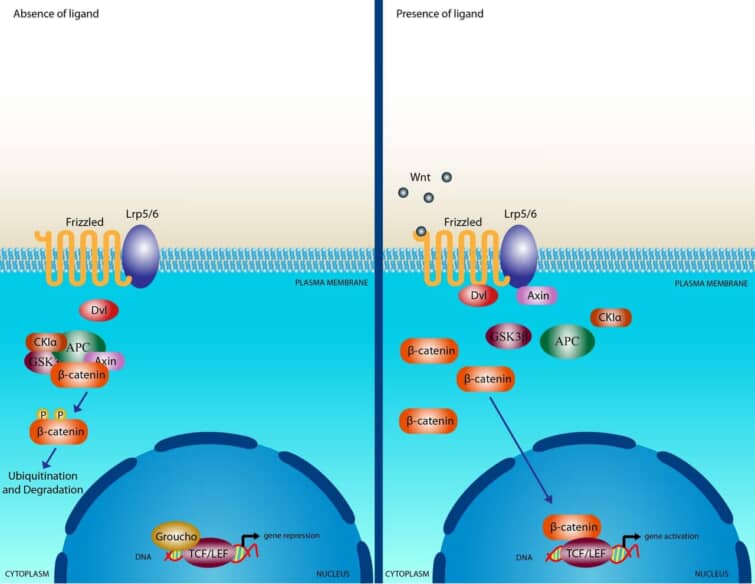
Wntシグナル伝達カスケードを模式的に示したもの。左は、Wntリガンドが存在しない状態で、Axin、APC、GSK3-β、CK1、β-カテニンの複合体が細胞質に存在している状態。β-カテニンは、CK1とGSK3-βによって二重にリン酸化され、β-TrCPを介したプロテオソーム機構によって分解される。右は、Wnt刺激により、Fz受容体とLRP5/6共受容体複合体を介したシグナル伝達により、CK1とGSK3-βによるLRP6の二重リン酸化が誘導され、Axinを含むタンパク質複合体が細胞質から細胞膜へと移動することを示している。また、Dshも膜にリクルートされてFzと結合し、Axinはリン酸化されたLRP5/6と結合する。Fz/LRP5/6の膜で形成されたこの複合体は、Axinの隔離および/または分解を介して、β-catの安定化を誘導する。β-カテニンは核に移動し、Lef/Tcfファミリーと複合体を形成し、標的遺伝子の転写誘導を媒介する。
カノニカルWnt経路は、ショウジョウバエの遺伝子スクリーニングによって初めて同定された。正規のWnt経路の特徴は、アドヘレンズジャンクション関連タンパク質であるβ-カテニンの蓄積と核内への移動である。Wntシグナルがなければ、細胞質のβ-カテニンは、Axin、adenomatosis polyposis coli (APC)、プロテインホスファターゼ2A (PP2A)、グリコーゲン合成酵素キナーゼ3 (GSK3)、カゼインキナーゼ1α (CK1α)からなるβ-カテニン破壊複合体によって分解される。 カゼインキナーゼやGSK3によるβ-カテニンのリン酸化は、β-カテニンをユビキチン化し、プロテオソーム機構による分解の対象とする。WntがFzとLRP5/6からなる受容体複合体に結合すると、β-カテニンの標的破壊に必要なAPC/Axin/GSK3複合体が破壊される一連のイベントが引き起こされる。WntがFz/LRP5/6複合体に結合すると、シグナル伝達の重要な負のレギュレーターであるAxinの膜移行が誘導される。Axinは、LRP5/6の細胞質側の尾部にある保存された配列に結合する。Wntの刺激は、Axinの安定性も制御していることに注意する必要がある。 微小管アクチン架橋因子1(MACF1)がAxinの膜移行に重要な役割を果たしている可能性が報告されたが、その正確なメカニズムはまだ不明である。Axinの膜移行に伴い、LRP5/6との結合は、CK1γまたはGSK3を介したLRP5/6のリン酸化によって触媒される。ここで重要なことは、CK1とGSK3は、カノニカルシグナルの2つのレベルで異なる役割を果たしていると考えられることである。LRP5/6のレベルでは両者の影響は正であり、β-カテニンのレベルでは両者の役割は負である。Axinの結合は、AxinのWntシグナルに対する負の作用を取り除き、リンタンパク質Dshの活性化につながると考えられている。Dshは、カゼインキナーゼ1、カゼインキナーゼ2、 Metastasis Associated Kinase、Protein Kinase C40、Par1などの多くのキナーゼによってリン酸化される。Dsh自体は、DIXドメイン、PDZドメイン、DEPドメインの3つの異なるドメインを含むモジュール化されたタンパク質であり、カノニカルなシグナル伝達においては、DIXドメインとPDZドメインがシグナル伝達の中心となっているようである。Dshが活性化されると、GSK3酵素の活性が阻害され、β-カテニンの分解が阻害され、その結果、β-カテニンが安定化して細胞質に蓄積されるという一連の複雑な事象が活性化される。β-カテニン自体は核局在化配列(NLS)を持たず、核内への移行にはインポリンタンパク質の機能やRanによる核内への取り込みが必要であると考えられている。β-カテニンは他の因子と「ピギーバック」して核内に移行する可能性が提案されており、その一つが核内シャトリングを行うように見えるアクシンである44,45。β-カテニンの輸送に関しては、β-カテニンが核輸出配列(NES)を持っていないこともあり、2つのメカニズムが確認されている。1つは、NESを持つAPCタンパク質とともにRan結合タンパク質3(RanBP3)が関与するもので、もう1つはRanに依存せずに核膜孔複合体内のタンパク質が直接関与するものである。核内でのβ-カテニンの結合相手は数多く発見されているが、最も特徴的なのはLEF/TCF DNA結合転写因子のメンバーであろう。この複合体は標的遺伝子のプロモーターに結合する。この複合体は、標的遺伝子のプロモーターに結合する。これらの標的遺伝子には、SiamoisやTwinのような胚形成時のオーガナイザー形成に必要な遺伝子や、MycやCyclinD1のような癌形成に関与する遺伝子が含まれる。
受精後、皮質回転の過程で背側因子が胚の将来の背側に移動し、スペマン-マンゴールドオーガナイザーと呼ばれるシグナルセンターの形成が確立される。これまでの研究で、皮質の回転が、Dshタンパク質をはじめとするWnt経路の構成要素を胚の背側に移動させ、β-カテニンを安定化させ、背側のスペマン-マンゴールドオーガナイザーの形成に重要な役割を果たしていることが明らかになっている。背側オーガナイザーの形成にWntリガンドが関与しているのか、あるいはリガンドを必要とせずにWntシグナルカスケードが細胞内で活性化されているのかは不明であった。その後、初期の背軸形成においてこの作用を担うWntリガンドは確かにWnt11であることが示された。Xenopus胚では、カノニカルWntシグナルを活性化するRNAをマイクロインジェクションで腹側に注入すると、異所性の背軸構造が形成される。さらに、Xenopusの発生初期において、β-カテニン/TCF複合体は、ホメオドメイン転写因子をコードするTwinおよびSiamoisの転写を促進する。これらのデータを総合すると、発生初期の背軸形成には正準経路が必要である。
スペマン-マンゴールドオーガナイザーの形成に続いて、正準Wnt経路は前頭部の形成と神経パターニングも制御している。これらの阻害タンパク質は、Wntと物理的に結合し、Wnt/Fz複合体の形成を阻害することで、胚の前方領域では核内βカテニンタンパク質のレベルが低く、後方領域ではレベルが高くなる。前後軸に沿ったWntシグナルの勾配は、前頭部の構造と神経外胚葉のパターニングの形成に重要である3。正準Wntシグナルは、その後の後頭部のパターニングや尾部の形成、さらには心臓、肺、腎臓、皮膚、骨などの様々な器官系の形成も制御している。Wntシグナルは、最近では、幹細胞の再生にも重要な役割を果たしていることが明らかになっている。胚の発生過程において、Wnt経路が直接または間接的に形成を制御していない器官系はないと思われる。この事実だけでも、正準Wnt経路の重要性と重要な機能を浮き彫りにしている。
非正規の平面細胞極性パスウェイ Non-Canonical Planar Cell Polarity Pathway
非正規の経路は、しばしばβ-カテニン非依存性の経路と呼ばれ、この経路はさらに、平面細胞極性経路(PCP経路)とWnt/Ca2+経路という2つの異なる枝に分けられる。
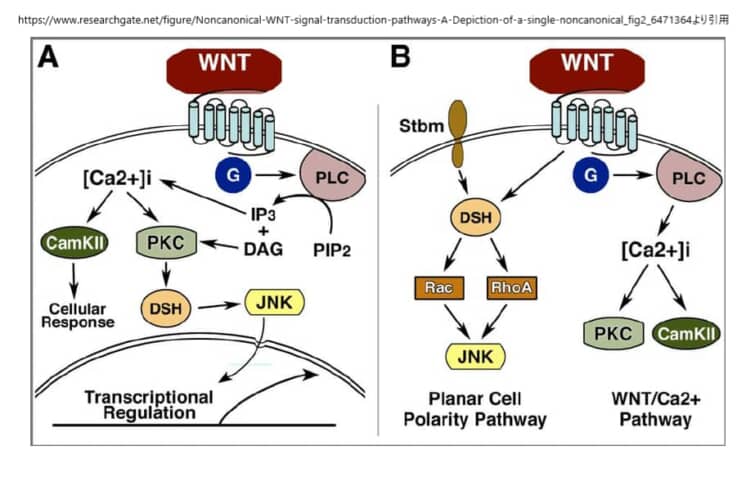
PCP経路
PCP経路は、ショウジョウバエを用いた遺伝学的研究から生まれたもので、FrizzledやDishevelledなどのWntシグナル成分の変異により、クチクラの毛や感覚のある剛毛などの上皮構造の向きがランダムになることがわかった。この硬い組織は、毛包、感覚毛、眼球の六角形の配列などの構造の方向性を支配している。脊椎動物では、この組織化が、内耳の感覚上皮における立体繊毛の組織化と配向、毛包の組織化、背側の中胚葉細胞の形態と移動行動の基盤となっていることが示されている。さらに、この経路は転写とは独立して機能しているようである。
この非正規経路は、ショウジョウバエの平面細胞極性経路と中核的な構成要素が同じであることから、おそらく同等のものであると考えられている。この過程では、極性を持った細胞が内側軸に沿って挿入され、内側が狭くなり(収束)、前方が伸びる(伸長)。非正規のWnt経路は、収束伸長時およびその後の神経管閉鎖時に、背側中胚葉細胞の細胞極性と動きの両方を制御することが示された。Wnt4、Wnt5a、Wnt11のリガンドは、非正規経路を介してシグナルを送ることが確立されているが、Wnt11が正規経路を介した初期の軸形成に重要な役割を果たしていることが明らかになった。非正規経路の他の多くの構成要素も収束伸長を阻害することが明らかにされており、Dsh、Fz、Daam1、Rho、Rac、Prickle、Strabismusなどが含まれる。PKAなどの他の因子は、非正規シグナルの負の制御因子として機能することが明らかにされた。PKAはRhoAと相互作用してRhoの活性を阻害することができ、またPKAはβ-カテニン依存性の遺伝子転写に影響を与えない。
非正規の経路では、Wntシグナルは、LRP5/6の共同受容体とは無関係にFzを介して伝達されると考えられている。しかし、最近の研究では、LRP6が収束的な伸長運動を制御することが示されており、この問題を解決するためにはさらなる研究が必要である。重要なのは、ショウジョウバエの場合、Wnt分子がこの経路を制御しているかどうかは明らかになっていないことである。非正規の経路におけるFzの共同受容体は、NRH1、77 Ryk、78 PTK779、ROR2などの候補があるものの、明確には定義されていない。DshのPDZドメインとDEPドメインはともに、低分子GTPaseであるRhoとRacを活性化する2つの並行した経路を活性化するために利用される。Rhoシグナルの分岐を活性化するために、WntシグナルはDsh-Daam1複合体を誘導し、Daam1が活性化され、その結果、これまでに同定された少なくとも1つのRhoグアニン交換因子であるWGEFを介してRho GTPaseが活性化される。Daam1(Dishevelled associated activator of morphogenesis 1)はFormin-homologyタンパク質であり、DshやRhoAと結合することができることから、シグナル伝達の正のフィードバックループの可能性が示唆されている。Rho GTPaseの活性化は、Rho関連キナーゼ(ROCK)82とミオシン83の活性化を引き起こし、アクチン細胞骨格の変化と細胞骨格の再編成を引き起こす。
シグナルの第2の枝は、DshのDEPドメインを必要とし、Rac GTPaseを活性化する。この活性化はDaam1とは無関係であり、活性化されたRacはJNK活性を刺激する。66,84 非正規のシグナル伝達におけるJNKの下流の因子については、まだ十分に解明されていない。RhoとRacはともに転写制御に関与しているとされているが、非正規のシグナル伝達のためにこれら2つのGTPaseの下流で転写される遺伝子があるかどうかは今のところ明らかになっていない。RhoとRacは相反する機能を持つと考えられているが、細胞の分極や方向性のある移動のために、RhoとRacの活動がどのように調整されるのかは、いまだによくわかっていない。
非正規のシグナル伝達が収束的な伸長運動に重要な役割を果たしていることは多くの実験で確認されているが、この経路が具体的にどのようにこのプロセスを制御しているのかは不明のままである。ショウジョウバエのPCP経路では、Fz、Flamingo (Fmi)、Dsh、Strabismus、Prickleなどの主要なコンポーネントの局在の違いが偏光を媒介する重要な役割を果たしていることが明らかになっている59。背側に移動する中胚葉細胞では、Xenopusでは移動細胞の内側と外側の端に沿ってDsh、Rac、PKCδの局在が異なることが観察されているが、Prickleは前方に局在しているようである(ゼブラフィッシュの細胞)62,85。Dshの細胞内局在は、最もよく解析されているものの一つである。2,87 Dshを過剰に発現させたり、発現量を低下させたりすると、細胞膜の局在や内側の細胞極性が乱れることが観察された。88 また、非正規のWntシグナルが、胚盤胞の移動に指示的あるいは容認的な役割を果たしているかどうかは、いまだ不明である。ゼブラフィッシュを用いた研究では、2細胞期の胚にWnt11のRNAを注入すると、silberblick変異体で観察されたガストロフィーの欠損を救うのに十分であることが示された。
非正規のWnt/Ca2+経路
非正規のWntシグナル伝達経路の第2の枝は、Wnt/Ca2+経路と呼ばれている。この経路は、前述の平面細胞極性経路と多くの構成要素を共有しているが、明確な違いがあるので、別の枝として記述することができる。この経路は、背軸形成のためのカノニカルシグナルと、胚盤胞の移動のための平面細胞極性シグナルをさらに調節する。Wnt/Ca2+経路は、いくつかのWntsとFz受容体が小胞体からの細胞内Ca2+放出を刺激すること、そしてこの経路がGタンパク質に依存していることを発見したことで登場した。さらに、胚におけるCa2+波は、ゼブラフィッシュ92やXenopusの胚93の胚盤形成領域で実証され、初期のパターン形成に重要な役割を果たしていると考えられている。Wnt5a, Wnt11およびラットFz2 (RFz-2)は、β-カテニンの安定化に影響を与えることなく、細胞内のCa2+を放出することができる。ゼブラフィッシュ胚においてWnt5aまたはRFz-2を過剰発現させた場合のカルシウム放出は、Gタンパク質シグナルを阻害するpertusis toxinおよびtransducinのaサブユニットによって抑制される。これらの報告は、Wnt/Fzシグナルが三量体Gタンパク質を介して細胞内のCa2+を放出させることを示している。これらの報告から、Wnt/Fzシグナルは、三量体Gタンパク質を介して細胞内のCa2+を放出させ、細胞内に蓄積されたカルシウムは、プロテインキナーゼC(PKC)96やカルシウム/カルモジュリン依存性キナーゼII(CamKII)など、いくつかのCa2+感受性タンパク質を活性化することが明らかになった。また、CamK11は、TGFβ活性化キナーゼ(TAK1)やネモ様キナーゼ(NLK)を活性化し、β-カテニン/TCFシグナルに拮抗することが明らかになっている。また、Ca2+はPKCを活性化し、低分子GTPaseであるCDC42の活性化を介して、胚盤形成時の組織分離プロセスを制御する。
胚発生におけるWnt/Ca2+経路の役割は多岐にわたり、背軸形成の負の制御、腹側細胞の運命の促進、胚盤形成時の組織分離と収束伸長運動の制御、そして後には心臓の形成にも関与している。Wnt5aとWnt11のリガンドは、Ca2+の放出を誘導し、PKCとCamKIIを活性化する。Wnt5aの誤発現によって引き起こされる収束伸長運動の阻害は、ゼブラフィッシュ胚におけるCamKIIの発現によって部分的に回復することができる。また、CamKII自体の過剰発現は、Xenopus胚のガストロレーション運動を阻害することができる97。これらの研究から、Wnt/Ca2+経路は、正則的な細胞極性経路と平面的な細胞極性経路の両方の重要な調節因子として機能していることが明らかになった。今後は、この経路が分子レベルでどのように機能し、これら2つの経路の多様な生物学的結果を制御しているのかを理解することが重要である。
その他のWntシグナル伝達経路
定説となっているPlanar Cell Polarity経路とWnt/Ca2+経路は、現在までのところ最も研究されている枝であるが、他にも多くの経路が登場してきている。これらの経路は、Planar Cell Polarity経路とWnt/Ca2+経路の構成要素が重複しているが、結果は異なるようである。
神経細胞の移動とシナプス形成の際には、Wntシグナルが微小管の細胞骨格を制御することが示されており、この経路はGSK3とDshの活性に依存している。軸索誘導の際には、Ryk受容体とプロトオンコプロテインSrcを介した別のWnt経路が神経細胞の反発を制御する。細胞成長では、DshとGSK3を介したWntシグナルが腫瘍抑制因子TSC2を制御し、mTorを負に制御する。上皮の極性と細胞移動では、Dsh、aPKC、Par3、Par6、LGlを介したWntシグナルが、細胞の極性と微小管の細胞骨格を調節している。筋形成期には、PKAと転写因子CREBを介したWntシグナルが、MyoDやMyf5などの筋特異的な遺伝子の転写を調節する。胚盤形成期には、ROR2受容体を介したWntシグナルが、CDC42とJNK経路を介してプロトカドヘリンPAPCの発現を調節する。これらの新たな経路は、Wntシグナルが多くの発達中の細胞システムに影響を及ぼす複雑さを示唆している。
Wntシグナルの特異性
脊椎動物には多数のWntリガンドが存在し、また、Wntリガンドによって引き起こされるシグナルの枝分かれが多いことから、特定のWntリガンドが特定のシグナルの枝分かれを選択的に活性化するのではないかという疑問が生じる。例えば、Wnt8は核内のβ-カテニンを蓄積させるが、Wnt/Ca2+シグナルを活性化せず、Wnt11はこれまでのところ、カノニカルなシグナルと非カノニカルなシグナルの両方を活性化することができる。同様に、Frizzled受容体は、正規の経路と非正規の経路の両方を活性化するようであり、これらのタンパク質を特定の活性化因子、正規のシグナル伝達、非正規のシグナル伝達のいずれかに直接分類することはできない。ゼブラフィッシュ胚にrat frizzled-1 (RFz-1)を誤発現させても、Ca2+の放出やPKCおよびCamKIIの活性化は増加しなかった。一方、RFz-2はCamKII活性を刺激し、PKCの転位を誘導する。このように、異なるWntリガンドやフリズルド受容体が、どのようにして特定の経路活性化を展開することができるのかは、まだ不明である。現在のところ、特定の経路の特異性は、特定のリガンドと受容体の組み合わせそのものによって決まるわけではないというのが定説のようである。例えば、LRP-5とLRP-6はカノニカル経路のみに関与しており、一方、NRH1、PTK7、ROR2は非カノニカル経路を選択的に伝達することがわかっている。
Dshタンパク質は、Fzに結合する最初の細胞内成分であり、シグナル伝達のすべての枝で機能する。Dshタンパク質は、3つの保存されたドメインを持っている。DshのDIXドメインは、β-カテニン破壊複合体の構成要素であるAxinと結合し、複合体の形成を阻害する。DIXドメインは、カノニカルパスウェイには必須であるが、非カノニカルパスウェイには必要ない。DshのPDZドメインはカノニカル、非カノニカル、Wnt/Ca2+経路で機能し、DEPドメインは非カノニカルなシグナル伝達で機能する。8 Daam1、Strabismus、Prickleなどの非正規のシグナル伝達成分は、DshのPDZドメインと結合してPCP経路で機能することができる。
Dshの細胞内での局在は、シグナル伝達の特異性にも重要である。Dshが細胞質と核の間を行き来していることが示されているが、核におけるDshの機能の重要性はまだ不明である。
この記事の著者:仲田洋美(医師)








