目次
この記事では、プロテインキナーゼの基本的な機能、リン酸化プロセス、そしてこれらの酵素が人体でどのような重要な役割を果たしているのかを解説します。医学と生化学の観点から、プロテインキナーゼの理解を深めるための情報を提供します。
第1章: プロテインキナーゼの基礎
プロテインキナーゼとは何か
プロテインキナーゼは、細胞内で重要な役割を果たす酵素の一種であり、タンパク質分子にリン酸基を付加する(リン酸化する)ことによって、タンパク質の活性や機能を制御します。このリン酸化プロセスは、細胞のシグナル伝達、代謝、細胞周期の進行、および多くの他の細胞機能において中心的な役割を担っています。
プロテインキナーゼは、特定のアミノ酸残基、すなわちセリン、スレオニン、またはチロシンにATP(アデノシン三リン酸)からのリン酸基を転移させることによってタンパク質をリン酸化します。このリン酸化は、受けたタンパク質の酵素活性、局在、タンパク質間相互作用などを変化させ、細胞内のシグナル伝達や機能調節に重要な役割を果たしています[1]。
ヒトゲノムには約530のプロテインキナーゼが存在し、これらはその構造や活性化メカニズムに基づいてさまざまなグループに分類されます。例えば、プロテインキナーゼC(PKC)は、遺伝子発現やタンパク質の分泌、細胞増殖、炎症反応など、多くの細胞応答を制御するプロテインキナーゼのファミリーの一つです。PKCは、自己抑制的な偽基質ドメインを含み、様々なセカンドメッセンジャーの結合によって活性化されることが知られています[2]。
また、マイトジェン活性化プロテインキナーゼ(MAPK)カスケードは、細胞増殖、成長、分化、形質転換およびアポトーシスなどの多種多様な細胞プロセスを制御する複雑なシグナル伝達ネットワークを形成します。MAPK経路のキーメディエーターの調節不全は、がんを含む多くの疾患の原因となることがあります[3]。
プロテインキナーゼは、細胞の様々な機能を調節するために、特定のタンパク質をリン酸化することによって、細胞内の情報伝達を調整します。このようにして、プロテインキナーゼは生体内での多様な生理的プロセスにおいて中心的な役割を果たしています。
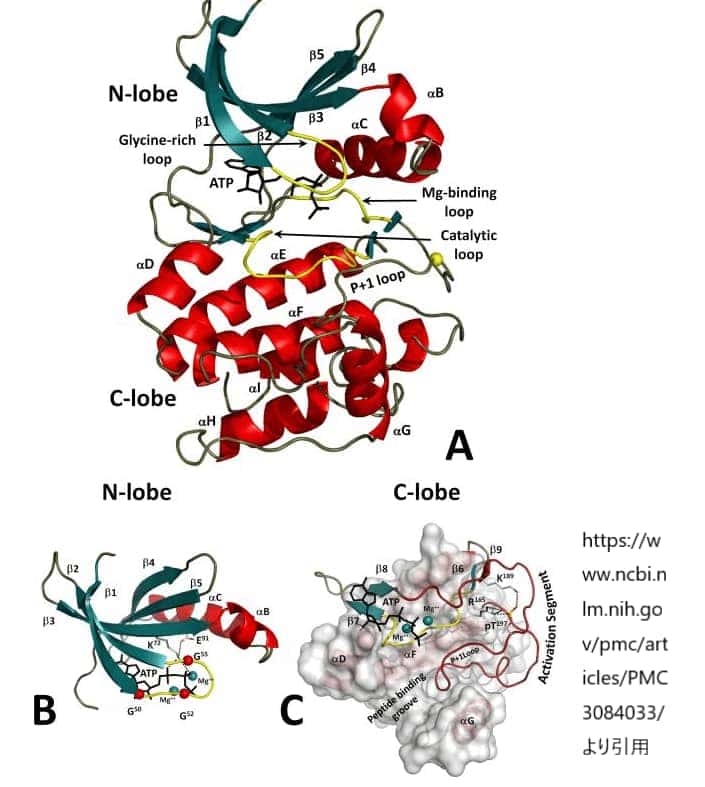
プロテインキナーゼの構造:
A. プロテインキナーゼの二重構造
プロテインキナーゼは二つの主要な部分、N末端側のローブ(N-lobe)とC末端側のローブ(C-lobe)から構成されています。N-lobeには5本のβストランドと普遍的に保存されたαCヘリックスが含まれ、これはキナーゼの活性部位の形成に寄与しています。C-lobeは主にらせん状の構造をしており、ATP分子はこの二つのローブが形成する深い裂け目に結合します。触媒的に重要なループは、酵素の活性に直接関与し、図では黄色で示されています。
B. N-lobeの詳細
N-lobe内のグリシンリッチループは、ATPのリン酸部分との相互作用において重要な役割を果たします。このループには3つの保存されたグリシンが含まれており、これらはリン酸塩とCヘリックスとの間の結合に関与するLys72と共に赤い球で示されています。
C. 触媒および制御装置
C-lobeでは、剛性の高いらせん状のコアに触媒および制御装置が結合しています。活性化セグメントはリン酸化部位を含んでおり、これがキナーゼ活性の調節に重要です。また、P+1ループはペプチド基質の特定の残基を受け入れるためのペプチド結合溝に位置しています。
これらの構造的詳細は、プロテインキナーゼの活性調節や特定の基質との相互作用を理解する上での鍵となります。このような情報は、新たな治療薬の開発やタンパク質工学の分野においても応用可能です。
N-lobe
キナーゼは、構造と機能が異なる二つのローブから成り立っています。これらのローブは触媒作用と制御のために互いに協力して機能し、その相互作用はヘキソキナーゼやATPaseなど他の代謝キナーゼとは大きく異なります。例としてPKAの残基番号を用いて説明しますが、これらの残基はキナーゼ全般に共通しています。小さなN-lobeには5本のβシートがあり、これがらせん状のC-helixサブドメインと結合しています。αC-β4ループはN-lobeで唯一、構造的にも機能的にもC-lobeに固定されています。
初めの3つのβストランドには、高度に保存された2つの配列モチーフが含まれています。最初のモチーフ(GxGxxG)は、β1とβ2の間のグリシンリッチループで、このループはATPのγ-リン酸を触媒位置に配置します。この部分はN-lobeで最も柔軟で、そのバックボーンはATPのγ-リン酸に固定される時に完全に閉じられます。Gly-rich Loopは、Walker-Aモチーフとは異なり、ATPのアデニン環との相互作用が異なります。PループはATPのプリン部分と接触しない一方で、Gly-rich Loopはアデニン環を保持する二本のβストランドをつなぎます。そのため、Walker-Aモチーフではγ-リン酸を固定するSer/Thrの代わりに、Gly-rich Loopの後に高度に保存されたVal57があり、ATPの塩基と疎水性の接触を行います。
もう一つの重要なモチーフ(AxK)は、β3ストランドに位置しています。このモチーフのLys72は、ATPのリン酸塩をC-helixに結合させます。C-helixはキナーゼ分子の中で非常にダイナミックな制御要素として機能し、N-lobeに属しながらも2つのlobe間の重要な位置にあります。C-helixは分子の様々な部分に接続され、「シグナル統合モチーフ」として働きます。C-helixのC末端はαC-β4ループによってC-lobeの剛体部分に固定され、N末端はActivation Loopに接続されています。効率的な触媒作用を行うためには、C-helixのN末端の位置調整がキナーゼの活性化によって達成される必要があり、その位置は触媒作用に必要な開閉動作を定義します。不活性なキナーゼでは、C-helixのN末端が乱れていることがありますが、それは単に最適な触媒位置にないというだけです。C-helixのもう一つの保存された残基であるGlu91は、β3のLys72と塩橋を形成し、これがキナーゼファミリー全体で高度に保存されており、活性化状態の特徴とされています。
活性状態では、C-helixがβシートコアに結合している時、N-lobeは触媒サイクルの一部として剛体として動きます。Gly-richループは、キナーゼが活性化されている時も非常に柔軟であり、キナーゼが開いているか閉じているかに関わらず、N-lobeと共に動きます。N-lobeの例外はαC-β4ループで、これはC-lobeにしっかりと固定されています。
C-lobe
C-lobeは、キナーゼの主要な構造部分であり、多くのヘリックスとβシートから構成されています。このローブは、キナーズのコア部分を形成し、タンパク質やペプチド基質を結びつける面としても機能します。H/D交換実験により、D、E、F、Hヘリックスのバックボーンアミドが溶媒から十分に遮蔽されていることが明らかにされていますが、Gヘリックスは例外で、これは溶媒にさらされています。βサブドメインは、4本の短いβ鎖(β6からβ9)から成り、ATPからタンパク質基質へのリン酸の転移に関わる触媒装置が含まれており、これらは疎水性残基を通じてらせん状のコアに固定されています。β6とβ7の間の触媒ループにはほとんどの触媒装置が位置しており、β8とβ9の間にはDFGモチーフがあり、Asp184はATPに結合するMg++イオンを認識するのに重要です。
活性化セグメントは、DFGモチーフからFヘリックスの最初のAsp220まで伸びており、キナーゼコアの中で最も変異が豊富な部分です。このセグメントはキナーゼの正確なオン/オフ制御に関与しており、そのダイナミックな制御は各キナーゼ固有でありながらも共通のメカニズムを持っています。FヘリックスはELKとEPKの両方で保存されていますが、Fヘリックスに続く拡張ヘリカルエレメントはEPK特有のものです。このセグメントはG-helixからI-helixまでを含み、GHIドメインと呼ばれます。多くの基質タンパク質や制御タンパク質がこのドメインに結びつけられ、キナーゼコアの活性化と安定化に寄与しているだけでなく、アロステリック部位としての重要な役割も担っています。活性部位から離れた位置にある2つの保存残基、APEモチーフのAsp208とαH-αIループのArg280が、GHIドメインを活性化セグメントに固定しています。
レギュラトリー・スパイン
プロテインキナーゼのLSPアライメントを用いて初めて実施された研究では、活性のあるキナーゼと活性のないキナーゼを比較し、少なくとも部分的に表面に露出している残基を検討しました。この分析から、すべての活性型キナーゼに共通して見られ、不活性型キナーゼには見られない、高度に保存された空間モチーフが明らかになりました。このモチーフは、4つの連続しない疎水性残基から構成され、N-lobeからはβ4鎖のLeu106とC-helixのLeu91、C-lobeからは活性化ループのPhe185と触媒ループのTyr164の4つの残基が含まれています。これらは、2つのローブ間を繋ぐ疎水性の「背骨」として機能し、キナーゼの構造的整合性と活性調節に重要な役割を果たしています。これまでのプロテインキナーゼの構造と機能の解析では見過ごされていたこれらの残基の重要性が、新たに認識されました。
キナーゼの種類と分類
キナーゼは、細胞内の信号伝達や代謝プロセスにおいて中心的な役割を果たす酵素の一群です。これらは、ATP(アデノシン三リン酸)からのリン酸基を特定の基質に転移させることにより、タンパク質の活性を調節します。キナーゼは、その基質となるアミノ酸残基の種類によって大きく分類されます。主な分類には、セリン/スレオニンキナーゼ、チロシンキナーゼ、およびその他のキナーゼ類があります。
● セリン/スレオニンキナーゼ
セリン/スレオニンキナーゼは、タンパク質のセリンまたはスレオニン残基をリン酸化する酵素です。これらは細胞内の多彩なシグナル伝達に関与しており、全プロテインキナーゼの約80%を占めます[14]。セリン/スレオニンキナーゼは、細胞の成長、分裂、死、代謝、および他の多くの重要な細胞機能の調節に関与しています。例えば、MAPキナーゼ(mitogen-activated protein kinase)は、細胞の成長や分化に関わる重要なセリン/スレオニンキナーゼの一例です[18]。
● チロシンキナーゼ
チロシンキナーゼは、タンパク質のチロシン残基をリン酸化する酵素です。これらは、細胞の成長、分化、移動、および細胞死など、多くの細胞機能の調節に関与しています。チロシンキナーゼは、受容体チロシンキナーゼ(RTK)と非受容体チロシンキナーゼの2つの主要なグループに分けられます。RTKは細胞膜に位置し、細胞外のシグナルを細胞内に伝達する役割を果たします。一方、非受容体チロシンキナーゼは細胞内に存在し、細胞内のシグナル伝達経路に関与します[19]。
● その他のキナーゼ類
セリン/スレオニンキナーゼとチロシンキナーゼ以外にも、特定のアミノ酸残基をリン酸化する多様なキナーゼが存在します。これらには、ヒスチジンキナーゼやアスパラギン酸キナーゼなどが含まれますが、これらは真核生物よりも原核生物で一般的に見られます。これらのキナーゼは、細胞の応答や適応において特定の役割を果たしますが、セリン/スレオニンキナーゼやチロシンキナーゼほど広く研究されているわけではありません。
キナーゼのこれらの分類と特徴は、細胞内の複雑なシグナル伝達ネットワークを理解する上で重要です。各キナーゼは、特定のシグナル伝達経路において独自の役割を果たし、細胞の適切な機能を保証するために相互作用します。
第2章: プロテインキナーゼの生物学的役割
シグナル伝達における役割
プロテインキナーゼは、細胞内シグナル伝達において中心的な役割を果たす酵素群です。これらの酵素は、細胞の応答を調節するために、特定のタンパク質にリン酸基を付加することによってタンパク質の活性を変化させます。このプロセスはタンパク質のリン酸化と呼ばれ、細胞の機能において重要な調節機構です。
● リン酸化によるタンパク質の活性化
プロテインキナーゼは、ATPからリン酸基を転移させることにより、タンパク質のセリン、スレオニン、またはチロシン残基をリン酸化します。リン酸化されたタンパク質は、その構造や電荷が変化し、結果として活性が増加したり減少したりします。この活性の変化は、タンパク質の機能を変え、細胞内のシグナル伝達経路を調節することにより、細胞の応答を制御します[5][6][10][12][15]。
● シグナル伝達経路における役割
プロテインキナーゼは、細胞増殖、分化、運動性、代謝、アポトーシスなど、多様な細胞プロセスを制御するシグナル伝達経路に関与しています。例えば、Gタンパク質共役受容体(GPCR)や酵素連結型受容体などの細胞表面受容体が外部のシグナルを受け取ると、これらの受容体はプロテインキナーゼを活性化し、細胞内のシグナル伝達カスケードを開始します[1][5][7][9][11][13][15]。
● セカンドメッセンジャーとの相互作用
プロテインキナーゼは、セカンドメッセンジャーとして知られる小分子と相互作用します。例えば、サイクリックAMP(cAMP)やサイクリックGMP(cGMP)、カルシウムイオン、ジアシルグリセロール(DAG)、イノシトールトリスリン酸(IP3)などが、プロテインキナーゼの活性を調節することにより、細胞内のシグナル伝達を促進します[5][9][15]。
● タンパク質キナーゼの種類と機能
プロテインキナーゼは、その基質特異性や活性化メカニズムに基づいて、さまざまなファミリーに分類されます。例えば、セリン/スレオニンキナーゼはセリンやスレオニン残基をリン酸化し、チロシンキナーゼはチロシン残基をリン酸化します。また、プロテインキナーゼC(PKC)は、リン脂質代謝産物によって活性化され、細胞の多彩な機能に関与しています[7][10][13][14]。
● 疾患との関連
プロテインキナーゼの異常は、がんをはじめとする多くの疾患の原因となり得ます。そのため、プロテインキナーゼは創薬のターゲットとしても非常に重要であり、多くの研究が行われています[6][10][11][15]。
総じて、プロテインキナーゼは細胞内シグナル伝達において、タンパク質のリン酸化を介して細胞の応答を調節する重要な役割を担っています。これにより、細胞は外部からのシグナルに適切に反応し、生存、成長、分化などの生命維持機能を遂行することができます。
- 参考文献・出典
-
[1] www2.huhs.ac.jp/~h990002t/resources/downloard/14/14biochem2/03signaling14_2.pdf
[2] www.amed.go.jp/news/release_20220214-03.html
[3] www.thermofisher.com/blog/learning-at-the-bench/cancer9/
[4] www.cellsignal.jp/learn-and-support/protein-kinases
[5] www.pharm.or.jp/words/word00613.html
[6] www.carnabio.com/japanese/images/news/031001-j.pdf
[7] www.cellsignal.jp/pathways/protein-kinase-c-signaling
[8] www.thermofisher.com/blog/learning-at-the-bench/cancer8/
[9] www.cosmobio.co.jp/product/detail/intracelluar-signaling-second-messanger.asp?entry_id=43013
[10] labchem-wako.fujifilm.com/jp/category/lifescience/protein/kinase/index.html
[11] www.med.kobe-u.ac.jp/tougou/signal/Research.html
[12] kotobank.jp/word/%E3%83%97%E3%83%AD%E3%83%86%E3%82%A4%E3%83%B3%E3%82%AD%E3%83%8A%E3%83%BC%E3%82%BC-673432
[13] med.toaeiyo.co.jp/contents/cardio-terms/pathophysiology/2-93.html
[14] ja.wikipedia.org/wiki/%E3%83%97%E3%83%AD%E3%83%86%E3%82%A4%E3%83%B3%E3%82%AD%E3%83%8A%E3%83%BC%E3%82%BC
[15] jp.sinobiological.com/research/signal-transduction/protein-kinase
疾患との関連
プロテインキナーゼは細胞内のシグナル伝達経路において中心的な役割を果たす酵素であり、多くの生物学的プロセスに関与しています。これらのキナーゼの異常は、がんや神経変性疾患など、多様な疾患の発症に深く関わっています。以下では、これらの疾患とプロテインキナーゼの関連について解説します。
● がん
プロテインキナーゼはがんの発症と進行において重要な役割を果たします。がん細胞では、プロテインキナーゼの活性化や発現が異常になることが多く、これが細胞の無制限な増殖、生存、転移を促進します。例えば、ABL1キナーゼはフィラデルフィア染色体転座によって活性化され、慢性骨髄性白血病の発症に関与します[13]。また、EGFRやHER2などの受容体型チロシンキナーゼは、乳がんや肺がんなど多くの固形がんで過剰発現または活性化され、がん細胞の増殖を促進します[10]。
● 神経変性疾患
プロテインキナーゼの異常は、アルツハイマー病(AD)、パーキンソン病(PD)、筋萎縮性側索硬化症(ALS)などの神経変性疾患の発症にも関与しています。これらの疾患では、プロテインキナーゼが異常なタンパク質のリン酸化を引き起こし、タンパク質の凝集や細胞機能の障害を誘発します。例えば、ADでは、タウタンパク質の異常なリン酸化が神経原線維変化の形成に寄与し、これが認知機能の低下につながります[16][18]。PDでは、LRRK2などのキナーゼの変異がα-シヌクレインの異常なリン酸化と凝集を促進し、神経細胞の死を引き起こします[6]。
● 治療標的としてのプロテインキナーゼ
プロテインキナーゼの異常が疾患の発症に深く関わっていることから、これらのキナーゼを標的とした治療戦略が開発されています。がん治療においては、イマチニブ(ABL1キナーゼの阻害剤)やトラスツズマブ(HER2を標的とする抗体)など、特定のキナーゼを標的とした薬剤が臨床で広く使用されています[13][14]。神経変性疾患においても、キナーゼの活性を調節することで病態の進行を遅らせる可能性があり、多くの研究が進められています[7][11]。
プロテインキナーゼの異常は、これらの疾患の発症メカニズムを理解し、新たな治療法を開発する上で重要な鍵を握っています。今後も、これらのキナーゼに関する研究が進むことで、より効果的な治療法の開発が期待されます。
- 参考文献・出典
-
[7] www.ncbi.nlm.nih.gov/pmc/articles/PMC10058590/
[8] www.ncbi.nlm.nih.gov/books/NBK548591/
[9] www.mdpi.com/1424-8247/16/9/1295
[10] www.nature.com/articles/s41392-022-01168-8
[11] cellandbioscience.biomedcentral.com/articles/10.1186/s13578-023-01189-y
[12] molecular-cancer.biomedcentral.com/articles/10.1186/s12943-018-0782-4
[13] www.cellsignal.com/learn-and-support/reference-tables/kinasedisease-associations
[14] www.nature.com/articles/s41577-023-00877-7
[15] www.cancer.gov/publications/dictionaries/cancer-terms/def/tropomyosin-receptor-kinase-protein-family
[16] www.jstage.jst.go.jp/article/biochemistry1922/121/2/121_2_179/_pdf
[17] www.sciencedirect.com/science/article/abs/pii/S002604952300269X
[18] www.sciencedirect.com/science/article/abs/pii/S0223523423007845
第3章: リン酸化とその制御
リン酸化プロセスの概要
タンパク質のリン酸化は、細胞内でのシグナル伝達やタンパク質の活性制御において重要な役割を果たす翻訳後修飾の一つです。このプロセスは、特定のアミノ酸残基にリン酸基が結合することにより行われます。リン酸化によってタンパク質の構造や機能が変化し、細胞内での多様な生物学的プロセスが調節されます。
● リン酸化の化学的プロセス
タンパク質のリン酸化は、主にセリン、スレオニン、チロシンの側鎖に存在する水酸基(-OH)にリン酸基(PO4^3-)が結合することによって起こります。この反応は、ATP(アデノシン三リン酸)をリン酸供与体として使用し、特定の酵素であるキナーゼによって触媒されます[8]。
リン酸化の一般的なステップは以下の通りです:
1. 活性化: キナーゼはATPと特定のタンパク質のリン酸化部位を認識し、結合します。
2. リン酸転移: ATPからリン酸基がキナーゼを介してタンパク質のアミノ酸残基に転移します。この過程で、ATPはADP(アデノシン二リン酸)に変換されます。
3. 解離: リン酸化されたタンパク質とADPがキナーゼから解離します。
● リン酸化の生物学的意義
リン酸化は、タンパク質の活性、安定性、相互作用能力を変化させることにより、細胞内の多くのプロセスを調節します。例えば、リン酸化によってタンパク質の立体構造が変化し、その結果、タンパク質の活性が調節されることがあります[1][2]。
また、リン酸化はシグナル伝達経路において重要な役割を果たします。細胞外のシグナルが細胞内に伝達される際、リン酸化と脱リン酸化の連鎖反応が起こり、これによって細胞の応答が調節されます[9][15]。
● リン酸化の調節
タンパク質のリン酸化状態は、脱リン酸化酵素であるホスファターゼによっても調節されます。ホスファターゼはリン酸化されたタンパク質からリン酸基を除去し、タンパク質を非リン酸化状態に戻します。このように、リン酸化と脱リン酸化のバランスが細胞内のタンパク質の機能を精密に制御しています[14][15]。
リン酸化は、細胞の成長、分裂、死、シグナル伝達など、生命現象において中心的な役割を果たしています。そのため、リン酸化の異常はがんや神経疾患などの多くの疾患の原因となることがあります[10]。
- 参考文献・出典
-
[1] sirabe.nirs.qst.go.jp/sirabe/%E3%82%BF%E3%83%B3%E3%83%91%E3%82%AF%E8%B3%AA%E3%83%AA%E3%83%B3%E9%85%B8%E5%8C%96
[2] www.ptglab.co.jp/news/blog/tips-for-detecting-phosphoproteins-by-western-blot/
[8] labchem-wako.fujifilm.com/jp/category/lifescience/protein/kinase/index.html
[9] www.cellsignal.jp/pathways/pathways-akt-signaling
[10] www.thermofisher.com/us/en/home/life-science/protein-biology/protein-biology-learning-center/protein-biology-resource-library/pierce-protein-methods/phosphorylation.html
[11] www.tcichemicals.com/JP/ja/c/12670
[12] www.jstage.jst.go.jp/article/kagakutoseibutsu1962/28/8/28_8_498/_pdf/-char/ja
[13] www.k.u-tokyo.ac.jp/information/category/press/9462.html
[14] yumenavi.info/vue/lecture.html?gnkcd=g001989
[15] jp.sinobiological.com/research/signal-transduction/protein-phosphorylation
リン酸化の生理的重要性
リン酸化は細胞機能の調節やシグナル伝達において重要な役割を果たしています。このプロセスは、特定のアミノ酸残基(主にセリン、トレオニン、チロシン)にリン酸基を付加することにより、タンパク質の機能を変化させることができます。以下に、リン酸化が細胞機能に与える影響の具体的な例を挙げます。
● タンパク質の構造と機能の調節
リン酸化はタンパク質の立体構造を変化させ、その結果、タンパク質の活性化または非活性化を引き起こすことがあります。例えば、[2]によると、タンパク質の天然変性領域のリン酸化は、そのタンパク質自体とその機能に影響を与えることが示されています。この研究では、リン酸化が液-液相分離を制御し、細胞内非膜型オルガネラの構造形成および機能発現に重要な役割を果たすことが明らかにされました。
● シグナル伝達の調節
リン酸化は細胞内シグナル伝達の重要な調節機構です。[6]によると、リン酸化は細胞全体のシグナル伝達において主要なメカニズムを担っており、成長因子などのシグナルが細胞に到達すると、これを受け取った受容体がリン酸化され、シグナル伝達カスケードが活性化されます。このプロセスは、細胞の増殖や分化など、多様な細胞応答を引き起こすことができます。
● 疾患の発生との関連
リン酸化の異常は、がんや糖尿病、免疫異常など多くの疾患の原因となり得ます。[4]では、チロシンリン酸化シグナルのバランスの破綻が様々な疾患の原因となることが示されています。例えば、特定のチロシンホスファターゼの異常なリン酸化は、細胞の異常な増殖を引き起こし、がんの発生につながる可能性があります。
● 細胞内オルガネラの形成
リン酸化は、細胞内オルガネラの形成にも重要な役割を果たします。[2]の研究では、リン酸化が核小体などの細胞内非膜型オルガネラの形成と崩壊に関与していることが示されています。リン酸化による液-液相分離の制御は、これらのオルガネラの構造と機能の維持に不可欠です。
これらの例から、リン酸化が細胞の様々な機能に深く関与しており、生命現象を理解する上で欠かせないプロセスであることがわかります。
第4章: 研究の最前線と臨床応用
最新の研究動向
プロテインキナーゼは細胞内のシグナル伝達において中心的な役割を果たす酵素であり、多くの生理的プロセスや疾患の発症に関与しています。最近の研究では、プロテインキナーゼの機能、調節機構、および疾患との関連について新たな知見が得られています。
● プロテインキナーゼCの運動制御への関与
群馬大学との共同研究により、プロテインキナーゼC (PKC) γ型が運動制御に重要な役割を果たしていることが明らかにされました。特に、成熟期の小脳プルキンエ細胞に存在するPKCγが協調運動の制御に関与していることが示され、脊髄小脳失調症14型における運動失調の原因の一端が解明されました[1]。
● 分子標的治療薬とプロテインキナーゼ
プロテインキナーゼは、分子標的治療薬の開発において重要なターゲットです。特に、がん細胞の増殖を促進するプロテインキナーゼを阻害することで、がん細胞の増殖を阻止する新しいタイプの治療薬が注目されています。例えば、ノバルティスファーマの慢性骨髄性白血病治療薬グリベックやロシュの乳癌治療薬ハーセプチンなどがその代表例です[2]。
● 精密な分子標的型抗がん剤の開発
理化学研究所の共同研究グループは、がん細胞中で異常に働くプロテインキナーゼをピンポイントで阻害し、がん細胞の増殖を阻害する化合物を発見しました。この研究成果は、副作用の少ない効果的な新しい抗がん剤の開発につながるものと期待されています[3]。
● プロテインキナーゼの研究ツールとしてのプロファイリングサービス
カルナバイオサイエンス社は、プロテインキナーゼの活性を測定するためのプロファイリングサービスを提供しています。このサービスを利用することで、製薬企業は時間や費用を有効に利用し、プロテインキナーゼを標的にした創薬に参入できます[2]。
● キナーゼの研究と創薬への応用
キナーゼは、りん酸化酵素の総称であり、プロテインキナーゼはその中でも特にタンパク質をりん酸化するものを指します。キナーゼの異常はがんをはじめとする様々な疾患の原因となっており、創薬研究における重要なターゲット分子とされています[7]。
● 研究成果の紹介
メディカル・プロテオスコープ社は、キナーゼ阻害剤の標的タンパク質の同定など、キナーゼに関する研究成果を紹介しています。例えば、プロテインキナーゼCの強力な阻害剤であるBisindolylmaleimide Ⅷの標的キナーゼを同定する研究が行われています[8]。
これらの研究動向は、プロテインキナーゼが生物学的プロセスにおいて重要な役割を果たしていることを示しており、特にがん治療における新たな治療薬の開発において重要な進展が見られます。プロテインキナーゼの機能解明や阻害剤の開発は、今後も医学研究の重要な分野であり続けるでしょう。
- 参考文献・出典
-
[1] www.amed.go.jp/news/release_20220214-03.html
[2] www.carnabio.com/japanese/images/news/031001-j.pdf
[3] www.riken.jp/press/2021/20210730_2/index.html
[7] labchem-wako.fujifilm.com/jp/category/lifescience/protein/kinase/index.html
[8] www.medicalproteoscope.com/technology/research_results/
プロテインキナーゼを対象とした新しい治療戦略
プロテインキナーゼは、細胞内でのタンパク質のリン酸化を担う重要な酵素であり、細胞の増殖や機能の調節に関わっています。異常なプロテインキナーゼの活動は、細胞の恒常性の崩壊や様々な病気の発症につながることが知られており、特に癌においては、無秩序な細胞増殖を引き起こす原因の一つとされています。このため、プロテインキナーゼを標的とした薬剤開発や治療法は、近年注目されている研究分野です。
● プロテインキナーゼの役割と治療への応用
プロテインキナーゼは、約500種類が報告されており、これらは細胞内でタンパク質をリン酸化し、その機能を調節することで細胞の増殖や機能を制御しています。キナーゼの異常活動は、細胞の恒常性の崩壊や様々な疾患の原因となり得るため、特定のキナーゼを標的とすることで、疾患の治療が可能になることが期待されています[6]。
● プロテインキナーゼを標的とした薬剤開発
プロテインキナーゼを標的とした薬剤開発は、特に癌治療において重要な進展を遂げています。従来の抗癌剤は、癌細胞だけでなく正常細胞にも影響を及ぼすことから、重篤な副作用を引き起こすことがありました。しかし、特定のキナーゼが変異した癌細胞を標的とすることで、癌細胞の増殖だけを抑制することが可能になり、高い治療効果を示しています[6]。
● 具体的な研究事例
– PKCγと運動制御: 群馬大学大学院医学系研究科の研究では、成熟期の小脳プルキンエ細胞に存在するプロテインキナーゼCγ (PKCγ) が協調運動の制御に重要な役割を果たしていることが明らかにされました。この発見は、脊髄小脳失調症14型における運動失調の原因解明につながり、将来的には新たな治療法の開発に貢献する可能性があります[1]。
– 分子標的型抗がん剤の開発: 理化学研究所の共同研究グループは、がん細胞中で異常に働くプロテインキナーゼをピンポイントで阻害し、がん細胞の増殖を阻害する化合物を発見しました。この研究成果は、副作用の少ない効果的な新しい抗がん剤の開発につながるものと期待されています[4]。
● まとめ
プロテインキナーゼを標的とした薬剤開発や治療法は、特に癌治療において大きな可能性を秘めています。特定のキナーゼを標的とすることで、癌細胞の増殖を効果的に抑制し、副作用を最小限に抑えることが可能になるため、今後もこの分野の研究は進展していくことが期待されます。
第5章: プロテインキナーゼ研究の課題と展望
研究上の課題
プロテインキナーゼの研究は、細胞の多様な生理機能の調節機構において重要な役割を果たす酵素群に焦点を当てています。これらの酵素は、基質蛋白質をリン酸化し、その機能を調節することにより、細胞内のシグナル伝達や代謝プロセスに深く関与しています。しかし、プロテインキナーゼの研究にはいくつかの未解決の問題が存在し、これらの問題は研究上の重要な課題となっています。
● 未解決の問題
1. 基質特異性の解明: プロテインキナーゼは、特定のアミノ酸残基にリン酸基を転移することにより、基質蛋白質の活性を調節します。しかし、これらの酵素がどのようにしてその基質特異性を達成しているのか、その分子メカニズムは完全には解明されていません[5]。
2. 機能的役割の特定: 多くのプロテインキナーゼが発見されていますが、それぞれの酵素が細胞内でどのような機能を果たしているのかについては、まだ多くの未解決の問題が残されています[5][6]。
3. 副作用の要因となるキナーゼ特有の問題: キナーゼ阻害剤は、がん治療などにおいて重要な役割を果たしていますが、しばしば副作用の要因となるキナーゼ特有の問題が存在します。これらの問題の解明は、より効果的で副作用の少ない治療法の開発につながります[3]。
● 研究上の課題
1. 基質認識機構の解明: プロテインキナーゼがどのようにして特定の基質を認識し、リン酸化するのかについての詳細な理解を深めることが必要です。これには、構造生物学的アプローチや生命情報学的解析が有効であると考えられます[3][12]。
2. 新規基質の同定: 生体内でのプロテインキナーゼの基質を網羅的に探索し、同定することで、これらの酵素の機能的役割をより深く理解することができます[7]。
3. 副作用の最小化: キナーゼ阻害剤の副作用を最小化するためには、キナーゼ特有の問題に対する解決策を見つけることが重要です。これには、より選択性の高い阻害剤の開発や、副作用のメカニズムに関する研究が必要です[3][4]。
プロテインキナーゼの研究は、細胞生物学や医学において極めて重要な分野であり、これらの未解決の問題に対処することは、新しい治療法の開発や疾患の理解を深める上で不可欠です。
- 参考文献・出典
-
[3] www.jstage.jst.go.jp/article/jcrsj/59/4/59_174/_pdf
[4] www.riken.jp/press/2021/20210730_2/index.html
[5] webview.isho.jp/journal/detail/abs/10.11477/mf.2425905307
[6] www.jstage.jst.go.jp/article/jrrsabst/2007/0/2007_0_63/_article/-char/ja/
[7] kaken.nii.ac.jp/ja/grant/KAKENHI-PROJECT-23650214/
[12] kaken.nii.ac.jp/ja/grant/KAKENHI-PROJECT-19K12220/
未来への展望
未来への展望において、学際的研究の発展は、社会の複雑な課題に対する解決策を提供する重要な鍵となります。学際的研究は、異なる分野の専門知識を組み合わせることで、新たな視点やアプローチを生み出し、従来の枠組みでは解決が難しい問題に対しても、革新的な解決策を提示する可能性を秘めています。
特に、持続可能な開発目標(SDGs)に関する研究は、経済学、環境科学、政治学、自然科学など、多様な分野の研究者が協力して持続可能な社会を目指す研究として、学際的研究の重要な例として挙げられます[1]。このように、社会的、環境的課題に対する包括的な理解と解決策の提案には、学際的なアプローチが不可欠です。
また、技術の進歩により、データ収集や分析の手法が向上していることも、学際的研究の発展を後押ししています。大量のデータを効率的に分析し、異なる分野の知見を統合することで、より精度の高い予測や新たな知識の創出が期待されます。
しかし、学際的研究の発展には、評価基準の確立や若手研究者への支援など、いくつかの課題も存在します[1]。異なる分野間での共通の評価基準を設けること、学際的な研究に取り組む若手研究者に対する十分な支援体制の構築が、今後の発展に向けた重要なポイントとなります。
さらに、学際的研究の推進には、異分野間のコミュニケーションの促進や、共同研究のためのプラットフォームの整備も必要です。異なる分野の研究者が互いの専門知識を理解し、協力して研究を進めるためには、言語や概念の壁を越えるための努力が求められます。
未来において、学際的研究は、社会の持続可能性、健康、安全、そして経済発展に貢献するための重要な役割を果たすことが期待されています。そのためには、学際的研究を支える環境の整備と、研究者間の協力の促進が鍵となります。






