目次
本記事では、細胞内タンパク質の分解を担うプロテアソームの役割と機能について詳細に解説します。ユビキチン-プロテアソームシステムのメカニズム、研究の最新動向、および医学や生物学におけるその意義に焦点を当てます。
第1章: プロテアソームの基本
プロテアソームの定義とは
● プロテアソームの科学的定義
プロテアソームは、細胞内でタンパク質の分解を行う巨大な酵素複合体です。真核生物の細胞において、細胞質および核内のいずれにも分布しており、細胞のタンパク質恒常性の維持、細胞周期の進行、シグナル伝達など様々な生命現象に必須の役割を果たしています[15]。
● プロテアソームの基本的な構造
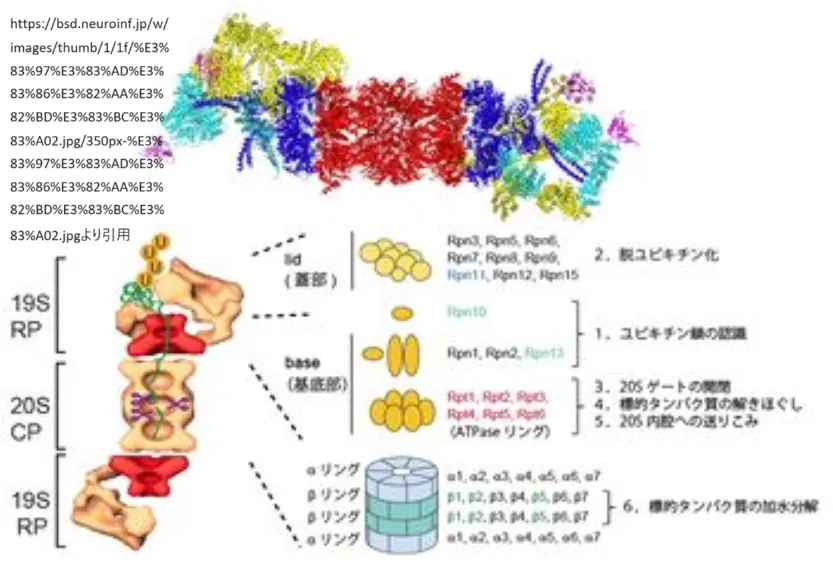
プロテアソームの基本的な構造は、20Sコア粒子(CP)と呼ばれる触媒粒子と、19S調節粒子(RP)から構成されています。20S CPは、αリングとβリングという2種類のリング構造が積み重なって形成されており、それぞれ7種類のサブユニットから構成されています。αリングはプロテアソームの入口を形成し、βリングにはタンパク質分解活性があります[1][16]。
19S RPは、20S CPの両端に会合して、タンパク質の認識、展開、ユビキチン鎖の除去、タンパク質の送り込みを行う役割を持っています。この19S RPが結合した形態を26Sプロテアソームと呼び、ユビキチン化されたタンパク質をATP依存的に分解する活性型のプロテアソームです[1][14]。
プロテアソームは、ユビキチンという小さなタンパク質が付加されたタンパク質を標的として選択的に分解することにより、生命活動に必須な役割を果たしています。不要になったり、品質が劣化したりしたタンパク質にユビキチンが付加され、これを標的としてプロテアソームが分解することで、細胞内のタンパク質の質を厳密に管理しています[20]。
プロテアソームの構造と機能は、神経変性疾患やがんなどの疾患の研究においても重要であり、プロテアソーム阻害剤が血液がんの治療に有効であることが明らかになっています[4][9]。また、プロテアソームの機能が低下すると、細胞の分裂回数が減り、寿命が短くなることがわかっており、老化やアンチエイジングとも関係があることが示されています[7]。
- 参考文献・出典
-
[1] brh.co.jp/s_library/interview/81/
[2] www.amed.go.jp/news/release_20200206-02.html
[3] leading.lifesciencedb.jp/3-e011
[4] www.jstage.jst.go.jp/article/biophys/55/1/55_019/_pdf
[5] www.metro.tokyo.lg.jp/tosei/hodohappyo/press/2020/02/06/documents/18a.pdf
[6] www.igakuken.or.jp/project/to-tomin/to-pro20.html
[7] www.igakuken.or.jp/project/to-tomin/to-pro-meta3.html
[8] www.e-kanpo.jp/saibousi/saibousi3.php
[9] bio.nikkeibp.co.jp/atcl/report/16/011900001/19/03/19/00239/
[10] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2015.870705/data/
[11] bsd.neuroinf.jp/wiki/%E3%83%97%E3%83%AD%E3%83%86%E3%82%A2%E3%82%BD%E3%83%BC%E3%83%A0
[12] ruo.mbl.co.jp/bio/product/autophagy/autophagy.html
[13] www.tanpaku.org/tp_fundamental_biology/fba2.php
[14] www.jstage.jst.go.jp/article/yakushi/122/9/122_9_615/_pdf
[15] ja.wikipedia.org/wiki/%E3%83%97%E3%83%AD%E3%83%86%E3%82%A2%E3%82%BD%E3%83%BC%E3%83%A0
[16] www.cosmobio.co.jp/product/detail/cac-20130520-1.asp?entry_id=10881
[17] www.kyushu-u.ac.jp/f/44774/21_08_06_01.pdf
[18] www.jstage.jst.go.jp/article/biophys1961/32/4/32_4_200/_pdf
[19] www.tohoku.ac.jp/japanese/newimg/pressimg/20100222_01.pdf
[20] dictionary.goo.ne.jp/word/%E3%83%97%E3%83%AD%E3%83%86%E3%82%A2%E3%82%BD%E3%83%BC%E3%83%A0/
プロテアソームの機能と生物学的役割
プロテアソームは、細胞内で不要となったタンパク質をピンポイントで分解する酵素であり、細胞内タンパク質の恒常性維持に中心的な役割を果たしています[5]。このシステムは、ユビキチン化されたタンパク質を選択的に分解する巨大で複雑なタンパク質分解酵素複合体であり、ユビキチン化されたタンパク質の除去によって細胞機能の発現と維持に必須の働きを持ちます[2][8]。
● プロテアソームの機能
プロテアソームは、細胞内でのタンパク質の品質管理において重要な役割を担っています。具体的には、以下のような機能を果たします:
– タンパク質の分解:不要になったり、損傷を受けたりしたタンパク質を分解し、アミノ酸へと分解します。これにより、細胞内のタンパク質の恒常性が維持されます[9]。
– 細胞の応答調節:細胞の外的・内的ストレスに応じて、プロテアソームの機能は影響を受けます。例えば、肥満がプロテアソームの機能の低下を招き、メタボリックシンドロームなどの生活習慣病を引き起こす可能性があります[6]。
– 免疫応答:プロテアソームは、免疫応答においても重要な役割を果たします。特に、免疫プロテアソームはウイルスタンパク質を切断し、免疫機構で起こっている問題を警告する役割を担います[9]。
● 生物学的重要性
プロテアソームの生物学的重要性は、その多様な機能によって示されます。細胞内でのタンパク質の品質管理、細胞の応答調節、免疫応答の調節など、生命活動を支える基本的なプロセスに深く関わっています。また、プロテアソームの機能が低下すると、がんやアルツハイマー病、パーキンソン病、炎症や心筋梗塞などの病気が起こる可能性があることから、その医学的重要性も非常に高いです[5]。
さらに、プロテアソームの機能は老化や寿命、アンチエイジングとも関係があり、プロテアソームの量を増やす実験では、寿命が少し長くなるという結果が出ています[6]。これは、プロテアソームが加齢に伴う変性タンパク質の蓄積を防ぎ、プロテアソームの機能低下が神経変性疾患などの病態に関与していることを示唆しています[14]。
プロテアソームの研究は、細胞生物学、分子生物学、医学などの分野において重要な意味を持ち、その機能の詳細な解明は、新しい治療法の開発につながる可能性を秘めています。
- 参考文献・出典
-
[2] bsd.neuroinf.jp/wiki/%E3%83%97%E3%83%AD%E3%83%86%E3%82%A2%E3%82%BD%E3%83%BC%E3%83%A0
[3] www.jstage.jst.go.jp/article/biophys/55/1/55_019/_pdf
[4] www.amed.go.jp/content/000026434.pdf
[5] www.igakuken.or.jp/public/news/014/cont2.html
[6] www.igakuken.or.jp/project/to-tomin/to-pro-meta3.html
[7] www.jstage.jst.go.jp/article/arerugi/61/6/61_KJ00008111626/_pdf
[8] www.u-tokyo.ac.jp/focus/ja/articles/a_00526.html
[9] numon.pdbj.org/mom/166?l=ja
[10] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2015.870705/data/
[11] www.jsps.go.jp/file/storage/grants/j-grantsinaid/12_kiban/ichiran_25/j-data/h25_j4202_murata.pdf
[12] kaken.nii.ac.jp/en/file/KAKENHI-PROJECT-23657083/23657083seika.pdf
[13] www.jstage.jst.go.jp/article/biophys1961/32/4/32_4_200/_pdf
[14] www.waseda.jp/fsci/wise/prj/2020/05/19/4754/
第2章: ユビキチン-プロテアソームシステム
ユビキチン化プロセスの概要
ユビキチン化は、タンパク質の翻訳後修飾の一つであり、細胞内でのタンパク質の運命を決定する重要なプロセスです。このプロセスは、タンパク質の分解、シグナル伝達、DNA修復、細胞周期制御など、多くの細胞内プロセスに関与しています。ユビキチン化されたタンパク質は、プロテアソームによって認識され、分解されます。以下に、ユビキチン化プロセスとプロテアソームによる分解の詳細を説明します。
● ユビキチン化プロセス
1. ユビキチン活性化酵素(E1): ユビキチン化の最初のステップは、ユビキチン活性化酵素(E1)によるユビキチンの活性化です。E1は、ATPを消費してユビキチンを活性化し、その後、ユビキチンを自身のシステイン残基に結合させます。
2. ユビキチン結合酵素(E2): 活性化されたユビキチンは、E1からユビキチン結合酵素(E2)へ転移されます。このステップでは、ユビキチンはE2のシステイン残基に結合します。
3. ユビキチンリガーゼ(E3): E2に結合したユビキチンは、次にユビキチンリガーゼ(E3)の作用によって標的タンパク質に転移されます。E3は、特定の標的タンパク質を認識し、ユビキチンをそのリジン残基に結合させる役割を果たします。このプロセスは、標的タンパク質のユビキチン化を引き起こします。
4. ポリユビキチン鎖の形成: タンパク質に最初のユビキチンが結合した後、追加のユビキチン分子が連結してポリユビキチン鎖を形成します。この鎖は、プロテアソームによる分解のシグナルとして機能します。
● プロテアソームによる分解
1. 認識: ポリユビキチン鎖が付加されたタンパク質は、26Sプロテアソームによって認識されます。プロテアソームは、タンパク質分解において中心的な役割を果たす大型の酵素複合体です。
2. 分解: プロテアソームの19S認識サブユニットがユビキチン化タンパク質を捕捉し、20S分解サブユニットへと導きます。20Sサブユニット内で、タンパク質は折りたたみが解かれ、小さなペプチド断片に分解されます。
3. ユビキチンの再利用: 分解プロセス中に、ユビキチン分子はタンパク質から切り離され、再利用のために細胞内に放出されます。
ユビキチン化とプロテアソームによる分解は、細胞内でのタンパク質の品質管理と量の調節に不可欠なプロセスです。このシステムの異常は、がんや神経変性疾患など、多くの疾患の発症に関与していることが知られています[2][6][12][18].
プロテアソームと疾患の関連
プロテアソームは、細胞内で不要になったり、うまく合成されなかったりしたタンパク質を分解処理することにより、細胞や組織の恒常性維持に必須の役割を果たすタンパク質複合体です。プロテアソームの機能不全は、細胞内でのタンパク質の適切な分解が行われないことにより、細胞や組織に様々な影響を及ぼし、特定の疾患の原因となり得ます。以下に、プロテアソームの機能不全が関連する疾患の具体例とそのメカニズムについて説明します。
● プロテアソーム関連自己炎症症候群(PRAAS)
プロテアソーム関連自己炎症症候群(PRAAS)は、プロテアソームの各サブユニットの遺伝子異常によって発症する自己炎症性疾患の総称です。プロテアソームの機能不全により、細胞内にユビキチン化されたタンパク質が蓄積し、これが炎症反応を引き起こすことがPRAASの発症メカニズムと考えられています。PRAASには、中條・西村症候群、JASL、JMP症候群、CANDLE症候群などが含まれます[3]。
● 神経変性疾患
加齢に伴うプロテアソーム活性の低下は、アルツハイマー病やパーキンソン病などの神経変性疾患の晩発性発症や進行に関与しているとされています。プロテアソームの機能不全により、神経細胞内に異常タンパク質が蓄積・凝集し、これが神経細胞の変性や脱落を引き起こすことが、神経変性疾患の発症メカニズムの一つと考えられています[5]。
● プロテアソームの機能不全と治療戦略
プロテアソーム関連疾患の治療戦略としては、症状の抑制に高濃度ステロイドが用いられることがありますが、減薬すると症状が再燃することがあります。TNF-α阻害剤やIL-6受容体抗体(トシリズマブ)の有効性は限定的であり、JAK1/2阻害剤が著効する場合があると報告されています。これらの治療戦略は、プロテアソームの機能不全による炎症病態を改善することを目的としていますが、病態にインターフェロン以外の要因がある可能性も示唆されており、さらなる研究が必要です[3]。
プロテアソームの機能不全が関与する疾患は、その機能の重要性から多岐にわたります。プロテアソームの機能不全による疾患の理解を深め、効果的な治療法の開発が進むことが期待されています。
第3章: プロテアソーム研究の応用
医薬品開発におけるプロテアソーム
プロテアソームは、細胞内でタンパク質を分解する重要な役割を果たす複合体であり、特にユビキチン・プロテアソーム系(UPS)を介してタンパク質の選択的分解を行います。このシステムの異常は、がん、神経変性疾患、自己免疫疾患など多くの疾患の発症に関与しているため、プロテアソームは医薬品開発の有望な標的とされています。
● プロテアソーム阻害剤の開発
プロテアソームの阻害剤は、特にがん治療において有効性が示されています。例えば、ボルテゾミブ(Velcade)は多発性骨髄腫の治療薬として承認されており、プロテアソームの活性を阻害することでがん細胞の生存に必要なタンパク質の分解を妨げ、がん細胞の死を誘導します[1][2][3][4][5][6][7][8][9][10][11][12][13][14][15][16][17][18][19][20]。
● 新規プロテアソーム活性化剤の開発
一方で、プロテアソームの機能を活性化することにより、神経変性疾患などの治療に役立つ可能性があります。例えば、アルツハイマー病においては、異常なタンパク質の蓄積が病態の一因とされており、プロテアソームの活性化によってこれらのタンパク質の分解を促進することが治療につながる可能性があります[14]。
● タンパク質分解誘導薬の開発
さらに、タンパク質分解誘導薬(PROTACs)は、特定のタンパク質をユビキチン・プロテアソーム系によって選択的に分解させる新しいアプローチです。この技術は、従来の阻害剤では標的とすることが困難だったタンパク質に対しても有効であり、がんや自己免疫疾患などの治療薬開発において大きな可能性を秘めています[9][10]。
● 現在の研究動向
プロテアソームを標的とした医薬品開発は、がん治療薬から神経変性疾患、自己免疫疾患治療薬まで幅広い分野に及んでいます。特に、タンパク質分解誘導薬の開発は、新たな治療薬の創出に向けた研究が活発に行われており、多くの製薬企業や研究機関がこの分野に注目しています。また、プロテアソームの活性化剤や、特定の疾患関連タンパク質を標的とする阻害剤の開発も進められており、将来的にはこれらの研究成果が新たな治療オプションとして臨床応用されることが期待されています[1][2][3][4][5][6][7][8][9][10][11][12][13][14][15][16][17][18][19][20]。
プロテアソームを標的とした医薬品開発は、疾患の根本的なメカニズムにアプローチすることで、従来の治療法では対応できなかった疾患に対しても効果的な治療法を提供する可能性を秘めています。今後も、この分野の研究進展により、多くの患者にとって新たな希望がもたらされることが期待されます。
- 参考文献・出典
-
[1] brh.co.jp/s_library/interview/81/
[2] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2022.940258/data/index.html
[3] kaken.nii.ac.jp/ja/file/KAKENHI-PROJECT-26000014/26000014_2019_seika.pdf
[4] www.cbms.k.u-tokyo.ac.jp/lab/rinsho.html
[5] www.peptide-soc.jp/files/newsletter/PNJ128.pdf
[6] www.jstage.jst.go.jp/article/fpj/156/1/156_20070/_pdf
[7] www.jstage.jst.go.jp/article/fpj/142/2/142_68/_pdf
[8] www.jstage.jst.go.jp/article/biophys/55/1/55_019/_pdf
[9] www.igakuken.or.jp/topics/2021/0210.html
[10] answers.ten-navi.com/pharmanews/24711/
[11] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2015.870705/data/
[12] www.jstage.jst.go.jp/article/faruawpsj/56/1/56_11/_pdf
[13] shingi.jst.go.jp/pdf/2023/2023_3chubu_003.pdf
[14] www.smrf.or.jp/report/2020/s2020i_2019_004.pdf
[15] bibgraph.hpcr.jp/abst/pubmed/22711561?click_by=p_ref
[16] jp.linkedin.com/pulse/%E3%83%97%E3%83%AD%E3%83%86%E3%82%A2%E3%82%BD%E3%83%BC%E3%83%A0%E9%98%BB%E5%AE%B3%E5%89%A4%E5%B8%82%E5%A0%B4%E3%81%AE%E5%B1%95%E6%9C%9B-%E6%8A%80%E8%A1%93%E9%9D%A9%E6%96%B0%E3%83%88%E3%83%AC%E3%83%B3%E3%83%89%E6%A9%9F%E4%BC%9A-vikash-singh-afhsc
[17] kaken.nii.ac.jp/ja/grant/KAKENHI-PROJECT-20K07969/
[18] www.takeda.com/ja-jp/announcements/2023/NINLARO-capsules
[19] kaken.nii.ac.jp/ja/grant/KAKENHI-PROJECT-16K08329/
[20] bio.nikkeibp.co.jp/atcl/news/p1/21/10/10/08717/
バイオテクノロジーにおける利用
プロテアソームは細胞内でタンパク質を分解する重要な役割を果たしており、その技術はバイオテクノロジーをはじめとする多くの科学分野や工業で応用されています。以下に、プロテアソーム技術の応用例を挙げます。
● 医薬品開発
プロテアソームの研究は、新しい医薬品の開発に直接的な影響を与えています。プロテアソームの働きを抑制する薬剤は、特定のがん種、特に多発性骨髄腫の治療に有効であることが確認されています[4][10]。また、プロテアソームの機能異常がパーキンソン病やアルツハイマー病などの神経変性疾患の一因とされており、これらの疾患の治療薬開発にも寄与しています[4]。
● タンパク質分解誘導技術
プロテアソームを利用したタンパク質分解誘導技術は、疾患関連タンパク質を選択的に分解することを可能にします。PROTACs(Proteolysis Targeting Chimeras)やSNIPER(Specific and Nongenetic IAP-dependent Protein Eraser)などの分子は、標的タンパク質をユビキチン化し、プロテアソームによる分解を促進します[7][8][12][13]。この技術は、創薬研究において新たな治療戦略を提供しています。
● プロテオーム解析
プロテオーム解析は、生物の持つ全タンパク質の構造や機能を網羅的に解析する技術であり、プロテアソームの研究はこの分野にも貢献しています。プロテアソームの機能を理解することは、タンパク質の寿命や細胞内での量を調節するメカニズムを解明し、プロテオーム解析の精度を高めることに繋がります[9]。
● バイオマーカーとしての利用
プロテアソームの活性やその構成要素は、特定の疾患のバイオマーカーとして利用されることがあります。例えば、プロテアソームの異常は炎症や免疫応答に関連しており、これらの状態を監視するためのマーカーとしての潜在的な価値があります[10]。
● 環境ストレス応答の研究
プロテアソームは細胞の環境ストレス応答にも関与しており、このメカニズムの理解は、ストレス耐性を持つ作物の開発や環境汚染への対策など、農業や環境科学の分野に応用される可能性があります[2][4]。
● 教育と情報提供
プロテアソームの研究成果は、教育資料や情報提供のためのコンテンツとしても活用されています。例えば、神経病理解析室が作成した神経病理eラーニングシステムは、デジタルパソロジーの分野で国際的に紹介されています[3]。
● その他の応用
プロテアソームの研究は、細胞の品質管理やシグナル伝達、抗原提示など、細胞生物学の基本的なプロセスを理解する上で不可欠です。これらの知見は、生物学的な研究だけでなく、生物工学や化学工業などの分野での応用にもつながっています[4][10]。
プロテアソーム技術の応用は、これらの例に限らず、さらに多岐にわたる可能性があります。研究が進むにつれて、新たな応用分野が開拓されることが期待されます。
- 参考文献・出典
-
[2] kaken.nii.ac.jp/ja/file/KAKENHI-PROJECT-26000014/26000014_2019_seika.pdf
[3] www.igakuken.or.jp/public/news/news038.pdf
[4] www.tanpaku.org/tp_fundamental_biology/fba2.php
[5] www.yodosha.co.jp/jikkenigaku/keyword/358.html
[6] www.igakuken.or.jp/project/to-tomin/to-pro20.html
[7] www.jstage.jst.go.jp/article/medchem/31/1/31_36/_pdf/-char/ja
[8] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2022.940258/data/index.html
[9] www.nite.go.jp/nbrc/genome/description/analysis3.html
[10] www.amed.go.jp/content/000026434.pdf
[11] katosei.jsbba.or.jp/view_html.php?aid=1324
[12] www.jstage.jst.go.jp/article/medchem/28/1/28_29/_pdf/-char/ja
[13] www.jstage.jst.go.jp/article/medchem/32/4/32_201/_article/-char/ja/
[14] www.ubiquitin.jp/l_kawaguchi.html
第4章: プロテアソームの研究手法と技術
プロテアソーム活性測定法
## プロテアソーム活性測定法
プロテアソームは細胞内でタンパク質の分解を担う重要な酵素複合体であり、その活性を測定することは、細胞のタンパク質品質管理機構の理解や疾患の研究、新しい薬剤の開発において重要です。プロテアソーム活性の測定法は、主に蛍光または発光を利用したアッセイに基づいています。以下に、現代のプロテアソーム活性測定法について解説します。
● 蛍光ベースのアッセイ
蛍光ベースのアッセイは、プロテアソームの活性を測定する最も一般的な方法の一つです。この手法では、プロテアソームの基質として特定の蛍光ペプチドを使用します。プロテアソームによるペプチドの分解が起こると、蛍光シグナルが発生し、その強度を測定することで酵素活性を定量化します。
– 20Sプロテアソームアッセイキット: これらのキットは、精製された20Sプロテアソームのキモトリプシン様プロテアーゼ活性を測定するために設計されており、非放射性の蛍光ペプチド基質を使用します[9][13][14][15][17]。
– 細胞ベースのアッセイ: 細胞内のプロテアソーム活性を直接測定するために、特定の蛍光基質を細胞に導入し、細胞内でのプロテアソームによる基質の分解を測定します[12][18][19]。
● 発光ベースのアッセイ
発光ベースのアッセイもプロテアソーム活性の測定に用いられます。この手法では、プロテアソームによる基質の分解が発光シグナルを引き起こし、そのシグナルの強度を測定することで活性を定量化します。
– Cell-Based Proteasome-Glo™ Assays: これは培養細胞内のプロテアーゼ活性を発光法で測定するホモジニアスアッセイであり、”添加 – 混和 – 測定” だけの簡便なプロトコールを提供します[18]。
● プロテアソームの濃縮と活性測定
プロテアソームを細胞から濃縮し、その後活性を測定する方法もあります。これにより、細胞ライセートからプロテアソームを分離し、その活性をより正確に測定することが可能になります。
– CycLex Proteasome Enrichment & Activity Assay Kit: このキットはUBL (hHR23B)レジンを用いて20Sプロテアソームを濃縮し、その後蛍光基質を用いてプロテアーゼ活性を測定します[20]。
● 阻害剤のスクリーニング
プロテアソーム活性測定は、プロテアソームに対する阻害剤や活性化剤のスクリーニングにも利用されます。これにより、新しい薬剤候補の同定や、プロテアソームの機能を調節する化合物の発見が可能になります。
– プロテアソーム阻害剤のハイスループットスクリーニング: 蛍光または発光ベースのアッセイを用いて、大量の化合物ライブラリーからプロテアソームの活性を阻害する化合物を迅速に同定できます[7][13][15][16][17]。
● 結論
プロテアソーム活性の測定は、蛍光や発光を利用したアッセイによって行われ、これらの手法は研究室での基本的な実験から薬剤開発に至るまで幅広い応用が可能です。これらのアッセイは、プロテアソームの機能を理解し、疾患の治療に向けた新しい治療戦略を開発するための重要なツールとなっています。
- 参考文献・出典
-
[7] catalog.takara-bio.co.jp/PDFS/200708_14.pdf
[8] kaken.nii.ac.jp/ja/file/KAKENHI-PROJECT-19H00997/19H00997seika.pdf
[9] search.cosmobio.co.jp/view/p_view.asp?PrimaryKeyValue=4763312&ServerKey=Primary&selPrice=1
[10] www.dojin-glocal.com/%E3%83%97%E3%83%AD%E3%83%86%E3%82%A2%E3%83%BC%E3%82%BC%E6%B4%BB%E6%80%A7
[11] www.funakoshi.co.jp/contents/68032
[12] teapot.lib.ocha.ac.jp/record/4866/files/45_14_2447.pdf
[13] www.funakoshi.co.jp/contents/3864
[14] www.cosmobio.co.jp/product/detail/products_bmo_20060417.asp?entry_id=761
[15] www.funakoshi.co.jp/contents/53134
[16] nbio.repo.nii.ac.jp/record/35/files/%E5%8D%9A%E5%A3%AB%E8%AB%96%E6%96%87.pdf
[17] www.sigmaaldrich.com/JP/ja/product/sigma/mak172
[18] www.promega.jp/products/protein-detection/protease-assays/cell_based-proteasome_glo-assays/
[19] kaken.nii.ac.jp/ja/grant/KAKENHI-PROJECT-09267211/
[20] ruo.mbl.co.jp/bio/product/cyclex/pickup/discovery/ub.html
実験モデルと研究の進め方
プロテアソーム研究においては、さまざまな実験モデルや手法が用いられています。これらの手法は、プロテアソームの構造、機能、および細胞内での動態を理解するために不可欠です。以下に、一般的に使用される実験モデルと研究の進め方を紹介します。
● 実験モデル
1. 酵母モデル: 酵母はプロテアソーム研究において広く使用されるモデル生物です。酵母は遺伝子操作が容易であり、プロテアソームの基本的な機能や構造に関する研究に適しています[2][11]。
2. 線虫モデル: 線虫はプロテアソームの機能が低下すると細胞の分裂回数が減り、寿命が短くなることが示されています。逆に、プロテアソームの量を増やす実験では、寿命が少し長くなるという結果が出ています[8]。
3. 哺乳類細胞: 哺乳類細胞を用いた研究では、プロテアソームの細胞内動態や、特定の疾患モデルにおけるプロテアソームの役割を解析します。特に、ヒト培養細胞を用いた研究が進められています[9]。
● 研究の進め方
1. 蛍光相関分光法: 蛍光タンパク質をプロテアソームに結合させた細胞を作製し、蛍光のゆらぎを測定することで、生きた細胞内でプロテアソームの動態を解析します[2][11]。
2. 遺伝子操作: 遺伝子操作を用いて、プロテアソームの特定のサブユニットの機能を抑制または強化することで、プロテアソームの機能に関する洞察を得ます[14]。
3. プロテアソーム活性の測定: プロテアソームのプロテアーゼ活性を測定することで、プロテアソームの機能的な状態を評価します。これには、特異的なプロテアソーム阻害剤や活性化剤の使用が含まれます[13]。
4. タンパク質分解の解析: プロテアソームによるタンパク質分解の過程を解析することで、プロテアソームの基質認識や分解機構についての理解を深めます[12]。
これらの実験モデルと手法を組み合わせることで、プロテアソームの複雑な生物学的機能や、疾患における役割についての包括的な理解が進められています。
- 参考文献・出典
-
[1] brh.co.jp/s_library/interview/81/
[2] www.riken.jp/press/2014/20140306_3/index.html
[3] kaken.nii.ac.jp/ja/file/KAKENHI-PROJECT-19H00997/19H00997seika.pdf
[4] kaken.nii.ac.jp/ja/file/KAKENHI-PROJECT-15K08183/15K08183seika.pdf
[5] www.igakuken.or.jp/public/news/014/cont2.html
[6] molbiolut.jp/research/forpublic/
[7] www.u-tokyo.ac.jp/focus/ja/features/voices078.html
[8] www.igakuken.or.jp/project/to-tomin/to-pro-meta3.html
[9] www.jstage.jst.go.jp/article/biophys/55/1/55_019/_pdf
[10] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2015.870705/data/
[11] www.igakuken.or.jp/topics/2014/0306.html
[12] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2021.930536/data/index.html
[13] shingi.jst.go.jp/pdf/2023/2023_3chubu_003.pdf
[14] kaken.nii.ac.jp/en/file/KAKENHI-PROJECT-25221102/25221102_kenkyu_shinchoku_hyoka_gaiyo_ja.pdf
第5章: 研究と未来の展望
プロテアソーム研究の最前線
プロテアソームは細胞内でタンパク質を分解する重要な役割を担っており、その研究は生命科学の多様な分野において重要な意味を持っています。最新の研究成果と現在プロテアソーム研究が直面している課題について、以下に考察します。
♦ 最新の研究成果
● プロテアソームの動作原理の解明
プロテアソームの動作原理の解明は、細胞内タンパク質分解の研究領域に新たな基軸を拓いています。特に、プロテアソームが液滴を形成してタンパク質分解センターとなることや、ユビキチンコードの解析によるタンパク質分解の選択性の理解が進んでいます[1]。
● プロテアソームの多様性と免疫システムとの関連
プロテアソームの多様性に関する研究は、免疫システムとの深い関連を明らかにしています。特に、免疫プロテアソームがMHCクラスⅠと結合しやすいペプチドを効果的に産出できることが示されています[2]。
● プロテアソームと疾患
プロテアソームの機能不全は、ガンやアルツハイマー病などの疾患の発症に関連しています。プロテアソームシステムの破綻がこれらの疾患の発症にどのように関わっているかの理解が深まっています[2]。
● プロテアソームの活性化に関する研究
プロテアソームの活性を促進する新しいアミノ酸配列の同定は、プロテアソームの活性化に関する理解を深めるものです。これは、プロテアソームの機能を高めることにより、細胞の健康を維持する新たな方法を提供する可能性があります[13]。
♦ 直面している課題
● ユビキチンコードの解析
ユビキチン鎖の種類や長さに刻印された「ユビキチンコード」には膨大な情報が含まれていますが、その個々の機能についてはほとんど分かっていません[1]。この複雑なコードの解読は、プロテアソーム研究における大きな課題の一つです。ユビキチンコードとは、タンパク質に対するユビキチン修飾のパターンや構造の多様性に基づく情報のことです。ユビキチンは、76残基のアミノ酸からなる小さなタンパク質で、タンパク質の品質管理、シグナル伝達、DNA修復、膜タンパク質の輸送など、細胞内の多彩な機能を調節するために重要な役割を果たしています。ユビキチン修飾は、ユビキチン分子が特定のイソペプチド結合を介して連結し、タンパク質に結合することで行われます。この修飾は、ユビキチン活性化酵素(E1)、ユビキチン結合酵素(E2)、およびユビキチン転移酵素(E3)という3つの異なる酵素を含むカスケードを介して行われます。
ユビキチンコードは、8種類のユビキチン鎖(M1鎖、K6鎖、K11鎖、K27鎖、K29鎖、K33鎖、K48鎖、K63鎖)が存在し、それぞれが異なる機能を持つことから、個々のユビキチン修飾が持つ機能情報として定義されます。これらのユビキチン鎖は、タンパク質のユビキチン化において、異なるトポロジーを持ち、複雑なシグナル伝達を媒介することで、タンパク質の機能、発現、局在に影響を与えます。
● 疾患との関連性のさらなる解明
プロテアソームの機能不全が様々な疾患の発症にどのように関わっているかの詳細なメカニズムの解明は、治療法の開発に直結する重要な課題です。特に、プロテアソームの機能を調節することによる疾患治療の可能性についての研究が求められています[2][4][5]。
● プロテアソームの多様性と機能の全体像の理解
プロテアソームの多様性に関する研究は進んでいますが、その全体像と機能の詳細な理解には至っていません。特に、異なるタイプのプロテアソームが細胞内でどのように機能し、相互作用するかの理解は、細胞の生理学および病理学において重要です[2][7]。
プロテアソーム研究は、生命科学の基礎研究から疾患治療に至るまで幅広い応用が期待されています。しかし、その複雑さと多様性は、研究者にとって多くの課題を提起しています。これらの課題に対処することで、プロテアソーム研究はさらなる進展を遂げるでしょう。
- 参考文献・出典
-
[1] kaken.nii.ac.jp/ja/file/KAKENHI-PROJECT-26000014/26000014_2019_seika.pdf
[2] brh.co.jp/s_library/interview/81/
[3] kaken.nii.ac.jp/ja/file/KAKENHI-PROJECT-19H00997/19H00997seika.pdf
[4] www.igakuken.or.jp/project/to-tomin/to-pro-meta3.html
[5] www.u-tokyo.ac.jp/focus/ja/features/voices078.html
[6] nanolsi.kanazawa-u.ac.jp/highlights/29557/
[7] www.mext.go.jp/a_menu/shinkou/hojyo/1300611.htm
未来への期待と課題
プロテアソーム研究は、細胞内のタンパク質分解と恒常性維持において中心的な役割を果たしていることが広く認識されています。これまでの研究により、プロテアソームの構造、機能、および細胞内での動態に関する多くの知見が得られていますが、未だに解明されていない側面も多く存在します。今後のプロテアソーム研究は、以下のような方向に進む可能性があります。
1. 疾患メカニズムの解明と治療応用
プロテアソームの機能不全は、がん、神経変性疾患、免疫疾患など多くの病態に関与しています。プロテアソームの動態と機能制御機構のさらなる解明は、これらの疾患の発症メカニズムを理解し、新たな治療法の開発につながる可能性があります[14]。特に、プロテアソーム阻害剤はがん治療において既に一定の成果を上げていますが[16]、プロテアソームの特定の機能やサブユニットを標的とした新規治療薬の開発が期待されます。
2. プロテアソームの細胞内動態の詳細な解析
プロテアソームは細胞内で非常に動的に振る舞い、多様な細胞機能に関与しています。プロテアソームの細胞内での正確な位置や動態を解析することで、細胞機能との関連性をより深く理解することができます[13][17]。また、プロテアソームの細胞内輸送機構や局在制御のメカニズムの解明も、細胞生物学の基本的な問題として重要です。
3. プロテアソームの多様性と特異性の研究
プロテアソームは、構成サブユニットの異なる複数の形態を持ち、細胞タイプや条件によってその構成が変化することが知られています。免疫プロテアソームや胸腺プロテアソームなどの特異的な形態の機能や、これらの形態が細胞機能にどのように寄与しているのかを明らかにする研究が進むことで、プロテアソームの多様性と特異性に関する理解が深まるでしょう[5]。
4. プロテアソームと細胞内シグナル伝達の相互作用
プロテアソームは、細胞内シグナル伝達経路において重要な役割を果たしています。プロテアソームによる特定のシグナル分子の分解が、シグナル伝達の調節にどのように関与しているのか、また、シグナル伝達経路がプロテアソームの活性や機能をどのように制御しているのかについての研究が進むことが期待されます[13]。
5. プロテアソームの機能的多様性の探索
プロテアソームはタンパク質分解以外にも、タンパク質の品質管理、細胞周期制御、DNA修復など、多岐にわたる細胞機能に関与しています。これらの機能におけるプロテアソームの役割や、未知の機能の発見に向けた研究が進むことで、プロテアソームの機能的多様性に関する新たな知見が得られるでしょう[13][17]。
これらの研究方向は、プロテアソームの基礎研究だけでなく、疾患治療への応用にも大きな影響を与える可能性があります。プロテアソーム研究のさらなる進展は、生命科学の基本的な問題の解明とともに、医学的な応用においても重要な成果をもたらすことが期待されます。
- 参考文献・出典
-
[5] brh.co.jp/s_library/interview/81/
[6] kaken.nii.ac.jp/ja/grant/KAKENHI-PROJECT-23K18107/
[7] www.igakuken.or.jp/topics/2014/0306.html
[8] www.jstage.jst.go.jp/article/kagakutoseibutsu1962/39/9/39_9_573/_pdf
[9] www.jstage.jst.go.jp/article/biophys/55/1/55_019/_pdf
[10] www.u-tokyo.ac.jp/focus/ja/features/voices078.html
[11] www.igakuken.or.jp/project/to-tomin/to-pro20.html
[12] www.igakuken.or.jp/topics/2017/0519.html
[13] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2015.870705/data/
[14] www.jsps.go.jp/file/storage/grants/j-grantsinaid/12_kiban/ichiran_25/j-data/h25_j4202_murata.pdf
[15] kaken.nii.ac.jp/ja/file/KAKENHI-PROJECT-18H03993/18H03993seika.pdf
[16] jp.linkedin.com/pulse/%E3%83%97%E3%83%AD%E3%83%86%E3%82%A2%E3%82%BD%E3%83%BC%E3%83%A0%E9%98%BB%E5%AE%B3%E5%89%A4%E5%B8%82%E5%A0%B4%E3%81%AE%E5%B1%95%E6%9C%9B-%E6%8A%80%E8%A1%93%E9%9D%A9%E6%96%B0%E3%83%88%E3%83%AC%E3%83%B3%E3%83%89%E6%A9%9F%E4%BC%9A-vikash-singh-afhsc
[17] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2015.870705/data/index.pdf