目次
この記事では、パルミトイルCoAの基本的な特性、その生物学的役割、および代謝経路について解説します。さらに、パルミトイルCoAが人体内でどのように機能するか、そして関連する疾患についても詳細に説明します。
第1章: パルミトイルCoAの基本
パルミトイルCoAの化学的性質
パルミトイルCoAは、生体内で重要な役割を果たす化合物であり、その化学的性質と分子構造は、生物学的プロセスにおいて中心的な役割を担っています。パルミトイルCoAの化学式はC37H66N7O17P3Sであり、これは複雑な構造を持つことを示しています。
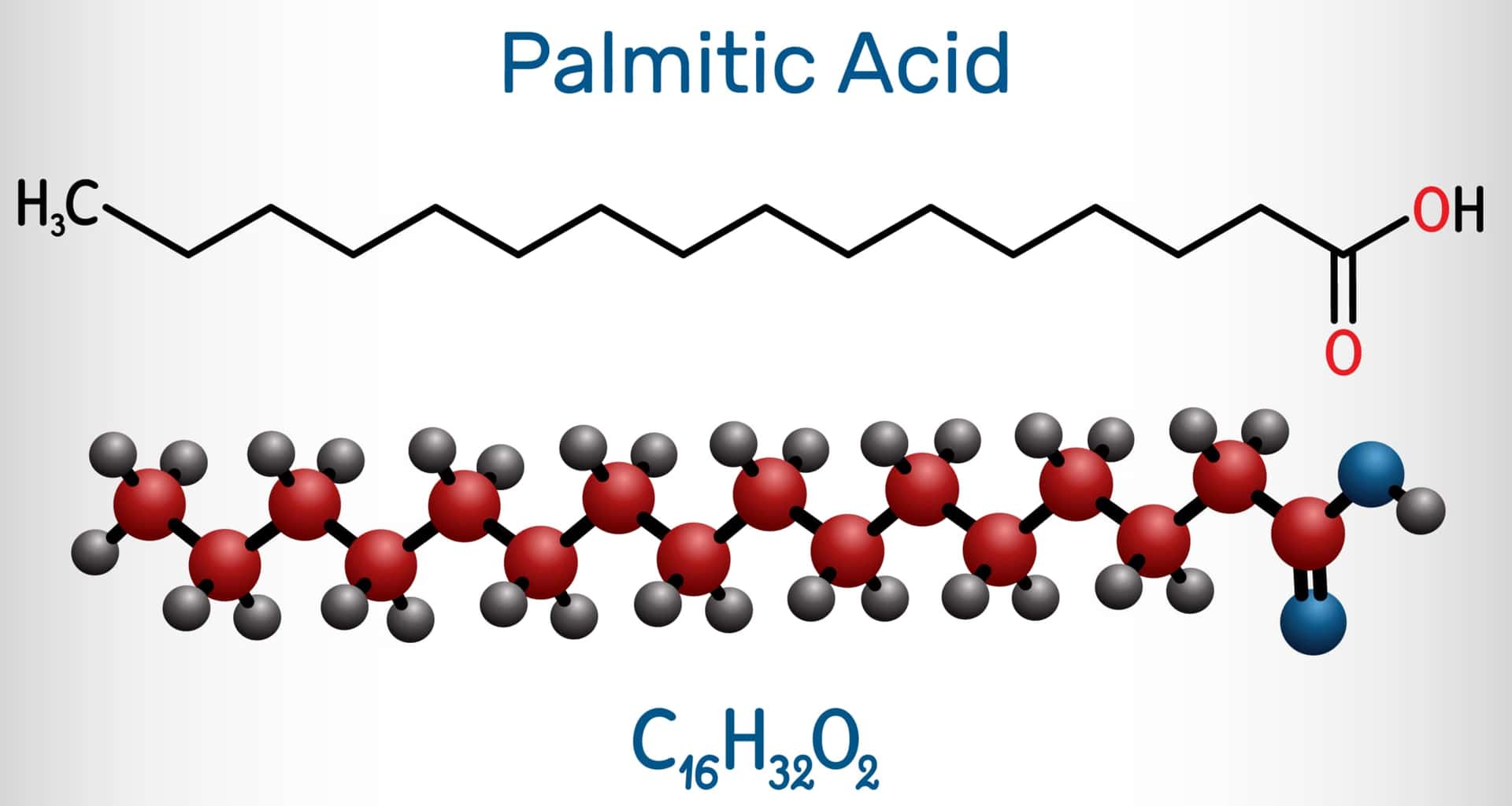
パルミトイルCoA(パルミトイル補酵素A)はパルミトイル化において中心的な役割を果たします。パルミトイルCoAは、パルミチン酸と共酵素Aが結合したもので、脂肪酸代謝と脂質の生合成において重要な中間体です。下図はパルミチン酸の構造式です。
パルミトイル化は、パルミチン酸や他の脂肪酸がタンパク質の特定の残基に結合する生化学的なプロセスです。この修飾は、主にシステイン残基(S-パルミトイル化)やセリン、スレオニン残基(O-パルミトイル化)に起こります。
S-パルミトイル化は、チオエステル結合を介してシステイン残基にパルミトイル鎖が結合することによって行われます。この反応は可逆的であり、特定の酵素によって制御されるタンパク質の翻訳後修飾です。S-パルミトイル化は、タンパク質が細胞膜に結合すること、特定の膜ドメインに局在すること、及び輸送や安定性に影響を及ぼすことなど、タンパク質の機能と活動に重要な役割を果たします。
一方、O-パルミトイル化では、パルミトイル鎖がセリンやトレオニンのヒドロキシル基に結合します。このタイプのパルミトイル化もタンパク質の機能と局在に重要な影響を与える可能性があります。
パルミトイルCoAは、タンパク質のパルミトイル化に必要なパルミチン酸を提供する役割を担います。この過程では、特定の酵素がパルミトイルCoAからパルミチン酸部分を切り離し、タンパク質のシステイン残基(S-パルミトイル化)やセリン、スレオニン残基(O-パルミトイル化)に結合させます。この修飾は、タンパク質の膜局在や機能調節に重要な役割を果たしています。
パルミトイル化は、タンパク質によって機能が異なります。この修飾はタンパク質の疎水性を高め、細胞膜との結合を助けます。パルミトイル化の特徴として、プレニル化やミリストイル化と異なり、タンパク質とパルミチン酸の間のチオエステル結合は可逆的であることが挙げられます。この逆反応は、哺乳類細胞では細胞質のアシルタンパク質チオエステラーゼ(APT)やリソソームのパルミトイルタンパク質チオエステラーゼによって触媒されます。このダイナミックな翻訳後のプロセスは、細胞内でのタンパク質の局在性、相互作用、および結合能力を変化させることで、細胞の機能調整に寄与しています。
パルミトイル化を受けるタンパク質の例には、インフルエンザウイルスのヘマグルチニンや、H-Ras、Gsαβ2アドレナリン受容体、内皮型一酸化窒素合成酵素(eNOS)などがあります。これらのタンパク質は、Gタンパク質介したシグナル伝達などで重要な役割を果たしています。例えば、Gタンパク質のαサブユニットのパルミトイル化は、細胞膜内にGタンパク質を固定し、受容体との相互作用を可能にします。
タンパク質のパルミトイル化は、システイン残基がパルミトイル基とチオエステル結合を形成することで行われます。この可逆的な脂質修飾は、細胞内タンパク質の機能を迅速に制御することを可能にし、細胞の反応性を高めます。
パルミトイル化を触媒する酵素であるパルミトイルトランスフェラーゼ(PAT)の異常は、多くの神経疾患やがんの進行に関連しています。
パルミトイルCoAは、脂肪酸の代謝において特に重要な役割を果たします。脂肪酸のβ酸化過程において、パルミトイルCoAはアシルCoAシンテターゼによって高エネルギー結合を持つアシルCoAに変換され、これがミトコンドリア内での脂肪酸の酸化分解の出発点となります[5]。β酸化は、脂肪酸の主要な酸化経路であり、この過程でパルミトイルCoAは7回のβ酸化を受け、8分子のアセチルCoAと7分子のFADH2、7分子のNADHが生成され、これらから最終的には106分子のATPが得られます[7]。
パルミトイルCoAは、その構造上、アデノシン3′-りん酸5′-[二りん酸β-[(R)-3-ヒドロキシ-4-[[3-[[2-(ヘキサデカノイルチオ)エチル]アミノ]-3-オキソプロピル]アミノ]-2,2-ジメチル-4-オキソブチル]]という非常に複雑な化学構造を持っています[15]。この構造は、パルミトイルCoAが多様な生化学的反応に関与することを可能にしています。
また、パルミトイルCoAは、パルミトイルCoAヒドロラーゼという酵素によって加水分解されることがあり、この反応はパルミチン酸の代謝に関与しています[16]。このように、パルミトイルCoAは生体内での脂肪酸の代謝において中心的な役割を果たし、その化学的性質と分子構造は、生物学的プロセスにおけるその機能を支えています。
- 参考文献・出典
-
[5] www.nutri.co.jp/nutrition/keywords/ch2-4/keyword6/
[6] www.sc.fukuoka-u.ac.jp/~bc1/Biochem/betaoxid.htm
[7] health.joyplot.com/HealthWordsWiki/
[8] www.sc.fukuoka-u.ac.jp/~bc1/Biochem/fa-syn.htm
[9] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2018.900125/data/index.html
[10] grj.umin.jp/grj/cpt2.htm
[11] eprints.lib.hokudai.ac.jp/dspace/bitstream/2115/62530/1/Kensuke_Abe.pdf
[12] ja.wikipedia.org/wiki/%CE%92%E9%85%B8%E5%8C%96
[13] www.jstage.jst.go.jp/article/vso/93/11/93_497_2/_pdf/-char/ja
[14] www.jstage.jst.go.jp/article/plmorphol/30/1/30_5/_pdf
[15] jglobal.jst.go.jp/detail?JGLOBAL_ID=200907045585314130
[16] ja.wikipedia.org/wiki/%E3%83%91%E3%83%AB%E3%83%9F%E3%83%88%E3%82%A4%E3%83%ABCoA%E3%83%92%E3%83%89%E3%83%AD%E3%83%A9%E3%83%BC%E3%82%BC
生化学における役割
パルミトイルCoAは、細胞内で重要な生化学的役割を担っています。この化合物は、脂質の代謝、特に脂肪酸の合成と分解、およびタンパク質の修飾において中心的な役割を果たします。以下に、パルミトイルCoAの主要な生化学的役割を詳細に解説します。
● 脂肪酸の合成
パルミトイルCoAは、脂肪酸の合成過程において重要な中間体です。脂肪酸の生合成は、アセチル-CoAを出発原料として、多くの反応段階を経て行われます。この過程で、パルミトイル-CoAは、パルミチン酸の合成における最終産物として生成されます。パルミチン酸は、加水分解されて遊離することで、細胞内でのさまざまな機能を果たす脂肪酸として利用されます[1][5]。
● 脂肪酸のβ酸化
脂肪酸のβ酸化は、脂肪酸を分解してエネルギーを産生する過程です。この過程では、パルミトイルCoAは、β酸化の逆反応として機能します。β酸化は、脂肪酸をアセチル-CoAに分解することで、エネルギー産生のための中間体を提供します。パルミトイルCoAは、この過程で重要な役割を果たす中間体の一つです[1][3]。
● タンパク質の修飾
パルミトイルCoAは、タンパク質の修飾にも関与します。特に、S-パルミトイル化というプロセスにおいて重要です。S-パルミトイル化は、タンパク質のシステイン残基にパルミトイル基が付加されることにより、タンパク質の局在や機能の制御に寄与します。この修飾は、細胞内タンパク質や膜タンパク質の機能調節において重要な役割を果たします[4]。
● 細胞内のその他の役割
パルミトイルCoAは、スフィンゴ脂質の合成にも関与します。スフィンゴ脂質は、細胞膜の構成成分であり、細胞の生存に必須の成分です。パルミトイル-CoAは、スフィンゴ脂質の生合成経路において、セラミドやスフィンゴシンなどの代表的な代謝産物の合成に必要なアシル基を提供します[2]。
以上のように、パルミトイルCoAは、脂肪酸の合成と分解、タンパク質の修飾、スフィンゴ脂質の合成など、細胞内で多岐にわたる生化学的プロセスにおいて中心的な役割を果たしています。これらのプロセスは、細胞のエネルギー代謝、構造維持、信号伝達など、生命活動の基本を支える重要な機能です。
- 参考文献・出典
-
[1] www.sc.fukuoka-u.ac.jp/~bc1/Biochem/pdf/bcC_10-11.pdf
[2] www.ompu.ac.jp/u-deps/med/staff/ikushiro/
[3] www.med.nagasaki-u.ac.jp/biochem/pdf/h23_hon.pdf
[4] bsd.neuroinf.jp/wiki/%E3%83%91%E3%83%AB%E3%83%9F%E3%83%88%E3%82%A4%E3%83%AB%E5%8C%96
[5] www.sc.fukuoka-u.ac.jp/~bc1/Biochem/fa-syn.htm
[6] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2015.870298/data/index.html
[7] www.jstage.jst.go.jp/article/plmorphol/30/1/30_5/_pdf
[8] www.jstage.jst.go.jp/article/jsnfs1983/42/1/42_1_1/_pdf
第2章: パルミトイルCoAの代謝経路
代謝におけるパルミトイルCoAの役割
パルミトイルCoAは、脂肪酸代謝において中心的な役割を果たす重要な中間体です。脂肪酸代謝は主にエネルギー産生、細胞膜の構成成分の合成、およびシグナル伝達分子の前駆体として機能する脂質の合成に関与しています。以下に、パルミトイルCoAが関与する代謝プロセスを詳細に説明します。
● 脂肪酸のβ-酸化
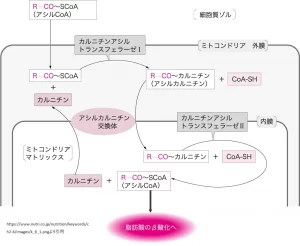
パルミトイルCoAは、脂肪酸のβ-酸化において重要な役割を果たします。β-酸化はミトコンドリア内で行われるプロセスで、脂肪酸をアセチルCoAに分解し、エネルギーを産生する過程です。この過程では、まず長鎖脂肪酸は細胞質でアシルCoAに活性化され、その後カルニチンと結合してミトコンドリア内に運ばれます。ミトコンドリア内でカルニチンから再びCoAに転換され、パルミトイルCoAとしてβ-酸化の出発原料になります[7]。
β-酸化の過程では、パルミトイルCoAは複数の酵素反応を経てアセチルCoAに分解されます。この過程で生じるアセチルCoAはクエン酸回路に入り、さらにエネルギーを産生します。また、β-酸化によって生じるNADHとFADH2は電子伝達系に供給され、ATPの合成に寄与します[7]。
● 脂肪酸の合成
脂肪酸の合成においても、パルミトイルCoAは重要な中間体です。動物細胞において、脂肪酸合成は主にアセチルCoAから始まり、パルミトイルCoAまでの合成が行われます。この過程では、アセチルCoAはマロニルCoAに変換され、その後一連の反応を経てパルミチン酸が生成されます。パルミチン酸はパルミトイルCoAとして活性化され、さらに他の脂肪酸や脂質の合成に利用されます[3]。
● スフィンゴ脂質の合成
パルミトイルCoAは、スフィンゴ脂質の合成にも関与しています。スフィンゴ脂質は細胞膜の構成成分であり、セリンとパルミトイルCoAからセラミドが合成されます。セラミドはさらにスフィンゴミエリンやグリコスフィンゴ脂質などのスフィンゴ脂質へと変換されます[4][8][12]。
● 細胞障害性脂質の合成の防止
セリンの合成不全によって生じる細胞障害性脂質の合成を防ぐためにも、パルミトイルCoAは重要です。セリンが不足すると、アラニンとパルミトイルCoAからデオキシスフィンゴ脂質が合成され、細胞毒性を持つ脂質が蓄積する可能性があります。このため、セリンの合成能力が低下すると、細胞内のアラニン/セリン比が増大し、細胞障害性脂質の合成が促進されることが示されています[12]。
● まとめ
パルミトイルCoAは、脂肪酸のβ-酸化、脂肪酸の合成、スフィンゴ脂質の合成、および細胞障害性脂質の合成の防止など、脂肪酸代謝における多様なプロセスにおいて中心的な役割を果たしています。これらのプロセスはエネルギー産生、細胞膜の構成、シグナル伝達など、細胞の生存と機能に不可欠な役割を担っています。
- 参考文献・出典
-
[4] www.ompu.ac.jp/u-deps/med/staff/ikushiro/
[7] www.sc.fukuoka-u.ac.jp/~bc1/Biochem/betaoxid.htm
[8] www.pharm.hokudai.ac.jp/seika/research/research_02.php
[9] www.jstage.jst.go.jp/article/kagakutoseibutsu1962/37/7/37_7_443/_pdf
[10] tuat.repo.nii.ac.jp/record/1740/files/202003OdoSatoshi_F.pdf
[11] kaken.nii.ac.jp/ja/report/KAKENHI-PROJECT-17H03805/17H038052018jisseki/
[12] www.kyushu-u.ac.jp/f/6081/2015_04_28.pdf
エネルギー生成への寄与
パルミトイルCoAは、細胞のエネルギー生成において重要な役割を果たします。この化合物は、脂肪酸の代謝過程であるβ酸化において中心的な中間体として機能し、エネルギー産生のための基質となります。
● β酸化におけるパルミトイルCoAの役割
β酸化は、ミトコンドリア内で行われる脂肪酸の酸化的分解過程です。この過程では、長鎖脂肪酸がアシルCoAシンテターゼによって活性化され、アシルCoAとなります。パルミトイルCoAは、16炭素の飽和脂肪酸であるパルミチン酸がCoAと結合した形態であり、β酸化の出発物質となります[10][12][17]。
β酸化の過程では、パルミトイルCoAは一連の酵素反応を経て、2炭素単位であるアセチルCoAに分解されます。この過程で、FADH2とNADHという還元型補酵素が生成され、これらは電子伝達系において利用されてATPを産生します[10][12][17]。
● ATP産生への寄与
β酸化によって生成されたアセチルCoAは、クエン酸回路(TCAサイクル)に入り、さらに多くのATPを産生するための基質となります。クエン酸回路を通じて、アセチルCoAからCO2とATPが生成され、FADH2とNADHもさらに産生されます。これらの補酵素は、ミトコンドリアの電子伝達系で利用され、最終的に大量のATPが合成されることになります[10][12][17]。
● エネルギー代謝の調節
パルミトイルCoAは、エネルギー代謝の調節にも関与しています。例えば、カルニチンパルミトイルトランスフェラーゼI(CPT1)は、パルミトイルCoAをアシルカルニチンに変換し、ミトコンドリア内への長鎖脂肪酸の輸送を促進します。CPT1の活性は、細胞のエネルギー状態に応じて調節され、マロニルCoAの濃度によって阻害されることが知られています。これにより、細胞のエネルギー需要に応じて脂肪酸の酸化が調節されます[13][14]。
● 結論
パルミトイルCoAは、β酸化における中心的な中間体として、アセチルCoAの生成、FADH2とNADHの産生、クエン酸回路への供給を通じて、細胞のエネルギー産生に大きく貢献しています。また、エネルギー代謝の調節にも関与し、細胞のエネルギー需要に応じた代謝の調整を行っています。
- 参考文献・出典
-
[10] www.nutri.co.jp/nutrition/keywords/ch2-4/keyword6/
[11] park.itc.u-tokyo.ac.jp/biotec-res-ctr/MBT/research.html
[12] www.sc.fukuoka-u.ac.jp/~bc1/Biochem/betaoxid.htm
[13] kaken.nii.ac.jp/ja/report/KAKENHI-PROJECT-17H03805/17H038052018jisseki/
[14] www.jstage.jst.go.jp/article/yakushi/133/5/133_13-00052/_pdf
[15] www.sc.fukuoka-u.ac.jp/~bc1/Biochem/fa-syn.htm
[16] www.kyushu-u.ac.jp/f/6081/2015_04_28.pdf
[17] ja.wikipedia.org/wiki/%CE%92%E9%85%B8%E5%8C%96
[18] www.jstage.jst.go.jp/article/plmorphol/30/1/30_5/_pdf
第3章: パルミトイルCoAと健康
健康への影響
パルミトイルCoAは、脂肪酸代謝において重要な役割を果たす化合物です。正常な機能としては、エネルギー産生のための脂肪酸のβ酸化、脂質の合成、および細胞内シグナル伝達の調節に関与しています。しかし、パルミトイルCoAのバランスが崩れると、様々な健康問題が生じる可能性があります。
● 正常な機能
1. エネルギー産生: パルミトイルCoAは、ミトコンドリア内での脂肪酸のβ酸化において中心的な役割を果たします。β酸化により、脂肪酸はアセチルCoAに分解され、さらにクエン酸回路を通じてATPとして利用可能なエネルギーを産生します[12]。
2. 脂質の合成: パルミトイルCoAは、脂質の合成にも関与しています。例えば、パルミチン酸の合成において、アセチルCoAからパルミトイルCoAへの変換は、脂肪酸合成の初期段階で重要なステップです[15]。
3. 細胞内シグナル伝達: パルミトイルCoAは、細胞内のシグナル伝達経路にも影響を及ぼすことが示唆されています。特定のタンパク質のパルミトイル化により、その活性や局在が調節されることがあります。
● バランス崩れの潜在的影響
1. インスリン抵抗性: パルミトイルCoAの過剰な蓄積は、インスリン抵抗性の原因となる可能性があります。これは、インスリンシグナル伝達経路の干渉により、糖の取り込みが阻害されるためです[16]。
2. 心血管疾患: 長鎖脂肪酸の代謝異常は、心血管疾患のリスクを高める可能性があります。パルミトイルCoAの異常な蓄積は、心筋のエネルギー代謝に影響を及ぼし、心臓疾患の発症につながることが示唆されています[16]。
3. 肥満: 脂肪酸の代謝異常は、肥満の発症にも関連しています。パルミトイルCoAのバランスが崩れると、脂肪細胞の脂質蓄積が促進され、肥満につながる可能性があります[16]。
4. 神経変性疾患: パルミトイルCoAの代謝異常は、神経変性疾患の発症にも関与する可能性があります。特に、ミトコンドリアの機能不全は、アルツハイマー病やパーキンソン病などの神経変性疾患の進行に寄与すると考えられています[16]。
パルミトイルCoAの正常な代謝は、健康維持に不可欠です。そのバランスが崩れると、多岐にわたる健康問題が生じる可能性があるため、適切な栄養摂取や生活習慣の管理が重要です。
関連する疾患
## パルミトイルCoAの代謝異常が関与する疾患
パルミトイルCoAは脂肪酸代謝において重要な中間体であり、その代謝異常はいくつかの疾患に関与しています。以下に、パルミトイルCoAの代謝異常が関与する可能性のある主な疾患を説明します。
● カルニチンパルミトイルトランスフェラーゼII(CPTII)欠損症
CPTII欠損症は、長鎖脂肪酸のミトコンドリアへの輸送とβ酸化に必要な酵素であるカルニチンパルミトイルトランスフェラーゼIIの活性が低下することによって引き起こされる疾患です。この酵素の欠損は、パルミトイルCoAをパルミトイルカルニチンに変換する反応を阻害し、長鎖脂肪酸の代謝を妨げます。CPTII欠損症には致死性新生児型、重症乳児肝心筋型、筋型の3つの臨床型があり、筋型は成人期にも発症する可能性があります[1]。
● 長鎖脂肪酸代謝異常症
長鎖脂肪酸代謝異常症は、長鎖脂肪酸の代謝に関わる酵素群の異常によって引き起こされる疾患群です。これにはカルニチンサイクル異常症を含む20種類以上の疾患があり、新しい原因酵素の発見が続いています。空腹時や飢餓時にエネルギー源として長鎖脂肪酸が利用されるため、これらの疾患は空腹時に突然発症することが多いです。症状としては低ケトン性低血糖、ライ様症候群、乳児突然死症候群などがあります[2][3]。
● その他の脂肪酸代謝異常症
脂肪酸代謝異常症には、CPTII欠損症や長鎖脂肪酸代謝異常症以外にも、マルチプルアシル-CoA脱水素酵素欠損症(グルタル酸血症II型)などが含まれます。これらの疾患は、脂肪酸の代謝に関わるさまざまな酵素の異常によって引き起こされ、代謝性アシドーシスや高アンモニア血症などの症状を引き起こすことがあります[4]。
これらの疾患は、遺伝的な要因によるものであり、適切な診断と治療が必要です。治療法としては、L-カルニチンの補充、食事中の脂肪摂取の減少、空腹を避ける生活指導、中鎖脂肪酸を含む食品の摂取などが挙げられます[2][3]。また、これらの疾患は新生児マススクリーニングの対象となっており、早期発見によって良好な経過をたどることが可能です[2][3]。
- 参考文献・出典
-
[1] grj.umin.jp/grj/cpt2.htm
[2] www.nanbyou.or.jp/entry/587
[3] www.nanbyou.or.jp/entry/790
[4] jsimd.net/iof/iof_04.html
[5] www.ncchd.go.jp/scholar/research/section/screening/NBS_guidance.pdf
[6] jsimd.net/pdf/nakamura/F3.pdf
[7] mhlw-grants.niph.go.jp/project/20142
[8] sukoyaka21.cfa.go.jp/media/tools/s4_nyu_lea026.pdf
第4章: パルミトイルCoAの研究と応用
研究の最前線
パルミトイルCoAは、細胞内での脂質代謝において重要な役割を果たす中間体であり、多くの生物学的プロセスに関与しています。近年の研究では、パルミトイルCoAの新たな機能が発見され、その代謝経路や調節機構に関する知見が深まっています。
● パルミトイルCoAの基本的な役割
パルミトイルCoAは、脂肪酸のパルミチン酸に補酵素Aが結合した化合物で、脂肪酸代謝の中心的な中間体です。主に以下のようなプロセスに関与しています:
– 脂肪酸のβ酸化:ミトコンドリア内での長鎖脂肪酸の分解において、パルミトイルCoAはβ酸化の基質として機能します。
– 脂質合成:セリンパルミトイル転移酵素(SPT)によるスフィンゴ脂質の合成において、パルミトイルCoAはセリンと結合してセラミドの合成を行います[10][13]。
● 新たに発見された機能と研究動向
– 細胞障害性脂質の合成抑制:九州大学の研究により、セリンの新たな代謝生理機能が解明されました。セリンが不足すると、パルミトイルCoAから細胞障害性を持つデオキシスフィンゴ脂質類が合成されることがわかりました。セリンの合成能力が低下すると、細胞内のアラニン/セリン比が増大し、アラニンがスフィンゴ脂質合成経路に入り込み、細胞障害性脂質が合成されることが示されました[11]。
– 脂質修飾酵素の研究:パルミトイル化はタンパク質の局在や機能の制御に重要な役割を果たす脂肪酸アシル化修飾の一つです。パルミトイルCoAは、この修飾においてドナー分子として機能します。最近の研究では、パルミトイル化と脱パルミトイル化のサイクルによるダイナミックな機能変動に焦点が当てられています[12]。
– 脂肪酸輸送・代謝機構の解明:カルニチンパルミトイルトランスフェラーゼ(CPT1)は、パルミトイルCoAをアシルカルニチンへと変換し、長鎖脂肪酸のミトコンドリア内への輸送を行う酵素です。しかし、ショウジョウバエにおいてCPT1を欠損しても脂質・エネルギー代謝に異常が見られないことが発見され、CPT1経路を代替する新たな脂肪酸輸送経路が存在することが示唆されました[9]。
● 総合的な視点
これらの研究は、パルミトイルCoAの代謝経路やその調節機構に関する新たな知見を提供しています。特に、細胞障害性脂質の合成抑制や脂質修飾酵素の機能解明は、細胞の生存や病態の理解に重要な影響を与える可能性があります。また、脂肪酸輸送・代謝機構の解明は、エネルギー代謝や代謝疾患の研究において新たな視点を提供しています。
これらの研究成果は、将来的には代謝疾患の治療や予防に応用される可能性があり、パルミトイルCoAを含む脂質代謝の研究は、生命科学の多様な分野において重要な役割を果たし続けるでしょう。
- 参考文献・出典
-
[9] kaken.nii.ac.jp/ja/report/KAKENHI-PROJECT-17H03805/17H038052018jisseki/
[10] www.niid.go.jp/niid/ja/from-biochem/3258-2013-02-25-06-40-14.html
[11] www.kyushu-u.ac.jp/f/6081/2015_04_28.pdf
[12] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2018.900125/data/index.html
[13] www.niid.go.jp/niid/ja/from-biochem.html?start=22
[14] agriknowledge.affrc.go.jp/RN/2039014629.pdf
[15] www.nips.ac.jp/public_r/nenpo43.pdf
未来の応用可能性
パルミトイルCoAは、細胞内での脂肪酸代謝において重要な中間体であり、多くの生物学的プロセスに関与しています。将来的な医学および生物学での応用可能性は、以下のような分野で期待されています。
● 代謝疾患の診断と治療
パルミトイルCoAは、特定の代謝疾患のバイオマーカーとしての役割を果たす可能性があります。例えば、カルニチンパルミトイルトランスフェラーゼ(CPT)欠損症は、長鎖脂肪酸の代謝に関与する酵素の異常によって引き起こされる疾患であり、パルミトイルCoAの蓄積が見られます[1][2]。将来的には、パルミトイルCoAのレベルを測定することで、これらの疾患の早期診断や治療効果のモニタリングが可能になるかもしれません。
● 新薬開発
パルミトイルCoAの代謝経路を標的とした新薬の開発が進められています。例えば、第一三共株式会社は、未充足医療ニーズに焦点を当てた新薬開発パイプラインを構築しており、パルミトイルCoAを含む代謝経路が標的の一つとなっている可能性があります[3]。
● 疾患のメカニズム解明
パルミトイルCoAは、細胞内シグナリングや脂質修飾などのプロセスに関与しており、これらのメカニズムの解明に貢献することが期待されています。例えば、S-パルミトイル化は、パルミトイルCoAからシステイン残基へのC16パルミトイル基の追加を介して行われ、タンパク質の局在や機能を調節する重要な修飾です[10]。このような修飾の理解を深めることで、疾患の原因や新たな治療標的の発見につながる可能性があります。
● 栄養学と健康
カルニチンは、パルミトイルCoAをミトコンドリアに輸送し、脂肪酸の酸化を促進する役割を持っています。カルニチン欠乏症は、エネルギー代謝に影響を与えるため、カルニチンの補充による治療が行われています[12]。将来的には、パルミトイルCoAの代謝を改善することで、栄養学的介入や健康維持に役立つ可能性があります。
● 抗がん剤の効果向上
パルミトイルCoAの代謝経路ががん細胞の生存や増殖に関与していることが示唆されており、この経路を標的とした抗がん剤の開発が期待されています。例えば、アボカド由来の成分が抗がん剤の効果を高めることが発見されており、パルミトイルCoAの代謝経路が関与している可能性があります[20]。
● 疾患モデルの開発
パルミトイルCoAの代謝異常を再現する疾患モデルの開発により、疾患の理解を深めることができます。これにより、疾患の病態生理の研究や新たな治療法の開発に貢献することが期待されます。
総じて、パルミトイルCoAは医学および生物学の多様な分野での応用が期待されており、今後の研究によってその可能性がさらに広がることでしょう。
- 参考文献・出典
-
[1] www.med.u-fukui.ac.jp/SHOUNI/MSMSscreening/tebiki120620.pdf
[2] grj.umin.jp/grj/cpt2.htm
[3] www.daiichisankyo.co.jp/rd/pipeline/
[4] patents.google.com/patent/JPH0640820B2/ja
[5] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2023.950072/data/index.html
[6] bsd.neuroinf.jp/wiki/%E3%83%91%E3%83%AB%E3%83%9F%E3%83%88%E3%82%A4%E3%83%AB%E5%8C%96
[7] www.igakuken.or.jp/topics/2022/0710.html
[8] plaza.umin.ac.jp/~s-igaku/DATA/71_03/71_03_02.pdf
[9] www.nanbyou.or.jp/entry/790
[10] www.thermofisher.com/us/en/home/life-science/protein-biology/protein-biology-learning-center/protein-biology-resource-library/pierce-protein-methods/overview-post-translational-modification.html
[11] www.nihonsyouni.jp/baby/about/
[12] www.msdmanuals.com/ja-jp/%E3%83%97%E3%83%AD%E3%83%95%E3%82%A7%E3%83%83%E3%82%B7%E3%83%A7%E3%83%8A%E3%83%AB/09-%E6%A0%84%E9%A4%8A%E9%9A%9C%E5%AE%B3/%E4%BD%8E%E6%A0%84%E9%A4%8A/%E3%82%AB%E3%83%AB%E3%83%8B%E3%83%81%E3%83%B3%E6%AC%A0%E4%B9%8F%E7%97%87
[13] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2015.870298/data/index.html
[14] www.jstage.jst.go.jp/article/nogeikagaku1924/66/1/66_1_49/_pdf/-char/ja
[15] kaken.nii.ac.jp/en/report/KAKENHI-PROJECT-17K19188/17K191882018hokoku/
[16] www.jstage.jst.go.jp/article/vso/91/5.6/91_391_2/_pdf/-char/ja
[17] www.jstage.jst.go.jp/article/plmorphol/30/1/30_5/_pdf
[18] kaken.nii.ac.jp/file/KAKENHI-PROJECT-16K21179/16K21179seika.pdf
[19] mhlw-grants.niph.go.jp/system/files/2004/043031/200400401A/200400401A0003.pdf
[20] www.juntendo.ac.jp/news/02845.html