目次
この記事では、微小管の構造、機能、および細胞内での役割について詳しく解説します。また、最新の研究成果とその科学的な意義にも焦点を当て、微小管が生物学のさまざまな領域でどのように利用されているかを探ります。
第1章: 微小管とは
微小管の定義と基本構造
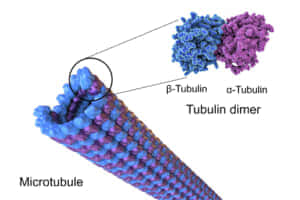
微小管は、細胞内に存在する管状の構造物であり、細胞骨格の一部を形成しています。これらは細胞の形状の維持、細胞分裂、物質輸送、細胞運動など多岐にわたる重要な機能を担っています。微小管は主にチューブリンと呼ばれるタンパク質から構成されており、その直径は約25ナノメートル(nm)です[1][7][17][18].
● 生化学的な構造
微小管の基本構成単位は、α-チューブリンとβ-チューブリンという2種類のタンパク質サブユニットからなるヘテロダイマーです。これらのダイマーが縦方向に連結していき、中空の円筒状の繊維を形成します[1][4]. 微小管は非常に動的な構造物であり、重合と脱重合を繰り返しながら細胞内での役割を果たします。微小管の一端はプラス端と呼ばれ、もう一端はマイナス端と呼ばれており、これらの端は重合速度の違いによって区別されます[4].
● 細胞内での位置づけ
細胞内では、微小管は細胞の中心から周辺部に向かって放射状に配置されており、物質輸送の「線路」として機能します[19]. 細胞分裂時には、微小管は紡錘体を形成し、染色体の正確な分配を助けます[15]. また、細胞の運動に関わる繊毛や鞭毛の内部構造も微小管によって構成されています[16].
微小管は細胞の様々な機能に不可欠であり、その構造とダイナミクスは細胞の生理活動に深く関与しています。特に、細胞の形態形成や染色体分離には、微小管の長さや本数が正確に制御される必要があります[3]. さらに、微小管は細胞内の物質輸送のレールとしても機能し、キネシンやダイニンといった分子モーターが微小管上を荷物を運ぶ際の経路を提供します[4][12].
微小管の構造と機能は、細胞生物学において非常に重要な研究対象であり、その理解は神経変性疾患やがんなどの病態解明にも寄与すると期待されています[3].
- 参考文献・出典
-
[1] bsd.neuroinf.jp/wiki/%E5%BE%AE%E5%B0%8F%E7%AE%A1
[2] www.riken.jp/press/2012/20121213/index.html
[3] www.riken.jp/press/2021/20210208_1/index.html
[4] www.yodosha.co.jp/jikkenigaku/keyword/434.html
[5] www.cosmobio.co.jp/product/detail/cytoskeleton-marker-antibody-pgi.asp?entry_id=34421
[6] www.jstage.jst.go.jp/article/biophys/39/4/39_4_235/_pdf
[7] www.weblio.jp/content/%E5%BE%AE%E5%B0%8F%E7%AE%A1
[8] www.jscb.gr.jp/glossary/category_glossary.php?category=%E5%BE%AE%E5%B0%8F%E7%AE%A1&category_id=5
[9] kotobank.jp/word/%E5%BE%AE%E5%B0%8F%E7%AE%A1-119755
[10] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2021.930867/data/index.html
[11] www.try-it.jp/chapters-10923/sections-10924/lessons-10957/point-2/
[12] numon.pdbj.org/mom/175?l=ja
[13] www.tmd.ac.jp/artsci/biol/textbook/cellmove.htm
[14] www.jstage.jst.go.jp/article/kagakutoseibutsu1962/16/2/16_2_117/_pdf/-char/ja
[15] www.jstage.jst.go.jp/article/kenbikyo/48/2/48_90/_pdf/-char/ja
[16] www.jsps.go.jp/file/storage/general/j-ab/data/list/h29/06/20170777_ichikawa.pdf
[17] ja.wikipedia.org/wiki/%E5%BE%AE%E5%B0%8F%E7%AE%A1
[18] dictionary.goo.ne.jp/word/%E5%BE%AE%E5%B0%8F%E7%AE%A1/
[19] www2.kek.jp/ja/newskek/2004/janfeb/KIF2.html
微小管の生物学的重要性
## 微小管の生物学的重要性
微小管は真核生物の細胞において、細胞骨格の主要な構成要素の一つであり、細胞の形態維持、細胞分裂、細胞内物質輸送、細胞運動など、多岐にわたる基本的な生物学的機能を担っています[1][2][3][4][5][6][7][8][9][10][11][12][13][14][15][16][17][18].
● 細胞分裂における役割
細胞分裂は生命を継承し、維持するために必須の現象です。微小管は細胞分裂時に紡錘体を形成し、染色体を分配して細胞を正しく二分する役割を持ちます[12][15][16][17]. この過程では、微小管は染色体を捕捉し、姉妹染色体を娘細胞に均等に分配するために短縮化することで染色体を運搬します[8][14][15]. この精密な機構が不均等になると、細胞死やがん化、あるいは遺伝的疾患の原因となる可能性があります[8].
● 細胞運動における役割
微小管は細胞運動にも重要な役割を果たします。細胞が動的にその形を変える際には、微小管ネットワークの構築と崩壊が活発に繰り返され、細胞の形や機能を変化させて外部環境の変化に対応します[6]. また、細胞の移動や変形には微小管の再構築が必要であり、これによって細胞は環境に適応し、適切な位置に移動することができます[1][4].
● 物質輸送における役割
微小管は細胞内物質輸送のレールとして機能し、モータータンパク質であるキネシンやダイニンが微小管上を移動することで、ミトコンドリアや小胞などの細胞小器官やタンパク質複合体を運びます[2][5][7][9][10][11][18]. この輸送システムは、細胞の生存に必要な物質を適切な場所に配置するために不可欠であり、神経細胞などでは特に重要です[9][10].
● 細胞の構造維持における役割
微小管は細胞の形態を維持するためにも重要です。細胞の形状や構造を支える細胞骨格として機能し、細胞内の様々な構造体の配置や整理に関与します[3][4][13]. また、細胞の機械的な強度を提供し、細胞が外部からの力に対して適切に反応することを可能にします[5].
● 細胞極性との関連
微小管は細胞極性の形成にも関与しています。細胞極性とは、細胞内で異なる機能を持つ領域が形成されることを指し、微小管はそのような領域の形成に必要な構造的基盤を提供します[13]. これにより、細胞は特定の方向に向かって成長したり、特定の物質を特定の場所に集中させたりすることができます.
微小管は細胞の基本的な機能を支える不可欠な構造であり、そのダイナミクスと調節機構の理解は、細胞生物学および医学研究において重要な意味を持ちます.
- 参考文献・出典
-
[1] www.nict.go.jp/press/2016/07/27-1.html
[2] bsj.or.jp/jpn/general/bsj-review/BSJ-Review_11B_143-149.pdf
[3] www.riken.jp/press/2021/20210208_1/index.html
[4] bsd.neuroinf.jp/wiki/%E5%BE%AE%E5%B0%8F%E7%AE%A1
[5] www.rcast.u-tokyo.ac.jp/ja/news/release/20211014.html
[6] www.riken.jp/press/2012/20121213/index.html
[7] www.yokohama-cu.ac.jp/news/2021/20211014ikeguchi.html
[8] www.lsmb.sci.waseda.ac.jp/news/news-research/20221215/post-673/
[9] scienceportal.jst.go.jp/gateway/clip/20211227_g01/index.html
[10] www.u-tokyo.ac.jp/focus/ja/features/f_00043.html
[11] www.jstage.jst.go.jp/article/tits1996/13/5/13_48/_pdf/-char/ja
[12] www.tmd.ac.jp/artsci/biol/textbook/celldiv.htm
[13] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2021.930867/data/index.html
[14] www.okayama-u.ac.jp/up_load_files/press_r4/press20221222-2.pdf
[15] www.jstage.jst.go.jp/article/kenbikyo/48/2/48_90/_pdf/-char/ja
[16] www.hiroshima-u.ac.jp/ilife/news/52941
[17] www.jstage.jst.go.jp/article/fiber/65/4/65_4_P_114/_pdf
[18] www2.kek.jp/ja/newskek/2004/julaug/KIF1A.html
第2章: 微小管のダイナミクスと調節メカニズム
微小管の動態と伸長メカニズム
微小管は細胞の骨格を構成するタンパク質繊維であり、細胞の形態形成、細胞内物質の輸送、細胞分裂時の染色体の分配など、多くの細胞機能に不可欠な役割を果たしています。微小管の動態は、その伸長、短縮、および安定性によって特徴づけられ、これらのプロセスは複数の分子因子によって精密に制御されています。
● 微小管の伸長
微小管の伸長は、α-チューブリンとβ-チューブリンというタンパク質のヘテロ二量体が重合して行われます。これらの二量体は、GTP(グアノシン三リン酸)を結合した状態で微小管のプラス端に付加され、GTPの加水分解によってGDP(グアノシン二リン酸)結合型のチューブリンに変換されます。GTP結合型のチューブリンは微小管の伸長を促進し、GDP結合型のチューブリンは不安定な状態をもたらし、微小管の短縮を引き起こす可能性があります[17]。
● 微小管の短縮
微小管の短縮は、GTPが加水分解されてGDP型チューブリンへと変換されることによって起こります。この変換により、微小管は繊維の先端から脱重合し、短縮する現象をカタストロフと呼びます[16]。微小管の短縮は、細胞分裂時の染色体の分配や細胞の形態変化に重要な役割を果たします。
● 微小管の安定性
微小管の安定性は、様々な微小管結合タンパク質(MAPs)によって調節されます。MAPsは微小管の重合や安定化活性を持ち、細胞内で微小管は動的不安定性と呼ばれる伸長・短縮運動を繰り返しますが、この動的不安定性を決定する重要な因子がMAPsです[9]。また、アセチル化などの翻訳後修飾も微小管の安定性に影響を与えることが知られています[2]。
● 制御因子とプロセス
微小管の動態は、キネシンやダイニンといった分子モータータンパク質によっても制御されます。これらのタンパク質は微小管上を移動し、微小管の伸長や短縮を調節することができます[16]。また、細胞内のカルシウムイオン濃度の変化も微小管の動態に影響を与えることが示されており、カルシウムイオンが欠乏すると微小管が不安定化し、染色体の整列異常が発生する可能性があります[6]。
さらに、微小管の伸長端に局在化して微小管を安定化するタンパク質群が存在し、これらの伸長端結合タンパク質群は微小管が中心体から染色体上のキネトコアや細胞皮質にたどり着いたとき、目的地のターゲットタンパク質に微小管をつなぐアンカーリングの役割を果たします[9]。
以上のように、微小管の動態は複雑な分子間相互作用によって制御されており、細胞の様々な機能を支える基盤となっています。
- 参考文献・出典
-
[2] www.cosmobio.co.jp/product/detail/cytoskeleton_news_201709.asp?entry_id=33339
[6] www.aist.go.jp/aist_j/press_release/pr2017/pr20170807/pr20170807.html
[9] www.ach.ehime-u.ac.jp/seminar/gist/127.pdf
[16] www.jstage.jst.go.jp/article/biophys/62/1/62_24/_html/-char/ja
[17] bsj.or.jp/jpn/general/bsj-review/0ce9827e5c187f5a4dda9e3a33d7cf7897a2a8b0.pdf
微小管結合タンパク質とその調節機能
微小管は細胞骨格の一部であり、細胞の形態維持、分裂、物質輸送など多岐にわたる機能を担っています。これらの機能は、微小管のダイナミクス、すなわち重合と脱重合のバランスによって調節されており、このプロセスは様々な微小管結合タンパク質(microtubule-associated proteins, MAPs)によって制御されています[2][6][8].
● MAPsの種類と機能
– 古典的MAPs(Classical MAPs): MAP2、tau、MAP4などが含まれ、これらは微小管の安定化に寄与し、細胞の構造を維持する役割を果たします。特にtauタンパク質はアルツハイマー病などの神経変性疾患と関連があります[15][17].
– 分子モーター: キネシンやダイニンといったタンパク質が含まれ、これらはATPを消費して微小管上を動き、細胞内物質輸送に関与します[2][16].
– プラス端結合タンパク質(+TIPs): 微小管のプラス端に結合し、重合を促進するXMAP215や、重合を阻害するCLASPなどがあります[2].
– マイナス端結合タンパク質(-TIPs): γ-チュブリンやnineinなどが含まれ、脱重合を防いだり重合開始点を特定の部位に局在化させる役割を持ちます[2][3].
● 微小管ダイナミクスの調節
微小管のダイナミクスは、細胞の様々な機能に不可欠です。例えば、細胞分裂時には微小管が紡錘体を形成し、染色体を分離するために重要な役割を果たします。また、細胞の移動や形態変化にも微小管のダイナミクスが関与しています[6][8].
MAPsは微小管のダイナミクスを調節することで、これらのプロセスを制御します。例えば、tauやMAP2は微小管を安定化させることで神経細胞の構造を維持し、キネシンやダイニンは微小管を利用して細胞内の物質を運搬します。また、+TIPsや-TIPsは微小管の成長や縮小を調節し、細胞の動的な変化に応じて微小管ネットワークを再構築します[2][6][8].
● 病態との関連
MAPsの機能異常は、神経変性疾患やがんなどの病態に関与していることが知られています。例えば、tauタンパク質の異常なリン酸化はアルツハイマー病の病理に関連しており、MAP4の異常は心筋細胞の形態異常を引き起こし、心不全などの病態につながる可能性があります[12][15][17].
以上のように、微小管結合タンパク質は細胞の構造と機能を維持するために微小管ダイナミクスを調節する重要な役割を担っており、その機能の理解は細胞生物学だけでなく、病態生理学においても重要な意味を持ちます。
- 参考文献・出典
-
[2] bsd.neuroinf.jp/wiki/%E5%BE%AE%E5%B0%8F%E7%AE%A1
[3] www.jscb.gr.jp/glossary/category_glossary.php?category=%E5%BE%AE%E5%B0%8F%E7%AE%A1&category_id=5
[4] humans-in-space.jaxa.jp/kibouser/subject/life/70740.html
[5] numon.pdbj.org/mom/175?l=ja
[6] www.cellsignal.jp/pathways/regulation-of-microtubule-dynamics
[7] www.abcam.co.jp/reagents/unravel-the-tubulin-code-microtubule-dynamics-and-function-1
[8] webview.isho.jp/journal/detail/abs/10.11477/mf.2425201179
[9] kaken.nii.ac.jp/ja/grant/KAKENHI-PROJECT-02454535/
[10] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2021.930867/data/index.html
[11] www.jstage.jst.go.jp/article/kagakutoseibutsu/52/8/52_499/_pdf/-char/ja
[12] www.kobe-u.ac.jp/ja/news/article/2018_10_02_01/
[13] www.kumamoto-u.ac.jp/daigakujouhou/kouhou/pressrelease/2022-file/release220412.pdf
[14] www.bri.niigata-u.ac.jp/docs/20010%20miyasaka.pdf
[15] www.bri.niigata-u.ac.jp/docs/4-10.r2.miyasaka_tomohiro.pdf
[16] www.jstage.jst.go.jp/article/biophys/62/1/62_24/_html/-char/ja
[17] www.bri.niigata-u.ac.jp/docs/r4_20010_miyasaka.pdf
第3章: 微小管と疾患
微小管と関連する疾患の概要
微小管は細胞の骨格を構成するタンパク質の一つで、細胞の形態維持や変化、細胞分裂、細胞内物質輸送、鞭毛や繊毛の運動など多様な細胞機能に重要な役割を果たしています[1]。微小管はαチューブリンとβチューブリンというタンパク質が重合して形成される管状の構造体であり、そのダイナミクス(重合と脱重合の過程)は細胞の機能にとって不可欠です[3]。
微小管の異常は、神経細胞の形成や維持に極めて重要な役割を果たしているため、神経系の発達や形態に異常を来す疾患を引き起こす可能性があります[1][6]。例えば、チュブリン遺伝子の変異は小頭症や滑脳症、多小脳回症などの病気を引き起こすことが報告されています[1]。また、微小管ダイナミクスの制御異常は神経変性疾患の病態解明に関連しており、抗がん剤などの薬剤による微小管の攻撃は末梢神経障害を引き起こすことが知られています[2][9][10]。
特定の疾患と微小管異常の関連については、以下のような例が挙げられます:
– チュブリン遺伝子異常: *TUBA1A*の変異は小頭症や滑脳症を引き起こし、*TUBB2B*の変異は小頭症や多小脳回症を引き起こすことが報告されています[1]。
– 末梢神経障害: 抗がん剤による微小管の攻撃は、末梢神経細胞の軸索に存在する微小管を損傷し、軸索障害を引き起こすことがあります[2]。これにより、手足のしびれや筋力低下などの症状が現れることがあります[9]。
– 神経変性疾患: 微小管の制御異常は、神経変性疾患の病態解明に関連しており、特にアルツハイマー病やパーキンソン病などの疾患において重要な役割を果たしていると考えられています[3][5]。
– 先天性外眼筋繊維症(CFEOM): CFEOM3は、微小管形成の阻害による脳神経の発生異常、特に神経軸索の形成不全が原因と考えられています[6]。
これらの疾患は、微小管の構造や機能の異常によって引き起こされるため、微小管ダイナミクスを制御する分子メカニズムの解明は、これらの疾患の治療法開発に貢献する可能性があります[3][14]。また、微小管関連の疾患は、神経系だけでなく、心不全や癌など他の臓器にも影響を及ぼすことが知られています[5][7]。
- 参考文献・出典
-
[1] bsd.neuroinf.jp/wiki/%E5%BE%AE%E5%B0%8F%E7%AE%A1
[2] survivorship.jp/peripheral_neuropathy/cause/01/index.html
[3] www.riken.jp/press/2021/20210208_1/index.html
[4] www.kpu-m.ac.jp/doc/news/2024/files/35231.pdf
[5] www.kobe-u.ac.jp/ja/news/article/2022_06_28_02/
[6] www.natureasia.com/ja-jp/ncomms/interview/contents/5
[7] www.kobe-u.ac.jp/ja/news/article/2018_10_02_01/
[8] www.jstage.jst.go.jp/article/kagakutoseibutsu/52/8/52_499/_pdf/-char/ja
[9] www.scchr.jp/book/manabi2/manabi-body10/mashoshinkei_shogai_chemo6.html
[10] www.jstage.jst.go.jp/article/naika/96/8/96_1585/_pdf
[11] www.jstage.jst.go.jp/article/joma/122/2/122_2_113/_pdf/-char/ja
[12] plaza.umin.ac.jp/~pmd/guideline11.html
[13] www.ncnp.go.jp/nin/guide/r5/achivement/201111_2.html
[14] chihara-lab.hiroshima-u.ac.jp/research_dynamin/
微小管をターゲットとした治療戦略
微小管は細胞の骨格を構成する重要な要素であり、細胞分裂や物質輸送など多くの細胞内プロセスに関与しています。そのため、微小管を標的とした医薬品の開発は、がん治療をはじめとする多くの疾患治療において重要な戦略となっています。
● 微小管を標的とした抗がん剤の開発
微小管を直接標的とする抗がん剤は、がん細胞の細胞分裂を阻害することで、がんの増殖を抑制します。例えば、パクリタキセルやビンブラスチンなどの微小管阻害剤は、微小管の重合を促進し、細胞分裂時の紡錘体の形成を阻害することで、細胞周期をG2/M期で停止させます[14]。これらの薬剤は、乳がんや卵巣がんなどの治療に広く用いられていますが、静止期細胞の微小管機能を阻害し、重篤な末梢神経障害を生じるなどの副作用が問題となっています[1][2]。
● 新しい作用機構を持つ微小管標的治療薬の開発
微小管を直接標的とするのではなく、微小管重合を制御する因子を標的とする新しいアプローチも研究されています。例えば、TACC3(Transforming acidic coiled-coil 3)は、微小管制御因子であり、様々ながんで発現が亢進していることが報告されています。TACC3を標的とする新規阻害剤、Spindlactone (SPL) の開発に成功し、これはがん細胞の細胞分裂を阻害し、経口投与が可能で、生体内でもがん細胞の抑制効果を示しています[1]。このような新しい作用機構を持つ薬剤の開発は、副作用の問題を克服し、新たな抗がんスペクトラムを持つ可能性があると期待されています。
● 神経変性疾患への応用
微小管の制御異常は、アルツハイマー病やパーキンソン病などの神経変性疾患にも関与しています。微小管ダイナミクス制御の一端を明らかにする研究は、これらの疾患の病態解明や、チューブリンを標的とする抗がん剤の開発に貢献すると期待されています[3]。
● まとめ
微小管を標的とした医薬品の開発は、がん治療だけでなく、神経変性疾患の治療にも応用される可能性を持っています。新しい作用機構を持つ薬剤の開発により、副作用を克服し、より効果的な治療法の提供が期待されています。
第4章: 微小管研究の最前線
最新の研究成果と技術進歩
微小管は細胞の骨格を形成し、細胞の形態維持、分裂、物質輸送など多岐にわたる重要な役割を担っています。最近の研究では、微小管のダイナミクス、構造、機能に関する新たな知見が明らかにされ、生物学の理解を一層深めています。
● 微小管の形成メカニズムの解明
理化学研究所と中央大学の国際共同研究グループは、微小管の形成(核生成)には、初めにタンパク質チューブリンが数個つながった直線状のオリゴマーが作られる必要があることを発見しました[1]。この発見は、微小管ダイナミクス制御の一端を明らかにし、神経変性疾患の病態解明や抗がん剤の開発に貢献すると期待されています。
● 非中心体性微小管ネットワークの形成
神戸大学大学院医学研究科の研究グループは、CAMSAP2タンパク質が非中心体性微小管ネットワークの形成を誘導することを発見しました[2]。CAMSAP2は相分離する性質を利用して内部にチューブリンを取り込み、微小管重合核を形成します。このメカニズムは、細胞極性形成・維持に重要であり、心筋細胞や神経細胞などの機能に影響を与えることが示唆されています。
● 染色体分配における微小管の役割
早稲田大学の研究グループは、染色体分配において微小管を短縮化する因子の発見を報告しました[3]。この因子を利用して人工的に微小管を短縮化することで染色体を運搬可能な分子機械を作製しました。これは、染色体分配の新たな理解につながり、細胞分裂のメカニズム解明に貢献する可能性があります。
● 微小管の進化的起源
東京工業大学の研究チームは、オーディン古細菌からチューブリンタンパク質を発見し、微小管の進化的起源に関する新たな知見を提供しました[4]。オーディンチューブリンは、原核生物のFtsZと真核生物のチューブリンの中間に位置する可能性が示唆され、微小管の進化を解き明かす手がかりとなっています。
● 細胞内の微小管の伸び縮み制御機構
東京大学大学院医学系研究科の研究グループは、微小管の伸び(重合)縮み(脱重合)を制御する仕組みを解明しました[5]。複数のタンパク質リン酸化酵素が微小管を脱重合するタンパク質KIF2の別々の部位を識別してリン酸化し、微小管のダイナミクスを制御することが明らかにされました。
これらの研究成果は、微小管の構造と機能に関する基礎的な理解を深めるとともに、神経変性疾患やがんなどの疾患治療への応用に向けた新たな可能性を開いています。
未来の研究方向性と期待される成果
微小管は細胞の骨格を構成するタンパク質であり、細胞の形態維持、物質輸送、細胞分裂など多岐にわたる生命現象に関与しています。近年の研究により、微小管のダイナミクスや微小管結合タンパク質の機能に関する理解が深まってきましたが、まだ解明されていないメカニズムも多く存在します。未来の研究方向性としては、以下のような分野が挙げられます。
● 微小管のダイナミクスと調節機構の解明
微小管のポリマー化とデポリマー化のダイナミクスは、細胞の形態変化や分裂において重要な役割を果たしています。微小管の成長と短縮を制御する分子機構の詳細な解明は、細胞生物学の基本的な問題解決につながります。また、微小管のダイナミクスを調節するタンパク質や小分子の同定とその作用機序の解明は、新たな治療薬の開発に貢献する可能性があります。
● 微小管と細胞極性の関係
微小管は細胞内物質輸送において重要な役割を担っており、細胞極性の形成と維持にも関与しています。微小管と細胞極性の関係を明らかにすることで、神経細胞の成長や癌細胞の浸潤・転移など、細胞極性が関与する病態の理解が深まることが期待されます。
● 微小管標的治療薬の開発
微小管はがん細胞の増殖や分裂に不可欠であるため、微小管を標的とした抗がん剤が多数開発されています。しかし、副作用の問題や耐性の発生が課題となっています。微小管の新たな標的部位の同定や、微小管ダイナミクスをより精密に調節する新規化合物の開発は、がん治療の新たな選択肢を提供することが期待されます。
● 植物細胞における微小管の研究
植物細胞における微小管は、細胞壁の合成や細胞の極性伸長に重要な役割を果たしています。微小管の機能や調節機構の植物細胞特有の側面を解明することで、作物の耐病性や耐乾性の向上など、農業生産性の向上に貢献する可能性があります。
これらの研究方向性は、微小管の基本的な生物学的理解を深めるだけでなく、がんや神経疾患、植物の生育制御など、幅広い応用につながる潜在的な科学的、医学的利益を持っています。微小管研究の進展は、生命科学の多くの分野に影響を与え、新たな治療法や農業技術の開発に貢献することが期待されます。






