目次
この記事では、タンパク質やペプチドのC末端(カルボキシル末端)に焦点を当て、その生化学的な意義と役割を解説します。C末端は、タンパク質やペプチドが合成される過程で形成される末端であり、多くの生物学的機能や細胞内プロセスにおいて重要な役割を果たします。この記事を通じて、C末端の基本構造、機能、およびタンパク質合成やポリメラーゼの活性におけるその役割について深く掘り下げます。
第1章 タンパク質のC末端とは
C末端の基礎知識
● C末端の定義とその特徴
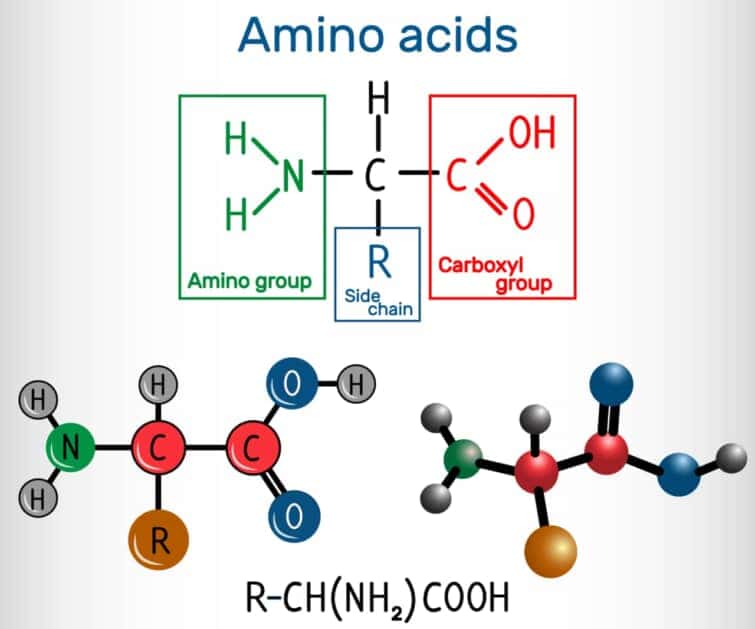
C末端とは、タンパク質やポリペプチドの一端に存在する遊離のカルボキシル基(-COOH)を持つ末端のことを指します。タンパク質やポリペプチドは、多数のアミノ酸がペプチド結合によって直鎖状につながったものであり、その一方の末端がアミノ基(-NH2)で終わるN末端であり、もう一方がカルボキシル基で終わるC末端です。
タンパク質の合成は、N末端からC末端に向かって行われ、アミノ酸がペプチド結合を形成しながら連結されていきます。この過程では、アミノ酸のカルボキシル基と次のアミノ酸のアミノ基が脱水縮合反応を起こし、ペプチド結合が形成されます。その結果、ポリペプチド鎖の最後のアミノ酸は他のどの構成アミノ酸のアミノ基とも結合せず、遊離状態のカルボキシル基を持つC末端が形成されます。
C末端、またはカルボキシル末端は、タンパク質やポリペプチドにおいて、フリーなカルボキシル基(-COOH)で終端している側の末端を指します。タンパク質やポリペプチドの配列を記述する際には、C末端を右側に置いて、N末端から記述するのが一般的な慣例です[6][12]。C末端は、タンパク質の生合成や機能において重要な役割を果たします。たとえば、タンパク質の立体構造や機能の決定に影響を与えることがあります。
● タンパク質合成におけるC末端の形成
タンパク質の合成は、アミノ酸がペプチド結合を形成することによって行われます。この過程は、N末端からC末端へ向かって進行します。具体的には、アミノ酸のアミノ基(-NH2)と別のアミノ酸のカルボキシル基(-COOH)が反応し、水分子が除去される脱水縮合反応によってペプチド結合が形成されます。この反応が連続して行われることで、ポリペプチド鎖が伸長し、最終的にタンパク質が合成されます[8][10]。
タンパク質の合成は、細胞内での遺伝子発現の過程の一部として行われます。mRNAの塩基配列がリボソームによって読み取られ、それに対応するアミノ酸がtRNAによって運ばれ、連結されていきます。この過程では、最初に運ばれたアミノ酸のアミノ基がタンパク質のN末端を形成し、最後に運ばれたアミノ酸のカルボキシル基がC末端を形成します[9]。
C末端の形成は、タンパク質の生合成の最終段階を示します。タンパク質が合成されると、その後、折りたたみや修飾などのプロセスを経て、最終的にその機能を果たす立体構造になります。C末端は、タンパク質の機能や相互作用において特定の役割を持つことがあり、例えば、特定のタンパク質間の結合や細胞内での局在に影響を与えることがあります[6][12]。
- 参考文献・出典
-
[1] www.us-yakuzo.jp/media/20230117-153516-559.pdf
[2] kotobank.jp/word/%E3%82%AB%E3%83%AB%E3%83%9C%E3%82%AD%E3%82%B7%E3%83%AB%E6%9C%AB%E7%AB%AF-670815
[3] www.tmd.ac.jp/artsci/biol/pdf3/Chapt9.pdf
[4] www.thermofisher.com/us/en/home/life-science/protein-biology/protein-biology-learning-center/protein-biology-resource-library/pierce-protein-methods/peptide-design.html
[5] www.jst.go.jp/pr/report/report40/details.html
[6] www.weblio.jp/content/C%E6%9C%AB%E7%AB%AF
[7] www.thermofisher.com/us/en/home/life-science/protein-biology/protein-biology-learning-center/protein-biology-resource-library/pierce-protein-methods/peptide-synthesis.html
[8] www.try-it.jp/chapters-15090/sections-15091/lessons-15128/point-2/
[9] www.try-it.jp/chapters-15090/sections-15091/lessons-15128/practice-3/
[10] www.labxchange.org/library/items/lb:LabXchange:b4cabe96:html:1
[11] ja.wikipedia.org/wiki/C%E6%9C%AB%E7%AB%AF
[12] kotobank.jp/word/C%E6%9C%AB%E7%AB%AF-671536
[13] www.spring8.or.jp/pdf/ja/SP8_news/no5_2k/plus-body.pdf
C末端の生化学的重要性
タンパク質のC末端は、その生物学的機能と構造において重要な役割を果たします。C末端はタンパク質の一次構造の末尾に位置し、タンパク質の安定性、局在、活性、および相互作用に影響を与えることが知られています。
● C末端の生化学的重要性
1. タンパク質の安定性と折りたたみ
– タンパク質のC末端は、タンパク質の折りたたみや安定性に影響を与えることがあります。特定のC末端配列は、タンパク質の正しい折りたたみを促進し、その機能的な立体構造を維持するのに役立ちます[4]。
2. 細胞内局在の決定
– タンパク質のC末端に存在する特定のシグナル配列は、そのタンパク質が細胞内の特定の場所に送られることを決定します。例えば、C末端にあるKDEL配列は、タンパク質が小胞体に留まることを指示します[2]。
3. タンパク質の活性調節
– C末端は、タンパク質の活性を調節する役割も果たします。例えば、特定の酵素のC末端には、その活性を調節するための調節ドメインが存在することがあります[4]。
4. タンパク質間相互作用の調節
– タンパク質のC末端は、他のタンパク質や分子との相互作用に関与することがあります。これにより、シグナル伝達経路や細胞内プロセスの調節に重要な役割を果たします[4]。
5. 翻訳後修飾
– C末端は、翻訳後修飾の標的となることがあります。例えば、C末端に付加されるリポイド修飾は、タンパク質の細胞膜への結合や細胞内局在を変更することがあります[2][12]。
● 生物学的意義
タンパク質のC末端は、その機能と細胞内での役割を決定する上で重要です。C末端の配列や構造が変化することで、タンパク質の活性が調節されたり、異常な細胞内局在が引き起こされたりすることがあります。このような変化は、疾患の発生に関連することがあり、C末端は疾患の診断や治療の標的としての可能性を持ちます。
タンパク質のC末端は、その生物学的機能を理解する上で不可欠な要素であり、タンパク質の構造と機能の研究において重要な焦点となっています。
- 参考文献・出典
-
[1] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2018.900781/data/index.html
[2] www2.huhs.ac.jp/~h990002t/resources/downloard/14/14biochem1/2014aminoacid_protein.pdf
[3] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2020.920695/data/index.html
[4] cjb.ijournals.cn/cjbcn/article/pdf/gc14071083
[5] www.ncbi.nlm.nih.gov/pmc/articles/PMC9274849/
[6] www.abace-biology.com/Protein-N-end-C-end-sequencing.htm
[7] citeseerx.ist.psu.edu/document?doi=69614ff9bba0913b09ac2f060d424abff47ed328&repid=rep1&type=pdf
[8] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2015.870194/data/index.html
[9] www.jstage.jst.go.jp/article/jsnfs/64/4/64_4_221/_pdf
[10] www.thermofisher.com/us/en/home/life-science/protein-biology/protein-biology-learning-center/protein-biology-resource-library/pierce-protein-methods/overview-crosslinking-protein-modification.html
[11] www.jst.go.jp/pr/report/report40/details.html
[12] www.thermofisher.com/us/en/home/life-science/protein-biology/protein-biology-learning-center/protein-biology-resource-library/pierce-protein-methods/overview-post-translational-modification.html
[13] ruo.mbl.co.jp/bio/support/method/antibody-structure.html
[14] www.spring8.or.jp/pdf/ja/SP8_news/no5_2k/plus-body.pdf
[15] www.jstage.jst.go.jp/article/kagakutoseibutsu1962/44/10/44_10_663/_pdf/-char/ja
[16] www.sigmaaldrich.com/HK/zh/technical-documents/technical-article/protein-biology/protein-labeling-and-modification/peptide-modifications-n-terminal-internal-and-c-terminal
[17] www.jikei.ac.jp/mb/Antizyme.html
[18] zh.wikipedia.org/zh-cn/%E8%9B%8B%E7%99%BD%E8%B4%A8%E7%BB%93%E6%9E%84
[19] www.labxchange.org/library/items/lb:LabXchange:b4cabe96:html:1
[20] www.pibb.ac.cn/pibbcn/article/html/20100253?st=article_issue
第2章 C末端の機能と役割
タンパク質の構造におけるC末端の影響
● タンパク質の折りたたみと安定性
タンパク質の折りたたみ(フォールディング)は、直鎖状のポリペプチドが特定の三次元構造に自己組織化する過程であり、この構造がタンパク質の機能を決定する[16][18]. タンパク質の安定性は、その内部の疎水性アミノ酸残基の側鎖がジグソーパズルのように密にパッキングされることによってもたらされる[18]. 疎水性効果は、水性媒体において大きな疎水性領域を含む両親媒性分子が存在する場合に熱力学的な推進力となり、折りたたみ後のタンパク質の安定性に大きく貢献する[14].
● 機能的ドメインとしてのC末端
タンパク質のC末端は、特定の機能を持つドメインとして重要な役割を果たすことがある. 例えば、RNAポリメラーゼIIのC末端ドメインは、Tyr-Ser-Pro-Thr-Ser-Pro-Ser配列の52回の繰り返しで構成され、しばしばポリメラーゼを活性化するタンパク質が結合する[12]. また、GRIPドメインは、酵母と哺乳類のゴルジ体タンパク質の一群に存在する保存されたC末端ドメインとして同定されており、C1ドメインは約50アミノ酸残基長で、タンパク質の膜へのリクルートに関与する[13][15].
C末端の配列は、タンパク質の寿命を規定することが知られており、N末端則と同様にC末端則が存在する[19]. これは、特定のE3ユビキチンリガーゼがC末端の特定の配列を認識してユビキチン化し、プロテアソームによる分解を導くためである[11]. さらに、タンパク質のC末端には非酵素的な翻訳後修飾が起こることがあり、これにはアスパラギン残基の脱アミド化やC末端側主鎖のペプチド結合切断反応などが含まれる[20].
研究によると、疎水性パッキングがゆるいタンパク質でも折りたたみ能を示し、超安定な人工タンパク質が設計されることがある[18]. これは、タンパク質の折りたたみと安定性が単純な疎水性パッキングだけでなく、他の相互作用や熱力学的特性によっても影響を受けることを示している.
総合すると、タンパク質のC末端は折りたたみと安定性に影響を与えるだけでなく、特定の機能的ドメインとしても重要であり、タンパク質の寿命や機能に直接的な影響を与える可能性がある.
- 参考文献・出典
-
[1] holdings.panasonic/jp/corporate/technology/technology-journal/pdf/v5803/p0207.pdf
[2] www.jstage.jst.go.jp/article/jscta/48/2/48_72/_pdf
[3] first.lifesciencedb.jp/18858
[4] patents.google.com/patent/JP2010532764A/ja
[5] www10.showa-u.ac.jp/~biolchem/H21-P2protein.pdf
[6] www.jove.com/science-education/10679/protein-folding-hydrogen-bonds-van-der-waals-interactions-disulphide?language=Japanese
[7] www.jstage.jst.go.jp/article/biophys/60/6/60_325/_pdf
[8] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2015.870194/data/index.html
[9] cs2.toray.co.jp/news/trc/news_rd01.nsf/0/8D347190724272D149257D5E00319521
[10] www.ptglab.co.jp/news/blog/protein-tags-advantages-and-disadvantages/
[11] math-signal.com/threads/view/49
[12] ja.wikipedia.org/wiki/C%E6%9C%AB%E7%AB%AF
[13] www.cellsignal.jp/learn-and-support/protein-domains-and-interactions/grip-protein-domain
[14] ja.wikipedia.org/wiki/%E3%83%95%E3%82%A9%E3%83%BC%E3%83%AB%E3%83%87%E3%82%A3%E3%83%B3%E3%82%B0
[15] www.cellsignal.jp/learn-and-support/protein-domains-and-interactions/c1-protein-domain
[16] minerva-clinic.or.jp/academic/terminololgyofmedicalgenetics/hagyou/protein-folding/
[17] www.labxchange.org/library/items/lb:LabXchange:b4cabe96:html:1
[18] www.amed.go.jp/news/release_20201124-01.html
[19] www.proteinlifetime.jp/message/
[20] www.jstage.jst.go.jp/article/cataract/34/1/34_34-019/_pdf/-char/ja
C末端による生物学的プロセスの調節
タンパク質のC末端は、生物学的プロセスの調節において重要な役割を果たします。C末端とは、タンパク質のアミノ酸配列の一端を指し、タンパク質の機能や活性、安定性、局在性などに影響を与えることが知られています。
● タンパク質間相互作用とC末端
タンパク質間相互作用(PPI)は、生体内でのシグナル伝達、細胞の成長、分化、死などの生物学的プロセスを制御する基本的なメカニズムです。C末端は、特定のタンパク質間相互作用を介してこれらのプロセスに関与することがあります。例えば、C末端に特定の配列や構造モチーフが存在することで、他のタンパク質との結合部位として機能し、シグナル伝達経路の活性化や抑制に寄与することがあります[9]。
● シグナル伝達とC末端の関与
シグナル伝達において、C末端は複数の役割を担います。一つの例として、C末端がリン酸化されることによって、タンパク質の活性が調節される場合があります。リン酸化は、細胞内のシグナル伝達において重要な修飾であり、C末端のリン酸化はタンパク質の機能を変化させることができます[7]。また、C末端に存在する特定のシグナル配列は、タンパク質の細胞内での局在を決定することがあり、これによってシグナル伝達経路の効率や特異性が影響を受けることがあります。
さらに、C末端はタンパク質の安定性にも影響を与えることがあります。例えば、C末端にユビキチン化の標的となるリジン残基が存在する場合、タンパク質はユビキチン-プロテアソーム系によって分解されることがあります。このプロセスは、シグナル伝達経路のダウンレギュレーションに寄与することがあります[4]。
● 結論
タンパク質のC末端は、タンパク質間相互作用やシグナル伝達において多様な機能を持ち、生物学的プロセスの精密な調節に寄与しています。C末端の配列や構造、化学的修飾は、タンパク質の活性、安定性、細胞内局在などを決定し、細胞の機能や生存に重要な影響を与えます。したがって、C末端の研究は、生命科学や医学研究において重要な意味を持ちます。
- 参考文献・出典
-
[1] www.amed.go.jp/news/seika/kenkyu/20220127-01.html
[2] www.riken.jp/press/2021/20211213_1/index.html
[3] www2.huhs.ac.jp/~h990002t/resources/downloard/14/14biochem2/03signaling14_2.pdf
[4] www.cosmobio.co.jp/product/detail/ubiquitin-protein-and-derivative-enz.asp?entry_id=18268
[5] www.jstage.jst.go.jp/article/fpj/134/5/134_5_254/_pdf
[6] bio.nikkeibp.co.jp/atcl/column/16/052700070/013000016/
[7] www.jstage.jst.go.jp/article/jscc1971b/33/3-4/33_163/_pdf/-char/ja
[8] www.jstage.jst.go.jp/article/jcrsj/64/4/64_269/_pdf
[9] www.jstage.jst.go.jp/article/faruawpsj/50/11/50_1101/_pdf
[10] www.hoku-iryo-u.ac.jp/~onishi/18-3.pdf
[11] www.thermofisher.com/blog/learning-at-the-bench/crosslinking-protein-interaction-analysis/
[12] www.thermofisher.com/blog/learning-at-the-bench/cancer9/
[13] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2018.900147/data/index.html
[14] www.med.kobe-u.ac.jp/tougou/signal/Research.html
[15] www.jstage.jst.go.jp/article/sicejl1962/18/12/18_12_1001/_pdf
[16] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2020.920420/data/index.html
[17] www.thermofisher.com/us/en/home/life-science/protein-biology/protein-biology-learning-center/protein-biology-resource-library/pierce-protein-methods/overview-crosslinking-protein-modification.html
[18] www.thermofisher.com/us/en/home/life-science/protein-biology/protein-biology-learning-center/protein-biology-resource-library/pierce-protein-methods/overview-post-translational-modification.html
[19] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2017.890273/data/index.html
[20] www.labxchange.org/library/items/lb:LabXchange:b4cabe96:html:1
第3章 C末端の修飾と生物学的影響
C末端の化学的修飾
C末端の化学的修飾とポストトランスレーショナル修飾:
ポストトランスレーショナル修飾(翻訳語修飾)(PTM)は、タンパク質が翻訳された後に起こる化学的修飾であり、タンパク質の機能、活性、安定性、局在性などを調節する重要な役割を果たします。これらの修飾は、タンパク質のアミノ末端(N末端)、カルボキシル末端(C末端)、側鎖など、様々な部位で起こり得ます。特に、C末端の修飾は、タンパク質の生理活性に直接影響を及ぼすことが多く、研究の対象となっています。
● C末端アミド化
C末端アミド化は、生理活性ペプチドに特徴的なポストトランスレーショナル修飾の一つで、生理活性ペプチドの半数にこの修飾が認められます。この修飾は、ペプチジルグリシンα-アミド化モノオキシゲナーゼによって触媒され、C末端のカルボキシル基がアミド基に変換されます。アミド化されたC末端は、タンパク質の安定性を高め、プロテアーゼによる分解を防ぐことで、生理活性を維持する効果があります[12]。
● C末端のその他の修飾
C末端の修飾には、アミド化以外にも様々な種類が存在します。例えば、C末端に特定の小分子やタンパク質を共有結合的に結合させることで、タンパク質の機能を調節することができます。これには、リポイル化、プレニル化、グリコシルホスファチジルイノシトール(GPI)アンカーの付加などが含まれます。これらの修飾は、タンパク質の細胞膜への局在や細胞内でのシグナル伝達の調節に関与しています[16]。
● 修飾によるタンパク質活性の調節
C末端の修飾は、タンパク質の活性を直接的に調節することができます。例えば、特定の修飾がタンパク質の活性部位近くに導入されることで、そのタンパク質の基質特異性や酵素活性が変化することがあります。また、C末端の修飾がタンパク質間相互作用の調節に関与することもあり、シグナル伝達経路における重要な調節機構となっています。
● 結論
C末端のポストトランスレーショナル修飾は、タンパク質の機能と活性を調節する重要な機構です。これらの修飾は、タンパク質の安定性、局在性、相互作用、および生理活性に影響を及ぼし、細胞内での正確な機能を保証するために不可欠です。C末端修飾の詳細な理解は、タンパク質の機能解析や疾患治療への応用において重要な意味を持ちます。
- 参考文献・出典
-
[1] patents.google.com/patent/WO2007046559A1/ja
[2] sci-tech.ksc.kwansei.ac.jp/~tanaka/old/SUMO.pdf
[3] www.jstage.jst.go.jp/article/fpj/124/4/124_4_235/_pdf
[4] www.jstage.jst.go.jp/article/jpros/2/1/2_17/_pdf/-char/ja
[5] www.funakoshi.co.jp/contents/67960
[6] www.jstage.jst.go.jp/article/fpj/130/5/130_5_373/_pdf
[7] www.cosmobio.co.jp/product/detail/enz-20121115.asp?entry_id=10211
[8] www.thermofisher.com/us/en/home/life-science/protein-biology/protein-biology-learning-center/protein-biology-resource-library/pierce-protein-methods/overview-crosslinking-protein-modification.html
[9] ruo.mbl.co.jp/bio/product/epigenome/article/histone-modification.html
[10] www.thermofisher.com/us/en/home/life-science/protein-biology/protein-biology-learning-center/protein-biology-resource-library/pierce-protein-methods/overview-post-translational-modification.html
[11] www.preppers.co.jp/columns/ms-protein
[12] webview.isho.jp/journal/detail/abs/10.11477/mf.2425200900
[13] www.jstage.jst.go.jp/article/fpj/124/4/124_4_235/_article/-char/ja/
[14] www.jstage.jst.go.jp/article/cataract/34/1/34_34-019/_pdf/-char/ja
[15] www.thermofisher.com/jp/ja/home/industrial/mass-spectrometry/proteomics-protein-mass-spectrometry/proteomics-protein-mass-spectrometry-workflows/post-translational-modification-ptm.html
[16] ja.wikipedia.org/wiki/%E7%BF%BB%E8%A8%B3%E5%BE%8C%E4%BF%AE%E9%A3%BE
[17] www.nedo.go.jp/content/100753475.pdf
[18] www.biologica.co.jp/products-service/custom-synthesis/peptide/c-terminus-modification/
[19] www.genscript.jp/peptide_modification.html
C末端修飾の例とその機能
C末端修飾はタンパク質の機能、安定性、局在などに重要な役割を果たします。以下にいくつかのC末端修飾の例とその機能について説明します。
● プレニル化
プレニル化は、C末端近くのシステイン残基にファルネシルまたはゲラニルゲラニルイソプレノイド膜アンカーが付加される修飾です。この修飾によりタンパク質は細胞膜に結合し、膜結合型のGタンパク質などがこの方法で修飾されます[4]。
● GPIアンカー
グリコシルホスファチジルイノシトール(GPI)アンカーは、C末端のプロペプチドがプロテアーゼにより切断された後に結合する修飾です。この修飾によりタンパク質は細胞膜に固定され、プリオンなどがこの修飾型を持ちます[4][19]。
● アミド化
C末端アミド化は、タンパク質のC末端カルボキシル基がアミド基(-NH2)に変換される修飾で、生理活性ペプチドに特徴的です。この修飾はペプチドの安定性を高め、生物活性を保持するのに寄与します[16]。
● リン酸化
リン酸化は、タンパク質のセリン、トレオニン、チロシン残基にリン酸基が付加される修飾です。C末端近くで起こるリン酸化は、タンパク質の活性調節、シグナル伝達、細胞周期制御などに関与します[8]。
● 糖化
糖化は、タンパク質に糖鎖が結合する修飾で、N-結合型糖鎖修飾やO-結合型糖鎖修飾があります。C末端近くでの糖化は、タンパク質の安定化、水溶性の向上、細胞の接着、抗原抗体反応などに関与します[2][10]。
これらの修飾は、タンパク質の機能に直接影響を及ぼし、細胞内での正しい局在や活性の調節に不可欠です。また、修飾の異常は病態の原因となることがあり、疾患の診断や治療の標的としても重要です。
- 参考文献・出典
-
[1] patents.google.com/patent/JP2014526884A/ja
[2] www2.huhs.ac.jp/~h990002t/resources/downloard/14/14biochem1/2014aminoacid_protein.pdf
[3] www.jstage.jst.go.jp/article/seibutsukogaku/100/6/100_100.6_306/_pdf
[4] www.weblio.jp/content/C%E6%9C%AB%E7%AB%AF%E4%BF%AE%E9%A3%BE
[5] patents.google.com/patent/WO2007046559A1/ja
[6] www.abcam.co.jp/neuroscience/beta-amyloid-and-tau-in-alzheimers-disease
[7] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2019.910659/data/index.html
[8] www.jstage.jst.go.jp/article/thermalmed/36/1/36_1/_pdf
[9] cs2.toray.co.jp/news/trc/news_rd01.nsf/0/8D347190724272D149257D5E00319521
[10] www.thermofisher.com/us/en/home/life-science/protein-biology/protein-biology-learning-center/protein-biology-resource-library/pierce-protein-methods/protein-glycosylation.html
[11] www.mcp-kyoto-u.jp/research/ubiquitin-about/
[12] ruo.mbl.co.jp/bio/product/epigenome/article/histone-modification.html
[13] www.thermofisher.com/us/en/home/life-science/protein-biology/protein-biology-learning-center/protein-biology-resource-library/pierce-protein-methods/overview-crosslinking-protein-modification.html
[14] www.biologica.co.jp/products-service/custom-synthesis/peptide/c-terminus-modification/
[15] www.thermofisher.com/us/en/home/life-science/protein-biology/protein-biology-learning-center/protein-biology-resource-library/pierce-protein-methods/overview-post-translational-modification.html
[16] webview.isho.jp/journal/detail/abs/10.11477/mf.2425200900
[17] bibgraph.hpcr.jp/abst/pubmed/37935692
[18] ja.teknopedia.teknokrat.ac.id/wiki/C%E6%9C%AB%E7%AB%AF
[19] ja.wikipedia.org/wiki/C%E6%9C%AB%E7%AB%AF
[20] www.thermofisher.com/jp/ja/home/life-science/protein-biology/peptides-proteins/custom-peptide-synthesis-services/standard-peptide-custom-synthesis-service/custom-peptide-modifications-selection-guide.html
第4章 C末端と疾患
C末端の異常と関連疾患
C末端の異常は、タンパク質の構造や機能に影響を与え、多様な疾患を引き起こす可能性があります。C末端はタンパク質の末端部分であり、タンパク質の安定性、局在、相互作用などに重要な役割を果たしています。以下に、C末端の異常が関与する疾患の例と、それらの疾患メカニズムとC末端の関係について説明します。
● CDC42-C末端異常症
CDC42-C末端異常症は、CDC42遺伝子のC末端突然変異によって引き起こされる自己炎症性疾患です。この疾患は、発熱、皮膚炎、関節炎などの症状が認められ、リウマチや膠原病に類似しています。病態の原因は、パイリンインフラマソームの過剰形成にあり、これにより炎症を惹起する物質が放出されます[15][14][12]。パイリンインフラマソームは、体内に侵入した特定の病原体や毒素を感知するセンサーのような働きをするタンパク質であり、炎症反応に関連するインフラマソームという巨大なタンパク質複合体を形成します
。インフラマソームは、細胞内に存在するタンパク質複合体で、病原体由来の菌体成分やストレス分子によって活性化され、炎症性サイトカインであるインターロイキン(IL)-1βの産生を誘導する役割を持っています。パイリンはMEFV(familial Mediterranean fever gene)遺伝子から作られており、この遺伝子に異常があると、パイリンの働きが過剰に活性化してしまい、家族性地中海熱を含めたパイリン関連自己炎症疾患という病気を引き起こすことがあります。家族性地中海熱は国内では指定難病の一つで、発作性の発熱や腹痛、胸痛、関節炎、皮疹などが認められる疾患です。研究により、パイリンインフラマソームの活性化メカニズムの解明とその制御法の開発が進められています。また、ゴルジ体への異常蓄積がパイリンインフラマソーム形成を過剰促進することが示されており、この発見は未解明の部分が多いパイリンインフラマソーム形成過程の全容解明へ新たな視点を提供し、新規治療法開発への足掛かりになることが期待されています。
● ジストロフィン異常症
ジストロフィン異常症は、Duchenne型筋ジストロフィーやBecker型筋ジストロフィーなど、X連鎖性筋疾患の一群を指します。ジストロフィンタンパク質のC末端に異常がある場合、筋細胞の膜の構造と機能が損なわれ、筋力低下や心筋症を引き起こします[5]。
● 悪性リンパ腫
悪性リンパ腫においては、ゲノム異常が疾患の原因となることがあります。特定の遺伝子のC末端に変異が生じることで、タンパク質の機能が失われ、細胞の異常増殖を引き起こす可能性があります[4]。
● クロイツフェルト・ヤコブ病
クロイツフェルト・ヤコブ病(CJD)は、異常プリオン蛋白の蓄積によって引き起こされる神経変性疾患です。プリオン蛋白のC末端に異常が生じると、正常なプリオン蛋白が異常構造に変換され、凝集体が形成されることで神経細胞が死滅します[3]。
● シャルコー・マリー・トゥース病
シャルコー・マリー・トゥース病(CMT)は、末梢神経障害による筋力低下や感覚低下を引き起こす遺伝性疾患です。特定の遺伝子のC末端に変異がある場合、神経細胞の機能が障害され、症状が現れます[6]。
● アルツハイマー病
アルツハイマー病では、アミロイド前駆体タンパク質(APP)の異常な切断が問題となります。APPのC末端断片が異常に蓄積することで、アミロイドβプラークが形成され、神経細胞の機能障害や死滅を引き起こします[7]。
● 副甲状腺ホルモン関連蛋白-C末端異常
副甲状腺ホルモン関連蛋白(PTHrP)のC末端に異常がある場合、高カルシウム血症を引き起こす可能性があります。PTHrPの分泌亢進が高カルシウム血症の原因となることが知られています[8]。
● 筋萎縮性側索硬化症(ALS)
TDP-43プロテイノパチーは、筋萎縮性側索硬化症(ALS)の病態に関与しています。TDP-43のC末端にプリオン様ドメインがあり、異常な凝集を引き起こすことで、神経細胞の機能障害や死滅が起こります[1]。
これらの疾患において、C末端の異常はタンパク質の機能を直接的に変化させることで病態を引き起こすことが多いです。タンパク質のC末端は、タンパク質の正しい折りたたみ、局在、相互作用に重要であり、これらのプロセスが妨げられると、細胞の正常な機能が損なわれ、疾患が発症することになります。
- 参考文献・出典
-
[1] www.jstage.jst.go.jp/article/jsnt/34/2/34_72/_pdf/-char/ja
[2] primary-care.sysmex.co.jp/sp/speed-search/index.cgi?c=speed_search-2&pk=614
[3] www.niid.go.jp/niid/ja/kansennohanashi/397-cjd-intro.html
[4] www.jst.go.jp/pr/announce/20090504/index.html
[5] grj.umin.jp/grj/dbmd.htm
[6] www.nanbyou.or.jp/entry/3773
[7] www.thermofisher.com/blog/learning-at-the-bench/neuro_disease2/
[8] www.okayama-u.ac.jp/user/kensa/kensa/koujou/pthrp.htm
[9] www.med.kobe-u.ac.jp/tougou/signal/Research.html
[10] www.tohoku.ac.jp/japanese/newimg/pressimg/tohokuuniv-press20220428_03web_cdc42.pdf
[11] www.jst.go.jp/pr/announce/20170505/index.html
[12] www.tohoku.ac.jp/japanese/2022/05/press20220502-01-cdc42.html
[13] bibgraph.hpcr.jp/abst/pubmed/28729032?click_by=rel_abst
[14] www.kyoto-u.ac.jp/ja/research-news/2022-05-02-0
[15] www.qlifepro.com/news/20220506/cdc42-c-terminal-variants.html
[16] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2021.930494/data/index.html
C末端を標的とした治療法
C末端、すなわちタンパク質のカルボキシル末端は、タンパク質の構造と機能において重要な役割を果たします。C末端はタンパク質の安定性、局在、および活性に影響を与えることが知られており、これを標的とした治療法の開発が進められています。
● C末端を標的とした医薬品開発
C末端を標的とした医薬品開発には、特定の疾患に関連するタンパク質のC末端領域に作用することで、そのタンパク質の機能を調節し、疾患の治療を目指すアプローチが含まれます。例えば、細胞不死化酵素であるテロメラーゼのC末端に新しいがん化機能があることが明らかにされ、テロメラーゼの新たな機能を標的にしたがん治療に対する薬剤の開発が期待されています[10]。また、内在性TDP-43 C末領域の部分欠損マウスを作成し、Q/Nリッチ領域がTDP-43の安定性に重要なことを発見した研究があります[12]。これらの研究は、C末端を標的とした治療法の開発において重要な示唆を与えています。
● 治療におけるC末端の役割
C末端は、タンパク質の機能を調節する上で重要な役割を果たします。例えば、タンパク質のC末端に存在する特定のシグナル配列は、そのタンパク質が細胞内でどのように局在するかを決定することがあります。また、C末端の特定のアミノ酸配列は、タンパク質間の相互作用や活性化に関与することがあります。このように、C末端を標的とすることで、タンパク質の機能を特異的に調節し、疾患の治療に寄与する可能性があります。
● まとめ
C末端を標的とした治療法の開発は、タンパク質の機能を理解し、特異的に調節することを目指しています。がんや神経変性疾患など、様々な疾患に関連するタンパク質のC末端領域に着目することで、新たな治療法の開発が期待されています。C末端を標的とした医薬品開発は、疾患の治療において重要な役割を果たす可能性があります。
- 参考文献・出典
-
[1] www.nihs.go.jp/mtgt/pdf/2019-PharmaTechJapan,35,2533-45.pdf
[2] www.amed.go.jp/news/seika/kenkyu/20220127-01.html
[3] www.jstage.jst.go.jp/article/dds/35/3/35_170/_pdf
[4] www.meti.go.jp/policy/tech_evaluation/e00/03/r03/595.pdf
[5] www.riken.jp/press/2021/20210722_2/
[6] primary-care.sysmex.co.jp/sp/speed-search/index.cgi?c=speed_search-2&pk=614
[7] www.mhlw.go.jp/content/10800000/000655558.pdf
[8] www.pmda.go.jp/files/000206143.pdf
[9] bio.nikkeibp.co.jp/atcl/column/16/052700070/013000016/
[10] www.ncc.go.jp/jp/information/pr_release/2020/0325/index.html
[11] www.med.kobe-u.ac.jp/tougou/signal/Research.html
[12] www.bri.niigata-u.ac.jp/research/result/001807.html
[13] www.tohoku.ac.jp/japanese/newimg/pressimg/tohokuuniv-press20220428_03web_cdc42.pdf
[14] www.jst.go.jp/pr/announce/20240221/pdf/20240221.pdf
[15] researchmap.jp/7000027359/research_projects/14678547
[16] kaken.nii.ac.jp/ja/grant/KAKENHI-PROJECT-15K21662/
[17] kaken.nii.ac.jp/en/grant/KAKENHI-PROJECT-15025241/
[18] www.ncgg.go.jp/zaitakusuishin/ninchisho/documents/shiryou5_forum10.pdf
[19] kaken.nii.ac.jp/ja/grant/KAKENHI-PROJECT-15659284/
[20] mhlw-grants.niph.go.jp/project/1771
第5章 C末端の研究動向と未来
C末端研究の最新動向
● 最新の研究事例
– タンパク質の非破壊シークエンシングのためのN/C末端ラベル化法の開発
経済安全保障重要技術育成プログラム(JST)において、タンパク質の非破壊シークエンシングのためのN/C末端ラベル化法の開発が研究課題として掲げられている。この研究は、タンパク質の構造と機能解析において重要な進展をもたらす可能性がある[13]。
– 自己炎症性疾患「CDC42-C末端異常症」の病態解明
京都大学などの研究グループが、CDC42遺伝子の突然変異を原因とする自己炎症性疾患「CDC42-C末端異常症」の病態を解明した。この研究は、新しい自己炎症性疾患の理解に寄与するものである[15]。
– 定量的末端プロテオミクスによるエクトドメインシェディング基質の同定
複数の細胞株についてプロテオーム規模で内因性プロテアーゼによる基質切断部位を俯瞰した初めての研究が行われた。この研究により、エクトドメインシェディングの基質がプロテオーム規模で同定され、新たなデータセットが得られた[19]。
● 技術の進展
– ゲノム編集の効率や安全性を100倍以上高める新技術
九州大学生体防御医学研究所の研究グループが、ゲノム編集の効率や安全性を100倍以上高める新技術を開発した。この技術は、過剰なゲノム切断によるオフターゲット変異や細胞毒性を抑制し、安全で効率的な遺伝子治療の標準化技術として期待されている[10]。
– ペプチド科学の合成技術
ペプチド科学における合成技術の進展が報告されている。この技術は、ペプチドのN末端やC末端を特定の方法で標識することにより、タンパク質の構造解析や機能解析に貢献するものである[17]。
これらの研究事例と技術の進展は、C末端研究における新たな可能性を示しており、タンパク質科学や遺伝子編集技術の発展に大きく寄与すると考えられる。
- 参考文献・出典
-
[1] www.titech.ac.jp/news/2023/065862
[2] www.gmp-platform.com/article_detail.html?id=10250
[3] www.amed.go.jp/news/release_20220311-01.html
[4] www.jstage.jst.go.jp/article/jpstj/74/1/74_39/_pdf/-char/ja
[5] www.jst.go.jp/pr/announce/20190813/index.html
[6] katosei.jsbba.or.jp/view_html.php?aid=1220
[7] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2017.890894/data/index.html
[8] bio.nikkeibp.co.jp/atcl/column/16/052700070/013000016/
[9] www.kanto.co.jp/dcms_media/other/CT_251_all.pdf
[10] www.kyushu-u.ac.jp/ja/researches/view/909/
[11] www.spring8.or.jp/ja/news_publications/research_highlights/no_06/
[12] www.proteinlifetime.jp
[13] www.jst.go.jp/k-program/program/bio1.html
[14] kaken.nii.ac.jp/file/KAKENHI-PROJECT-20590452/20590452seika.pdf
[15] www.qlifepro.com/news/20220506/cdc42-c-terminal-variants.html
[16] www.jstage.jst.go.jp/article/vso/96/7/96_281/_pdf
[17] www.scej.org/docs/publication/journal/backnumber/8802-open-article.pdf
[18] kaken.nii.ac.jp/report/KAKENHI-PROJECT-20K06517/20K065172021hokoku/
[19] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2022.940381/data/index.html
[20] www.shimadzu.co.jp/aboutus/ms_r/archive/files/tanaka-pj_report/tanaka-pj_report1.pdf
C末端の研究が開く未来
C末端、すなわちタンパク質やペプチドの末尾部分は、生物学と医学の両分野において重要な役割を果たしています。C末端の研究は、タンパク質の構造と機能の理解、疾患の診断と治療、さらには新しい薬物の開発に至るまで、幅広い応用可能性を秘めています。
● 生物学におけるC末端の重要性
C末端はタンパク質の安定性、局在性、および機能に影響を与えることが知られています。例えば、C末端の特定のアミノ酸配列は、タンパク質が細胞内の特定の位置に送られるためのシグナルとして機能することがあります。また、C末端の修飾は、タンパク質の活性を調節する重要なメカニズムの一つです。これらの理由から、C末端の研究はタンパク質の機能解析に不可欠であり、生物学的プロセスの理解を深めるために重要な役割を果たしています。
● 医学におけるC末端の応用
医学分野においては、C末端の研究は疾患の診断や治療に応用されています。例えば、特定の疾患に関連するタンパク質のC末端の変異や異常な修飾を特定することで、疾患のバイオマーカーとして利用することができます。また、C末端を標的とした薬物設計は、特定のタンパク質の活性を選択的に調節する新しい治療法の開発につながる可能性があります。
● 未解決の問題と今後の研究方向性
C末端の研究にはまだ多くの未解決の問題が存在します。例えば、C末端の特定の修飾がタンパク質の機能にどのように影響を与えるか、また、これらの修飾がどのようにして細胞内で制御されているかについては、完全には理解されていません。さらに、C末端の異常がどのようにして疾患の発症に関与しているかについても、多くの疑問が残されています。
今後の研究では、これらの未解決の問題に対する答えを見つけることが重要です。これには、高度な生化学的および分子生物学的手法を用いたC末端の詳細な解析、さらにはC末端の修飾や相互作用に関するシステム生物学的アプローチが必要とされます。また、C末端を標的とした新しい治療法の開発に向けた研究も、重要な研究方向性の一つです。
総じて、C末端の研究は生物学と医学の両分野において大きな可能性を秘めており、今後もこの分野の研究が進展することで、新しい科学的知見の獲得や革新的な治療法の開発が期待されます。
- 参考文献・出典
-
[1] www.wjgnet.com/1009-3079/full/v19/i14/1436.htm
[2] www.f.waseda.jp/wako/introduction/Abe-Wako/02_%E7%AC%AC2%E7%AB%A0_%E3%82%BF%E3%83%B3%E3%83%91%E3%82%AF%E8%B3%AA%E5%88%86%E5%AD%90%E3%81%AE%E3%83%95%E3%82%A9%E3%83%BC%E3%83%AB%E3%83%87%E3%82%A3%E3%83%B3%E3%82%B0%E5%95%8F%E9%A1%8C%E3%81%A8%E3%81%AF%EF%BC%9F.pdf
[3] www.ncbi.nlm.nih.gov/pmc/articles/PMC10753262/
[4] cjb.ijournals.cn/cjbcn/article/pdf/gc14071083
[5] www.ncbi.nlm.nih.gov/pmc/articles/PMC10396996/
[6] www.ncbi.nlm.nih.gov/pmc/articles/PMC9274849/
[7] patents.google.com/patent/JP4086642B2/ja
[8] www.abace-biology.com/Protein-N-end-C-end-sequencing.htm
[9] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2019.910500/data/index.html
[10] www.jstage.jst.go.jp/article/biophys/39/5/39_5_295/_pdf
[11] www.sigmaaldrich.com/US/en/technical-documents/technical-article/protein-biology/protein-labeling-and-modification/peptide-modifications-n-terminal-internal-and-c-terminal
[12] sohu.com/a/567821035_121124375/?pvid=000115_3w_a
[13] www.x-mol.com/paper/1301591374418907136/t?recommendPaper=1382384327984177152
[14] www.x-mol.com/paper/1684573051214925824/t
[15] kaken.nii.ac.jp/ja/grant/KAKENHI-PROJECT-07671122/
[16] ja.wikipedia.org/wiki/%E7%89%A9%E7%90%86%E5%AD%A6%E3%81%AE%E6%9C%AA%E8%A7%A3%E6%B1%BA%E5%95%8F%E9%A1%8C
[17] www.cyagen.com/cn/zh-cn/community/frontier/information-20180102-3.html
[18] www.pmda.go.jp/files/000265847.pdf
[19] zh-cn.hsc.unm.edu/medicine/departments/ophthalmology/research/deretic-lab.html
[20] patents.google.com/patent/WO2007091627A1/ja






