目次
エクソンとイントロンに関する用語の集約、スプライシングの概要、がん治療への応用、エクソンシャフリングの科学まで、この記事で遺伝子の暗号を解読しましょう。
第1章: エクソンとイントロンの基本
概要
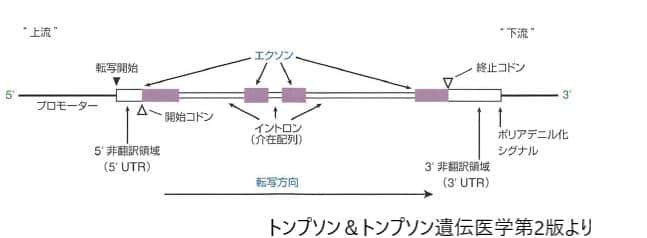
● 概要
エクソンとイントロン、これらは遺伝子の中で大きな役割を担っています。エクソンはタンパク質を作る指示が記された部分で、私たちの体を構成するタンパク質の設計図を持っています。イントロンはエクソンの間に位置し、直接タンパク質を作るわけではありませんが、遺伝子の働きをコントロールする重要な役割を持っています。これらの要素が、生物の多様性や進化の鍵を握っています。
● エクソンとイントロンの定義
エクソンとは、最終的に体内でタンパク質として作られる部分の設計図を持つ遺伝子の区画です。体を構成するタンパク質を作るには、エクソンに含まれる情報が不可欠です。イントロンはエクソンの間に存在し、タンパク質を直接作るわけではないものの、遺伝子の表現を調整するという大切な役割を果たしています。
● 遺伝子の構造と役割
遺伝子はDNAの特定の部分に位置し、生物の形質や機能を決定する情報をコードしています。この遺伝子の構造にはエクソンとイントロンが含まれ、これらの組み合わせが生物の多様性に寄与しています。遺伝子の役割は非常に幅広く、タンパク質の合成から、生物の成長、発達、維持に至るまで、生命現象の基本的なプロセスに関わっています。遺伝子の研究は生物学だけでなく、医学、農学、環境科学など、多くの分野で重要な意味を持っています。
関連用語と情報
● 関連用語と情報
この部分では、エクソンとイントロンを理解する上で欠かせない関連用語や情報について紹介します。エクソン(Exon)とイントロン(Intron)に関わる科学の世界は、専門的な用語で溢れています。ここでは、それらの用語をわかりやすく解説し、エクソンとイントロンの基礎知識を深めていきます。
● 主要な科学用語の解説
遺伝子発現(Gene Expression)、転写(Transcription)、翻訳(Translation)、スプライシング(Splicing)など、エクソンとイントロンに関連するプロセスは複雑です。遺伝子発現はDNAからmRNAへの情報の転写、そしてタンパク質への翻訳を指します。転写ではDNAの情報がmRNAに写され、翻訳でそのmRNAをもとにタンパク質が合成されます。スプライシングは、このプロセス中にイントロンが除去され、エクソンが結合することで、成熟したmRNAが生成されます。
● エクソンとイントロンの英語表記と種類
エクソン(Exon)とイントロン(Intron)の用語は、遺伝子の研究が進むにつれて、生物学における基本的な概念として確立しました。エクソンは遺伝子のコーディング領域を指し、イントロンは非コーディング領域ですが、生物の種類や遺伝子によって、その数や構造は大きく異なります。例えば、ヒトの遺伝子では、イントロンがエクソンよりもはるかに多く存在するケースが多いですが、他の生物では異なるパターンを示すことがあります。このように、エクソンとイントロンの研究は、遺伝子の構造や機能を理解する上で不可欠な要素です。
第2章: スプライシングとは
スプライシングの概要
● スプライシングの概要
スプライシングは遺伝子発現における重要な段階で、エクソンとイントロンの間で起こる複雑なプロセスです。このプロセスを通じて、遺伝子の情報が効率的にタンパク質へと翻訳されるように調整されます。ここでは、スプライシングのプロセスとその意義、さらにはmRNAの生成と調整について掘り下げていきます。
● スプライシングのプロセスと意義
スプライシングは、転写されたmRNA前駆体からイントロンを取り除き、エクソンをつなぎ合わせることで成熟したmRNAを生成するプロセスです。このプロセスは細胞核内で行われ、スプライソソームと呼ばれる分子機構によって実行されます。スプライシングによって、一つの遺伝子から異なるスプライシングバリアントを生み出すことが可能になり、タンパク質の多様性と細胞の機能的多様性が保証されます。このように、スプライシングは生物の適応能力と進化に不可欠な役割を果たしています。
● mRNAの生成と調整
mRNAの生成は、DNAからの情報の転写を経て行われますが、スプライシングによる調整を受けることで、最終的なタンパク質の生産に影響を及ぼします。スプライシングにより、同じ遺伝子からでも、異なる機能を持つ複数のmRNA(およびタンパク質)が生成されることがあります。この過程により、細胞は限られた数の遺伝子から大きな機能的多様性を引き出すことができます。また、スプライシングは特定の細胞型や発達段階、外部からのシグナルに応じて細かく調節されることで、生物の体内環境に適したタンパク質の合成を可能にします。
スプライシングの種類と例
● スプライシングの種類と例
スプライシングにはいくつかの異なるタイプがあり、それぞれが遺伝子発現において特有の役割を果たしています。このセクションでは、スプライシングの代表的な方法と、スプライシングの異常が関連する症状や疾患の例について紹介します。
● 代表的なスプライシングの方法
– 代替スプライシング:一つのmRNA前駆体から異なる成熟mRNAを生成するプロセス。これにより、一つの遺伝子から複数のタンパク質が生産されることがあります。代替スプライシングは、タンパク質の多様性と細胞の機能的多様性を高める重要な機構です。
– エクソンスキッピング:スプライシング中に一つ以上のエクソンがmRNAから省略される現象。これによって、異なる機能を持つタンパク質が生成されることがあります。
– イントロンリテンション:スプライシングプロセスでイントロンが成熟したmRNA内に残る現象。これは特定の条件下での遺伝子発現の調節に関与しています。
● 症状と関連疾患の例
スプライシングの異常は、さまざまな遺伝性疾患や症状の原因となり得ます。例えば:
– 筋ジストロフィー:エクソンスキッピングの異常により、筋肉タンパク質であるディストロフィンが適切に生成されない場合があります。これにより、筋力の低下や筋組織の損傷が引き起こされます。
– 脊髄性筋萎縮症:SMN1遺伝子の代替スプライシングの異常により、運動神経細胞が徐々に機能を失い、筋力の弱化や運動能力の低下を引き起こします。
– 一部のがん種:特定の代替スプライシングイベントががん細胞の成長や生存に関与していることが示されています。異常なスプライシングパターンは、がん診断や治療の標的としての可能性を持っています。
これらの疾患は、スプライシングの精密な調節が生物の健康維持にいかに重要であるかを示しています。スプライシングに関連する症状や疾患の研究は、遺伝子治療の分野における新たな治療法の開発に貢献する可能性があります。
第3章: エクソンシャフリングと遺伝子の進化
エクソンシャフリングの意味
● エクソンシャフリングの意味
エクソンシャフリングは、進化の過程でエクソンが新しい組み合わせを形成し、新たなタンパク質や遺伝子機能が生み出される現象です。このプロセスは、異なる遺伝子間でのエクソンの交換や、同一遺伝子内のエクソンの再編成を通じて行われます。エクソンシャフリングにより、生物は新しい生理的特性や適応能力を獲得し、進化の過程で多様性が増すことが可能になります。
● シャフリングの科学的背景
エクソンシャフリングの概念は、遺伝子の進化が単純な突然変異だけでなく、より複雑な機構によっても促進されることを示しています。このプロセスは、遺伝子の構造がモジュール式であることを前提としています。つまり、エクソンが独立した機能的ユニットとして振る舞い、これらが組み合わさることで新しいタンパク質や遺伝子機能が生み出されるのです。エクソンシャフリングは、特に多細胞生物において、タンパク質の多様性と複雑性の増大に大きく寄与しています。
● 遺伝子の多様性への影響
エクソンシャフリングによって生み出される遺伝子の多様性は、生物の進化と種の多様性に深く関わっています。新しいタンパク質の機能が出現することで、生物は環境の変化に対してより柔軟に対応できるようになり、生存競争において有利な位置を占めることができます。また、エクソンシャフリングは遺伝子の機能的な進化を加速させ、疾患抵抗性や新しい生理的機能の発展に寄与する可能性があります。このように、エクソンシャフリングは生命の進化における重要なドライバーとして機能し、生物の多様性と複雑性の増加に貢献しています。
生物進化におけるエクソンの役割
● 生物進化におけるエクソンの役割
エクソンは生物進化の過程において中心的な役割を果たします。これらは、遺伝子のコーディング領域として、タンパク質の多様性と機能の進化に直接的に関わっています。エクソンの再編成、変異、およびシャフリングは、生物の適応能力と種の多様化を促進する重要な機構です。
● 種の進化と遺伝子の多様化
種の進化は、遺伝的多様性の増加に深く依存しています。エクソンにおける変異や再編成は、新しいタンパク質の特性を生み出し、それによって生物が新しい環境へ適応する能力を高めます。例えば、特定のエクソンの変異によって、特定の病原体に対する抵抗性が生まれたり、新しい栄養素を利用する能力が開発されたりします。このような遺伝的変化は、生物が変化する環境条件下で生き残り、繁栄するための基盤を提供します。
● 研究事例と現代への影響
エクソンと生物進化に関する多くの研究事例があり、これらは現代の科学と医学において重要な影響を与えています。例えば、エクソンシャフリングによって生じた新しいタンパク質が、特定の疾患の治療に役立つ可能性があることが示されています。また、遺伝子編集技術の発展により、エクソンの精密な操作が可能となり、遺伝子治療における新たなアプローチが開発されています。これらの進歩は、エクソンが生物の進化だけでなく、人類の健康改善にも深く関わっていることを示しています。エクソンの研究は、進化生物学、分子生物学、および医学の分野で続けられ、これからも生物の理解を深め、医療の進歩に貢献することが期待されています。
第4章: がん治療とエクソン
エクソンとがんの関連性
● エクソンとがんの関連性
エクソンはがんの発生と進行において重要な役割を果たしています。がん細胞では、エクソンに起因する遺伝子の変異や異常なスプライシングが頻繁に観察され、これらの変化ががん細胞の成長、分裂、転移の促進に寄与しています。特定のエクソン変異は、がんの特定のタイプと強く関連しており、それらを標的とすることで、がんの診断や治療に新たなアプローチを提供します。
● がん治療におけるエクソンの重要性
エクソンの研究は、がん治療において画期的な進展をもたらしています。エクソンにおける特定の変異やスプライシングパターンを標的とする治療法が開発されており、これにより、患者にとってより効果的で副作用の少ない治療オプションが可能になっています。例えば、特定のエクソン変異を有するがん細胞に特異的に作用する分子標的薬は、従来の化学療法や放射線療法に比べて標的のがん細胞をより正確に攻撃できます。
● 治療方法と研究の進歩
エクソンを標的とした新しいがん治療法には、分子標的療法や遺伝子編集技術が含まれます。これらの治療法は、がんの特定の遺伝的特性に基づいてカスタマイズされ、患者個々の遺伝的背景に合わせたパーソナライズドメディシンの実現を目指しています。また、CRISPR-Cas9などの遺伝子編集技術を用いて、がん細胞内のエクソン変異を直接修正する研究も進行中です。このような研究の進歩は、がん治療においてより効率的で副作用の少ない方法を提供するだけでなく、将来的にはがんの予防にも寄与する可能性があります。エクソンとがんの関連性に関する継続的な研究は、がん治療の新たな地平を開くことが期待されています。
消化管間質腫瘍(GIST)の研究
● 消化管間質腫瘍(GIST)の研究
消化管間質腫瘍(GIST)は、消化管の平滑筋や神経細胞から発生する比較的まれながんで、その成長と進行には特定のエクソン変異が深く関わっています。GISTの研究は、がん生物学および分子遺伝学の分野において重要な進展を遂げており、エクソン変異とがんの行動との関連性を解明することで、効果的な治療法の開発に貢献しています。
● GISTとエクソンの関連
GISTの発生には、c-KIT遺伝子やPDGFRA遺伝子のエクソンにおける変異がしばしば関与しています。これらの変異は、遺伝子のコーディング領域におけるエクソンの特定の部分に生じ、タンパク質の活性を異常に高め、細胞の制御不能な増殖を引き起こします。このような知見は、GISTの診断や分類、さらには標的治療法の開発において重要な役割を果たしています。
● 最新の治療法と研究成果
GISTに対する最新の治療法は、エクソン変異を特異的に標的とする分子標的薬の開発に焦点を当てています。イマチニブ(Gleevec)は、最初に成功した例で、特定のc-KITやPDGFRAの変異を有するGIST患者に対して有効です。この治療法は、GISTの管理を根本的に変え、多くの患者の生存率を大幅に改善しました。さらに、耐性が発生した場合やイマチニブに反応しない特定のエクソン変異に対処するため、サンチニブやレゴラフェニブなどの新しい分子標的薬も開発されています。これらの進歩は、GISTの治療におけるパーソナライズドメディシンの実現を一歩前進させており、継続的な研究が新たな治療オプションをもたらすことが期待されています。









