目次
エピゲノムは遺伝情報の上に存在する制御層で、遺伝子の発現を調節します。この記事では、エピゲノムの基礎、研究の最前線、およびその医学・生物学における応用について掘り下げます。
第1章:エピゲノムとは
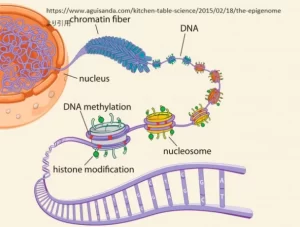
エピゲノムの基本概念
エピゲノムは遺伝子の発現や細胞の機能を制御するさまざまな要因の総体を指します。エピゲノムの変化は、DNAの配列そのものに変化が生じる遺伝とは異なり、DNA配列は変わらずに遺伝子の活性化や非活性化を調節します。このような調節メカニズムによって、細胞は同じDNAを持ちながらも異なる細胞型や機能を持つことができます。エピゲノムの基本的な概念には以下のようなものがあります:
1. DNAメチル化: DNAのシトシン塩基にメチル基が付加されることにより、遺伝子の発現を抑制する現象。このメチル化によって遺伝子が「オフ」の状態にされることがあります。
2. ヒストン修飾: ヒストンはDNAを巻きつけるタンパク質で、このヒストンにさまざまな化学的修飾が加わることで、DNAの構造が変化し、遺伝子のアクセシビリティが調節されます。アセチル化、メチル化、リン酸化などが代表的な修飾で、遺伝子の発現を促進または抑制する効果があります。
3. クロマチンリモデリング: クロマチンの構造を変化させることによって、遺伝子のアクセス可能性を調整するプロセス。ヒストン修飾と相互作用しながら、遺伝子の発現を細かく制御します。
4. 非コーディングRNA: RNAの中には、タンパク質をコードしないものがありますが、これら非コーディングRNAもエピゲノムの重要な要素です。例えば、microRNAやlong non-coding RNAは遺伝子の発現を調節することにより、細胞の機能に大きな影響を与えます。
エピゲノムの変化は、発生、環境応答、疾患の発生など、生物学的プロセスにおいて重要な役割を果たします。また、エピゲノムの研究はがんや神経疾患など、さまざまな疾患の治療法の開発に貢献する可能性を秘めています。
エピジェネティクスとゲノムの関係
エピジェネティクスとゲノムは密接に関連しており、生物学において重要な役割を担っています。ゲノムは生物の遺伝情報が記録されたDNAの全体を指し、この遺伝情報に基づいてタンパク質の合成など生命活動が行われます。一方、エピジェネティクスは、DNAの配列自体を変えることなく、遺伝子の発現を制御する一連のメカニズムを指します。エピジェネティクスとゲノムの関係を理解するためには、以下のポイントが重要です。
● ゲノム:遺伝情報の青写真
– ゲノムは、生物が生きていくために必要な指示や情報を含んでいるDNAの完全なセットです。
– この遺伝情報には、生物の成長、発達、維持、繁殖に必要なタンパク質の設計図が含まれています。
● エピジェネティクス:遺伝情報の使い方を制御
– エピジェネティクスは、遺伝子がいつ、どのように、そしてどの程度発現するかを制御するメカニズムです。これにはDNAメチル化、ヒストン修飾、非コーディングRNAなどが関与しています。
– これらのエピジェネティックな変化は、細胞の種類、組織、発達段階、外部環境の影響などに応じて、遺伝子の活性を調整します。
● エピジェネティクスとゲノムの相互作用
– エピジェネティクスは、ゲノム内の特定の遺伝子が特定の時期や条件下で「オン」または「オフ」になるように制御します。このプロセスにより、同じDNA配列を持つ細胞でも、異なる機能を持つ細胞へと分化することができます(例:肝細胞と脳細胞)。
– エピジェネティックな変化は可逆的であるため、生活習慣や環境因子によって変化することがあります。これは、ゲノムが固定された静的な情報であるのに対し、エピジェネティクスがより動的で、外部環境に応じた遺伝情報の利用方法を調節するためです。
エピジェネティクスとゲノムの関係は、生物がどのようにして遺伝情報を適切に利用し、多様な細胞型や生理的応答を生み出すかを理解する上で中心的な概念です。また、この相互作用の理解は、遺伝性疾患、癌、老化などの生物学的プロセスや健康問題の研究にも重要な意味を持ちます。
第2章:エピゲノムの研究方法
エピゲノム研究の主要な手法
エピゲノム研究は、遺伝子の発現や細胞の機能を制御するエピジェネティックな変化を理解するためのものです。この研究領域では、DNAメチル化、ヒストン修飾、クロマチン構造の変化、非コーディングRNAの役割などを解明するための多岐にわたる手法が用いられています。以下は、エピゲノム研究で主要な手法の一部です:
● 1. DNAメチル化解析
– ビスルファイトシークエンシング(Bisulfite Sequencing): DNAのメチル化パターンを詳細に分析する手法。ビスルファイト処理によってメチル化されていないシトシンがウラシルに変換され、シークエンシングによってメチル化されたシトシンの位置を特定します。
– メチル化特異的PCR(Methylation-Specific PCR, MSP): メチル化されたDNAとメチル化されていないDNAを区別して増幅するPCR技術。特定の遺伝子領域のメチル化状態を迅速に評価します。
● 2. ヒストン修飾の解析
– クロマチン免疫沈降(Chromatin Immunoprecipitation, ChIP): 特定のヒストン修飾またはDNA結合タンパク質に対する抗体を使用して、それらが結合するDNA領域を特定する技術。ChIP後にシークエンシング(ChIP-Seq)を行うことで、ゲノム全体での結合パターンを解析できます。
● 3. クロマチンアクセシビリティの解析
– アッセイ・フォー・トランスポゼーゼ・アクセシブル・クロマチン(ATAC-seq): クロマチンがどの程度アクセス可能かを評価する手法。トランスポゼーゼを使用して開いているクロマチン領域に小さな断片を挿入し、その後シークエンシングを行います。これにより、遺伝子の発現調節に関わるクロマチンのアクセシビリティをゲノム全体で解析できます。
● 4. RNA関連手法
– RNAシークエンシング(RNA-seq): mRNAや非コーディングRNAなど、細胞内の全RNAをシークエンシングすることにより、遺伝子の発現レベルや発現パターンを定量的に解析します。エピジェネティックな変化が遺伝子の発現に与える影響を調べるのに有効です。
● 5. エピゲノムワイドアソシエーション研究(EWAS)
– エピゲノムワイドアソシエーション研究(EWAS): 特定の表現型や疾患とエピジェネティックな変化との関連を大規模に探索する研究手法。DNAメチル化アレイなどを使用して、多数のサンプルにわたってメチル化パターンを比較分析します。
これらの手法は、エピジェネティックな変化を詳細に解析し、それらが生物学的プロセスや疾患発生にどのように関与しているかを理解するために重要です。各手法は特定のエピジェネティック現象を探るために設計されており、それぞれの強みと制限があります。エピジェノム研究の進展により、これらの手法は継続的に改良され、より高精度かつ包括的な解析が可能になっています。
● 統合的アプローチの重要性
エピジェノムの研究では、これらの手法を単独で用いるだけでなく、しばしば複数のアプローチを組み合わせることで、より豊かな情報を得ることができます。たとえば、ChIP-Seqで特定のヒストン修飾の分布を調査した後、RNA-seqを用いてその修飾が遺伝子発現にどのように影響しているかを解析することができます。また、ATAC-seqとDNAメチル化解析を組み合わせることで、クロマチンのアクセシビリティとメチル化パターンがどのように相互作用して遺伝子の発現を制御しているかを理解することが可能になります。
● 最新技術の活用
最近では、シングルセル解析技術の進展により、単一細胞レベルでのエピジェネティックな変化を解析することが可能になりました。これにより、異なる細胞型や発達段階におけるエピジェネティックなダイナミクスをより詳細に理解することができるようになりました。シングルセルRNAシークエンシング(scRNA-seq)、シングルセルATACシークエンシング(scATAC-seq)などの技術は、複雑な組織や発達過程における細胞間のエピジェネティックな多様性を明らかにするために広く用いられています。
● 結論
エピジェネティクスは、遺伝情報の利用方法を制御する多様なメカニズムを含む複雑な分野です。エピゲノム研究の手法は、これらのメカニズムを解明し、健康と疾患の背景にあるエピジェネティックな基盤を理解するための強力なツールを提供します。科学技術の進歩に伴い、新たな手法の開発や既存手法の精度向上が進んでおり、これからもエピジェネティクスの謎を解き明かす鍵となるでしょう。
エピゲノム研究における最新技術
エピゲノム研究の分野では、技術の進歩が目覚ましく、新しい手法が次々と開発されています。これらの技術は、遺伝子の発現や細胞の運命を制御するエピジェネティックな機構をより詳細に理解するために不可欠です。以下は、エピゲノム研究における最新技術のいくつかです:
● 1. シングルセルエピジェノミクス
– シングルセルRNAシークエンシング(scRNA-seq): 個々の細胞レベルでの遺伝子発現プロファイルを提供し、細胞集団内の異質性を明らかにします。
– シングルセルATACシークエンシング(scATAC-seq): 個々の細胞におけるクロマチンアクセシビリティを解析し、遺伝子の活性化状態に関する細胞間の違いを探ります。
– シングルセルDNAメチル化シークエンシング: 細胞毎のDNAメチル化パターンを解析し、エピジェネティックな変異を細胞レベルで詳細に研究します。
● 2. クロマチンコンフォーメーション技術
– Hi-Cおよび派生技術: ゲノム内の物理的な距離に関わらず、DNA断片間の相互作用を検出し、クロマチンの3D構造を解明します。これにより、遺伝子の発現調節における空間的な側面を理解できます。
● 3. エピトランスクリプトミクス
– RNA分子上の化学的修飾(例えば、m6Aメチル化)の研究は、RNAの安定性や翻訳の制御など、新たな調節層を明らかにしています。これらの研究には、特定の修飾を精密にマッピングする高度なシークエンシング技術が用いられます。
● 4. クリスパー関連技術
– クリスパー/Cas9および派生システムは、特定のエピジェネティックマーカーの導入、除去、または変更を目的としたゲノム編集に利用されます。これにより、特定のエピジェネティック変化が細胞機能に与える影響を直接的に研究できます。
● 5. マシンラーニングとデータ解析技術
– エピジェネティックスのデータは非常に大規模で複雑であるため、新しいデータ解析技術が必要です。マシンラーニングアルゴリズムとビッグデータ解析ツールの進化は、大量のエピジェネティックデータから有意義なパターンを抽出し、新しい生物学的洞察を得るために不可欠です。
● 6. 3Dゲノムマッピング
– 3Dゲノムマッピング技術は、クロマチン構造の詳細な3次元的な配置と機能的な相互作用を理解するために重要です。この分野の進展は、遺伝子の発現、クロマチンのダイナミクス、および細胞の運命決定における空間的な制約の役割を明らかにします。
● 7. ナノポアシークエンシング
– ナノポア技術を使用したシークエンシングは、長い読み出し長と実時間のデータ取得を特徴とし、DNAおよびRNAの修飾を直接的に検出することが可能です。この技術は、従来のシークエンシングが難しいエピジェネティックマーカーの解析を可能にします。
● 8. メタゲノミクスおよびエピメタゲノミクス
– メタゲノミクスは、環境サンプルからのDNAの直接的な解析を指し、エピメタゲノミクスはこれにエピジェネティックな分析を加えたものです。これらのアプローチにより、微生物群集の遺伝的およびエピジェネティックな多様性を理解することができます。
● 9. 多重オミクス統合解析
– ゲノム、エピゲノム、トランスクリプトーム、プロテオーム、メタボロームなど、異なる「オミクス」データレイヤーを統合することで、生物学的システムの包括的な理解が可能になります。これにより、エピジェネティックな変化が生物学的プロセス全体に与える影響を多角的に分析できます。
● 10. 高度なイメージング技術
– ライブセルイメージング、超解像顕微鏡技術、およびクロマチンの3D構造を可視化するための新しいイメージング手法は、エピジェネティックな変化のダイナミクスと細胞内での空間的な配置を実時間で追跡する能力を提供します。
これらの技術の発展により、エピジェノム研究はこれまでにないスピードと精度で進展しています。エピジェネティックな制御メカニズムのより深い理解は、がん、神経疾患、代謝症候群など、多くの疾患の原因と治療に関する新しい洞察を提供する可能性があります。また、これらの技術は、個々の遺伝的およびエピジェネティックな背景に基づいたパーソナライズドメディシンの発展にも貢献しています。
第3章:エピゲノムの役割と機能
遺伝子発現の制御におけるエピゲノムの役割
遺伝子発現の制御において、エピゲノムは非常に重要な役割を果たします。エピゲネティックな変化は、DNAの配列を変更することなく、遺伝子の活性化や非活性化を調節する一連のメカニズムです。これにより、細胞は特定の時期や条件下で必要なタンパク質を正確に生産することができます。エピゲノムの役割は以下のような主要なメカニズムを通じて遺伝子発現を制御します:
● 1. DNAメチル化
– DNAメチル化は、シトシン塩基の炭素原子にメチル基が付加する化学的変化です。このプロセスは主に遺伝子のプロモーター領域で起こり、遺伝子の発現を抑制します。メチル化されたDNAは、特定のタンパク質を引き付けることが難しくなり、遺伝子の転写を妨げることで、その遺伝子の発現を「オフ」にすることができます。
● 2. ヒストン修飾
– ヒストン修飾は、DNAを巻きつけるタンパク質であるヒストンのアミノ酸残基に様々な化学基団が結合するプロセスです。これには、アセチル化、メチル化、リン酸化などが含まれます。ヒストンのアセチル化は一般的に遺伝子の活性化と関連しており、DNAがよりアクセスしやすくなることで転写が促進されます。逆に、特定のヒストンのメチル化は遺伝子の抑制に寄与することがあります。
● 3. クロマチンリモデリング
– クロマチンリモデリングは、DNAとヒストンから成るクロマチンの構造を変化させるプロセスです。これにより、転写因子やRNAポリメラーゼなどの転写調節因子が遺伝子のプロモーター領域にアクセスしやすくなったり、逆にアクセスが難しくなったりします。クロマチンの構造がリラックスしているとき(ユークロマチン)、遺伝子は転写されやすくなります。一方、構造が密集しているとき(ヘテロクロマチン)、遺伝子の転写は抑制されます。
● 4. 非コーディングRNA
– 非コーディングRNAは、タンパク質をコードしないRNA分子で、遺伝子の発現を多様な方法で調節します。例えば、microRNA(miRNA)は、特定のメッセンジャーRNA(mRNA)に結合してその安定性を下げたり、翻訳を阻害したりすることで、遺伝子の発現を抑制することができます。
これらのエピジェネティックなメカニズムは、細胞が発達する過程での分化、環境への適応、さらには疾患の発生に至るまで、生物学的プロセス全般にわたって中心的な役割を果たします。細胞分化では、特定のエピジェネティックな変化が細胞の運命を決定し、神経細胞、肝細胞、心筋細胞など特定の細胞型に特有の遺伝子発現パターンを確立します。この過程は、遺伝子の正確な発現調節を通じて、各細胞型がその特定の機能を果たすことを可能にします。
また、環境因子に対する応答として、エピジェネティックな変化は細胞が外部からのシグナルに適応する方法を提供します。例えば、栄養状態やストレスといった環境の変化は、DNAメチル化パターンの変更やヒストン修飾の変化を引き起こし、これによって遺伝子の発現が変化することがあります。このようにして、細胞は生存や成長のための新しい状況に適応することができます。
エピジェネティックな変化は疾患の発生においても重要な役割を果たします。がんを含む多くの疾患は、異常なDNAメチル化やヒストン修飾パターンに関連しています。これらのエピジェネティックな異常は、腫瘍抑制遺伝子の不活性化やがん遺伝子の活性化につながり、細胞の無制限な成長を促進します。このように、エピジェネティックな変化は、正常な生理的プロセスと疾患状態の両方で遺伝子発現の調節に深く関与しています。
エピジェネティックなメカニズムの理解は、新しい治療戦略の開発にもつながっています。例えば、特定のDNAメチル化またはヒストン脱アセチル化酵素を標的とする薬剤は、エピジェネティックな変化を修正し、疾患の進行を遅らせるか逆転させる可能性があります。さらに、エピジェネティックな変化はしばしば早期に発生するため、これらの変化を検出することで疾患の早期診断に役立つ可能性もあります。
総じて、エピジェノムは遺伝子発現の精密な調節に不可欠であり、細胞の機能、発達、環境適応、疾患発生に至るまで幅広い生物学的プロセスに影響を与えます。エピジェネティックな研究は、これらのプロセスを理解し、将来的な治療法の開発に貢献するための重要な分野です。
疾患発生におけるエピゲノムの影響
疾患発生におけるエピゲノムの影響は、近年の研究によりますます明らかになっています。エピジェネティックな変化は、遺伝子の発現を調節するため、細胞の機能障害や病態の発生に直接的に関与することがあります。以下は、疾患発生におけるエピゲノムの影響を示す主な例です:
● がん
がんはエピジェネティックな変化によって特徴づけられる代表的な疾患です。特定の遺伝子の異常なDNAメチル化やヒストン修飾は、腫瘍抑制遺伝子のサイレンシングやがん促進遺伝子の過剰発現を引き起こし、細胞の無秩序な成長や分裂を促します。また、クロマチンの構造変化によってDNA修復メカニズムが阻害されることもあり、これが遺伝的不安定性を高め、がんの進行に寄与します。
● 神経疾患
アルツハイマー病、パーキンソン病、ハンチントン病などの神経変性疾患も、エピジェネティックな変化が関与することが示されています。これらの疾患では、特定の遺伝子の異常なメチル化やヒストン修飾が神経細胞の損傷や死を引き起こし、症状の発現に寄与すると考えられています。例えば、アルツハイマー病では、アミロイド前駆体タンパク質遺伝子のプロモーター領域のメチル化が関連している可能性があります。
● 心血管疾患
心血管疾患の発生にもエピジェネティックな要因が関与します。たとえば、高血圧や動脈硬化は、血管壁の細胞における遺伝子発現の変化によって引き起こされる可能性があり、これにはDNAメチル化やヒストン修飾の異常が関与することが示唆されています。これらのエピジェネティックな変化は、炎症反応や血管新生の調節によって心血管系の機能に影響を与えることがあります。
● 代謝疾患
肥満や2型糖尿病などの代謝疾患にもエピジェネティックな変化が密接に関連しています。これらの状態は、食生活や運動不足などの生活習慣の影響を受けやすく、それによって引き起こされるエピジェネティックな変化が、脂肪細胞の機能やインスリン感受性に影響を与えることがあります。例えば、特定の栄養素の摂取はDNAメチル化パターンを変化させ、これが代謝経路の調節に関与する遺伝子の発現に影響を与えることがあります。このようなエピジェネティックな変化は、インスリンの効果を調節する遺伝子にも影響を及ぼし、結果としてインスリン抵抗性の発達や2型糖尿病のリスクの増加につながります。また、肥満に関連するエピジェネティックな変化は、後代にも影響を及ぼす可能性があることが研究で示されており、代謝疾患の家族歴に一因があると考えられています。
● 自己免疫疾患
エピジェネティックな変化は、自己免疫疾患の発生にも重要な役割を果たします。自己免疫疾患では、体の免疫系が誤って自己の細胞や組織を攻撃するようになります。この過程には、免疫系の調節に関与する遺伝子のエピジェネティックな変調が関与している可能性があります。例えば、リウマチ性関節炎や全身性エリテマトーデス(SLE)では、炎症反応を促進するサイトカインや免疫応答を調節する遺伝子のメチル化パターンの異常が報告されています。
● 発達および精神疾患
発達障害や精神疾患も、エピジェネティックなメカニズムによる遺伝子発現の変化と関連しています。自閉症スペクトラム障害(ASD)、注意欠陥・多動性障害(ADHD)、うつ病、統合失調症などの疾患では、神経発達や神経伝達に関わる遺伝子のエピジェネティックな調節異常が関与していることが示されています。これらの変化は、脳の構造や機能に影響を及ぼし、疾患特有の行動や認知の問題を引き起こす可能性があります。
● エピジェネティクスと環境因子
環境因子とエピジェネティックな変化との関連は、疾患発生におけるエピジェネティクスの理解を深める重要な視点です。ストレス、栄養状態、化学物質への暴露などの環境因子は、エピジェネティックな変化を介して遺伝子発現に長期的な影響を及ぼすことがあります。これらの変化は、疾患の発症に寄与するだけでなく、世代を超えて影響を与える可能性があるため、公衆衛生の観点からも注目されています。
エピジェネティックな研究は、これらの疾患メカニズムの理解を深めるだけでなく、新たな治療法や予防策の開発に向けた道を切り開いています。例えば、特定のエピジェネティックな変化を標的とした薬物治療が、がんや神経変性疾患、自己免疫疾患などにおいて研究されています。これらの治療法は、疾患の根本的な原因に直接作用する可能性があり、従来の症状を緩和する治療法に比べて、より効果的で持続的な解決策を提供することが期待されます。
エピジェネティックな治療のアプローチには、DNAメチル化抑制剤やヒストン脱アセチル化酵素(HDAC)阻害剤などがあります。これらの薬剤は、エピジェネティックな変化を逆転させ、遺伝子発現の異常を正常化することで、疾患の進行を遅らせるか、病状を改善することができます。既にいくつかのエピジェネティック治療薬が臨床使用されており、特にがん治療において有望な成果を示しています。
さらに、エピジェネティックな変化は、疾患の早期発見や進行の予測に利用することができるバイオマーカーとしても期待されています。特定のDNAメチル化パターンやヒストン修飾のプロファイルは、疾患特有のものであることが多く、これらのマーカーを用いて早期診断やリスク評価が可能になる可能性があります。これは、効果的な介入が可能な早い段階での疾患検出や、個々の患者に最適化された治療戦略の策定に貢献することが期待されます。
エピジェネティクスと環境因子との関連に関する研究は、生活習慣の変更がエピジェネティックな変化に及ぼす影響を示唆しており、これにより疾患予防の新たなアプローチが提案されています。健康的な食生活や適度な運動、ストレス管理などは、エピジェネティックな変化を正の方向に導く可能性があり、結果として疾患リスクの低減に寄与することが示唆されています。
疾患発生におけるエピゲノムの影響を理解することは、現代医学においてますます重要になっています。エピジェネティクスの進展は、疾患の根本原因への洞察を深め、より効果的な治療法や予防策の開発に繋がることが期待されています。
第4章:エピゲノムと疾患
エピゲノム異常が関与する主な疾患
エピゲノム異常が関連する疾患は多岐にわたり、がん、神経疾患、代謝症候群、自己免疫疾患など、多数の病態にエピジェネティックな変化が影響を与えることが明らかになっています。以下は、エピゲノム異常が関与する主な疾患の例です:
1. がん
がんはエピジェネティックな変化と最も密接に関連する疾患の一つであり、DNAメチル化の異常、ヒストン修飾の変化、クロマチン構造の変動が、腫瘍抑制遺伝子のサイレンシングやがん促進遺伝子の活性化に寄与します。これらの変化は、細胞の成長制御メカニズムの破壊や遺伝的不安定性の増加を引き起こし、がんの発生と進行を促進します。
2. 神経変性疾患
アルツハイマー病、パーキンソン病、ハンチントン病などの神経変性疾患は、エピジェネティックな変化が疾患の発生と進行に重要な役割を果たすことが示されています。これらの疾患では、特定の遺伝子のメチル化異常やヒストン修飾の変化が神経細胞の死を引き起こす可能性があります。
3. 代謝疾患
2型糖尿病、肥満などの代謝疾患も、エピジェネティックな要因によって影響を受けます。生活習慣の選択や栄養状態がDNAメチル化パターンに変化をもたらし、これがインスリン感受性や脂肪細胞の機能に影響を与えることがあります。
4. 自己免疫疾患
リウマチ性関節炎や全身性エリテマトーデス(SLE)などの自己免疫疾患は、エピジェネティックな異常が免疫系の誤認識と過剰反応を引き起こし、組織の損傷をもたらすことがあります。これらの疾患では、炎症に関連する遺伝子のメチル化異常やヒストン修飾の変化が報告されています。
5. 心血管疾患
心血管疾患においても、エピジェネティックな変化は重要な役割を果たします。例えば、高血圧や動脈硬化は、血管細胞における遺伝子のエピジェネティックな調節異常によって引き起こされる可能性があります。
6. 精神疾患
うつ病、統合失調症、双極性障害などの精神疾患も、エピジェネティックなメカニズムによる影響を受ける可能性があります。これらの疾患では、ストレスや環境因子がDNAメチル化やヒストン修飾のパターンを変化させ、これが脳内の神経伝達物質のバランスや神経細胞間の通信に影響を与えることで、症状が発現すると考えられています。
7. 発達障害
自閉症スペクトラム障害(ASD)、注意欠陥・多動性障害(ADHD)などの発達障害も、エピジェネティックな変化との関連が指摘されています。これらの障害においては、発達初期のエピジェネティックな調節異常が、脳の発達や機能に長期的な影響を与え、特定の行動や認知の問題を引き起こすと考えられています。
8. 加齢に関連する疾患
老化プロセス自体も、エピジェネティックな変化に大きく影響されます。加齢に伴うDNAメチル化の変化やヒストン修飾の変動は、細胞の老化、組織の機能低下、加齢に関連する疾患のリスク増加に寄与するとされています。これには、心血管疾患、神経変性疾患、および特定のがんの種類が含まれます。
9. 表現型可塑性に関わる疾患
特定の環境因子への暴露が原因で発生する疾患(例:職業性がんや環境由来のアレルギー反応)は、エピジェネティックな変化を介してその表現型が形成されることがあります。環境毒素、化学物質、食生活などがエピジェノムに変化を引き起こし、それが疾患発生の一因となる可能性があります。
これらの疾患に共通しているのは、エピジェネティックな変化が、遺伝子の発現パターンに持続的な影響を及ぼし、細胞の機能や組織の動態を変化させることにより、病態を引き起こす可能性があるという点です。エピジェネティックな研究の進展により、これらの疾患のより深い理解と、エピジェネティックな変化を標的とした新たな治療法の開発が期待されています。
エピゲノムをターゲットとした新規治療法
エピゲノムをターゲットとした治療法は、疾患の根本的な原因に直接作用する可能性を秘めており、特にがんや神経変性疾患、自己免疫疾患など、エピジェネティックな変化が大きな役割を果たす病態において大きな期待が寄せられています。以下に、エピゲノムを対象とした新規治療法のいくつかを紹介します。
1. DNAメチル化阻害剤
DNAメチル化は多くのがんで見られるエピジェネティックな変化の一つであり、腫瘍抑制遺伝子の不活性化に関与します。DNAメチル化阻害剤は、異常なメチル化を減少させ、抑制されていた遺伝子の再活性化を促します。例えば、アザシチジン(Azacitidine)やデシタビン(Decitabine)は、特定の種類の白血病や骨髄異形成症候群の治療に使用されています。
2. ヒストン脱アセチル化酵素(HDAC)阻害剤
HDAC阻害剤は、ヒストン脱アセチル化酵素の活性を阻害し、ヒストンのアセチル化を促進することで遺伝子発現を調節します。ヒストンのアセチル化増加は、一般に遺伝子の発現を促進し、がん細胞の成長抑制やアポトーシス(プログラム細胞死)の誘導に寄与します。バロリノスタット(Vorinostat)やロマイデプシン(Romidepsin)は、特定のリンパ腫治療に承認されています。
3. BET阻害剤
BET(Bromodomain and Extra-Terminal domain)阻害剤は、クロマチンの構造に作用し、特定の遺伝子の発現を調節する薬剤です。BET阻害剤は、がん細胞の成長を促進する遺伝子の発現を抑制することにより、がん治療において有望な結果を示しています。
4. RNA誘導エピジェネティックシロンシング(RNAi)
RNA干渉(RNAi)技術は、小さな干渉RNA(siRNA)や短い髪の毛のようなRNA(shRNA)を用いて、特定のmRNAを標的とし、遺伝子の発現を抑制する方法です。この技術は、エピジェネティックな調節因子を含む遺伝子の発現を特異的にダウンレギュレートすることで、疾患の進行を遅らせるまたは逆転させる可能性があります。
5. クリスパー/Cas9を用いたエピジェネティック編集
クリスパー/Cas9技術は、遺伝子の編集に革命をもたらしましたが、エピジェネティックな変化を直接編集するためにも利用され始めています。この技術は、Cas9タンパク質を変更してDNAを切断せずに特定の遺伝子領域に結合させ、そこにエピジェネティックな修飾を導入または除去することができます。例えば、DNAメチルトランスフェラーゼやヒストンアセチルトランスフェラーゼの酵素活性部分をクリスパー/Cas9システムに融合させることで、特定の遺伝子領域のメチル化やアセチル化を調節し、遺伝子の発現を制御することが可能になります。この手法は、エピジェネティックな異常が原因である疾患の治療に向けた新しいアプローチとして期待されています。
6. エピジェネティックなリーダードメイン阻害剤
エピジェネティックなリーダードメインは、特定のエピジェネティックな修飾を認識し、それに応じて遺伝子の発現を調節するタンパク質です。これらのドメインを標的とする阻害剤は、エピジェネティックなマークの読み取りを阻害し、異常な遺伝子発現パターンを正常化することができます。このタイプの阻害剤は、がん治療などでの応用が研究されています。
7. エピジェネティックなクロマチンリモデリング阻害剤
クロマチンリモデリングは、DNAとヒストンタンパク質からなるクロマチン構造の再構築を通じて遺伝子のアクセシビリティを変化させるプロセスです。クロマチンリモデリングを担う酵素複合体を標的とする阻害剤は、特定の遺伝子の発現を調節し、疾患の治療に寄与する可能性があります。
これらの新規治療法は、エピジェネティックな機構を利用して疾患の治療にアプローチすることにより、従来の治療法では対応が困難だった病態に対しても効果を示すことが期待されています。また、エピジェネティックな変化は可逆的であるため、治療によって異常なエピジェネティックな状態を元に戻し、疾患の根本的な治療を目指すことが可能になるかもしれません。しかし、これらの治療法の開発と臨床応用には、さらなる研究と試験が必要です。
第5章:エピゲノム研究の未来
エピゲノム研究の現状と課題
エピゲノム研究は、生物学、医学、そして治療学の多様な分野で急速に発展しており、遺伝子発現の制御、細胞のアイデンティティ、疾患の発生メカニズムの理解に大きく貢献しています。しかし、この分野の探求はまだ始まったばかりであり、多くの現状と課題が存在します。
● 現状
1. 技術の進歩: 高度なシークエンシング技術、シングルセル解析、クリスパー/Cas9によるゲノム編集などの技術進歩が、エピゲノム研究を大きく推進しています。これにより、エピジェネティックな変化をより詳細に、かつ大規模に研究できるようになりました。
2. 疾患への関連性の認識: がん、神経変性疾患、心血管疾患、精神疾患など、多くの疾患でエピジェネティックな変化が重要な役割を果たしていることが認識されています。これらの知見は、新たな診断法や治療法の開発につながっています。
3. エピジェネティクスと環境: 環境因子とエピジェネティックな変化との相互作用に関する研究が進んでいます。栄養、ストレス、化学物質への曝露などが、エピジェネティックなマークに長期的な影響を及ぼし、健康や疾患のリスクに影響を与えることが示されています。
● 課題
1. 因果関係の解明: エピジェネティックな変化と疾患の発生との間に関連性が認められても、それが原因なのか結果なのかを区別することは困難です。因果関係の明確な解明が必要です。
2. 個体差の理解: エピジェネティックな変化は個体間で大きく異なることがあり、この多様性をどのように理解し、治療に役立てるかが課題です。
3. 逆転可能性の研究: エピジェネティックな変化は理論的には可逆的ですが、異常なエピジェネティックな状態を安全かつ効果的に正常化する方法を見つけることは大きな挑戦です。
4. 長期的影響の評価: エピジェネティックな治療法が持つ長期的な影響についてはまだ十分に理解されていません。特に、エピジェネティックな編集が次世代にどのような影響を及ぼすかについては、慎重な評価が必要です。
5. 倫理的な懸念: エピジェネティックな情報の取り扱いや、エピジェネティックな編集の応用には、重大な倫理的な懸念が伴います。特に、遺伝情報のプライバシー保護、遺伝的な改変へのアクセスの公平性、そして将来の世代に対する影響など、社会的な合意形成が必要な問題が多く存在します。
6. 治療法の個別化: エピジェネティックな変化は個々の生活習慣や環境に深く影響されるため、治療法を患者一人ひとりに最適化することが求められます。このパーソナライズドメディシンの実現には、精密な診断ツールの開発と大規模なデータの解析能力が不可欠です。
7. 予防への応用: エピジェネティックな変化は、疾患の早期発見や予防に有用な情報を提供する可能性がありますが、どのようにこれらの情報を効果的に活用し、実際の予防策に繋げるかが課題です。
8. 環境因子との相互作用: 環境因子によるエピジェネティックな変化のメカニズムを明らかにし、それを防ぐまたは利用するための戦略を開発することが重要です。これには、環境、栄養学、エピジェネティックスを横断する研究が必要です。
9. 国際的な協力と基準設定: 研究データの共有と、エピジェネティックス研究における倫理的基準やプロトコルの国際的な調和が求められます。これにより、研究の進捗を促進し、異なる人口集団でのエピジェネティックな変化の理解を深めることができます。
エピゲノム研究のこれらの現状と課題は、分野が直面する複雑さを示しています。しかし、これらの課題に対処することで、エピジェネティックスの知見を広げ、新たな治療法や予防策の開発につなげることができるでしょう。継続的な研究と、科学的、倫理的、社会的な問題に対する多角的なアプローチが重要です。
未来のエピゲノム科学への展望
課題への対応
エピジェネティック研究の進展は、倫理的および社会的な課題も提起します。疾患予防や治療におけるエピジェネティック情報の利用は、プライバシーの保護、情報の公正なアクセス、そして将来の世代への影響といった問題を含みます。未来のエピゲノム科学では、これらの課題に対する明確なガイドラインと政策が必要とされ、科学者、医療従事者、患者、一般市民を含む幅広いステークホルダー間での対話が促進されるでしょう。これにより、エピジェネティクスの知見を倫理的にも責任を持って利用し、社会全体の福祉に寄与することが期待されます。
● 世代を超えた影響の理解
エピジェネティックな変化は、親から子へと遺伝する可能性があり、健康や疾患のリスクに長期にわたって影響を与えることがあります。将来のエピゲノム科学では、このような世代間影響のメカニズムを深く理解し、疾患予防や健康増進の戦略に役立てることが重要です。また、遺伝的ではないが遺伝する特性(エピジェネティックな遺伝)の知識を社会に広め、予防医学の新たなアプローチを提案することも期待されます。
● データ科学との統合
エピゲノム研究は膨大なデータを生み出し、これらのデータの分析と解釈には高度なデータ科学技術が必要です。機械学習や人工知能(AI)を活用した新しい分析手法の開発が進むことで、エピジェネティックな変化のパターンから新たな生物学的洞察を得ることが可能になります。これにより、個々の患者に最適化された治療法の選択や、疾患の早期発見、さらには新しい治療薬の開発に繋がる可能性があります。
● 環境とライフスタイルの影響
環境とライフスタイルがエピジェネティックな変化に与える影響の理解を深めることで、疾患の予防につながる生活習慣の推奨が可能になります。健康的な食事、適度な運動、ストレス管理など、科学的に根拠のあるライフスタイルの改善策が提案され、個々人の健康増進に貢献することが期待されます。
未来のエピゲノム科学の展望は明るく、そのポテンシャルは計り知れません。科学技術の進展と社会的な対話を通じて、エピジェネティックな知見を健康と疾患の理解、予防、治療に活かすことができるでしょう。さらに、エピジェネティクスの進歩は、生命科学の根底にある基本的な原理に新たな光を当てる可能性を秘めています。研究者たちは、細胞のアイデンティティがどのように決定され、維持されるのか、そしてそれがどのようにして環境や時間の経過とともに変化するのかについて、より深い理解を得ることを目指しています。
この分野の発展は、疾患治療だけでなく、健康な人々のウェルビーイングを高め、生活の質を改善するための新たなアプローチを提供します。未来のエピゲノム科学は、遺伝だけでなく、環境やライフスタイルの選択が私たちの健康にどのように影響するかを明らかにすることで、より良い健康選択を促進する情報を提供するでしょう。
しかし、この進歩を現実のものとするためには、科学的な課題だけでなく、倫理的、社会的、法的な問題にも取り組む必要があります。データのプライバシー、遺伝情報の利用、不平等の是正など、エピジェネティックな情報がもたらす可能性のある問題に対処するためには、広範な社会的合意と規制の枠組みが必要です。
最後に、未来のエピゲノム科学の成功は、多様な専門分野間の協力に依存します。生物学、医学、情報科学、社会科学、倫理学など、様々な分野の専門家が共同で作業し、エピジェネティックな研究の可能性を最大限に引き出し、その成果を公平に全人類に還元することが重要です。このような総合的なアプローチによって、エピゲノム科学は未来にわたって私たちの健康と疾患への理解を根本から変える可能性を秘めています。