目次
エピジェネティクスは遺伝情報の表現を制御する分野で、遺伝子のオン・オフを決定します。この記事では、エピジェネティクスの基本概念、そのメカニズム、および生物学及び医学における応用について詳しく解説します。
第1章:エピジェネティクスとは
Eepigeneticsの語源
「エピジェネティクス」(epigenetics)という言葉は、「遺伝子」を意味する「genetics」と、「その上に」や「加えて」という意味のギリシャ語の接頭辞「epi-(エピ)」を組み合わせた造語です。したがって、「エピジェネティクス」は直訳すると「遺伝子の上に」または「遺伝子に加わる」などという意味になり、DNAの塩基配列に変更を加えることなく遺伝子の活性を制御するメカニズムを指す言葉として用いられています。
この用語は、1942年に発展途上の生物の発生過程での遺伝子の表現に関連する現象を記述するために、英国の発生生物学者コンラッド・ハリントン・ウォディントン(Conrad Hal Waddington)によって初めて使われました。ウォディントンは、遺伝子が環境の影響を受けてどのように発現するか(つまり、遺伝情報がどのように形質として現れるか)を説明するために「エピジェネティックス」という概念を提唱しました。
当初は主に発生学的な文脈で使われていましたが、今日では細胞の遺伝情報の読み出しを調節する一連のメカニズム全体、特にDNAメチル化、ヒストン修飾、クロマチン構造の変化、非コーディングRNAによる調節などを指す言葉として、広く使われています。エピジェネティクスは、遺伝子の塩基配列自体は変わらないにもかかわらず、遺伝子の発現が変化する現象を捉えるための重要な概念となっています。
エピジェネティクスの定義
エピジェネティクスEpigeneticsは、DNAの塩基配列に変化を加えることなく遺伝子の活性を調節し、遺伝子発現パターンに長期的な影響を及ぼす一連の現象を指します。この調節メカニズムには、DNAメチル化、ヒストン修飾、クロマチンリモデリング、非コーディングRNAによる遺伝子発現の調節などが含まれます。エピジェネティックな変化は、細胞の分化、発達過程、環境応答、さらには疾患の発生に至るまで、生物のさまざまな生理的および病理的状態において重要な役割を果たします。
エピジェネティクスは、遺伝情報の読み出し方を変えることにより、同じDNA配列を持つ細胞が異なる形態や機能を持つことを可能にします。これにより、多細胞生物は様々な細胞型を形成し、複雑な組織や器官を構築することができます。また、エピジェネティクスは、生物が環境の変化に対応し、生存戦略を調整するための機構としても機能します。
重要なのは、エピジェネティックな変化は可逆的であり、外部のシグナルや環境因子によって調節されることが多いという点です。この性質により、エピジェネティクスは疾患の治療や予防の新しいアプローチを提供する可能性を秘めています。エピジェネティックな治療法は、異常な遺伝子発現パターンを正常化することを目指し、疾患の根本的な原因に対処することが期待されています。
エピジェネティクスの歴史と進化
エピジェネティクスの概念と研究は、20世紀初頭に遡りますが、この分野が大きく発展し、広く認識されるようになったのは近年のことです。エピジェネティクスの歴史と進化を追うことは、現代生物学における遺伝子の理解がどのように深まってきたかを示す興味深い旅です。
● 初期の概念形成
– 1942年: コンラッド・ハリントン・ウォディントンによって「エピジェネティクス」という用語が導入されました。彼は発生過程において遺伝子の発現が環境によってどのように調節されるかに興味を持ち、エピジェネティクスの概念を提唱しました。しかし、この時点では、エピジェネティックな変化を分子レベルで理解するための技術や知識はまだありませんでした。
● 分子エピジェネティクスの誕生
– 1975年: ロビン・ホリデイとジョン・ポーが、遺伝子の発現に影響を与えるDNAメチル化についての理論を提案しました。これは、分子レベルでエピジェネティックな現象を説明する最初の試みの一つでした。
● 技術の進歩と概念の拡大
– 1990年代~2000年代: PCR(ポリメラーゼ連鎖反応)技術やシークエンシング技術の進化により、エピジェネティックな変化をより詳細に研究することが可能になりました。この時期には、ヒストン修飾やクロマチンリモデリングといった他のエピジェネティックなメカニズムに関する研究も進みました。
● エピジェノムプロジェクト
– 2000年代後半: ヒトゲノムプロジェクトの成功に続き、エピジェノムマッピングプロジェクトが世界中で開始されました。これらのプロジェクトは、健康な細胞と疾患細胞のエピジェネティックな状態を広範囲にわたって解析し、特定の疾患とエピジェネティックな変化との関連を明らかにすることを目指しました。
● 現在と未来への展望
– 近年、クリスパー/Cas9をはじめとする遺伝子編集技術の進化は、エピジェネティックな変化を意図的に誘導または修正する可能性を提供しています。これにより、エピジェネティックな変化が原因の疾患に対する新たな治療法の開発が期待されています。
エピジェネティクスの研究は、生命科学の多くの基本的な質問に答えるための鍵を提供し、遺伝学、発生生物学、医学、さらには心理学や行動科学に至るまで、幅広い分野に影響を及ぼしています。エピジェネティクスが示す、環境と遺伝子の間の相互作用の理解は、遺伝だけでなく生活習慣や環境が健康に及ぼす影響を再評価することにつながりました。特に、発達初期や生命の早い段階での環境因子が、成人期の健康や病気のリスクに長期的な影響を与える可能性があることが示されています。
また、精神健康や行動の分野では、ストレス、トラウマなどの経験がエピジェネティックな変化を通じて、心理的な健康や行動に影響を与えることが明らかになってきています。これは、心理療法や社会的サポートがエピジェネティックなレベルでポジティブな変化を促す可能性があることを示唆しており、治療法の開発に新たな方向性を提供しています。
このように、エピジェネティクスの研究は、生物学的なプロセスだけでなく、人間の健康や病気への理解を深めるための新しい視点を提供します。しかし、エピジェネティックな研究はまだその初期段階にあり、エピジェネティックな変化と特定の疾患や行動との間の因果関係を完全に解明するためには、さらなる研究が必要です。
未来の展望としては、個人のエピジェノムを詳細にマッピングし、それを健康管理や疾患治療に活用することが考えられます。また、エピジェネティックな変化を正確に操作する技術の発展により、遺伝的な疾患だけでなく、エピジェネティックな変化が関与する疾患の治療にも新たな道が開かれるでしょう。さらに、エピジェネティクスの知見を基にした新しい予防策や治療法の開発により、より健康で質の高い生活を送ることが可能になると期待されています。
このように、エピジェネティクスの進展は、生命科学のみならず、医学、心理学、社会科学など多岐にわたる分野において、新たな理解と治療法の開発を促進する可能性を秘めています。今後も技術の進化とともに、エピジェネティクス研究の新たな地平が開かれることでしょう。
第2章:エピジェネティクスの主要なメカニズム
DNAメチル化と遺伝子の制御
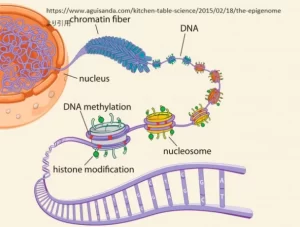
DNAメチル化はエピジェネティクスにおける主要なメカニズムの一つで、遺伝子の発現を制御する重要な役割を担っています。DNAメチル化とは、DNA分子のシトシン塩基にメチル基(-CH3)が付加される化学的変更のことを指します。このメチル化は、主にCGダイヌクレオチド(シトシンの後にグアニンが来る塩基対)の領域で発生しますが、これをCpGサイトと呼びます。CpGサイトが多く集まる領域をCpGアイランドと呼び、これらはしばしば遺伝子のプロモーター領域に位置しています。
● DNAメチル化の役割
1. 遺伝子の発現の抑制: DNAメチル化は一般的に遺伝子のサイレンシングに関与しています。メチル化されたCpGアイランドは、遺伝子のプロモーター領域の活性を低下させ、その結果、遺伝子の転写が抑制されます。これは、転写因子がDNAに結合するのを妨げることで起こります。
2. 細胞分化における役割: DNAメチル化パターンは、細胞が分化する過程で変化し、特定の細胞型に特有の遺伝子発現プロファイルを確立します。これにより、全ての細胞が同じゲノムを持ちながらも、異なる機能を持つ細胞型に分化することが可能になります。
3. 遺伝的インプリンティング: 特定の遺伝子は、父親または母親から受け継がれたアレルに応じてのみ発現することがあります。この現象は遺伝的インプリンティングと呼ばれ、DNAメチル化はこの過程において重要な役割を果たします。
4. X染色体の不活化: 女性はX染色体を2つ持ちますが、そのうちの1つは早い発生段階でランダムに不活化されます。このX染色体の不活化にもDNAメチル化が関与しており、不活化されたX染色体上の遺伝子が発現されないようにします。
5. ゲノムの安定性の維持: DNAメチル化は、トランスポゾンなどの移動遺伝子要素の活動を抑制することでゲノムの安定性を維持に寄与します。これにより、突然変異の発生率が抑えられ、ゲノムの整合性が保たれます。
● 課題と展望
DNAメチル化の研究は、がんや神経変性疾患、心血管疾患など、多くの疾患との関連を明らかにしています。DNAメチル化パターンの異常は、これらの疾患の発生メカニズムに深く関与していることが示されており、エピジェネティックな治療法の開発や、疾患の早期診断およびリスク評価に向けたバイオマーカーとしての利用が期待されています。しかし、これらのポテンシャルを完全に活用するためには、いくつかの課題があります。
1. 因果関係の解明: DNAメチル化の変化が特定の疾患の原因であるか、またはその結果であるかを区別することは依然として難しい問題です。この区別を明確にするためには、長期的な疫学研究や、介入研究が必要です。
2. 個体差の理解: 個人のDNAメチル化パターンは、遺伝的背景だけでなく、生活習慣や環境因子によっても大きく影響されます。これらの個体差を理解し、それを治療や予防策にどのように組み込むかは、今後の大きな課題です。
3. 逆転可能性の研究: DNAメチル化は理論上は可逆的な変化ですが、実際に異常なメチル化パターンを正常化することが、すべての疾患において可能か、また安全かどうかはまだ明らかではありません。この逆転可能性を探るための研究が重要です。
4. 技術の発展: DNAメチル化を詳細にかつ大規模に分析するための技術、特にシングルセルレベルでのメチル化状態を解析する技術の発展が、エピジェネティクス研究を加速します。これにより、より正確な疾患モデルの構築や、個別化医療への応用が進むことが期待されます。
5. 治療法の開発: DNAメチル化に基づいた治療法の開発、特にメチル化パターンを特定の疾患に対して効果的に調節する薬剤の開発は、今後の研究で注目される分野です。これらの治療法が実際に臨床で使用されるには、効果の検証と安全性の確認が必要です。
エピジェネティクス、特にDNAメチル化の研究は、私たちの健康と病気に対する理解を根本的に変える可能性を秘めています。これらの研究が進むにつれて、新しい診断ツールや治療法が開発され、より効果的な疾患管理や予防策が実現されることが期待されています。
ヒストン修飾とクロマチンの構造変化
ヒストン修飾とクロマチンの構造変化は、エピジェネティクスにおける重要なメカニズムであり、遺伝子の発現を制御する上で中心的な役割を果たします。これらの過程は、DNAがどのようにパッケージされ、アクセス可能になるかを調節し、細胞の機能と運命を決定します。
● ヒストン修飾
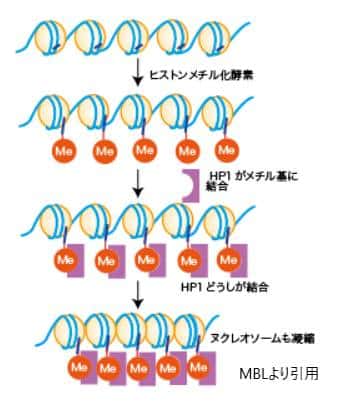
ヒストン修飾とは、ヒストンタンパク質のアミノ酸残基に様々な化学基が結合することです。ヒストンはDNAを巻きつけるタンパク質で、DNAと共にクロマチンを形成します。ヒストン修飾には、アセチル化、メチル化、リン酸化、ウビキチン化など多岐にわたる修飾があり、これらはヒストンの構造と機能を変化させ、遺伝子の発現を調節します。
– アセチル化: ヒストンのリジン残基にアセチル基が結合すると、DNAとヒストンの間の静電気的な相互作用が弱まり、クロマチンがリラックスした状態になります。これにより、遺伝子が転写しやすくなり、遺伝子の発現が促進されます。
– メチル化: リジンやアルギニン残基のメチル化は、遺伝子の活性化または抑制の両方に関与することがあり、その効果はメチル化されるアミノ酸残基の位置とメチル基の数に依存します。
● クロマチンの構造変化
クロマチンの構造変化は、ヒストン修飾と密接に関連していますが、クロマチンリモデリング複合体によっても引き起こされます。これらの複合体はATPを消費してヒストンとDNAの間の相互作用を変化させ、クロマチンの構造をアクティブな(リラックスした)状態やサイレントな(コンパクトな)状態へと変換します。
– アクティブなクロマチン: リラックスしたクロマチンは、転写因子やRNAポリメラーゼIIなどの転写機構がDNAにアクセスしやすい状態です。これにより遺伝子の発現が促進されます。
– サイレントなクロマチン: コンパクトなクロマチン構造は、遺伝子のプロモーター領域が転写機構によってアクセスされにくくなり、遺伝子の発現が抑制されます。
ヒストン修飾とクロマチンの構造変化は、細胞の分化、発達、応答性の調節に不可欠であり、異常が発生するとがんや神経変性疾患などの疾患に繋がる可能性があります。エピジェネティクスの研究において、これらの過程を理解することは、新たな治療戦略の開発に向けた鍵となります。特に、異常なヒストン修飾やクロマチンの構造変化が原因である疾患に対して、これらの過程を正常化することが治療の新たなアプローチとして考えられています。
● 新たな治療戦略の展開
– ヒストン修飾酵素の阻害剤: 異常なヒストン修飾を標的とする薬剤が開発されています。例えば、ヒストン脱アセチル化酵素(HDAC)阻害剤は、クロマチンをリラックスさせて遺伝子の発現を促進することにより、がんなどの疾患に対して効果を示すことがあります。同様に、ヒストンメチルトランスフェラーゼ阻害剤も研究されています。
– クロマチンリモデリング因子を標的としたアプローチ: クロマチンの構造を特定の遺伝子領域で変化させることにより、その遺伝子の発現を制御する戦略も考えられています。これにより、特定の遺伝子を選択的に活性化または抑制することが可能になります。
● 疾患の早期診断と予防
– エピジェネティックマーカーの利用: 異常なヒストン修飾やクロマチンの構造変化は、疾患の早期診断や予後の予測に役立つバイオマーカーとしての潜在力を持っています。これらのマーカーを用いて、疾患の進行を監視したり、治療の効果を評価したりすることができます。
● 未来への展望
– 個別化医療への応用: 個人のエピジェネティックプロファイルを詳細に解析することで、よりパーソナライズされた治療戦略を開発することが期待されています。このアプローチにより、患者一人ひとりに最適な治療法を提供することが可能になります。
– エピジェネティクス研究の技術進歩: シングルセルエピジェネティクス解析、高解像度クロマチン構造マッピング、実時間エピジェネティクスイメージングなど、新しい技術の開発がエピジェネティクス研究を加速し、新たな発見につながることが期待されています。
ヒストン修飾とクロマチンの構造変化の理解は、生命科学の多くの分野において基礎となる知識です。この知見を深めることで、疾患の根本的な原因にアプローチし、より効果的で副作用の少ない治療法の開発につながることが期待されています。
第3章:エピジェネティクスの生物学的意義
発生生物学におけるエピジェネティクス
発生生物学におけるエピジェネティクスは、個体発生の過程で細胞の分化と組織の形成を調節する基本的なメカニズムとして中心的な役割を担っています。エピジェネティックな変化は、遺伝子の発現パターンを制御し、同じゲノムを持つ細胞が異なる細胞型に分化することを可能にします。このプロセスは、胚発生、器官形成、さらには成体のホメオスタシス(恒常性維持)に至るまで、生物の発達の各段階で不可欠です。
● 分化と発生過程でのエピジェネティクスの役割
1. 細胞分化: 初期胚の細胞は多能性を持ち、任意の細胞型に分化する能力があります。エピジェネティックな調節により、特定の遺伝子が活性化または抑制され、細胞は特定の運命に導かれます。この過程は、DNAメチル化、ヒストン修飾、クロマチンリモデリングによって細かく制御されます。
2. X染色体の不活化: 女性哺乳類の細胞では、二つのX染色体のうち一方が不活化されます。これはエピジェネティックな機構によるもので、遺伝子の発現のバランスを保つために必要です。X染色体の不活化は、XISTという非コーディングRNAによって開始され、エピジェネティックな修飾が維持されます。
3. 遺伝的インプリンティング: 特定の遺伝子は、母親または父親から受け継がれたアレルのみが発現します。この現象は遺伝的インプリンティングと呼ばれ、DNAメチル化が重要な役割を果たします。インプリンティング遺伝子の異常は、成長障害や神経発達障害を引き起こすことがあります。
4. 組織特異的な遺伝子発現: 組織や器官が形成される過程で、細胞は特定の遺伝子セットの発現を必要とします。エピジェネティックな調節によって、組織特異的な遺伝子発現パターンが確立され、細胞のアイデンティティが維持されます。
● 発生生物学におけるエピジェネティクスの課題と展望
– 課題: 発生過程におけるエピジェネティックな変化の全貌を解明することは、依然として大きな課題です。特に、多能性から特定の細胞型への遷移を制御する詳細なメカニズムの理解は、再生医療や疾患モデリングにおいて重要です。
– 展望: エピジェネティックな変化を精密に制御する技術の開発は、組織工学や再生医療の分野において大きな進歩をもたらす可能性があります。例えば、特定の細胞型に必要なエピジェネティックな状態を人工的に誘導することで、損傷した組織の修復や代替することが期待されています。このアプローチは、心筋梗塞後の心筋の再生や、1型糖尿病患者のためのインスリン産生細胞の再生など、具体的な臨床応用に繋がる可能性を秘めています。
さらに、エピジェネティクスの知見は、発生異常や先天性疾患の予防および治療への応用も見込まれます。遺伝的インプリンティングの異常や、エピジェネティックな変化による発生障害の早期診断と介入は、疾患の発症を防ぐか、その影響を最小限に抑えるための新たな戦略を提供します。
また、エピジェネティクスは、環境因子が発生過程に与える影響の理解を深めることにも貢献します。母親の栄養状態やストレスレベルが胎児の健康に長期的な影響を与えることが知られており、これらの影響はしばしばエピジェネティックなメカニズムを通じて媒介されます。したがって、妊娠中の適切な栄養摂取やストレス管理が、子どもの健康に及ぼすエピジェネティックな影響を最小限に抑える重要な戦略となります。
エピジェネティックな研究は、個体発生の理解を根本から変えつつありますが、この分野の知識はまだ完全には解明されていません。今後の研究が進むにつれて、発生生物学におけるエピジェネティクスの謎を解き明かし、それを医学的応用に結びつける新たな可能性が開かれることでしょう。
エピジェネティクスと環境因子
エピジェネティクスと環境因子との関係は、遺伝情報の読み出し方における環境の役割を理解する上で重要な概念です。環境因子は、栄養状態、ストレス、化学物質の曝露、運動など、生活のあらゆる側面を含みます。これらの因子はエピジェネティックな変化を誘導し、遺伝子の発現を変化させることができます。この相互作用は、健康や疾患のリスクに深い影響を及ぼすことがあります。
● 栄養とエピジェネティクス
栄養はエピジェネティクスにおいて中心的な役割を果たします。たとえば、葉酸、ビタミンB12、ビタミンB6、メチオニンなどの栄養素は、メチル化反応に必要なメチル基の供給源となります。これらの栄養素の摂取が適切でないと、DNAメチル化が影響を受け、遺伝子の発現に変化が生じる可能性があります。このようなエピジェネティックな変化は、がんや心血管疾患といった慢性疾患のリスクに影響を及ぼすことが示されています。
● ストレスとエピジェネティクス
心理的ストレスもエピジェネティックな変化を引き起こすことがあります。ストレスは、特定の遺伝子のメチル化パターンを変化させることにより、ストレス応答に関わる遺伝子の発現を変えることができます。例えば、児童虐待などの早期のトラウマは、ストレス関連疾患のリスクを高めるエピジェネティックな変化を引き起こすことが知られています。
● 環境化学物質の曝露
化学物質への曝露、特に妊娠中や発達初期の曝露は、エピジェネティックな変化を引き起こし、発達障害や後の生活での疾患リスクを高める可能性があります。例えば、ビスフェノールA(BPA)やフタル酸エステルなど、内分泌攪乱化学物質の曝露は、特定の遺伝子のメチル化を変化させることが示されています。
● 運動とエピジェネティクス
定期的な運動は、多くの遺伝子のメチル化パターンに影響を与えることができます。これらの変化は、炎症反応の低下、インスリン感受性の向上、心血管系の健康の向上など、運動が持つ健康効果に寄与する可能性があります。
エピジェネティクスと環境因子の相互作用の理解は、健康を促進し、疾患の予防や治療に向けた戦略を開発する上で重要です。環境因子によって引き起こされるエピジェネティックな変化を理解することは、個人の健康リスクを特定し、カスタマイズされた予防措置や治療法を提供するためのパーソナライズドメディシンへの道を開きます。
● 環境因子の長期的影響
特に、妊娠期や幼少期など、生命の初期段階での環境因子の影響は、生涯にわたって健康に影響を及ぼす可能性があるため、注意が必要です。たとえば、妊娠中の栄養不足は、子どもの将来の肥満や2型糖尿病のリスクを高めることが知られています。これらのエピジェネティックな影響は、時には次世代にも伝えられることがあり、疾患の発生や健康不均衡の根本的な原因となる可能性があります。
● 予防と介入
エピジェネティクスと環境因子の相互作用に関する知識は、疾患の予防策や生活習慣の改善指針を提供します。たとえば、適切な栄養摂取、定期的な運動、ストレス管理などは、エピジェネティックな健康を維持し、慢性疾患のリスクを低減するための効果的な手段です。さらに、特定の化学物質への曝露を避けることによって、エピジェネティックなリスクを減らすことも可能です。
● 未来の研究方向
エピジェネティクス研究の未来は、環境因子とエピジェネティックな変化の間の具体的なメカニズムを解明することに焦点を当てています。このような知見は、より効果的な予防措置や治療法の開発に繋がる可能性があります。また、エピジェネティックな変化をリバースする、または調節する技術の開発も、未来の研究における重要なテーマです。
エピジェネティクスと環境因子の相互作用に関する理解の深化は、健康促進と疾患予防の新たなパラダイムを提供し、将来的には人々の生活の質を向上させることに貢献するでしょう。