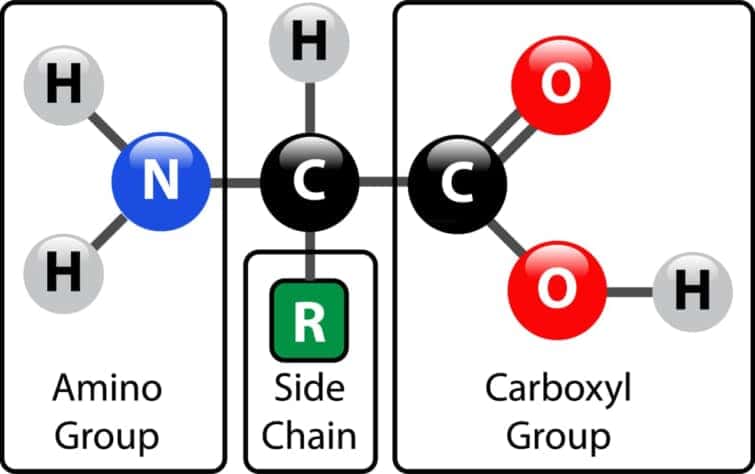
アミノ酸は、塩基性のアミノ基(-NH2)、酸性のカルボキシル基(-COOH)、およびそれぞれのアミノ酸特有の有機R基(側鎖)を含む有機分子です。これらはα-アミノカルボン酸とも呼ばれ、各分子の中心にあるα-炭素という炭素原子にアミノ基とカルボキシル基が結びついています。α-炭素原子の他の2つの結合位置は、通常、水素原子とR基で構成されています。
アミノ酸の化学構造の基本
アミノ酸は塩基性のアミノ基(-NH2)、酸性のカルボキシル基(-COOH)、そしてそれぞれのアミノ酸に特有の有機R基(側鎖)から構成される有機分子です。これらの分子は中心に位置するα-炭素にアミノ基とカルボキシル基が結びついており、α-炭素の残りの二つの結合は一つは水素原子、もう一つはR基で占められています。この構造がアミノ酸の基本骨格を形成しています。
アミノ酸は、実際には「α-アミノカルボン酸」の略称で、中央の炭素原子(α-炭素)にアミノ基とカルボキシル基が接続された分子を指します。α-炭素は結合するための「手」が4つあると考えることができ、残りの2つの「手」は通常、水素原子とRグループ(側鎖)によって占められています。この構造が、アミノ酸の特徴的な骨格を形成しています。
アミノ酸の種類
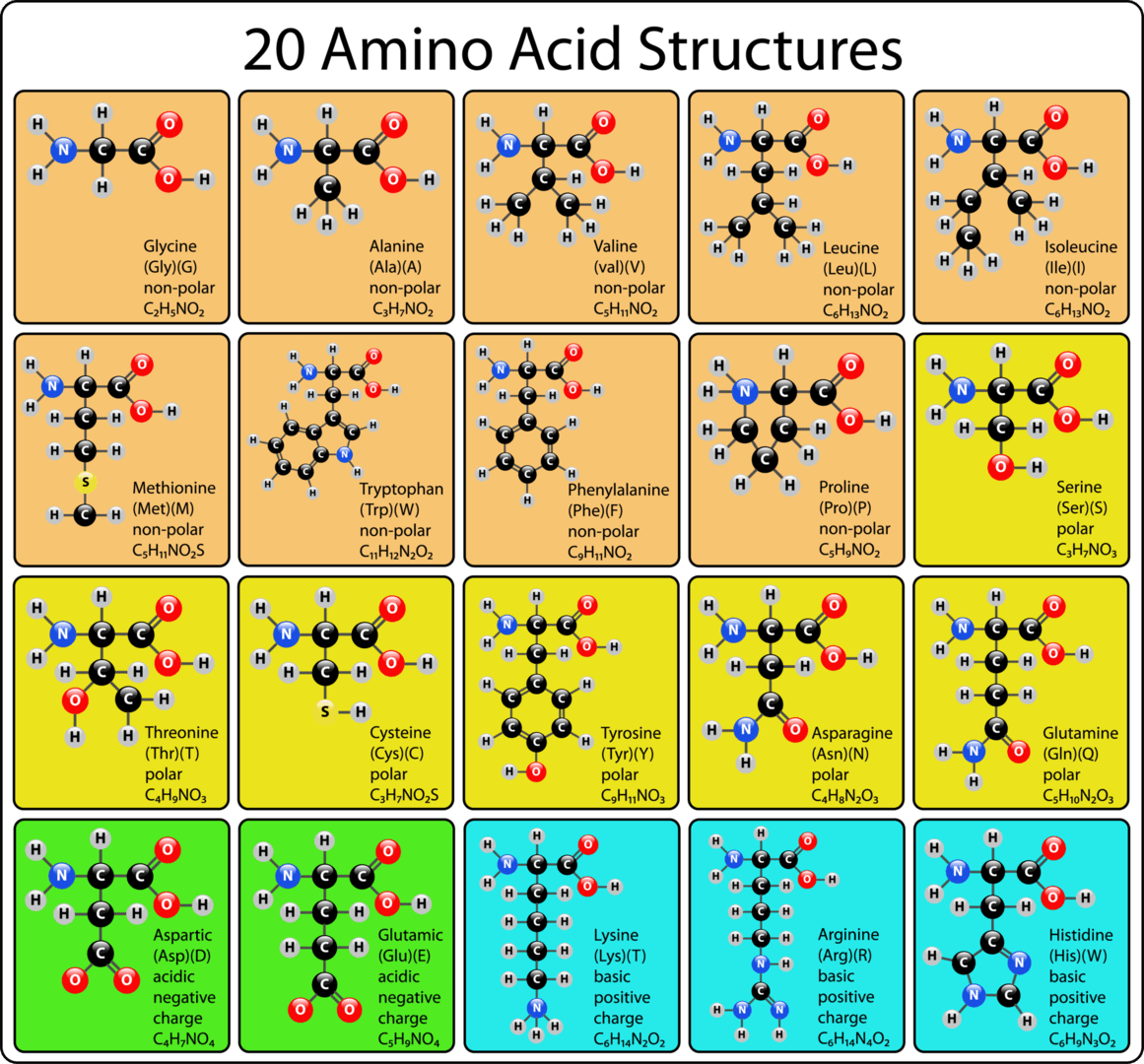
以下は20個の主要なアミノ酸の化学構造式である。
アミノ酸の分類|必須かそうでないか
人体では、20種類のアミノ酸がタンパク質の構成要素として重要な役割を果たしています。このうち9種類は「必須アミノ酸」と呼ばれ、私たちの食事から摂取する必要があります。これらはヒスチジン、イソロイシン、ロイシン、リジン、メチオニン、フェニルアラニン、スレオニン、トリプトファン、バリンです。一方で、アラニン、アスパラギン、アスパラギン酸、グルタミン酸、セリンの5種類は体内で合成できる「非必須アミノ酸」です。残りの6種類はアルギニン、システイン、グルタミン、グリシン、プロリン、チロシンで、これらは特定のライフステージや特定の疾患がある場合にのみ必須とされる「条件付きアミノ酸」です。
アミノ酸は、そのR基(側鎖)の極性や電荷の分布に基づき、通常「標準」または「非標準」に分類されます。タンパク質を構成する20種類のアミノ酸は「標準アミノ酸」とされます。非標準アミノ酸は、タンパク質に組み込まれた後に化学的に修飾されるアミノ酸(翻訳後修飾)や、タンパク質には存在しないが生体内で特定の機能を持つアミノ酸を指します。例えば、血液凝固タンパク質のプロトロンビンに含まれるカルシウム結合性アミノ酸残基であるγ-カルボキシグルタミン酸が非標準アミノ酸の一例です。真核生物では、セリン、スレオニン、チロシンのR基の水酸基にリン酸分子が付加されるリン酸化が最も重要な翻訳後修飾の一つであり、タンパク質の機能や細胞のシグナル伝達の調節に重要な役割を果たしています。
荷電したアミノ酸
1. 中性で正の電荷を持つ塩基性アミノ酸:リジン(Lys)、アルギニン(Arg)
2. 中性で負の電荷を持つ酸性アミノ酸:アスパラギン酸(Asp)、グルタミン酸(Glu)
塩基性アミノ酸であるリジン(Lys)、アルギニン(Arg)は中性状態で正の電荷を持ち、一方、酸性アミノ酸であるアスパラギン酸(Asp)、グルタミン酸(Glu)は中性状態で負の電荷を持ちます。これらの正と負に帯電したアミノ酸の側鎖が互いに作用し合い、いわゆる塩橋を形成することが、タンパク質の立体構造を安定化させるのに重要であるとされています。特に、80℃から90℃やそれ以上の高温で生存する好熱性生物のタンパク質では、これら電荷を持ったアミノ酸がタンパク質の表面に広がる塩橋のネットワークを作り出し、高温による変性からタンパク質を保護する耐熱性に貢献しています。また、AspとGluの負に帯電したカルボキシル基は、金属イオンと結合するという重要な機能も担っています。これにより、タンパク質の構造や機能に対する金属イオンの影響が理解されます。
極性アミノ酸
アミノ酸の極性は、その側鎖(R基)の化学的性質によって決まります。アミノ酸は、その側鎖が水と相互作用する能力に基づいて、極性と非極性に分類されます。極性アミノ酸は、水に溶けやすい(親水性がある)特性を持ち、非極性アミノ酸は、水に溶けにくい(疎水性がある)特性を持ちます。
極性アミノ酸の側鎖には、水素結合を形成できる電気陰性な原子(例:酸素、窒素)や、イオン化して正または負の電荷を帯びることができる官能基が含まれています。これにより、極性アミノ酸は水分子と強く相互作用し、溶液中での溶解性が高くなります。一方、非極性アミノ酸の側鎖は、炭素と水素から成り、水との相互作用が弱いため、溶解性が低くなります。
極性アミノ酸はさらに、その側鎖の電荷に基づいて、非電荷(中性)極性アミノ酸、正に帯電した塩基性アミノ酸、負に帯電した酸性アミノ酸に細分化されることがあります。この極性は、タンパク質が特定の構造をとる際の相互作用や、タンパク質同士、または他の分子との相互作用に大きな影響を与え、タンパク質の機能や活性を決定します。
アミノ酸の極性について考える際、セリン(Ser)、スレオニン(Thr)、チロシン(Tyr)はその水酸基(-OH)の存在により明らかに極性を持ち、これらの極性基は他の極性基と水素結合を形成することで、プロトンの供与や受容に関与します。アスパラギン(Asn)とグルタミン(Gln)も極性を持ち、極性のあるアミド基を含んでいます。
R基にカルボキシ基が追加されると、アスパラギン酸(RがCH2-COOH)とグルタミン酸(Rが(CH2)2-COOH)のみが該当し、これらは明確に酸性アミノ酸として極性を持ちます。
ヒスチジン(His)はその環境やpHに応じて極性と電荷の両方を持ち得る特殊なアミノ酸です。2つの-NH基を持つヒスチジンの側鎖は、pKa値が約6であり、プロトン化されると+1の電荷を帯びます。このpKaはタンパク質の環境によって変化し、側鎖はプロトンを放出したり受容したりして電荷の変動が生じます。ヒスチジンはこの性質を活かして、酵素の活性部位でプロトンの引き抜きに必要な場面で重要な役割を果たします。
芳香族アミノ酸であるトリプトファン(Trp)、チロシン(Tyr)、および非芳香族のメチオニン(Met)は、極性と非極性の両方の性質を持ち、これらはタンパク質と溶媒の界面に存在することが多いです。また、ヒスチジン、チロシン、フェニルアラニン、トリプトファンの側鎖は環構造内の電子雲を利用して、弱い水素結合(OH-π型やCH-O型)を形成することが可能です。これらの相互作用はタンパク質の立体構造や機能に影響を与える重要な要素です。
塩基性アミノ酸の一つであるリシンは、そのR基にさらに一つのアミノ基(-NH2)を持ちます。具体的には、R基の構造は(CH2)4-NH2となり、これはリシンの特徴的な側鎖を形成しています。この追加のアミノ基により、リシン(R:(CH2)4 –NH2)は塩基性を示し、タンパク質の立体構造や機能において重要な役割を果たします。
●酸性アミノ酸は、その側鎖に負の電荷を持つカルボキシル基(-COOH)がイオン化してカルボキシレートアニオン(-COO⁻)の形を取ることが特徴です。このカテゴリーに属する主なアミノ酸は、アスパラギン酸(Aspartic acid, Asp, D)とグルタミン酸(Glutamic acid, Glu, E)の2種類です。これらのアミノ酸は、生理的pHでは一般的に負の電荷を帯びており、タンパク質の構造内で他の帯電した側鎖や水分子と強い静電的相互作用を行うことができます。
### アスパラギン酸(Asp, D)
– 側鎖に1つのカルボキシル基を持ちます。
– この追加のカルボキシル基がイオン化して負の電荷を持ちます。
– 水溶性が高く、タンパク質の表面に位置することが多いです。
### グルタミン酸(Glu, E)
– 側鎖がアスパラギン酸よりも1つ長い炭素鎖を持ち、その末端にカルボキシル基があります。
– イオン化すると、このカルボキシル基も負の電荷を持ちます。
– アスパラギン酸と同様に、水溶性が高く、タンパク質の表面で活動的な役割を果たします。
これらの酸性アミノ酸は、タンパク質の活性サイトや静電的相互作用を必要とするタンパク質間の相互作用において重要な役割を担います。また、酸性アミノ酸は、金属イオンの結合や酵素反応における基質の結合にも関与しており、生命活動における多様な機能を有しています。
●塩基性アミノ酸
塩基性アミノ酸は、その側鎖に含まれるアミノ基(-NH2)がプロトン(H⁺)を受け取りやすく、生理的pHでは正の電荷を帯びることが特徴です。このカテゴリーには、リジン(Lysine, Lys, K)、アルギニン(Arginine, Arg, R)、およびヒスチジン(Histidine, His, H)の3種類のアミノ酸が含まれます。これらのアミノ酸はタンパク質の構造や機能において重要な役割を果たし、特にタンパク質間相互作用や酵素の活性化、遺伝子の発現調節において重要です。
### リジン(Lys, K)
– 側鎖には長い炭素鎖の末端にアミノ基が存在し、このアミノ基がプロトンを受け取り、正の電荷を持ちます。
– タンパク質の構造内で、他の負に帯電した側鎖やDNAと強い静電的相互作用を行うことができます。
### アルギニン(Arg, R)
– 側鎖が複雑な構造を持ち、末端にはグアニジウム基があります。このグアニジウム基がプロトンを受け取りやすく、強い塩基性を示します。
– DNAやRNAとの結合、タンパク質のアセンブリ、酵素活性において中心的な役割を果たします。
### ヒスチジン(His, H)
– 側鎖にはイミダゾール環があり、この環の窒素原子がプロトンを受け取ることができます。
– 生理的pHに近いpKa値を持ち、微妙にプロトンの受け渡しを行い、酵素の触媒反応において重要な役割を果たします。
これらの塩基性アミノ酸は、タンパク質の正の電荷を通じて静電的相互作用を提供し、タンパク質の構造の安定化、分子間相互作用、および生化学的プロセスの調節に貢献します。また、特定の塩基性アミノ酸は、細胞内シグナリングや遺伝子の転写調節などのプロセスにおいて特に重要な機能を持っています。
●中性アミノ酸
中性アミノ酸は、その側鎖(R基)が生理的pHで電荷を持たないアミノ酸のグループを指します。これらは極性中性アミノ酸と非極性中性アミノ酸に分けることができます。極性中性アミノ酸は、側鎖に電荷を持たないが水と相互作用できる極性官能基を含み、一方、非極性中性アミノ酸は、主に炭素と水素で構成される疎水性の側鎖を持ちます。
※極性中性アミノ酸
これらのアミノ酸は、水溶性があり、タンパク質の表面や活性部位に位置することが多く、特定の分子間相互作用に重要な役割を果たします。
セリン(Ser, S):側鎖に水酸基(-OH)を持ち、水素結合を形成することができます。
スレオニン(Thr, T):側鎖に水酸基を持ち、セリンと同様に水素結合による相互作用が可能です。
チロシン(Tyr, Y):側鎖に芳香族環と水酸基を持ち、強い極性を示します。
アスパラギン(Asn, N):側鎖にアミド基を持ち、水との相互作用に寄与します。
グルタミン(Gln, Q):アスパラギンと同様にアミド基を持ちます。
システイン(Cys, C):側鎖にチオール基(-SH)を持ち、酸化されるとジスルフィド結合を形成します。
※非極性中性アミノ酸
これらは、タンパク質の内部や疎水性環境で見られ、タンパク質の構造の安定化に寄与します。
アラニン(Ala, A)
バリン(Val, V)
ロイシン(Leu, L)
イソロイシン(Ile, I)
メチオニン(Met, M)
フェニルアラニン(Phe, F)
トリプトファン(Trp, W)
プロリン(Pro, P)
中性アミノ酸は、タンパク質の構造や機能において多様な役割を果たします。極性中性アミノ酸は、特に酵素反応や分子間の特定の相互作用において重要であり、非極性中性アミノ酸はタンパク質の構造の安定化や疎水性相互作用に貢献します。
疎水性アミノ酸
疎水性アミノ酸にはアラニン(Ala, A)、バリン(Val, V)、ロイシン(Leu, L)、イソロイシン(Ile, I)、プロリン(Pro, P)、フェニルアラニン(Phe, F)、そしてシステイン(Cys)が含まれます。これらのアミノ酸は主に、水分子との相互作用が少ないために、タンパク質の内部で見られることが多く、その疎水性の性質がタンパク質の立体構造の安定化に貢献しています。疎水性アミノ酸はファンデルワールス力を介して相互作用し、これによりタンパク質内部のコアを安定させるのに重要な役割を果たしています。
特にシステイン(Cys)は、その独特な性質から、タンパク質構造の安定化に特別な役割を担っています。システインのチオール基(-SH)が酸化されると、二つのシステインがジスルフィドブリッジ(S-S結合)を形成し、これがタンパク質の3次元構造の安定化に寄与します。ジスルフィドブリッジは、タンパク質の異なる領域を互いに結びつけたり、タンパク質複合体の異なるサブユニット間の結合を強化することもあります。
システインが疎水性アミノ酸に分類されるかについては意見が分かれることがあります。一方で、その疎水性によってタンパク質内部に位置すると見なされることがありますが、他方で、システインのチオール基が特定の化学反応やタンパク質の表面近くでの機能に関与することもあるため、極性を持つと考える場合もあります。このように、システインはその位置や機能に応じて、疎水性または極性の性質を示すことができるユニークなアミノ酸です。
グリシンとプロリン
グリシン(Gly)は、その側鎖が存在しないために特別な位置を占める一般的なアミノ酸です。この単純さにより、グリシンはタンパク質のループやコイルのような二次構造を持たない領域に多く存在し、ポリペプチド鎖に大きな柔軟性を与えます。この柔軟性は、特にタンパク質のループ領域において、ポリペプチド鎖の急速な回転を可能にし、タンパク質の様々な機能を果たすための構造的適応性を提供します。
一方で、プロリン(Pro)はグリシンとは対照的な性質を持つアミノ酸です。プロリンは一般的に非極性であり、その独特な側鎖は主鎖に共有結合して環状構造を形成します。この結合により、プロリンを含むポリペプチド鎖の部分のファイ角(φ角)が制約され、鎖に剛性を与えます。この剛性は、ポリペプチド鎖の特定のねじれ角を強制し、タンパク質の特定の構造形成に寄与します。プロリンは、その独特の構造的特性から、α-ヘリックスの末端やターンによく見られ、”helix breaker”(ヘリックスを破壊する)と呼ばれることがあります。これは、プロリンの存在がα-ヘリックス構造の形成を妨げ、タンパク質の構造に特定の曲がりや折れ曲がりをもたらすことを意味します。
グリシンとプロリンは、タンパク質の構造と機能に重要な役割を果たすことで、タンパク質生物学の中で特に注目されるアミノ酸です。
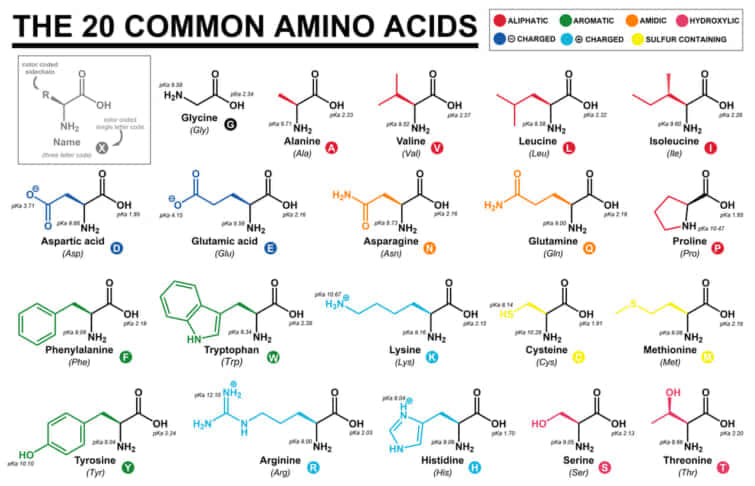
アミノ酸の分類のまとめ
以下に、タンパク質の中で最も一般的な20種類のアミノ酸を、3文字と1文字のコードとともに示します。
荷電性(側鎖がしばしば塩橋を形成する)
- – アルギニン – Arg – R
- – リジン – Lys – K
- – アスパラギン酸(Asp)・・・D
- – グルタミン酸(Glu)・・・E
荷電性アミノ酸の覚え方:酸性で(DE)くらーい(KRH)アルカリ
酸性はASP(D)、グルタミン酸(E)です。
極性(プロトン供与体または受容体として水素結合を形成する)
- – グルタミン – Gln – Q
- – アスパラギン – Asn – N
- – ヒスチジン – His – H
- – セリン – Ser – S
- – スレオニン – Thr – T
- – チロシン – Tyr – Y
- – システイン – Cys – C
極性アミノ酸の覚え方:極端にHなYCさんSTでキュン(QN)死
両性具有(タンパク質や脂質膜の表面に多く存在し、極性具有に分類されることもある)
- – トリプトファン – Trp – W
- – チロシン – Tyr – Y
- – メチオニン – Met – M (金属イオンのリガンドとして機能することがある)
両性具有アミノ酸の覚え方:Men Y Women 両性具Yu
※疎水性と両性具有はすべてnon-polarとなります。
疎水性(通常はタンパク質のコアの中に埋もれている)
- – アラニン – Ala – A
- – イソロイシン – Ile – I
- – ロイシン – Leu – L
- – メチオニン – Met – M
- – フェニルアラニン – Phe – F
- – バリン – Val – V
- – プロリン – Pro – P
- – グリシン-Gly-G
疎水性アミノ酸の覚え方: VIPのLIFAはGMで泳げない(疎水性)
※疎水性と両性具有はすべてnon-polarとなります。
アミノ酸のはたらき
アミノ酸は生命現象を支える基本的な分子であり、その働きは多岐にわたります。以下に、アミノ酸の主な機能をいくつか紹介します。
### タンパク質の構成要素
アミノ酸は、タンパク質を形成する基本的な単位です。生体内で特定の配列に並んだアミノ酸がペプチド結合により連結し、この連鎖が折りたたまれてタンパク質が形成されます。タンパク質は酵素、免疫分子、ホルモンなど、生体の構造と機能の両方に不可欠です。
### 酵素の活性部位の形成
多くの酵素はタンパク質であり、その活性部位は特定のアミノ酸残基によって形成されます。これらのアミノ酸は、基質と結合したり、化学反応の触媒として働いたりすることで、生体内の無数の化学反応を助けます。
### エネルギー源
アミノ酸は、分解されることでエネルギーを供給することができます。特に、飢餓時などには筋肉からアミノ酸が分解され、グルコースの生成(糖新生)やケトン体の生成に利用されます。
### 細胞と組織の成長と修復
アミノ酸は、新しい細胞の生成や損傷した組織の修復に必要です。特に、成長期の子供や、怪我をした後の修復過程では、アミノ酸の需要が高まります。
### 代謝とシグナル伝達
一部のアミノ酸は、神経伝達物質やホルモンの前駆体として機能します。例えば、トリプトファンはセロトニンの合成に、チロシンはドーパミンやアドレナリンの合成にそれぞれ関与しています。
### 免疫機能
アミノ酸は、免疫系の正常な機能にも必要です。例えば、システインは抗体の生成に重要な役割を果たし、グルタミンは腸の健康を支える免疫細胞のエネルギー源となります。
### 栄養吸収と輸送
特定のアミノ酸は、他の栄養素の吸収や輸送を助けます。例えば、アルギニンは血管を拡張させることで血流を改善し、栄養素や酸素の運搬効率を高めます。
アミノ酸のこれらの機能は、生体内での役割のほんの一部に過ぎません。生命活動を支えるためには、これらの小さな分子が複雑に相互作用し合うことが不可欠です。