承認済シンボル:EIF4E
遺伝子名:eukaryotic translation initiation factor 4E
参照:
HGNC: 3287
AllianceGenome : HGNC : 3287
NCBI:1977
Ensembl :ENSG00000151247
UCSC : uc003hue.3
遺伝子OMIM番号133440
●遺伝子のlocus type :タンパク質をコードする
●遺伝子のグループ:
●遺伝子座: 4q23
●ゲノム座標:(GRCh38): 4:98,879,276-98,929,133
遺伝子の別名
EIF4F
EIF4E1
遺伝子の概要
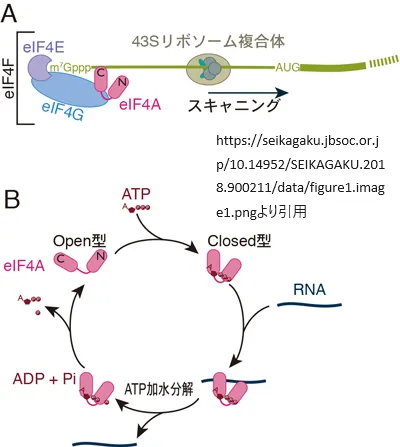
eIF4E(eukaryotic translation initiation factor 4E)は、真核生物の細胞におけるタンパク質の合成過程、特に翻訳の開始段階において重要な役割を果たすタンパク質です。このタンパク質は、mRNAの5’末端に存在するキャップ構造(メチル化されたグアニンヌクレオチド)を認識し、その後の翻訳開始過程に必要な他の因子やリボソームとの結合を促進します[3][7]。
eIF4EはeIF4GおよびeIF4Aと共にeIF4F複合体を形成し、この複合体はmRNAのキャップ構造に結合します。その後、43Sリボソーム複合体をmRNA上にリクルートし、スキャニングの過程を通じて翻訳の開始を促進します[2]。このプロセスは、細胞が環境の変化に適応し、遺伝子発現を調節するために不可欠です[5]。
eIF4Eの活性は、がん細胞の急速な成長に関連しています。がん細胞は、eIF4Eを過剰に活性化させることで、通常の細胞に対する成長制御を回避し、タンパク質合成を制御する機械に発がん性変化を起こします。このため、eIF4Eの作用を遅らせることでがん細胞の成長を抑制する研究が進められています[3]。
また、植物ウイルスに対する劣性抵抗性の決定因子としても報告されています。様々な作物において、eIF4Eファミリー遺伝子が変異するとウイルスが感染できない劣性(潜性)抵抗性植物になることが知られています。植物にはeIF4Eファミリー遺伝子が3つ存在し、それぞれ異なるウイルスに対する劣性抵抗性に関与します。ゲノム編集技術を利用してeIF4Eファミリーと特定の遺伝子の結合性を改変することで、ウイルス抵抗性作物の開発につながると期待されています[1]。
- 参照・引用
-
[1] www.a.u-tokyo.ac.jp/topics/topics_20230529-1.html
[2] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2018.900211/data/index.html
[3] numon.pdbj.org/mom/230?l=ja
[4] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2016.880135/data/index.html
[5] www.jstage.jst.go.jp/article/biophys/56/3/56_168/_pdf
[6] kaken.nii.ac.jp/ja/grant/KAKENHI-PROJECT-12215015/
[7] ja.wikipedia.org/wiki/EIF4E
[8] kaken.nii.ac.jp/ja/grant/KAKENHI-PROJECT-11780427/
遺伝子と関係のある疾患
遺伝子の発現とクローニング
マッピング
EIF4Eは、キャップ結合タンパク質の重要な構成要素であり、成長調節において重要な役割を果たしています。また、がん遺伝子としての機能の可能性も指摘されています。Jonesらによる1996年の研究では、ヒトEIF4E遺伝子のプロモーターと最初のエキソンをコードするDNAセグメントがヒトからクローニングされました。この研究は、EIF4E遺伝子が第4染色体に位置していることを確認し、以前のマッピングが偽遺伝子とのクロスハイブリダイゼーションにより複雑であったことを明らかにしました。Jonesらは1997年に、プロモーター領域に特異的なプローブを使用して、4番染色体特異的なヒト/ネズミ体細胞パネルをPCRで増幅し、EIF4Eのシングルコピーが4q21-q25領域にマッピングされることを発見しました。
Dorfmanらによる1991年の研究では、EIF4E遺伝子がマウスの12番染色体に存在することが確認されましたが、ヒトとマウスの間のシンテニーの相同性から、このホモログの関連性は低いと考えられています。Jonesらは1997年にも、ヒト-げっ歯類の体細胞パネルを使用してEIF4E遺伝子をヒトの4q21-q25にマッピングし、偽遺伝子に関連する曖昧さを指摘しながら、プロモーター領域の配列を利用してこの研究を進めました。
生化学的特徴
遺伝子の機能
eIF4Aを含むDEAD-boxタンパク質は、その構造がN末端ドメイン、C末端ドメイン、そしてこれらを繋ぐリンカー部分から成っています。通常、これらのドメインは離れて開いた「open型」の構造を取ります。DEAD-boxタンパク質は、ATP依存的なRNA結合タンパク質として機能し、N末端ドメインとC末端ドメインの間にATPが結合することで、RNA結合インターフェイスが形成されます(これを「closed型」と呼びます)。加えて、DEAD-boxタンパク質はATP加水分解酵素としての役割も果たし、ATPをADPに加水分解することによって再び「open型」に戻り、RNAから解離します。このATP依存的なRNAへの結合と解離のサイクルは、翻訳プロセスにおいて重要な役割を担っています。
DEAD-boxタンパク質は、二本鎖RNAを解くRNAヘリカーゼとしての役割も持ちます。通常、二本鎖RNAはA型ヘリックス構造を取りますが、DEAD-boxタンパク質に結合したRNAはA型ヘリックスを形成できない折れ曲がった立体構造を取ります。これにより、DEAD-boxタンパク質はRNAの二次構造を解きほぐす能力を持つとされています。
翻訳の開始過程では、43Sリボソーム複合体がmRNAの5′非翻訳領域(UTR)を移動しながら、AUG開始コドンを探す「スキャニング」過程が行われます。eIF4AはそのRNAヘリカーゼ活性を通じて、5′ UTRに存在するRNAの二次構造を解きほぐし、スキャニング過程を促進することが長らく考えられてきました。しかし、最新の研究では、eIF4Aが5′ UTRの二次構造を単に解きほぐすだけでない可能性が示唆されています。これにより、eIF4Aの機能を完全に理解するためには、より詳細な研究が必要であることが強調されています。この点は、eIF4Aや他のDEAD-boxタンパク質の研究において重要な課題となっています。
 出典
出典
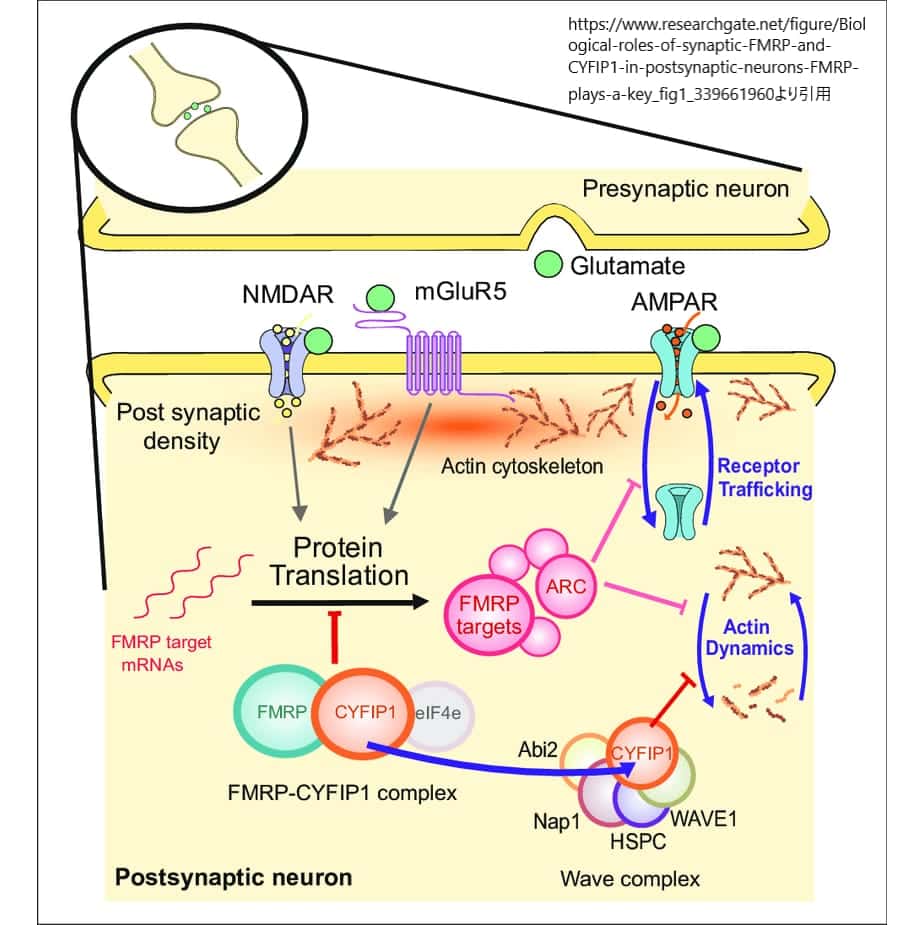
上図の説明:シナプス後神経細胞におけるFMRPとCYFIP1の生物学的役割は、シナプスの可塑性や機能に深く関与しています。FMRP(fragile-X精神発達障害タンパク質)は、CYFIP1(細胞質FMRP相互作用タンパク質)と複合体を形成し、この複合体は、開始因子であるeIF4eと共に、ARC(activity-regulated cytoskeleton associated protein)を含む数百にも及ぶFMRPの標的mRNAの翻訳を負に制御する重要な役割を果たします。この翻訳制御機能は、シナプス可塑性の調節に不可欠であり、上流のNMDA受容体やmGluR5(向性代謝性グルタミン酸受容体5)の活性化によって部分的に媒介されます。
FMRPの標的であるARCは、AMPA(α-アミノ-3-ヒドロキシ-5-メチル-4-イソオキサゾールプロピオン酸)受容体の輸送や内部化を制御し、アクチン細胞骨格の安定性を増加させることにより、シナプス可塑性の変化を促進することができます。これは学習や記憶形成にとって重要なメカニズムです。
一方で、CYFIP1はWAVE制御複合体に結合してその活動を阻害することにより、アクチン細胞骨格の再配列を促進することを抑制します。シナプス活性化の状態では、CYFIP1はWAVE複合体との結合を増やし、一方でFMRP複合体との結合を減少させるように再分布します。この再分布は、シナプス後神経細胞におけるアクチン細胞骨格の再配列やシナプス可塑性の調節において、重要な調整メカニズムを示唆しています。
このように、FMRPとCYFIP1の相互作用は、シナプス機能と可塑性における複雑な調節メカニズムの一部を形成しており、学習や記憶などの高次脳機能の基礎を支える重要な役割を果たしています。
Pauseらによる1994年の研究では、EIF4Eの活性を制御するとされる2つの相同タンパク質、EIF4EBP1とEIF4EBP2が同定されました。Jonesら(1997年)は、EIF4Eがタンパク質合成の律速段階において重要であり、成長調節に関わる可能性があると指摘しました。また、EIF4Eの過剰発現はがん化を引き起こす可能性があるとも述べられています。
Waskiewiczら(1997年)はマウスで、Mnk1(MKNK1)とMnk2(MKNK2)の潜在的な生理的基質としてEIF4Eを特定しました。Pyronnetら(1999年)は共免疫沈降実験を通じて、MNK1がEIF4EではなくEIF4GのC末端領域と相互作用することでEIF4F複合体と結びつくことを明らかにしました。EIF4Gへの結合能を欠いたEIF4Eの変異体は、細胞内でのリン酸化が不十分であることがわかりました。このことから、EIF4GがMNK1によるEIF4Eのリン酸化のためのドッキングサイトを提供するという仮説が立てられました。
哺乳類においては、MTORはPI3K依存性のエフェクターとして機能し、生化学的シグナル伝達経路を通じて細胞の大きさを調節します。Fingarら(2002年)は、S6k1α-II、Eif4e、Eif4ebp1がMtor依存的な細胞サイズ制御に関与しているという証拠を提供しました。
Wendelら(2004年)は、マウスリンパ腫モデルを用いて、Aktがアポトーシスを抑制し、腫瘍形成と薬剤耐性を促進すること、およびmTOR阻害剤ラパマイシンでAktシグナル伝達を阻害することで、Aktを発現しているリンパ腫では化学療法抵抗性が逆転するが、他のアポトーシス欠損を持つリンパ腫では逆転しないことを示しました。この研究は、mTORとEif4eを介したAktシグナル伝達ががん化と薬剤耐性における重要なメカニズムであることを証明しました。
Syntichakiら(2007年)は、特定のeIF4EアイソフォームIfe2の欠損が、線虫で全体のタンパク質合成を減少させ、酸化ストレスから保護し、寿命を延ばすことを示しました。寿命延長はインスリン様シグナル伝達経路とは独立しており、Ife2の欠損はclkや食事制限を受けるeat変異体の寿命をさらに延長しました。
Boussemartら(2014年)は、eIF4F複合体の持続的な形成が、BRAF(V600)変異を持つメラノーマ、結腸癌、甲状腺癌細胞における抗BRAF+抗MEK薬併用療法の治療抵抗性と関連していることを発見しました。彼らは、eIF4Fが自然耐性と獲得耐性の両方の指標であるだけでなく、治療標的としても機能する可能性があることを示しました。
最後に、Haimovら(2018年)は、eIF4G1がeIF4EおよびeIF1と相互作用するが、これらの相互作用は互いに排他的であることを示しました。この相互作用は、タンパク質の翻訳において重要な役割を果たしています。
EIF4Eに関連する経路としては、Translation Insulin regulation of translation、4-hydroxytamoxifen, dexamethasone, and retinoic acids regulation of p27 expressionなどがあります。この遺伝子に関連するGene Ontology (GO) annotationは、RNA結合と翻訳開始因子活性です。この遺伝子の重要なパラログはEIF4E1Bです。
EIF4E(Eukaryotic Translation Initiation Factor 4E)は、タンパク質合成開始の初期段階で7-メチルグアノシンを含むmRNAキャップを認識して結合し、mRNAの二次構造の巻き戻しを誘導することでリボソームの結合を促進します (文献1, 文献2PubMed:22578813) 。翻訳開始における役割に加え、細胞質での翻訳と安定性の調節因子としても働く (文献) 。mRNAキャップに結合し、翻訳抑制を仲介するCYFIP1-EIF4E-FMR1複合体の構成要素であり、この複合体では、EIF4EがmRNAキャップへの結合を仲介します。神経発生時にproneurogenic factorsの翻訳を抑制する多タンパク質複合体の構成要素です。
分子遺伝学
この結果は、EIF4E遺伝子における特定の変異が自閉症の発生に関連している可能性を示唆しています。特に、この変異がプロモーター領域に存在するため、遺伝子の発現調節に重要な役割を果たしていることが示唆されます。プロモーター領域とは、遺伝子の発現を開始するための重要なDNA領域であり、この領域の変異は遺伝子の活性に直接的な影響を及ぼす可能性があります。この研究は、自閉症の遺伝学的基盤に関する理解を深める上で重要な一歩です。
動物モデル
一方、Gkogkasら(2013年)の研究では、真核翻訳開始因子4E結合タンパク質-2(EIF4EBP2;602224)、すなわちEIF4Eの抑制因子のノックアウト、またはEIF4Eの過剰発現が、自閉症スペクトラム障害(ASD)と関連するシナプス後タンパク質であるニューロリジンの翻訳を増加させることを示しました。Eif4ebp2をノックアウトしたマウスは、自閉症様行動を示し、この行動はEif4eの活性を薬理学的に阻害することで是正されました。この研究は、EIF4Eによる翻訳制御が自閉症様表現型の発生に関与していることを示しています。
Santiniら(2013年)の研究では、マウスでEif4eのレベルを遺伝的に増加させると、キャップ依存的な翻訳が強調され、自閉症を思わせる異常行動が誘発されることが見出されました。これらの自閉症様行動は、キャップ依存性翻訳阻害剤である4EGI-1を用いて改善され、キャップ依存性翻訳と自閉症に関連する行動異常との間に因果関係があることが示唆されました。
アレリックバリアント
0001 自閉症、感受性、19
eif4e、1-bp ins、-25c
Neves-Pereiraら(2009)は、血縁関係のない家族の自閉症発端者2人(AUTS19; 615091)において、EIF4E遺伝子のプロモーター領域の-25位に同じ1塩基対のCヌクレオチドの挿入を検出しました。各発端者には自閉症のきょうだいがおり、そのきょうだいにも変異が認められました。この変異は4人の患児の父親にも認められましたが、対照染色体2,040本には認められませんでした。挿入は、HNRNPK(600712)と結合するEIF4E基底プロモーターエレメント(4EBE)内の7Cヌクレオチドから8Cヌクレオチドに拡張。Neves-Pereiraら(2009)は、電気泳動移動度シフトアッセイとレポーター遺伝子研究を行い、この変異が核因子(おそらくHNRNPK)の結合とEIF4Eプロモーター活性を増強することを示しました。Neves-Pereiraら(2009)は、EIF4Eの薬理学的操作により、EIF4E活性を制御する収束経路の障害に起因する自閉症患者に対する治療効果が得られる可能性を示唆。