承認済シンボル:EDA
遺伝子名:ectodysplasin A
参照:
HGNC: 3157
AllianceGenome : HGNC : 3157
NCBI:1896
Ensembl :ENSG00000158813
UCSC : EDA (ENST00000374553.6) from GENCODE V47
遺伝子OMIM番号300451
●遺伝子のlocus type :タンパク質をコードする
●遺伝子のグループ:Tumor necrosis factor superfamily
MicroRNA protein coding host genes
●遺伝子座: Xq13.1
●ゲノム座標:X:69,616,113-70,039,472
遺伝子の別名
ectodysplasin
ectodysplasin-A
ED1
ED1-A1
EDA-A1
EDA-A2
EDA1
EDA_HUMAN
HED
XHED
XLHED
遺伝子の概要
エクトディスプラシンAタンパク質の中でも、特にエクトディスプラシンA1が重要な役割を担っており、これは細胞表面に存在するエクトディスプラシンA受容体(EDAR遺伝子から生成)と結合します。鍵が鍵穴に収まるように結合することで、この2つのタンパク質は細胞分裂や成長、成熟といった活動を調節するシグナル伝達経路を活性化します。このシグナル伝達は、毛包や汗腺、歯などの外胚葉性構造の形成を制御し、これらの組織が正常に発達するために重要な役割を果たします。このプロセスは出生前から始まり、身体の正常な発育に欠かせないものです。
遺伝子と関係のある疾患
遺伝子の発現とクローニング
その後、Kereら(1996年)はEDA1遺伝子のクローニングに成功し、汗腺や毛包、ケラチノサイトなどで発現する135アミノ酸からなる膜貫通型タンパク質(アイソフォームI)を同定しました。このタンパク質は、上皮間葉系シグナル伝達に関与する新しいクラスに属する可能性があると考えられました。また、EDA患者でこの遺伝子に欠失や変異が確認され、病因との関連が示唆されました。
さらに、Srivastavaら(1997年)は、ヒトEDA1タンパク質の第2のアイソフォーム(アイソフォームII)を発見しました。この391アミノ酸からなるアイソフォームには、細胞外にコラーゲン様ドメインが含まれ、胚発生における異なる役割を担っている可能性が示されました。
Srivastavaら(1997年)は、マウスの「Tabby」(Ta)遺伝子をクローニングし、3つの異なる転写アイソフォーム(391、177、および220アミノ酸)を同定しました。これらのアイソフォームは、いずれもヒトEDA遺伝子のエクソン1と同じ最初の132アミノ酸を持ち、88%の相同性を示しました。マウスの392アミノ酸のアイソフォームは、予測される分子量が41.6kDであり、歯の形成や表皮で発現していることが確認されました。突然変異したタビーマウスでは、この遺伝子の発現が欠損していました。これにより、エクトディスプラシン-Aの異なるアイソフォームが胚発生中に異なる役割を果たす可能性が示唆されました。
Fergusonら(1997年)も、マウスのTa遺伝子に相当するcDNAを特定し、これがEDAのマウス版であることを確認しました。cDNAには246アミノ酸が追加されており、コラーゲン様ドメインが19個存在することがわかりました。このドメインは、細胞外のC末端領域にある他の膜結合タンパク質と類似していました。ノーザンブロット分析により、この遺伝子の発現は、影響を受ける構造が発達する胚発生の期間に増加することが示されました。
Bayesら(1998年)は、EDA遺伝子のスプライシングマップを構築し、EDA-Aという391アミノ酸の膜貫通タンパク質をコードする完全長転写産物を特徴づけました。また、コラーゲン様ドメインを欠く4つの新しい転写産物も検出されました。これらのスプライシングバリアントは、異なる組織で異なる発現パターンを示し、EDA遺伝子の複雑な発現制御が示唆されています。Bayesら(1998年)は、完全長型のタンパク質が細胞膜に輸送され、細胞の丸まりを誘導することを発見しました。
遺伝子の構造
遺伝子の機能
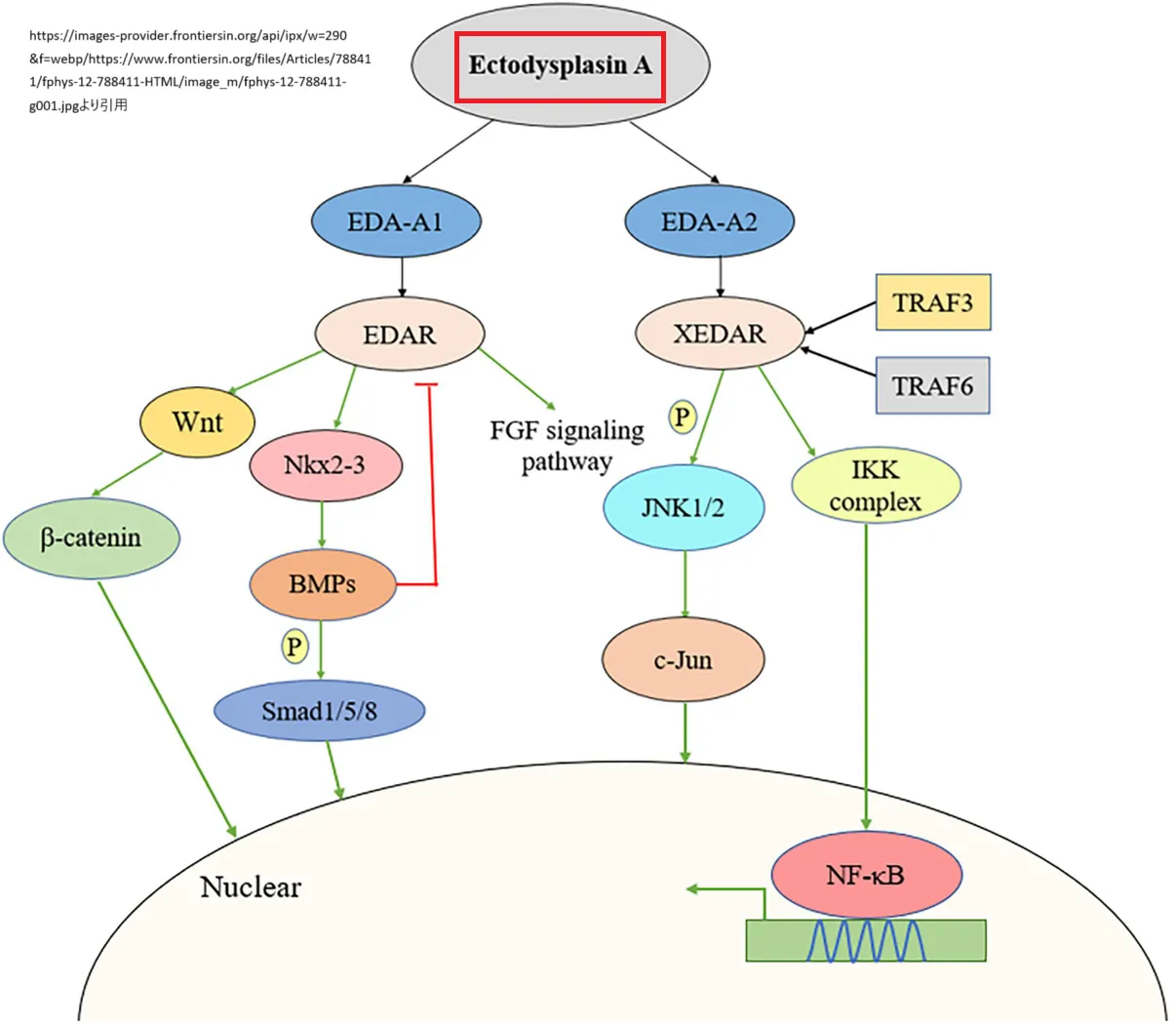
Yanら(2000年)は、EDAの異なるアイソフォームであるEDA-A1が、391残基のタンパク質をコードし、そのC末端にTNFドメインを持つことを確認しました。EDA-A1は、EDAR(エクトディスプラシンA受容体)と特異的に結合します。また、EDAにはEDA-A2というアイソフォームも存在し、これにはグルタミン酸308とバリン309が欠失しています。このEDA-A2は、XEDARと呼ばれる別の受容体に結合し、これらの2つの受容体の発現は、発達中の毛包で異なるパターンを示しました。
さらに、Chenら(2001年)は、XHED(X連鎖無汗性外胚葉異形成症候群)がフリンプロテアーゼによるプロセシングの欠陥に関連することを明らかにしました。EDA分子の茎領域にはフリンのプロテアーゼ切断部位が含まれており、この部位での切断がエクトディスプラシンによるシグナル伝達に必要であることが示されました。特に、EDA分子はフリンによって切断され、可溶性のTNFコアドメインが放出されることで、外胚葉構造の形成に重要なシグナル伝達を促進します。
Elomaaら(2001年)は、Chenら(2001年)の研究結果を確認し、エクトディスペラシン(EDA)とその受容体EDARがリガンド-受容体ペアを形成し、外胚葉付属器の発達に重要な役割を果たすことを証明しました。彼らの研究では、in situハイブリダイゼーションおよび免疫染色により、エクトディスペラシンとEDARが発達中のヒト皮膚で隣接または重複して発現していることが示され、EDAがEDARと相互作用し、外胚葉構造の発達を制御するシグナルを媒介していると結論づけました。
Durmowiczら(2002年)は、ED1(EDA)のプロモーターエレメントを分析し、この遺伝子がWntシグナル伝達経路に依存して発現することを示しました。彼らは、LEF1とβ-カテニンがED1遺伝子発現に重要であり、GSK3Bの阻害が転写を促進することを確認しました。ED1はWntシグナルの標的であり、皮膚付属器の形成における役割が確認されました。
さらに、Srivastavaら(2001年)は、タビーマウスにEDA-A1アイソフォームを遺伝子導入することで、毛髪、汗腺、臼歯などの発達が部分的に回復することを示し、EDA-A1が皮膚付属器形成の主要な調節因子であることを確認しました。この研究は、EDA-A1の可溶性リガンドが将来的に治療に応用できる可能性を示唆しています。
Cui ら(2002年)は、15,000遺伝子マウス cDNA マイクロアレイを使用して、EDA経路の分析を行い、野生型、EDA欠損(タビー)マウス、そしてEDA-A1アイソフォームを補ったタビーマウスの皮膚の発現プロファイリングを比較しました。この研究では、EDA-A1アイソフォームがタビーマウスの複数の表現型を回復させることが確認されました。15,000の遺伝子のうち、8,500個が皮膚で発現しており、その中には転写因子や成長制御遺伝子が含まれていましたが、野生型とタビーの間で有意な差があったのは24個の遺伝子のみでした。さらに、リアルタイムRT-PCRにより8つの遺伝子の発現の差異が確認されました。タビーマウスの皮膚では、コラーゲン関連遺伝子(Col1a1、Col1a2、Col3a1など)のアップレギュレーションが見られ、一方で、NF-kappa-BおよびJNK経路のダウンレギュレーションが確認されました。これにより、EDAが両方の経路を調節していることが示唆されました。
Cui ら(2003年)のさらなる研究では、テトラサイクリン制御トランス遺伝子システムを使用して、ED1アイソフォームを条件的に発現させました。EDA-A1の発現は、汗腺や毛包に強い影響を与え、皮脂腺にも効果をもたらしました。成体動物でEDA-A1の発現を抑制すると、この効果は逆転し、EDAの栄養作用がアイソフォーム特異的であることが確認されました。
さらに、GaideとSchneider(2003年)は、胎盤バリアを越えるように設計された組み換え型EDA1を妊娠中のタビーマウスに投与し、その結果、タビーマウスの子孫の表現型が恒久的に回復することを示しました。この研究は、出生後にもEDA1が汗腺を誘導できることを示し、短期間の組み換えタンパク質治療で発生遺伝的欠陥を修正できる例となりました。
Cui ら(2006年)は、野生型マウスとEDA欠損(タビー)マウスの毛包発生中の胚性皮膚の転写プロファイリングを比較し、Eda制御タンパク質を発見しました。この研究では、ヘッジホッグシグナル伝達経路のShh、Wntシグナル伝達経路のDkk4、BMP経路のSostdc1、NFKBシグナル伝達経路のLtbが関与していることが確認されました。Ltbは発達中の毛包において豊富に存在しますが、タビーの毛包には存在せず、Ltbの欠如は毛の構造異常に関連しているとされます。Ltbの活性化の失敗がタビーの表現型の一部を説明できる可能性が示唆されています。
Kunisada ら(2009年)は、タビーと野生型マウスの汗腺形成過程を比較しました。EDAによって制御される汗腺と毛包の発生にはShh経路のアップレギュレーションが関与していることが判明しました。また、汗腺の分泌部分の発達において、Foxa1とFoxi1遺伝子が重要であり、これらの遺伝子は成熟した汗腺で高レベルを維持する一方、タビーの足パッドでは増加しないことが確認されました。
さらに、Harjunmaa ら(2012年)は、複数のシグナル伝達経路を同時に調整することで、マウスの歯の複雑性を大幅に増加させることができると報告しています。EDA、アクチビンA、SHH経路の調整により、歯のカスプ数や表面の複雑さが増加し、これが歯のサイズの増加ではなく発生の初期段階のパターン形成の変化によるものであることが示されました。この研究は、複雑な表現型の増加が、シグナル伝達経路の複雑な調整によって引き起こされる可能性があることを示唆しています。
進化
著者らは、歯の形状の多くの側面が進化の過程で関連して変化し、これを考慮しない場合、系統発生の歴史が正確に理解できない可能性があると指摘しています。この発見は、進化における歯の特徴の連鎖的な変化を理解する上で重要であり、形態の進化に関する新たな視点を提供します。
分子遺伝学
無汗性外胚葉形成不全1、X染色体連鎖
Kere ら(1996年)は、X/常染色体転座または顕微鏡下での欠失が認められた6人の低汗性外胚葉形成不全症(XHED、ECTD1; 305100)患者のEDA1遺伝子に変異があることを発見しました。さらに9人の患者に点突然変異が認められましたが、研究対象となった患者の約10分の1でしか突然変異が検出されなかったとしています。
Ferguson ら(1998年)は、常染色体優性遺伝の保因者またはEDAの症状が現れている男性162名および女性21名を対象にED1遺伝子のスクリーニングを実施したところ、エクソン1内に推定変異が確認されましたが、エクソン2内には変異は見つかりませんでした。発症者の表現型と遺伝子型の間には相関は認められず、他の未確認エクソンに変異がある可能性が示唆されました。
Monreal ら(1998年)は、XHED患者18家族中17家族においてEDA1遺伝子の変異を特定し、これには12のミスセンス変異、1つのナンセンス変異、4つの欠失変異が含まれていました。これにより、EDA1アイソフォームIIが歯、毛髪、汗腺の形態形成に重要な役割を果たしていることが示唆されました。
Bayes ら(1998年)は15人のEDA患者のうち12人でEDA1遺伝子変異を確認しましたが、特にコラーゲン様ドメインにおけるGly-X-Y反復配列の欠失が注目され、コラーゲン様ドメインの機能的役割が示唆されました。Kobielak ら(2001年)やVincent ら(2001年)もEDA1遺伝子における新規変異を特定し、特にエクソン3のCpGジヌクレオチドに影響を与える変異が多く、変異アレリックの35%を占めていましたが、臨床症状のばらつきが大きく、遺伝子型と表現型の明確な相関は見られませんでした。
Vincent ら(2001年)の調査では、52人のXHED患者の65%でEDA遺伝子変異が確認され、そのうち14件が新規のものでしたが、依然として患者間の表現型のばらつきは大きく、女性キャリアにおけるX不活性化パターンも病気の重症度と弱い相関しか見られませんでした。
Visinoni ら(2003年)は、X連鎖外胚葉形成不全症(XHED)に関連する64種類の異なるEDA遺伝子変異をまとめました。
漢民族のXHED患者がいる家族において、Huang ら(2006年)は、EDA遺伝子のエクソン4に1塩基対の新生挿入(300451.0016)を特定しました。この挿入は、EDA遺伝子で特定された最初の新生挿入として報告されました。
Lexner ら(2008年)は、オランダ人家族19例のXHED患者において、EDA遺伝子に16種類の異なる変異を特定し、そのうち9種類は新規変異でした。多重リガーゼ依存性プローブ増幅(MLPA)分析により、エクソン1の欠失も確認されましたが、遺伝子型と表現型の明確な相関は見られませんでした。
Ferrier ら(2009年)は、XHEDの父子間伝達が性染色体異数性によって生じた事例を報告しました(300451.0019)。
パキスタン人男性で重度の全身性過角化症を呈し、当初はレリス症候群(608290)と診断されていた患者について、van Steensel および van der Hout(2009年)は、EDA遺伝子にR156H変異(300451.0007)を特定しました。これにより、レリス症候群がX連鎖性HEDの一部の症状である可能性が示唆されました。
Schneider ら(2018年)は、EDAの受容体結合ドメインとヒトIgG1のFcドメインからなる組換え融合タンパク質Fc-EDAを、XHEDを持つ一組の双子の胎児と、無関係な男性胎児に羊水注入で投与しました。その結果、乳児は正常に発汗し、生後14~22か月までにXLHED関連疾患を発症しなかったことが報告されました。
X連鎖選択的歯牙欠損症
X連鎖低歯牙症(X-linked hypodontia)は、X染色体上のEDA遺伝子の変異によって引き起こされる疾患で、通常は乳歯または永久歯の一部が先天的に欠如することを特徴としています。
Taoら(2006年)は、モンゴルの選択的歯牙欠如(STHAGX1; 313500)の家族において、EDA遺伝子における新しい変異(300451.0014)を特定しました。同様に、Tarpeyら(2007年)は、インドのX連鎖性低歯性症の家族において、EDA遺伝子の別の変異(300451.0015)を特定し、特に切歯に影響を与えることが確認されました。
また、Hanら(2008年)は、先天的に低歯牙症のある中国人家族において、4人の罹患者男性と1人の罹患者女性キャリアを特定し、EDA遺伝子におけるT338M変異(300451.0018)を同定しました。この変異は、歯の発育に重要な役割を果たしていると考えられています。
さらに、Songら(2009年)は、選択的歯牙欠如の中国人男性15人の無関係なサンプルを解析し、EDA遺伝子の塩基配列を決定しました。その結果、ミスセンス変異を持つ4人の患者が特定され、A259E(300451.0020)、R289C(300451.0021)、R334H(300451.0022)といった変異が確認されました。これらの変異は、歯の発育に影響を与える可能性があり、選択的歯牙欠如の原因として重要です。
遺伝子型と表現型の相関
また、LS8細胞株を用いた研究では、NFKBサブユニットp65の核移行が6つのEDA変異体すべてにおいて減少し、XHEDを引き起こす変異体の方が、非症候性歯牙欠如に関連する変異体よりも顕著に影響が出ていることがわかりました。さらに、デュアル・ルシフェラーゼ・アッセイでは、NFKBの転写活性化においてすべての変異タンパク質が野生型よりも障害されていましたが、STHAGX1とXHEDに関連する変異体間には有意差は見られませんでした。
RT-PCR分析によると、変異体はBMP4の発現を有意に増加させ、特にXHED関連変異体でその増加が顕著でした。一方、WNT10Aの発現はすべての変異体でダウンレギュレーションされ、WNT10Bの発現はXHED関連変異体で特に顕著に低下しました。
シェンら(2016年)は、STHAGX1関連の変異がNFKB経路を完全に遮断するのではなく、そのシグナル伝達を減弱させることによって非症候性歯牙欠如を引き起こす可能性があることを示唆しています。
動物モデル
治療結果として、5頭のXHED犬のうち4頭で、成犬の歯がほぼ正常に発達することが確認されました。さらに、治療により、正常な涙液の分泌、眼や気道の感染症に対する抵抗力の回復、発汗能力の改善などが認められました。この研究は、EDAを用いた治療がXHEDの潜在的な治療法として有効であることを示すとともに、二次歯列の発生におけるEDAの重要性を明らかにしています。
アレリックバリアント
EDA、TYR61HIS
Kere ら(1996年)は、英国の家族に発症したX連鎖性低汗性外胚葉異形成症(XHED、ECTD1; 305100)において、ヌクレオチド423におけるTからCへの転位により生じた新規の膜貫通タンパク質におけるtyr61-to-his変異を特定しました。これは、この疾患を持つ患者で確認された9つの点突然変異のうちの1つです。 .
0002 外胚葉異形成症1、無汗/毛髪/歯型、X染色体連鎖
EDA、ARG69LEU
Kere ら(1996年)は、英国と米国の家系におけるX連鎖性低汗性外胚葉異形成症(XHED、ECTD1; 305100)について、EDAと点突然変異(ヌクレオチド448番目のGからTへの転換によるアルギニン69からロイシンへのアミノ酸置換)との関連性を発見しました。
0.0003 ectodermal dysplasia 1, hypohidrotic/hair/tooth type, X-linked
EDA, GLN23TER
Fergusonら(1998年)がXHED患者から発見した比較的少数のEDA(305100)突然変異のひとつは、gln23-to-terナンセンス変異を引き起こす366C-T転位でした。 .
0004 先天性表皮異形成症1型、無汗性/毛髪/歯型、X連鎖
EDA、GLU63LYS
Fergusonら(1998年)がXHED患者から発見した比較的少数のEDA(305100)突然変異のひとつは、グルタミン酸63がリジンに置換する429G-A転位でした。
0.0005 表皮水疱症1型、汗腺低形成/毛髪/歯型、X染色体遺伝
EDA、ARG155CYS
XHED患者(305100)において、Monrealら(1998年)はEDA遺伝子のエクソン3に704C-T転位を見出し、EDAタンパク質のアイソフォームIIにおけるアルギニン155からシステインへのアミノ酸置換を引き起こしていることを発見しました。
0.0006 外胚葉性異形成症1、低汗症/毛髪/歯型、X連鎖
EDA、ARG156CYS
XHED患者(305100)において、Monrealら(1998年)はEDA遺伝子のエクソン3に707C-T転位を発見しました。これは、EDAタンパク質アイソフォームIIにおけるアルギニン156からシステインへのアミノ酸置換を引き起こすことが予測されています。これは新生突然変異です。
0.0007 表皮異形成症1、低汗症/毛髪/歯型、X連鎖
EDA、ARG156HIS
XHED(305100)患者において、Monreal ら(1998)はEDA遺伝子のエクソン3に708G-A転位を発見し、EDAタンパク質のアイソフォームIIにおいてアルギニン156がヒスチジンに置換されることが分かりました。
XHED患者52人の研究において、Vincent ら(2001年)は9人の患者からR156H変異を検出しました。EDA遺伝子に隣接するマーカーと遺伝子内の2つの多型を用いたハプロタイプ解析により、R156H、R155C(300451.0005)、R156C(300451.0006)がそれぞれ独立して生じたことが明らかになりました。突然変異は3例で新生であることが判明しました。
もともとレリス症候群(608290)と診断されていた重度の全身性過角化症のパキスタン人男性について、van Steenselとvan der Hout(2009年)はEDA遺伝子を分析し、R156H変異を特定しました。著者らは、レリス症候群はX連鎖性HEDの症状である可能性があると示唆しています。
0.0008 表皮異形成症1、低汗症/毛髪/歯型、X連鎖
EDA、PRO209LEU
XHED(305100)患者において、Monreal ら(1998)はエクソン5に867C-T転位を発見し、EDAタンパク質のアイソフォームIIにおいてpro209からleuへのアミノ酸置換が起こると予測されました。
0.0009 表皮異形成症1、異汗性/毛髪/歯型、X連鎖
EDA、GLY224ALA
XHED患者(305100)において、Monrealら(1998年)はEDA遺伝子のエクソン5に912G-C転換を見出し、EDAタンパクのアイソフォームIIにおけるグリシン224からアラニンへのアミノ酸置換が予測されました。
0.0010 表皮異形成症1、低汗症/毛髪/歯型、X連鎖
EDA、ALA349THR
一見何の関連性もないように見える2つの家族において、Monrealら(1998年)は、XHED(305100)の男性がEDA遺伝子のエクソン9に1285G-A転位があることを発見しました。これは、EDAタンパク質のアイソフォームIIにおいてALA349からTHRへのアミノ酸置換を引き起こすことが予測されます。これらの家族のうち1つでは、影響を受けた男性が新生突然変異であったため、2つの家族はほぼ確実に無関係であると考えられます。
0.0011 外胚葉異形成症1、低発汗/毛髪/歯型、X連鎖
EDA、TYR61TER
EDAの日本人患者(305100)において、Yotsumotoらは(1998年)コドン61のTAC(チロシン)からTAG(ストップ)への変化を発見しました。このナンセンス変異(tyr61からter)は、相対的に頻度の高いY61Hミスセンス変異(300451.0001)に関与するものと同じ膜貫通ドメインの最も細胞外側の位置にあるコドンで起こりました。 .
0012 外胚葉異形成症1、低発汗/毛髪/歯型、X連鎖
EDA、36-BP欠失、EX5
Visinoni ら(2003年)は、XHED(305100)のブラジル人家族4例のうちの1例において、エクソン5における36塩基対の欠失が、エクトディスペラシンAのコラーゲンサブドメインにおける4つのGly-X-Y反復配列の喪失の原因となっていることを報告しています。この欠失は、すでに他の8家族でも報告されています。7つの異なる切断点が、同じ欠失結果につながる可能性があります。欠失につながる突然変異プロセスは、報告された家族によって異なる可能性があります。この経験は、エクトデスプラシンAの機能におけるコラーゲンサブドメインのGly-X-Y反復の重要性を示しています(Bayes et al., 1998)。
0.0013 表皮水疱症1、異汗性/毛髪/歯型、X連鎖
EDA、1-BP欠失、EX6
Visinoni ら(2003年)は、XHED(305100)を有するブラジル人家族4組のうち1組において、エクソン6のEDA遺伝子(966または967番目の部位)におけるグアニン欠失が、241番目のアミノ酸以降のエクトディプラシンAを変化させ、279番目のアミノ酸で早期終結をもたらしたことを報告しています。
0.0014 選択的歯牙形成不全、X連鎖、1
EDA、ARG65GLY
X連鎖孤立性先天性低歯牙症(STHAGX1; 313500)を隔世的に発症するモンゴル人家族において、Taoら(2006年)は、EDA遺伝子のエクソン1における193C-G転換を特定しました。その結果、この遺伝子に変異のある男性とキャリアである女性では、タンパク質の膜貫通領域においてアルギニン65がグリシンに置換(R65G)されました。この突然変異は、無関係な正常な中国人90人には認められませんでした。
0.0015 選択的歯牙形成不全、X連鎖性、1
EDA、GLN358GLU
X連鎖低歯牙症(STHAGX1; 313500)のインド人大家族の患者において、Tarpeyら(2007年)はEDA遺伝子のエクソン8における1072C-G転換を特定し、その結果、gln358がglu(Q358E)に置換されました。この残基は観察されたすべての種で完全に保存されていますが、タンパク質の機能を部分的にしか損なわないと予測されており、独特な低歯牙数という表現型と一致しています。ほとんどの患者は下顎のすべての切歯と上顎の側切歯が欠如しており、上顎の中央切歯が欠如している症例もありました。乳歯および永久歯の両方が影響を受けています。
.0016 表皮発育異常症1型、無汗症/毛髪/歯型、X連鎖
EDA、1-BP INS、573T
X連鎖性異汗性外胚葉異形成(305100)の2人の漢民族の兄弟と、その影響を受けていない母親において、Huangら(2006年)はEDA遺伝子のエクソン4に1bpの挿入(573insT)を同定しました。この突然変異は、母親の祖父母や200人の対照者には認められませんでした。著者らは、これがEDA遺伝子で同定された最初の新生挿入であると述べています。 .
0017 表皮異形成症1、無汗/毛髪/歯型、X連鎖
EDA、2bp挿入、913TA
X連鎖性異汗性外胚葉異形成症候群(305100)の男児において、シュナイダーとミュール(2009年)はEDA遺伝子のエクソン8に2bp挿入(913insTA)を同定しました。その結果、フレームシフトと早期終結が起こります。この突然変異について、影響を受けていない母親はヘテロ接合型でした。 配列分析により、この挿入はDNA複製時に鎖のずれによるミスマッチが生じやすいTAリピート伸長であることが示されました。
0.0018 選択的歯発生、X連鎖、1
EDA、THR338MET
先天性低歯牙症(STHAGX1; 313500)の中国人家族の患者男性4名において、Hanら(2008年)はEDA遺伝子のエクソン8におけるヘミ接合体1013C-T転位を同定しました EDA遺伝子のエクソン8における1013C-Tのヘミ接合型変異が同定され、その結果、Thr338からMet(T338M)への置換が起こり、親水性から疎水性へと残基が変化し、ホモトリマーの安定性に影響を与える構造変化を引き起こすことが予測されました。この変異は、側切歯が欠如している罹患女性1名を含む6名の女性キャリアで発見されましたが、罹患していない家族メンバーでは発見されず、また、120名の対照者の染色体でも発見されませんでした。
0.0019 表皮異形成症1、無汗症/毛髪/歯型、X染色体連鎖
EDA, ARG276CYS
X連鎖性低汗性外胚葉異形成(XHED; 305100)の患者である男児とその父親について、Ferrier ら(2009年)はエクソン7における826C-T転位のヘミ接合体が検出され、アルギニン276がシステイン(R276C)に置換していることを明らかにしました。X染色体上の多型マーカーの分析結果は、X染色体が父親から遺伝していることを示していました。家系調査により、父方の曽祖父、一回しか会ったことのない従兄弟、および2人の従兄弟に患者がいることが明らかになりました。2人の従兄弟のEDA遺伝子を分析したところ、R276変異のヘテロ接合性が認められ、これはキャリアである母親から遺伝したものでした。
0.0020 選択的歯牙欠如、X連鎖、1
EDA、ALA259GLU
Song ら(2009年)は、選択的歯牙欠如(STHAGX1; 313500)の中国人男性2人の無関係な症例において、EDA遺伝子のエクソン6におけるc.776C-A転換を特定し、ホモトリマーの外表面の残基におけるala259からglu(A259E)への置換が起こっていることを明らかにしました。この突然変異は患者の1人に新生で生じたことが示され、60人の中国人女性対照者では認められませんでした。
0.0021 選択的歯発生、X連鎖、1
EDA、ARG289CYS
選択的歯牙欠如(STHAGX1; 313500)の中国人男性において、Song ら(2009年)はEDA遺伝子のエクソン7におけるc.865C-T転位を特定し、ホモトリマーの外表面の残基におけるアルギニン289からシステイン(R289C)への置換が起こっていることを明らかにしました。この突然変異は、影響を受けていない母親が保有しており、60人の中国人女性対照者では認められませんでした。
0.0022 選択的歯牙形成不全、X連鎖、1
EDA、ARG334HIS
選択的歯牙欠如(STHAGX1; 313500)の中国人男性において、Song ら(2009年)はEDA遺伝子のエクソン8におけるc.1001G-A転位を特定し、その結果、モノマー-モノマー界面でアルギニン334がヒスチジン(R334H)に置換しました。この突然変異は、影響を受けていない母親が保有していましたが、60人の中国人女性対照者には認められませんでした。 .
0023 表皮異形成症1、無汗症/毛髪/歯型、X連鎖
EDA、ヒス252ルウ
X連鎖性低汗症外胚葉異形成症(XHED;305100)の患者において、Monrealら(1998年)はEDA遺伝子のエクソン7における986A-T転換のヘテロ接合性を特定し、EDAタンパク質のアイソフォームIIにおけるヒスチジン252からロイシン(H252L)への置換が起こっていることを明らかにしました。この突然変異は、60個の対照X染色体では見つかりませんでした。