目次
チューブリン tubulin
チューブリンとは?
チューブリンは、真核生物の細胞骨格を構成する重要な分子であり、微小管の主な構成要素となっている。
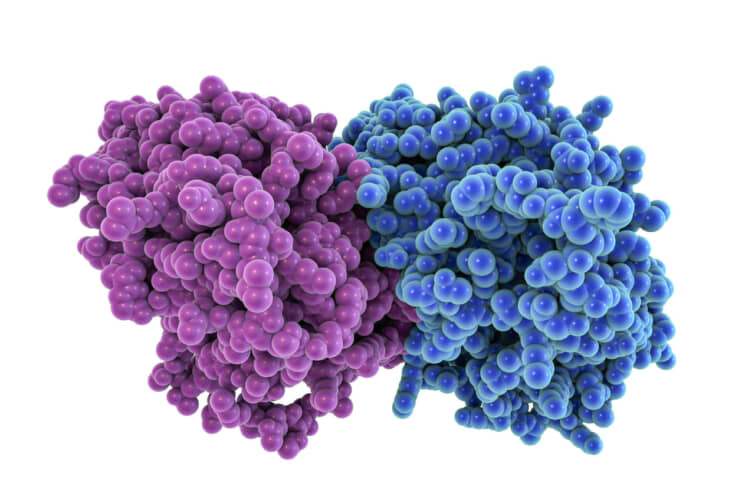
チューブリンタンパク質のα-とβ-が重合して長い鎖やフィラメントを形成し、真核細胞の細胞骨格の重要な要素である微小管を形成する。この微小管は、細胞の支持や運動に重要な役割を果たしており、チューブリンは細胞の正常な機能に欠かせない存在となっている。
また、チューブリンは、細胞の構造や基本的な動作に不可欠な役割を果たすだけでなく、がん治療のための新たな治療法としても期待されている。
チューブリンの特徴
チューブリンは、進化的に保存されたTubulin/FtsZファミリーのGTPaseタンパク質ドメインによって特徴づけられる。
このGTPaseタンパク質ドメインは、真核生物のすべてのチューブリン鎖に見られる。
チューブリンの機能
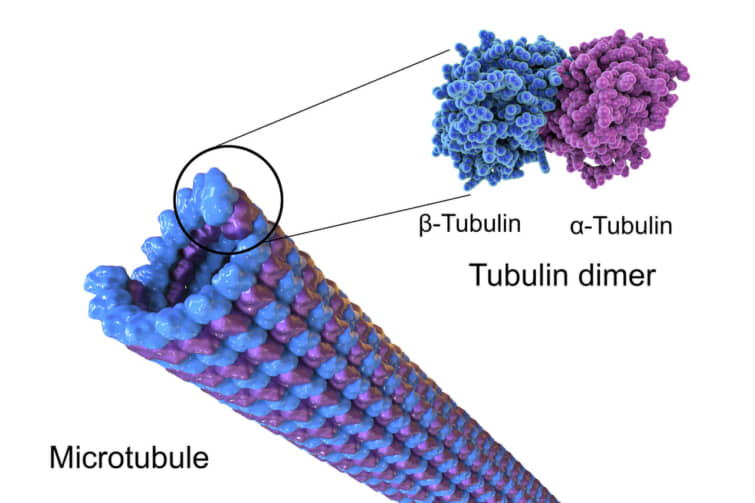
α-チューブリンとβ-チューブリンが重合して動的な微小管を形成する。真核生物では、微小管は細胞骨格の主要な構成要素の一つであり、構造支持、細胞内輸送、DNA分離など多くのプロセスで機能している。
微小管を形成するために、α-チューブリンとβ-チューブリンの二量体はGTPと結合し、GTP結合状態で微小管の(+)端に集合する。β-チューブリンのサブユニットは微小管のプラス端に、α-チューブリンのサブユニットはマイナス端に露出する。二量体が微小管に取り込まれた後、βチューブリンサブユニットに結合していたGTP分子は、微小管原繊維に沿った二量体間の接触によって最終的に加水分解されてGDPになる。チューブリン二量体のβ-チューブリンメンバーがGTPとGDPのどちらに結合しているかは、微小管内での二量体の安定性に影響する。GTPに結合した二量体は微小管に集合しやすく、GDPに結合した二量体はバラバラになりやすい。したがって、このGTPサイクルは、微小管の動的不安定性に不可欠である。
チューブリンの種類
真核生物のチューブリン
チューブリン・スーパーファミリーには,6つのファミリー(α-チューブリン,β-チューブリン,γ-チューブリン,δ-チューブリン,ε-チューブリン,ζ-チューブリン)がある.
α-チューブリン
α-チューブリンは、生体内で普遍的に存在し、高い発現パターンを示す分子であり、β-チューブリンとともに微小管を形成する。
β-チューブリン
哺乳動物のβ-チューブリンには、以下の7つのアイソタイプがある。
βII(TUBB2)
βII(TUBB2A、TUBB2B)
βIII(TUBB3) :強い細胞発現/分布パターンを示す。すべての発生段階における中枢および末梢神経系のニューロンで発現するため、有用な神経細胞マーカーとされる。
βIVa(TUBB4)
βIVb(TUBB2C)
βV(TUBB6):強い細胞発現/分布パターンを示す。繊毛構造で発現し、その発現パターンの変化は癌マーカーとして使用可能。
βVI(TUBB1)
ヒトのチューブリンに結合することが知られている薬剤はすべてβ-チューブリンに結合する。これらの薬剤にはパクリタキセル、コルヒチン、ビンカアルカロイドなどがあり、それぞれがβ-チューブリン上に異なる結合部位を持っている。
クラスⅢ β-チューブリンは神経細胞にのみ発現する微小管要素であり、神経組織の神経細胞に特異的な識別子としてよく知られている。他のアイソタイプのβチューブリンに比べてコルヒチンとの結合が非常に遅い。
β1チューブリンは、クラスVIβチューブリンと呼ばれることもあり、アミノ酸配列レベルで最も分岐している。 クラスVIβチューブリンを哺乳類細胞で発現させると、微小管ネットワークの破壊や微小管断片の形成を引き起こし、最終的には巨核細胞や血小板に存在するマージナルバンド様構造の原因となります。
カタニンは、微小管をβ-チューブリンのサブユニットで切断するタンパク質複合体であり、神経細胞や高等植物において微小管の迅速な輸送に必要である。
マウスの骨髄細胞を用いて、生体内の異数性と、潜在的なアニューゲン(aneugen:娘細胞に異常な数の染色体を持たせる物質のこと)によって誘発される細胞周期の乱れとの関係を調べた研究では、ビンブラスチンとコルヒチンは細胞周期の乱れに関連したメカニズムで染色体の異数性を誘導するのに対し、ハイドロキノンは細胞周期の延長とは無関係に異数性を誘導することが示唆された。これは、紡錘体成分ではなく、染色体分離の染色体成分を変化させている可能性がある。文献
γ-チューブリン
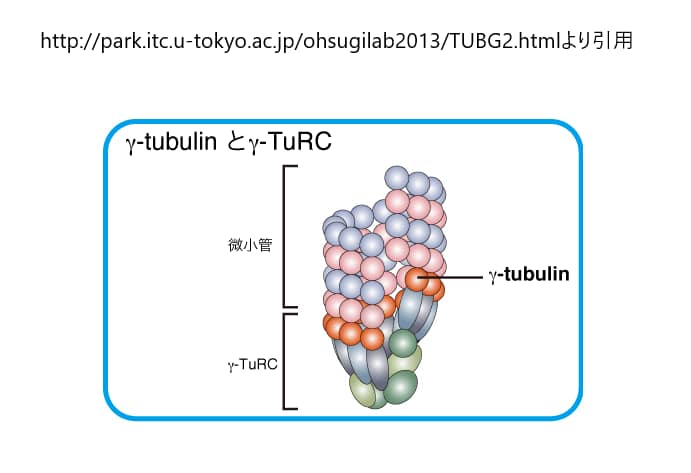
γ-チューブリンは、チューブリンファミリーのひとつであり、微小管の核形成と極性形成に重要な役割を果たしている。γ-チューブリンは、微小管の核形成に重要な役割を果たしており、主に中心体や紡錘体に多く存在する。これらの小器官では、複数のγ-チューブリンと他のタンパク質分子がγ-チューブリンリング複合体(γ-TuRC)として知られる複合体を形成しており、この複合体は化学的に微小管の(+)端を模倣し、微小管の結合を可能にしている。γ-チューブリンは、微小管の核形成のメカニズムとして最もよく理解されているが、ある種の研究では、その正しい発現を阻害する突然変異やRNAi研究によって示されたように、ある種の細胞は、その不在に適応できる可能性がある。γ-チューブリンは、γ-TuRCを形成して微小管の核形成と組織化を行うほか、重合してフィラメントを形成し、束や網目構造に組み立てることができます。
δチューブリンとεチューブリン
セントロソーム(中心体)は、α-チューブリンとβ-チューブリンからなる微小管を組織化しており、微小管の核形成に関与するセントロソーム結合型のγ-チューブリンが含まれている。δ-チューブリンとɛ-チューブリンは中心体に局在している。しかし、δ-チューブリンとɛ-チューブリンの中心体への局在は、微小管とは無関係であり、局在のパターンは互いに、またγ-チューブリンの局在とは異なる。δ-チューブリンは中心核に結合しているのに対し、ɛ-チューブリンは中心核周辺に局在する。ɛ-tubulinは、細胞周期に特異的な局在パターンを示し、最初は新しく複製されたペアの古い方の中心体にのみ結合し、後に両方の中心体に結合する。ɛ-tubulinは、腹腔周囲物質のレベルで古い中心体と新しい中心体を区別しており、このことは、ɛ-tubulinの採用によって示される中心体の成熟イベントが存在する可能性を示している。(出典)
δ-チューブリンは精子形成時の細胞間架橋や初期及び成熟核周囲リングの構成要素である。
哺乳類の精子形成には、成熟した精子の形成に至るまでの劇的な形態変化が伴う。精子の発生には、先体と鞭毛の形成、核-先体の細胞表面への移動、核の凝縮と伸長などがある。さらに、精子形成細胞は、細胞間の橋でつながったユニットの集合体として分化する。しかし、結合した精子形成細胞の形成に関わる構造要素や、雄性配偶子の核形成のメカニズムについては、ほとんど分かっていない。δ-チューブリンの2つのアイソフォームを同定し、長いアイソフォームは精巣で主に発現しているのに対し、短いアイソフォームは調べたすべての組織で発現していることを明らかにした。また、δ-チューブリンは、姉妹の精子形成細胞をつなぐ細胞間ブリッジを形成することがわかった。また、δ-チューブリンは、マンシェットの核周辺リングの構成要素であり、核の移動や伸長に作用している。さらに、丸い精子の細胞表面には、細胞間の橋とは明らかに異なる小さなリングが検出され、これは精子形成の後期にマンシェットの核周辺リングに成熟する可能性がある。これらの結果から、δ-チューブリンは、細胞間橋と核周囲リングの2種類のリングの構成要素であり、精子から成熟精子への形態変化に関与している可能性が示唆された。(出典)
チューブリンに効果を発揮する薬物
チューブリンは、ビンカアルカロイド系薬剤、ビンブラスチン、ビンクリスチン、パクリタキセルなどの抗がん剤の標的である。 また、抗虫剤のメベンダゾールやアルベンダゾール、抗痛風剤のコルヒチンはチューブリンと結合し、微小管の形成を阻害する。前者は最終的にミミズの細胞死につながるが、後者は好中球の運動を停止させ、ヒトでは炎症を抑える。また、抗真菌薬のグリセオフルビンは、微小管形成を標的としており、がん治療に応用されている。
チューブリンの翻訳後修飾
微小管に取り込まれたチューブリンは、多くの翻訳後修飾を受けるが、その多くは微小管に特有のものである。これらの修飾には、デチロシン化、アセチル化、ポリグルタミル化、ポリグリシル化、リン酸化、ユビキチン化、スモイル化、パルミトイル化などがある。チューブリンは急性の細胞傷害などの際に酸化的な修飾や凝集を起こしやすい。
最近では、微小管で行われるアセチル化について多くの科学的研究がなされており、特にα-チューブリンN-アセチルトランスフェラーゼ(ATAT1)によるアセチル化については、多くの生物学的・分子的機能において重要な役割を果たしていることが明らかになっており、そのため、多くのヒト疾患、特に神経疾患との関連も指摘されている。
アセチル化
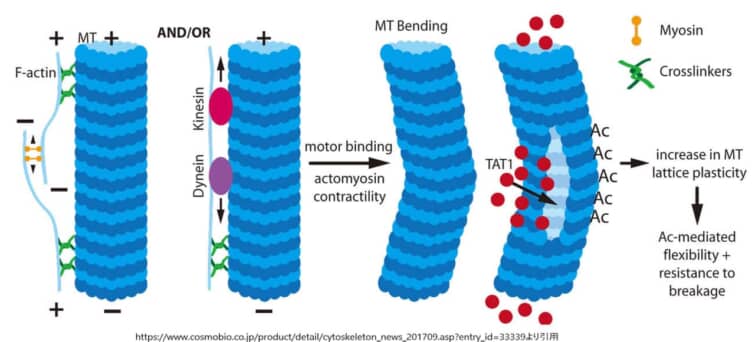
アセチル化は、微小管集合体のα-チューブリン上の第40位リジン残基(Lys40)に生じる。α-チューブリンアセチルトランスフェラーゼはαチューブリンにアセチル基を付加する酵素であるがTAT1/MEC-17がこれに当たる。
アセチル化されたチューブリンからアセチル基を除去する脱アセチル化は、サーチュイン2(SIRT2)により行われる。Lys40は長期にわたり唯一のアセチル化部位と考えられてきた。プロテオーム解析によるとα-チューブリンやβ-チューブリン上の他のリジン残基がアセチル化の標的であるのに対して、機能解析では微小管内腔内のLys40残基に焦点が当てられている。
アセチル化は、安定化された半減期が数時間の長命な微小管のマーカーである。安定化の定義はノコダゾールやコルヒチン誘導性脱重合に対して耐性である微小管である。しかし、アセチル化それ自体が微小管の安定化を誘導するわけではないが、Lys40のアセチル化が微小管の長命かつ安定化に必要であることが分かっている。たとえばノコダゾール処理して微小管の重合を阻害しても微小管は存在できるが、アセチル化を行うTAT1を欠損させると、微小管は欠損する。逆に、TAT1過剰発現によりノコダゾール耐性微小管が増える。しかし、チューブリンのアセチル化は成長過程の神経と成熟した神経の両方でみられ、半減期が数分しかないような動的微小管の亜集団にも観察されるため、チューブリンのアセチル化が安定化した微小管に限定されるというわけではない。
チューブリンを安定化させる因子
多様なタンパク質が様々な架橋因子(linker)、重合核形成因子(nucleator)、制御因子(regulator)を作り、微小管が行う様々な仕事を補助している。
微小管を不安定化させるタンパク質もありスタスミン(stathmin)と呼ばれる。
スタスミン
スタスミンはチューブリンを構成する2つの2量体に結合し、2量体を閉じ込めて集まるのを妨げたり、既存の微小管が分解するのを促したりする。
スタスミンは、細胞の必要性に応じて細胞骨格の微小管の迅速なリモデリングを制御する重要な機能を果たしている。
この記事の著者:仲田洋美医師
医籍登録番号 第371210号
日本内科学会 総合内科専門医 第7900号
日本臨床腫瘍学会 がん薬物療法専門医 第1000001号
臨床遺伝専門医制度委員会認定 臨床遺伝専門医 第755号









