ロイシンリッチリピート
ロイシン・リッチ・リピート(LRR)は、20-30のアミノ酸からなる2-45のモチーフで構成されていて、一般に弧状または馬蹄形に折りたたまれている(論文)。ロイシンリッチリピートLRRを含むタンパク質には、チロシンキナーゼ受容体、細胞接着分子、病原因子、細胞外マトリックス結合糖タンパク質などがあり、シグナル伝達、細胞接着、DNA修復、組み換え、転写、RNA処理、疾病抵抗性、アポトーシス、免疫反応など様々な生物学的プロセスに関与している(参考文献1、2)。
LRRタンパク質の配列解析から、ロイシンリッチリピートLRRにはいくつかの異なるサブファミリーが存在することが示唆された。この分類の意義は、異なるサブファミリーのリピートが同時に発生することはなく、おそらく独立して進化してきたということである。すべての主要なクラスのロイシンリッチリピートLRRが、凹面側に平行なベータシート、凸面側に大部分のヘリカル要素を持つ湾曲した馬蹄形構造を持っていることが分かっている。ロイシンリッチリピートLRRタンパク質には、繰り返しの長さやコンセンサス配列が異なるという特徴を持つ少なくとも6つのファミリーが同定されている。
 (引用)
(引用)
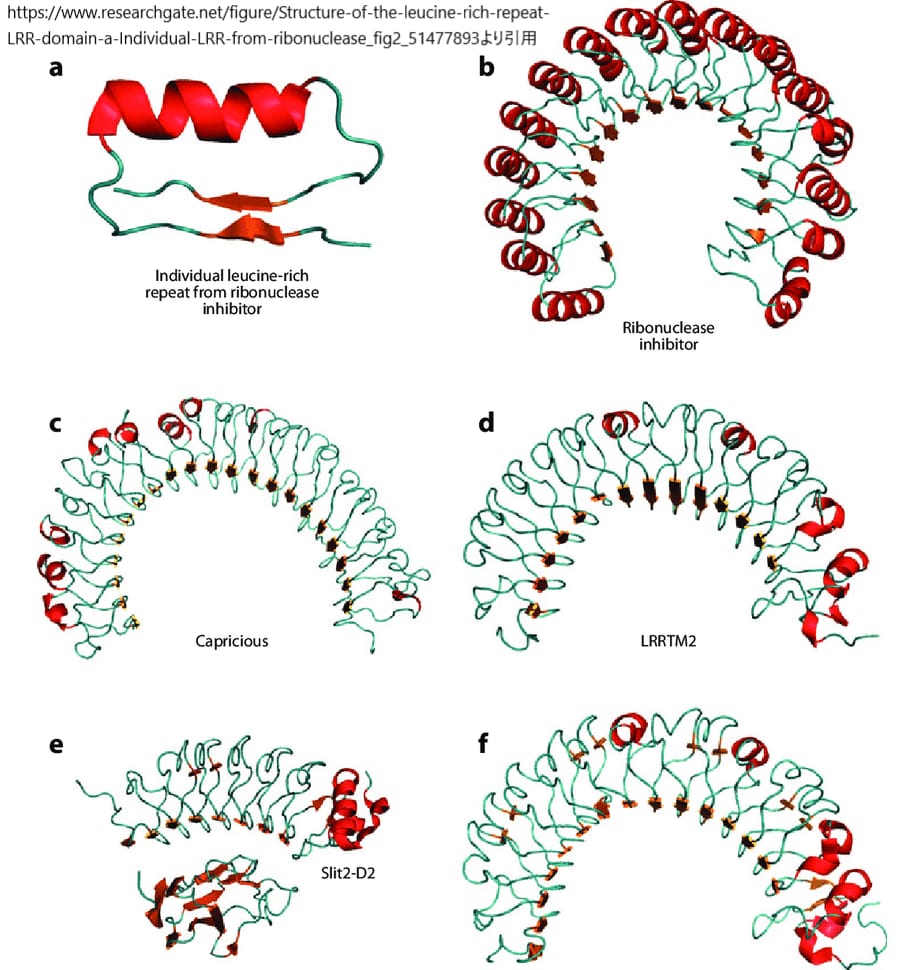
上図はロイシンリッチリピート(LRR)ドメインの構造を示したものである。
(a) リボヌクレアーゼ阻害剤(RI)の個々のLRR。LRRは右巻きのβ鎖(オレンジ色)がループ領域(ティール色)でαヘリックスモチーフ(赤色)と鎖にほぼ平行に接続された構造である。連続するLRRのβストランドも示している。カラーコードはすべてのパネルで同じである。
(b) ブタRI (PDB ID: 2BNH) 。凸側のαヘリックスに富むLRRドメインは、より顕著な曲率を示す。
(c)ショウジョウバエCapriciousのエクトドメインのホモロジーモデル。ヒトToll様受容体3の細胞外ドメインの構造をテンプレートとしてモデルを構築した(PDB ID: 1ZIW)。
(d) ヒト LRRTM2 のエクトドメインのホモロジーモデル。LINGO-1の細胞外ドメインの構造を鋳型としてモデルを構築した(PDB ID: 2ID5)。
(e) Slitの第2LRRドメインとRobo1の第1Igドメインとの複合体の立体構造 (PDB ID: 2V9T)。
(f) LINGO-1エクトドメインの三次元構造 (PDB ID: 2ID5).
ロイシンリッチリピートLRRの11残基のセグメント(LxxLxLxxN/CxL)は、βストランドと隣接するループ領域に相当し、LRRタンパク質で保存されているが、繰り返しの残りの部分は可変領域と考えられ、非常に異なっている場合がある。その違いにもかかわらず、それぞれの可変部分は、両端に2つの半回転を含み、中央には通常ヘリックスによって形成される直線セグメントがある。
凹面と隣接するループは、ロイシンリッチリピートLRRタンパク質で最も一般的なタンパク質相互作用面である。いくつかのロイシンリッチリピートLRRタンパク質-リガンド複合体の立体構造から、LRRドメインの凹面はα-ヘリックスとの相互作用に理想的であることが示されており、細長く湾曲したLRR構造は多様なタンパク質-タンパク質相互作用を実現するための優れたフレームワークを提供すると考えられている。
分子モデリングにより、20-30残基の繰り返し構造を持つタンパク質に特徴的な馬蹄形の曲率を与えるには、以前提案されたLxxLxLxxN/CxLよりも短い保存パターンLxxLxLが十分であることが示唆されている。
この記事の著者:仲田洋美医師
医籍登録番号 第371210号
日本内科学会 総合内科専門医 第7900号
日本臨床腫瘍学会 がん薬物療法専門医 第1000001号
臨床遺伝専門医制度委員会認定 臨床遺伝専門医 第755号








