目次
Rasタンパク質
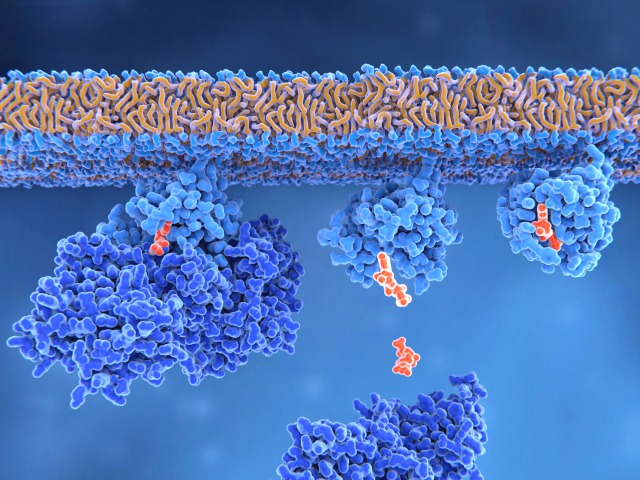
Rasタンパク質は、細胞内のシグナルネットワークを制御する2つの分子スイッチとして機能する。Rasが制御するシグナルパスウェイは、アクチン細胞骨格の完全性、細胞増殖、細胞分化、細胞接着、アポトーシス、細胞移動などのプロセスを制御する。
RASタンパク質は、ヒトのがんの原因となる役割を果たしている。また、RASの異常な活性は、自閉症やその他の神経疾患にも重要な役割を果たしている可能性がある。
RASタンパク質はシグナル伝達経路の分子スイッチである
RASタンパク質は、グアノシン三リン酸(GTP)に結合した活性型状態とグアノシン二リン酸(GDP)に結合した不活性型の状態の間を行き来する分子スイッチである。このスイッチ機構は、バクテリアからヒトまでのさまざまなGDP/GTP結合タンパク質の間で高度に保存されている。
安定した不活性なGDP結合型から活性なGTP結合型への変換は、グアニンヌクレオチド交換因子(GEF)によって促進される。不活性型への変換は、GTPase-activating proteins (GAP)によって媒介される。GEFとGAPは巨大なマルチドメインタンパク質であり、他のタンパク質、脂質、制御分子と驚くほど多様な相互作用をし、RASの活性と不活性のレベルを制御する。
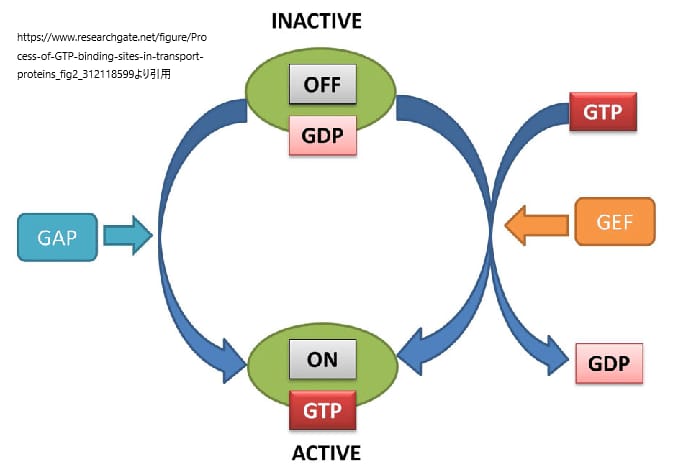
RASや他のGTPaseは、GEFやGAPに依存してオン・オフを切り替えるため、両方のプロセスが高度に制御され、複数のシグナル入力に反応することができる。しかし、これらのプロセスには、「移動」という重要な原則がある。GEFとGAPは、細胞膜にリクルートされてRASのすぐ近くに配置されると、RASのスイッチを入れたり切ったりする。RASタンパク質は、細胞膜へのリクルートによってエフェクターを活性化する。しかし、他のエフェクターと同様に、RASの直接結合も活性化に寄与している。さらに、RASエフェクターの差次的な活性化は、膜内の局所的な脂質組成によって決定される可能性がある。したがって、細胞膜の文脈でRASタンパク質を理解することは、RAS生物学の基本的な側面を理解することであり、これらの相互作用を特徴づけることは、RAS疾患を目的とした介入に重要な戦略となる。
オンかオフかというバイナリスイッチとしてのRAS
HRASのGドメインと非加水分解性GTPアナログであるGppNHpとの複合体の結晶構造は、RASがどのようにしてバイナリスイッチとして機能するかについての最初の洞察をもたらした(Milburnら、1990年、Paiら、1989年)。その後、RASとGAP、GEF、エフェクターのRAS結合ドメイン(RBD)との複合体の構造研究により、スイッチI(aa30-38)とスイッチII(aa59-76)という2つのスイッチ領域が明らかになり、タンパク質間の相互作用に重要な役割を果たしていることがわかった。この2つのスイッチ領域は、GDP状態とGTP状態の間で構造変化を起こし、ロードスプリング(荷重ばね)機構を用いて説明されている。GTP結合状態では、T35とG60がγ-リン酸と水素結合を形成し、スイッチI領域とスイッチII領域をそれぞれ活性型コンフォメーションに保持する。GTPが加水分解されると、γ-リン酸が遊離し、両スイッチ領域はGDP結合状態のコンフォメーションに戻る。
RASタンパクの活性化
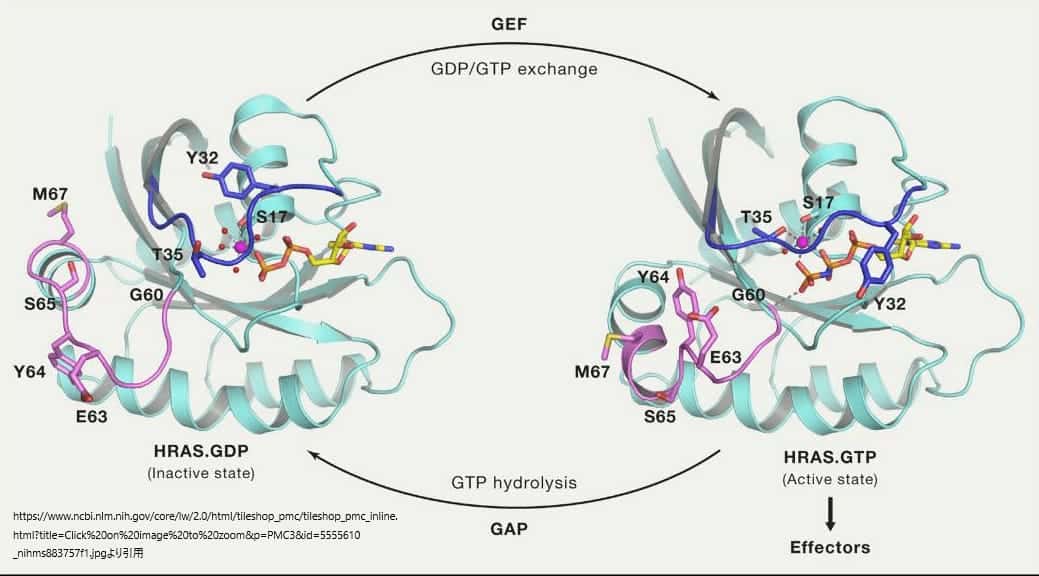
上の図はRASが不活性なGDP結合状態から活性なGTP結合状態に移行する際のスイッチ領域のコンフォメーションの変化を表したものである。スイッチI領域を青、スイッチII領域を紫で表し、遷移時に大きな構造変化を起こす残基の側鎖原子を棒状で表している。また、γ-リン酸とマグネシウムイオンが形成する相互作用が破線で示されている。RASは、GEFによるGDP/GTP交換によって活性化され、GAPによるGTP加水分解によって不活性化される。
RASタンパク質はシグナルがGDP/GTP交換を引き起こすまで、不活性状態を維持する。RASの活性化のためには交換反応を数桁加速するためのGEF活性が必要である。GEFがRASに結合すると、スイッチ領域とPループ(aa10-17)の構造変化が起こり、GDPの親和性が弱まり、その結果、GDPが放出されてGTPに交換される。RASのGDPとGTPに対する親和性は同程度であり、GEFはGDPやGTPの再結合を好まないため、GTPに結合したRASの量が増えるのは、主にGDPに比べてGTPの細胞内濃度が約10倍高いことに起因する。GTPが結合するとGEFが解離し、エフェクターを結合できる活性なGTP結合型RASが形成されることになる。
活性化RASタンパクの不活化
RASタンパク質の内在性GTP加水分解速度は非常に遅く、効率的なGTP加水分解には、開裂ステップを数桁加速するGAPとの相互作用が必要である。GAPがHRAS(RASタンパクの一つ)のスイッチII領域と相互作用することで、Q61(61番目のQつまりグルタミン)の位置が安定し、触媒の水分子が調整される。
さらに、アルギニンフィンガーと呼ばれるRASA1の残基R789は、HRASの活性部位に突出しており、GDPやAlF3のα-およびβ-リン酸基と相互作用し、γ-リン酸の負電荷を中和することで遷移状態を安定化させる。Q61は、触媒水とアルギニンフィンガーの主鎖カルボニル基との相互作用により、攻撃側の水分子から水素原子を取り出すことができる。その結果、負電荷を帯びたヒドロキシルイオンが生成され、GTPのγ-リン酸を攻撃してGTPの加水分解反応を行う。
RAS GAPのGTPase-activating protein-related domain (GRD)は高度に保存されている。
RASエフェクター
哺乳類の正常な細胞では、RAFキナーゼ(ARAF、BRAF、CRAF)がRASの主要なエフェクターである。マウス胚線維芽細胞では、RASはRAFキナーゼの活性化を通じて増殖、生存、移動を維持しており、これらのプロセスにおいて他のエフェクターの役割は明らかではない。
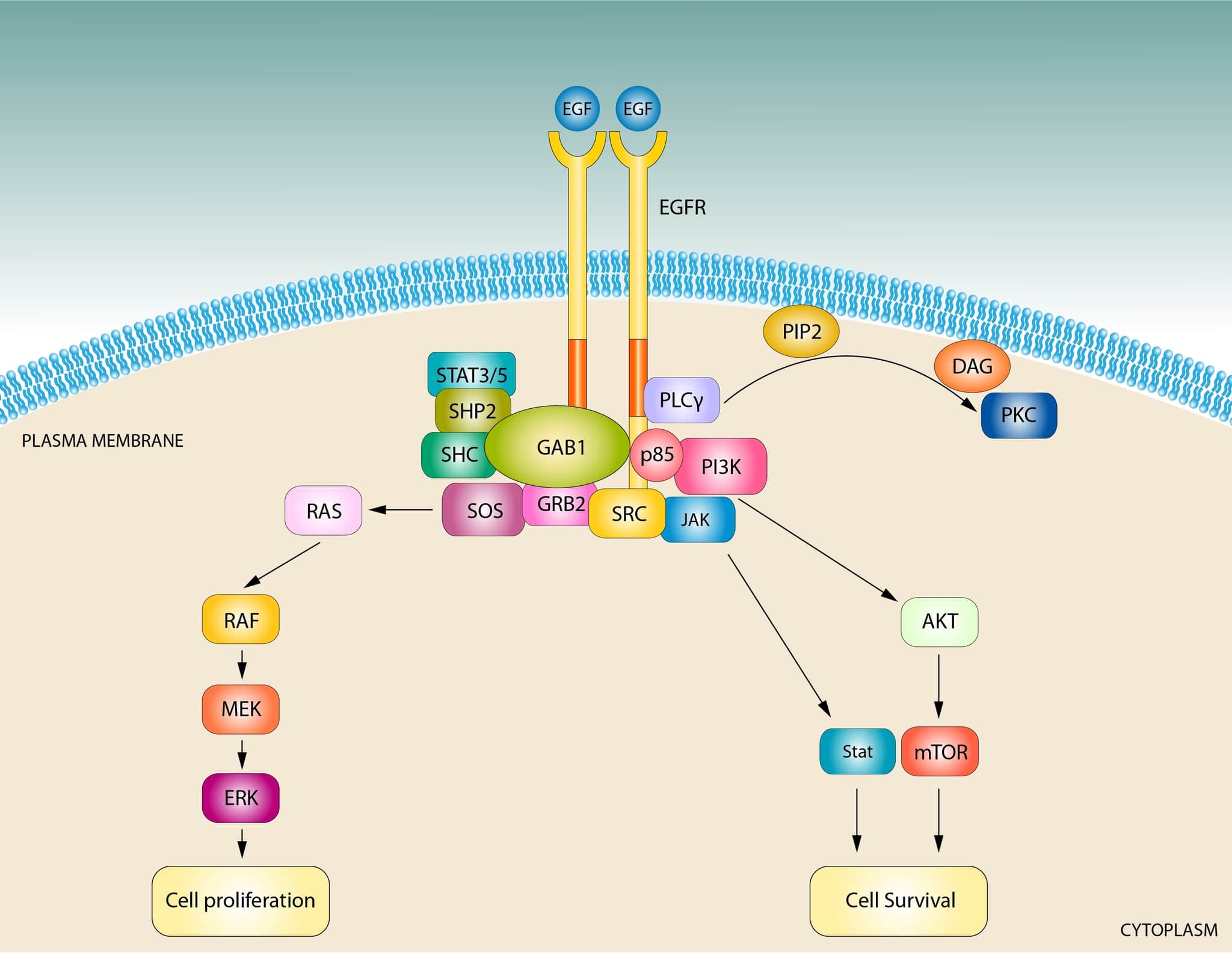
RASの生物学におけるRAF/MAPKカスケードの中心的な重要性が強調されている。ほ乳類のRASタンパク質には他にも重要なエフェクターがあり、その中でもPI3-キナーゼ(PI3K)は最もよく知られている。
がん細胞では、よく研究されているRAFキナーゼは、PI3K、RalGDSに加えて、novel RAS effector 1A(NORE1A)、Af6、ホスホリパーゼC(PLC)、RAS and Rab interactor 1(RIN1)、T cell lymphoma invasion and metastasis-inducing protein(TIAM)、および成長因子受容体14(Grb14)7つ以上の異なるRASエフェクタータンパク質が同定されている。
エフェクタータンパク質のRBDにはユビキチン様の構造があり、主にRBDのβ2鎖を介してHRASのスイッチ領域と相互作用している。HRASのエフェクター結合部位は、エフェクタータンパク質によって異なる。RAFキナーゼは主にβ2ストランドとスイッチI領域を介して相互作用するが、他のエフェクタータンパク質はスイッチII領域に存在する残基とも相互作用する。
RAFキナーゼに対するRASの親和性は10-50nMの範囲にあり、他のエフェクターやGAPに対するRASの親和性が低マイクロモルの範囲にあるのに比べてかなり高い。このことから、GAPはRAFと効果的に競合してRASに結合することができず、GAPはRAFへのRASシグナルを終結させる役割を担うことができないという指摘がなされているが、GAPおよびGEFといったエフェクターががRASタンパク質を制御するメカニズムは、P-Tyr相互作用やその他のシグナルに反応して細胞膜にリクルートされることである。膜内に入ると、RASと効果的に相互作用することができる高い局所濃度を得ることができる。同様に、RASのPI3Kに対する親和性は比較的低いが、これらの酵素は受容体チロシンキナーゼ(RTK)のシグナル伝達時に、やはりP-Tyr相互作用やその他のシグナルを介して細胞膜にリクルートされ、やはりRAS.GTPとの直接的な相互作用に適した局所的な濃度を形成する。実験的に困難なのは、RASタンパク質とそのエフェクターの間の複合体は、細胞の溶解や分析の際に膜から放出されてしまうと解析ができないという点にある。
HRAS、NRAS、KRAS4a、KRAS4bのエフェクター結合領域は同一であり、エフェクターはすべてのアイソフォームに結合する。しかし、これらのRASタンパク質の生物学的特性には明らかな違いがあることが報告されている。これらの違いがなぜ生じるかという理由としては、以下のようなものが考えられている。
- 遺伝子発現の違いを反映
- C末端の超可変領域(HVR)とタンパク質や膜との特異的な相互作用
- 個々のアイソフォームに特異的なエフェクターが存在する可能性
RASタンパク質の細胞膜における局在
RASタンパク質の細胞内局在は、特定の脂質修飾、膜の局所組成、C末端に存在する19-20残基で形成されるアイソフォーム特異的HVRの静電的性質によって決定される。
ヒトでは、3つのRAS遺伝子が4つの異なるアイソフォームをコードしている。HRAS、NRAS、そしてそれぞれエクソン4aと4bを含むKRAS遺伝子の2つのスプライスバリアント、KRAS4aとKRAS4bである。RASの4つのアイソフォームは、GTPaseドメイン(G-domain)の前半部分に同一の残基を持ち、G-domainの後半部分では82%の配列同一性を持つ。C末端の19~20個のアミノ酸は、RASアイソフォーム間で大きな配列の違いがあり、「超可変領域(hypervariable regions; HVRs)」を構成している。他のRASアイソフォームと異なり、KRAS4bはパルミトイル化されておらず、多塩基性領域を含んでいる。
下流のシグナル伝達経路を活性化するためには、膜との結合が必須であり、HVRに存在するシステイン残基のプレニル化やパルミトイル化によって、この結合が促進される。RASタンパク質のプレニル化には、ファルネシルトランスフェラーゼによるC末端のCaaXモチーフ(Cはシステイン、aは脂肪族アミノ酸、×は任意のアミノ酸)に存在するシステイン残基のファルネシル化が関与している。プレニル化後、CaaXモチーフの追加処理として、RCE1(RAS converting CaaX endopeptidase 1)による-aaX残基の切断、続いてICMT(isoprenylcysteine carboxyl methyltransferase)によるファルネシル化システイン残基のカルボキシメチル化が行われる。
ファルネシルトランスフェラーゼ阻害剤(FTI)は、HRASが駆動する腫瘍において高い抗がん作用を示すがKRASを主体とするがんに対しては同じ効果を示すことができない。これはFTIの存在下では、HRASではなくKRAS、さらにはNRASが、ゲラニルゲラニルトランスフェラーゼ-Iによる代替的なプレニル化を受けるためである。
HRASとNRASは、ゴルジ体でそれぞれDHHC9とGCP16によってパルミトイル化され、その後、小胞体で細胞膜に輸送される。KRAS4aのパルミトイルアシルトランスフェラーゼはまだ解明されていないが、パルミトイル化された後、ゴルジ体を経由せずに細胞膜に移行するようである。KRAS4bだけはパルミトイル化を受けないが、HVRにポリリジン領域があり、膜脂質の負電荷を帯びた頭部基と相互作用することでRASと膜の結合を促進する。









