ポリコームタンパク(Polycomb proteins)は、遺伝子の発現を調節するタンパク質のグループです。これらのタンパク質は細胞の分化と発達において重要な役割を果たします。特に、染色体の構造を変化させて特定の遺伝子がオフになるように働きます。これにより、細胞のアイデンティティや特定の発達段階での遺伝子発現パターンが維持されます。
ポリコームタンパクの機能は主に二つの主要な複合体を通じて行われます。
ポリコーム抑制複合体1(PRC1): これは染色体を凝縮し、遺伝子の発現を抑制する役割を持ちます。
ポリコーム抑制複合体2(PRC2): これはヒストンのメチル化を触媒し、遺伝子の発現を抑制することで染色体の構造を変化させます。
これらの複合体は、遺伝子のサイレンシング、幹細胞の維持、X染色体の不活化、がんの発生など、多くの生物学的プロセスに関与しています。異常なポリコームタンパクの活動は、発達障害や多くの種類のがんと関連しているため、これらのタンパク質は生物学と医学の研究の重要な対象となっています。
PRC1/2とは?
ポリコムタンパク群はさまざまな遺伝子の発現(オン)・抑制(オフ)といった遺伝子発現の切り換えをすることで、細胞が未分化の状態から特定の細胞へと分化する運命決定に深く関与しています。ポリコムタンパク群には、PRC1、PRC2という2種類のポリコム複合体があり、これらがDNAに結合することで、遺伝子の発現を抑制していることが明らかとなっています。
PRC1/2 Polycomb repressive complexes 1/2 は、ヒストン修飾を行うことでクロマチン修飾を行い、遺伝子発現を抑制するタンパク複合体です。発生の際にはホメオボックス遺伝子を制御することで体の前後軸や体節の決定にかかわります。ポリコーム抑制タンパク複合体に関わる遺伝子の変異はがん、幹細胞機能異常と関連していることが報告されています。
PRC2は、サイレンシングされるべきゲノム領域((PRC Response Elements PRC応答エレメント;PRE)を最初にターゲットするのに必要であり、PRC1は、このサイレンシングの安定化に必要であり、細胞分化後のサイレンシング領域の細胞内記憶の基盤となっています。
ポリコームグループの遺伝子は、抗がん剤のバリアーとして働くDNA損傷応答を直接的および間接的に制御しています。PRC2複合体は、DNAの二本鎖切断部位に存在し、非相同末端結合による切断の修復を促進しているようです。
PRC1/2の機能とは?
PRC1とPRC2は、標的遺伝子に非重複的に作用し、遺伝子の転写を抑制的に制御しています。
PRC2はヒストンH3の27番目のリジンをメチル化し(H3K27me)、PRC1はヒストンH2Aの119番目のリジンをモノユビキチン化する(H2AK119ub1)ことで機能を発揮します。
PRC1
PRC1は非運動性の微小管関連タンパク質(MAP)であり、PRC1タンパクは、細胞周期のS期およびG2/M期に比較的高レベルで発現し、有糸分裂が終了してG1期に入ると急激に減少します。PRC1は、間期には核内に存在し、分裂期には紡錘体と非常にダイナミックに結合し、細胞質分裂時には細胞の中央体に局在します。哺乳類ではPRC1を欠損させると紡錘体の中央体の組み立てが阻害されることが示されています。
PRC1は、溶液中および単一の微小管上では柔軟な分子ですが、紡錘体の中間部で見られるように、微小管結合ドメインが逆平行の微小管フィラメントの架橋によって制限されると、より強固になるというモデルが提案されています。PRC1のホモダイマーの全体的な構造はアクチン結合タンパク質を思わせるものであり、この微小管フィラメントの架橋の過程はアクチンと同様です。
細胞質分裂時にはPRC1は、キネシン4と協力して、紡錘体の中間帯に重なり合った逆平行の微小管の制御されたゾーンを設定することで、哺乳類の細胞運動機構に不可欠な中央帯微小管形成をします。 PRC1は通常、CDK1によるリン酸化によって二量体化が阻害されており、アナフェイズに入ると、PRC1の二量体が形成されます。PRC1二量体は、紡錘体の中間部に見られる反平行な微小管の重なりを特異的に認識して結合し、微小管の滑走、微小管フィラメントの架橋、そしてキネシン4などの紡錘体の中心を担うタンパク質の集合を可能にします。
キネシン4との高親和性の相互作用に必要なPRC1二量体は,キネシン4を微小管が反平行に重なっている領域にリクルートし,微小管の力学を阻害するプラス端指向のモータータンパク質であるキネシン4が,長さに依存したエンドタグの形成を助け、細胞質分裂における紡錘体微小管の組み立ての安定化と制御を助けています。PRC1-キネシン-4複合体は、細胞分裂の際に紡錘体中央部の微小管を識別して制御しています。この制御は、細胞質分裂が適切に進行するために大変重要です。
PRC2
PRC2はヒストンH3の27番目のリジンをメチル化し(H3K27me)します。
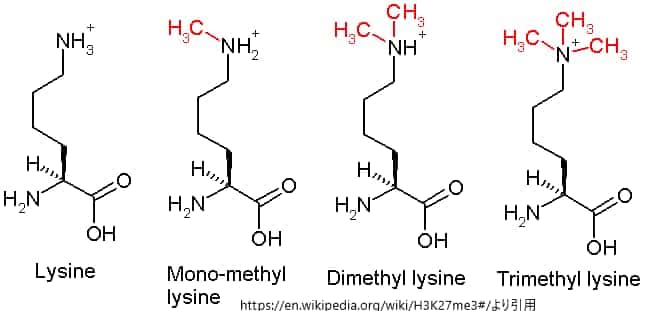
H3K27me2/3 はそれぞれメチル基が2/3個リジンに結合しているという意味です。
真核生物のクロマチンは、ヒストンタンパクとヒストンがDNAと結合して形成するヌクレオソームによって構成されています。ヒストンの尾部ドメインには、さまざまな翻訳後修飾が施されていることがよく知られています。翻訳後修飾は高度に保存されていて、1つまたは複数の尾部に存在する異なるヒストン修飾が、連続的または複合的に作用して「ヒストンコード」を形成し、他のタンパクによって読み取られて、下流の現象が引き起こされると考えられています。
H3のリシン27に抑制マークを配置する(サイレンシングする)には、転写因子によるクロマチンレギュレーターがさらに必要です。これらの修飾因子は、ヒストンを共有結合的に修飾してヌクレオソームの周りを移動してクロマチンを開くヒストン修飾複合体、またはヌクレオソームを直接修飾せずに移動するクロマチンリモデリング複合体のいずれかだと考えられています。これらのヒストンマークは、H3K27me3で見られるように、他のコアクチベーターのドッキングサイトとして機能することができます。これは、ヒストンのメチル化とクロモドメインの相互作用を介したポリコームを介した遺伝子サイレンシングによって発生します。ポリコーム抑制複合体(PRC); PRC2は、ヒストンメチルトランスフェラーゼ活性を介してリジン27上のヒストン3のトリメチル化を仲介します。このマークは、クロマチンの圧縮に結合して寄与するPRC1を動員します。
H3K27me3は、DNA損傷の修復、特に相同組換え修復による二本鎖切断の修復に関連しています。
PRC2のサブユニットであるEZH1とEZH2を標的としたマウス胚性幹細胞を作製し、クロマチン上の異なるH3K27メチル化状態とPRC2/1の存在の寄与を識別することに成功した報告からは、ES細胞の適切な分化にはクロマチンへのこれらの分子のリクルートではなく、H3K27のメチル化が必須であることが明らかになっています。PRC2による発生制御の喪失には、アセチル基転移酵素による拡散したクロマチンの修飾が寄与していることがわかっています。(文献)
PRC2は、X染色体の不活性化、幹細胞の運命の維持、刷り込み(インプリンティング)に役割を果たしています。PRC2の発現異常は、がんで観察されています。様々なヒトのがんにおいてPRC2構成要素の機能喪失および機能獲得の両方の変異が確認されており、これらの構成要素が悪性腫瘍において複雑な役割を果たしていることが示唆されています。
この記事の著者:仲田洋美医師
医籍登録番号 第371210号
日本内科学会 総合内科専門医 第7900号
日本臨床腫瘍学会 がん薬物療法専門医 第1000001号
臨床遺伝専門医制度委員会認定 臨床遺伝専門医 第755号






