目次
PCR(ポリメラーゼ連鎖反応)は、DNAを増幅するための基本的な技術です。本記事では、PCRの基本原理、手順、応用分野、最新技術、さらには注意点や課題について詳しく解説します。初心者から専門家まで、幅広い読者に役立つ情報を提供します。
PCRとは何か?
PCRの基本原理
PCR(ポリメラーゼ連鎖反応)は、特定のDNA配列を迅速かつ正確に増幅する技術です。この技術は、DNAの特定領域を何百万倍にも複製することで、微量のDNAから大量の分析可能なDNAを得ることができます。PCRのプロセスは、以下の3つの主要なステップで構成されています:
1. デナチュレーション: 反応温度を約95℃に加熱し、DNAの二本鎖を一本鎖に解離させます。
2. アニーリング: 温度を50-65℃に下げ、プライマーがターゲットDNAに結合します。
3. エロンゲーション: 温度を約72℃に上げ、DNAポリメラーゼがプライマーに続いて新しいDNA鎖を合成します。
これらのステップを30-40回繰り返すことで、ターゲットDNA領域を指数関数的に増幅します。PCRは、遺伝子研究、医療診断、法医学など多岐にわたる分野で広く利用されています。
PCRの歴史と発展
PCR技術は、1983年にキャリー・マリスによって発明されました。この発明は、分子生物学に革命をもたらし、1993年にはノーベル化学賞を受賞しました。初期のPCR技術は手動で行われていましたが、サーマルサイクラーの開発により自動化が進みました。さらに、ターモスアクアティクス由来の耐熱性DNAポリメラーゼ(Taqポリメラーゼ)の導入により、PCR反応の効率と正確性が大幅に向上しました。近年では、リアルタイムPCRやデジタルPCRなどの新技術が登場し、定量的解析や高感度検出が可能となっています。
PCRの手順
サンプル準備
PCRを始める前に、適切なサンプル準備が不可欠です。以下の手順と注意点を詳述します:
1. サンプル収集:
– サンプル(血液、組織、唾液など)を採取します。無菌状態で行い、コンタミネーションを防ぎます。
2. DNA抽出:
– サンプルからDNAを抽出します。市販のキットやフェノール・クロロホルム抽出法を使用します。
3. DNA精製:
– 抽出したDNAを精製し、PCR阻害物質を除去します。精製キットを利用すると便利です。
4. DNA濃度と純度の測定:
– ナノドロップやゲル電気泳動を用いて、DNAの濃度と純度を確認します。
5. 保存と取扱い:
– 抽出したDNAは、-20℃または-80℃で保存し、劣化を防ぎます。
注意点として、サンプル準備の各ステップでコンタミネーションを防ぐため、滅菌された器具と試薬を使用し、作業環境を清潔に保つことが重要です。
サーマルサイクラーの役割
サーマルサイクラーは、PCR(ポリメラーゼ連鎖反応)において不可欠な装置であり、DNAの増幅を効率的に行うための温度制御システムです。以下にサーマルサイクラーの機能と役割を説明します:
1. 温度制御:
– サーマルサイクラーは、PCRの各ステップ(デナチュレーション、アニーリング、エロンゲーション)に必要な温度を正確に制御します。通常、各サイクルは高温(95℃)、中温(50-65℃)、低温(72℃)の3つの温度段階を繰り返します。
2. 迅速な温度変化:
– 装置は短時間で温度を急速に変化させることができるため、PCR反応を短時間で行うことができます。これにより、効率的なDNA増幅が可能となります。
3. プログラム可能性:
– サーマルサイクラーは、ユーザーが設定したプログラムに基づいて温度と時間を自動的に管理します。これにより、反応条件を正確に再現でき、実験の再現性が高まります。
4. 多様な機能:
– 最新のサーマルサイクラーには、温度勾配機能やリアルタイムPCR機能が搭載されており、複雑な実験条件にも対応できます。
サーマルサイクラーは、PCRの成功に不可欠な装置であり、その正確な温度制御と迅速な温度変化能力により、DNA増幅の効率と精度を高める役割を果たしています。
PCRサイクルの詳細
PCRサイクルは、デナチュレーション、アニーリング、エロンゲーションの3つの主要ステップで構成されています。
● デナチュレーション:
デナチュレーションは、PCRの最初のステップであり、DNAの二本鎖を一本鎖に分離するために行われます。具体的には、次のように進行します:
1. 高温処理:
– 反応温度を94-95℃に加熱します。この高温環境により、DNAの水素結合が破壊され、二本鎖DNAが解離して一本鎖DNAになります。
2. 時間の設定:
– デナチュレーションの持続時間は通常20-30秒間です。ただし、初期デナチュレーションステップでは、サンプルの完全なデナチュレーションを確実にするために2-5分間行うこともあります。
3. 影響:
– デナチュレーションにより、ターゲットDNA配列がプライマーにアクセス可能な状態になり、次のアニーリングステップでプライマーが結合できるようになります。
デナチュレーションは、正確なDNA増幅を行うための重要なステップであり、適切な温度と時間の設定が必要です。
● アニーリング:
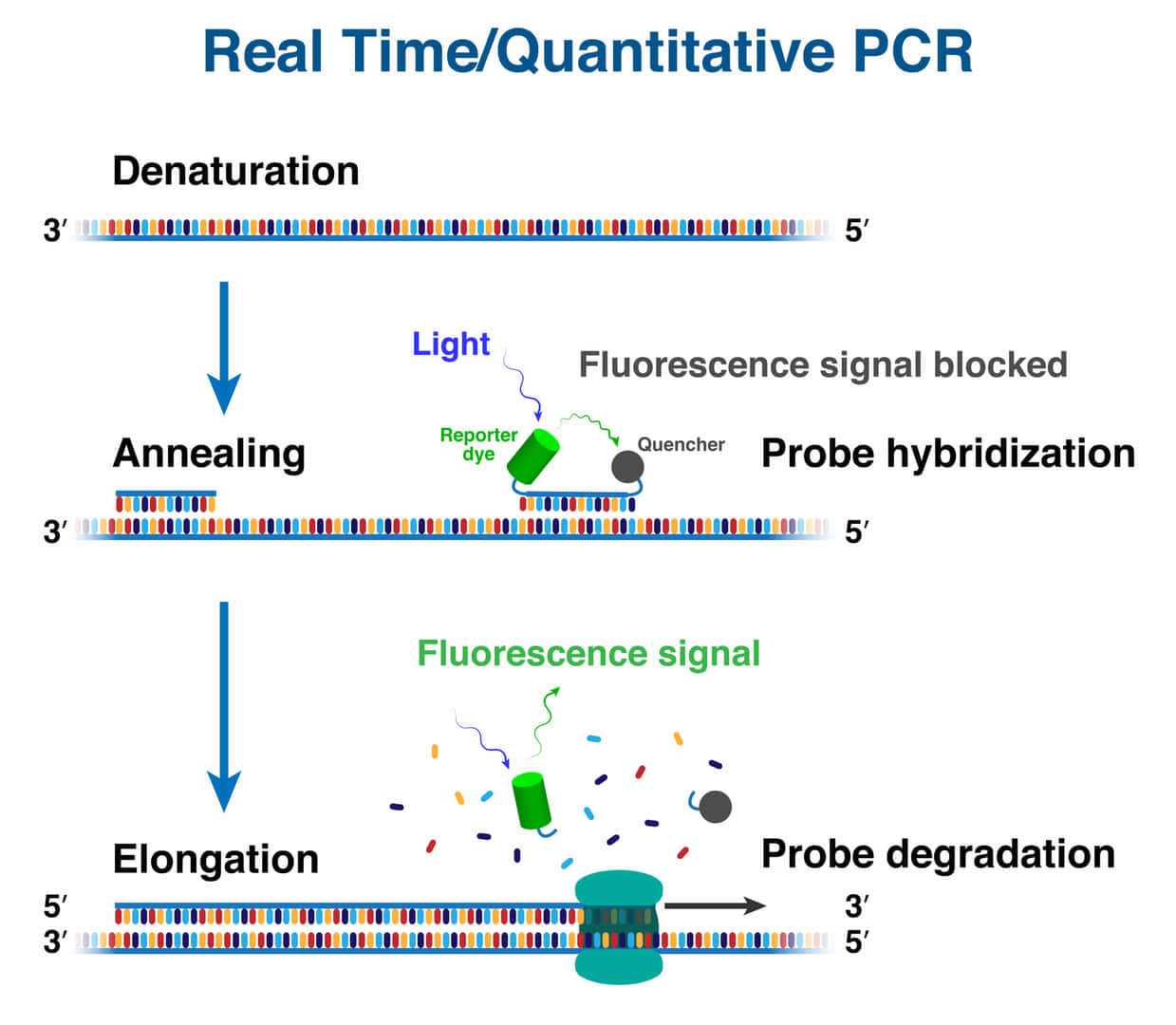
アニーリングは、PCRの第二ステップで、プライマーが一本鎖DNAに結合する重要な過程です。具体的には、以下のように進行します:
1. 温度調整:
– 反応温度を50-65℃に下げます。この温度はプライマーの設計に依存し、最適な結合温度(Tm値)に設定されます。
2. プライマー結合:
– 温度が下がると、プライマーがターゲットDNAの特定の配列に結合します。プライマーは、DNAポリメラーゼが新しいDNA鎖を合成するための起点となります。
3. 時間の設定:
– アニーリングの持続時間は通常20-40秒間です。適切な時間が設定されることで、プライマーが効率的に結合します。
4. 特異性の確保:
– 適切な温度と時間により、プライマーが正確にターゲットDNAに結合し、非特異的な結合を防ぎます。
アニーリングは、正確なDNA増幅を行うために重要なステップであり、最適な温度と時間の設定が必要です。
● エロンゲーション:
エロンゲーション(伸長)は、PCRの第三ステップであり、DNAポリメラーゼが新しいDNA鎖を合成する過程です。具体的には、以下のように進行します:
1. 温度設定:
– 反応温度を72℃に設定します。これは、TaqポリメラーゼなどのDNAポリメラーゼが最適に機能する温度です。
2. DNA合成:
– DNAポリメラーゼがプライマーに結合し、dNTP(デオキシヌクレオシド三リン酸)を基にして新しいDNA鎖を5’から3’方向に伸長させます。
3. 時間の設定:
– エロンゲーションの時間は増幅するDNAの長さに依存します。通常、1キロベースあたり約1分間設定します。
エロンゲーションは、PCRにおけるDNA合成の中心的なステップであり、新しいDNA分子を正確に複製するために不可欠です。
PCRの応用分野
医療診断におけるPCR
PCRは医療診断で広く使用されており、特に感染症の診断や遺伝子異常の検出において重要な役割を果たしています。
1. 感染症の診断:
– PCRは、ウイルスや細菌のDNAやRNAを迅速かつ正確に増幅することで、感染症の診断に用いられます。例えば、新型コロナウイルス(SARS-CoV-2)の診断では、RT-PCR(逆転写PCR)が標準的な手法として採用されています。微量のウイルスRNAを増幅し、特異的な遺伝子領域を検出することで感染の有無を判断します。
2. 遺伝子異常の検出:
– 遺伝性疾患の診断やがんの分子診断において、PCRは特定の遺伝子異常を検出するために使用されます。例えば、BRCA1やBRCA2遺伝子の変異検出により、乳がんや卵巣がんのリスク評価が行われます。また、染色体異常や点突然変異の検出にもPCRは有効です。
PCRはその高感度と特異性により、早期診断や個別化医療の実現に寄与しています。医療分野でのPCRの応用はますます広がっており、患者の治療と予後の改善に大きく貢献しています。
遺伝子研究におけるPCR
PCRは遺伝子研究において多岐にわたる応用があります。その重要性をいくつかの例を通して解説します。
1. クローン作製:
– PCRは特定のDNA断片を増幅し、プラスミドやベクターに挿入してクローンを作成するために使用されます。これにより、特定の遺伝子を詳細に研究することが可能になります。
2. 変異解析:
– PCRは遺伝子の特定部位を増幅し、塩基配列を解析することで、点突然変異や遺伝子多型を検出します。これにより、遺伝子変異の機能や疾患との関連を調べることができます。
3. 遺伝子発現解析:
– RT-PCR(逆転写PCR)を用いて、mRNAからcDNAを合成し、特定の遺伝子の発現量を定量化することができます。これにより、遺伝子の機能や発現調節のメカニズムを研究することができます。
PCRは、その高い感度と特異性により、遺伝子研究の基盤技術として広く利用され、遺伝子の機能解析や疾患研究に不可欠なツールとなっています。
法医学におけるPCR
PCRは犯罪捜査におけるDNA分析において非常に重要な役割を果たしています。
1. DNAプロファイリング:
– PCRを用いて、犯罪現場から採取された微量のDNAを増幅し、個人特有のDNAプロファイルを作成します。これにより、犯人の特定や容疑者の排除が可能となります。
2. 古いサンプルの分析:
– PCRは、劣化したり微量しか存在しないDNAサンプルを増幅できるため、古い証拠品からでも有効なDNA情報を得ることができます。
3. 親子鑑定や身元確認:
– 遺伝子の一致を確認するために、PCRを使用してDNAサンプルを分析し、親子関係や被害者の身元確認を行います。
これらの応用により、PCRは法医学における強力なツールとなっており、犯罪捜査の精度と効率を大幅に向上させています。
最新のPCR技術
リアルタイムPCR(qPCR)
リアルタイムPCR(qPCR)は、DNA増幅の進行をリアルタイムで観察することができる技術です。この技術は、蛍光染料や蛍光プローブを使用して、DNAが増幅されるごとに発生する蛍光シグナルを測定します。これにより、増幅の各サイクルで生成されたDNAの量を定量的に解析できます。qPCRは、遺伝子発現解析、病原体の定量検出、遺伝子変異の検出など、さまざまな分野で広く応用されています。
● qPCRの応用
1. 遺伝子発現解析:
– qPCRは、特定の遺伝子の発現量を定量的に測定するために使用されます。これにより、特定の条件下で遺伝子がどのように発現するかを調べることができます。
2. 病原体の検出:
– 病原体のDNAやRNAを迅速かつ正確に検出するためにqPCRが利用されます。例えば、新型コロナウイルス(SARS-CoV-2)の診断ではqPCRが標準的な方法として使用されています。
3. 遺伝子変異の検出:
– qPCRは、特定の遺伝子変異の有無を確認するためにも使用されます。これにより、遺伝子異常に関連する疾患の診断や研究が進められます。
qPCRはその高感度と特異性により、研究から臨床診断まで幅広い分野で利用されています。リアルタイムでDNA増幅を追跡できるため、定量的なデータが得られ、非常に信頼性の高い結果が得られます。
デジタルPCR(dPCR)
デジタルPCR(dPCR)は、PCR技術の革新的なバージョンであり、特に高感度かつ定量的なDNA分析において優れた性能を発揮します。dPCRは、従来のPCRと異なり、DNAサンプルを多数の小さな反応区画に分割し、各区画で個別にPCRを実行します。これにより、DNA分子の絶対数を正確に定量化することが可能です。
● dPCRの利点
1. 高感度:
– 極めて低い濃度のDNAを検出できます。dPCRは、微量のDNAや希少な遺伝子変異の検出に非常に適しています。
2. 正確な定量化:
– DNAのコピー数を正確に定量化することができます。従来のqPCRでは相対的な定量化しかできませんが、dPCRは絶対定量化が可能です。
3. 高再現性:
– サンプルの分割と独立したPCR反応により、結果のばらつきが少なく、再現性が高いです。
● dPCRの応用
– がん研究: 微量ながん関連遺伝子変異の検出に利用され、早期診断や治療効果のモニタリングに役立ちます。
– 遺伝子診断: 遺伝性疾患の診断やキャリア検査で、正確な遺伝子変異の検出が可能です。
– 環境モニタリング: 微生物の検出や環境DNAの定量化に利用されます。
デジタルPCRは、特に高感度が求められるアプリケーションにおいて、従来のPCR技術を補完する強力なツールとして広く活用されています。
その他の新技術
最新のPCR技術やその改良点について紹介し、その利点と可能性を探ります。
1. マルチプレックスPCR:
– 一度に複数のターゲットDNA配列を同時に増幅できる技術です。これにより、複数の遺伝子や病原体を同時に検出することが可能になり、時間とコストの効率が向上します。
2. リバーストランスクリプトPCR(RT-PCR):
– RNAからcDNAを合成し、その後PCRで増幅する技術です。遺伝子発現解析やウイルスRNAの検出に広く利用されています。
3. 高速PCR:
– 温度制御技術の改良により、PCR反応のサイクルタイムが短縮され、迅速なDNA増幅が可能です。これにより、診断や研究における時間効率が大幅に向上します。
4. アイソサーマル増幅技術:
– LAMP(Loop-mediated Isothermal Amplification)などの技術は、一定温度でDNA増幅を行います。専用機器を必要とせず、現場診断や簡便なDNA増幅に適しています。
これらの新技術は、PCRの応用範囲を広げ、さらなる精度と効率を提供します。今後も技術の進展により、PCRの可能性はさらに拡大するでしょう。
PCRを実施する際の注意点
コンタミネーションの防止
PCR実験においてコンタミネーションの防止は極めて重要です。コンタミネーションが発生すると、偽陽性結果が生じ、実験の信頼性が損なわれます。以下の防止策を講じることが推奨されます:
1. 無菌操作:
– 滅菌された器具と試薬を使用し、クリーンベンチ内で作業する。
2. 作業エリアの分離:
– PCR反応の調製、増幅、解析を異なる場所で行う。
3. 使い捨てグローブとラボコートの着用:
– 常に使い捨てグローブとラボコートを着用し、頻繁に交換する。
4. 試薬の管理:
– 試薬の交差汚染を防ぐため、各試薬専用のピペットチップを使用する。
5. 陰性コントロールの使用:
– 反応ごとに陰性コントロールを設け、コンタミネーションの検出に利用する。
これらの防止策を徹底することで、PCR実験の精度と信頼性を確保できます。
最適化の重要性
PCR実験の成功には最適化が不可欠です。以下に具体的な最適化方法とそのポイントを説明します:
1. プライマー設計:
– プライマーの配列は特異性が高く、ターゲットDNAに適切に結合する必要があります。プライマーの長さは18-24塩基が一般的です。
2. アニーリング温度:
– 最適なアニーリング温度を見つけるために温度勾配PCRを行います。プライマーのTm値に基づき、一般的にはTm値より2-5℃低い温度を設定します。
3. マグネシウム濃度:
– MgCl2の濃度を調整することでDNAポリメラーゼの活性を最適化します。0.5-2.5mMの範囲で試験します。
4. サイクル数:
– 適切なサイクル数を設定することで非特異的な増幅を防ぎ、目的のDNA断片を効率よく増幅します。通常は25-35サイクルが推奨されます。
5. DNAテンプレート量:
– 適切な量のDNAテンプレートを使用することで効率的な増幅を行います。過剰なテンプレートは非特異的な産物を生じやすいので注意が必要です。
最適化により、特異性の高い増幅を実現し、実験結果の信頼性を向上させることができます。
PCRの課題と将来の展望
PCRの限界
PCR技術は強力ですが、いくつかの限界があります。
1. コンタミネーション:
– 微量のDNAでも増幅されるため、汚染による偽陽性が発生しやすいです。これを克服するために、厳格な無菌操作と陰性コントロールの設定が必要です。
2. 特異性:
– 非特異的な増幅が起こることがあります。プライマーの最適化や適切なアニーリング温度の設定が重要です。
3. 感度の限界:
– 極微量のDNAの検出には限界があります。デジタルPCR(dPCR)などの技術がこれを補完します。
4. 定量化の限界:
– 絶対定量化が難しいです。リアルタイムPCR(qPCR)やdPCRが定量化を補助します。
これらの限界を克服するために、新技術や改良手法の開発が進められています。
次世代技術との比較
PCRと次世代シーケンシング(NGS)などの新しい技術を比較し、それぞれの利点と欠点を分析します。
● PCR
– 利点:
– 迅速性: 短時間で特定のDNA配列を増幅可能。
– 感度: 微量のDNAからも増幅可能。
– コスト: 比較的低コストで実施可能。
– 欠点:
– 特異性: 非特異的増幅のリスク。
– 定量化の難しさ: 絶対定量化が困難。
– 情報量の制限: 単一のターゲット領域のみ増幅。
● 次世代シーケンシング(NGS)
– 利点:
– 情報量: 全ゲノムや複数遺伝子の一度に解析が可能。
– 多様性: 遺伝的変異や多様性の検出が高精度。
– 定量化: 高精度な絶対定量が可能。
– 欠点:
– コスト: 高額であることが多い。
– 時間: データ解析に時間がかかる。
– 複雑性: 実施とデータ解析が複雑。
● 結論
PCRは迅速かつ低コストで特定のDNA配列を解析するのに適していますが、情報量に限りがあります。NGSは広範な情報を提供し、多様な遺伝的変異を高精度で解析できますが、コストと時間がかかります。これらの技術は、目的に応じて適切に使い分けることが重要です。
PCRの未来
PCR技術の将来的な展望は、さらなる革新と応用の広がりを期待されています。
1. 高感度・高特異性:
– デジタルPCR(dPCR)の普及により、微量なDNAの正確な定量化が可能になり、診断や研究の精度が向上します。
2. 迅速診断:
– 新しいポータブルPCRデバイスの開発により、現場での迅速な病原体検出や遺伝子解析が可能になります。
3. 多重PCR:
– 一度に複数のターゲットを同時に増幅できる技術の進展により、効率的な診断と研究が進みます。
4. AIと自動化:
– 人工知能(AI)とロボット技術の導入により、PCR実験の自動化とデータ解析の高速化が期待されます。
5. 新しい酵素の開発:
– 高温耐性や反応効率の高い新しいDNAポリメラーゼの開発により、PCRの性能がさらに向上します。
これらの進展により、PCR技術はより迅速、正確、そして多機能なツールとして、医療診断、環境モニタリング、遺伝子研究などの幅広い分野で活用され続けるでしょう。









