目次
この記事では、ノーザンブロットの基本的な原理、手順、そしてこの技術が遺伝子発現の研究にどのように利用されているかについて詳細に解説します。また、この技術の限界と可能性についても掘り下げ、最新の科学研究におけるその応用例を紹介します。
ノーザンブロットの概要
基本原理
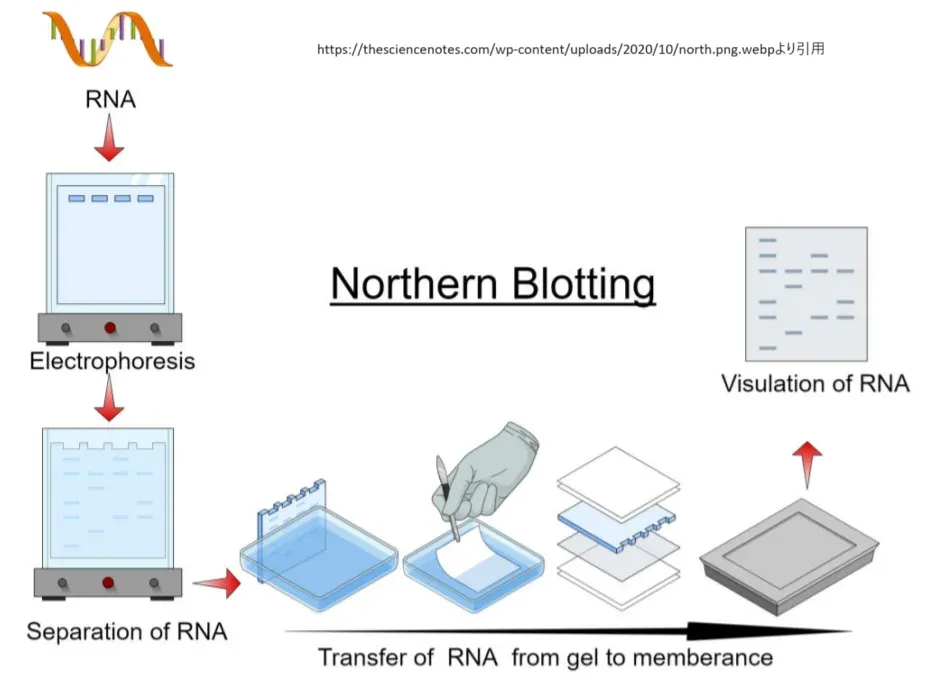
ノーザンブロットは、RNAのサイズと存在量を特定するための分子生物学的手法です。この技術は、特定のRNA分子の存在と量を測定することにより、遺伝子の発現パターンを解析するのに非常に有用です。ノーザンブロットの「ブロット」とは、ゲルを用意して、それをサンドイッチのように重ね、その上に転写したいメンブレンを置き、さらにペーパータオルなどの吸収材を重ねて、あたかもDNAをメンブレンの上にブロッティングして分析するかのようにするプロトコルのことです。
● RNAのサイズと量の特定
ノーザンブロットのプロセスは、まずRNAの抽出から始まります。得られたRNAは電気泳動によってサイズ別に分離されます。RNA分子は、その長さに応じてゲル中を異なる速度で移動します。このため、大きいRNA分子はゲルの上部に留まり、小さい分子はより遠くに移動します。
● 転写と固定化
分離されたRNAは、次にゲルからニトロセルロースやナイロンの膜へと移されます(ブロッティング)。膜に移されたRNAはUV照射または加熱によって膜上に固定されます。これにより、RNAが洗浄過程で洗い流されることなく、プローブとのハイブリダイゼーションが可能になります。
● ハイブリダイゼーション
特定のRNAを検出するために、放射性または蛍光標識されたプローブが用いられます。このプローブは特定のRNA配列と補完的に結合します。ハイブリダイゼーション後、非特異的に結合したプローブは洗浄によって除去され、特異的に結合したプローブのみが膜上に残ります。
● シグナルの検出
プローブが標識されているため、X線フィルムを使用して放射性プローブ、または適切な光源と検出器を用いて蛍光プローブのシグナルを可視化します。このシグナルの強さと位置から、特定のRNAの存在量とその分子サイズが測定されます。
ノーザンブロットは、その感度と特異性により、遺伝子発現研究における重要なツールとして広く利用されています。この手法は特定のRNAの発現レベルを正確に定量化し、遺伝子の機能解析や疾患研究に貢献しています。
歴史的背景と技術の発展
ノーザンブロットは、1977年にジェームス・アルワイン、デビッド・ケンペルマン、ジョージ・スタークによって開発されました。この技術は、当初からRNAのサイズと存在量を特定するための強力な手法として認識され、遺伝子発現の研究に革命をもたらしました。
● ノーザンブロットの起源
ノーザンブロットの名前は、DNAを分析する手法である「サザンブロット」にちなんで名付けられました。サザンブロットはエドウィン・サザンによって発明されたため、RNAの分析法であるこの新しい技術に「ノーザンブロット」という名前が付けられました。これは科学のユーモアの一例であり、後にプロテインを分析するウェスタンブロットがこの命名法を引き継ぎました。
● 技術の進化
初期のノーザンブロットは主に放射性プローブを使用していましたが、時間が経つにつれて、非放射性の標識、特に蛍光標識が一般的になりました。これにより、研究室での安全性が向上し、より詳細なイメージングが可能になりました。また、自動化技術の進展により、サンプルの処理とデータの取得が効率化され、実験の再現性と精度が向上しました。
● 現代の応用と挑戦
デジタルイメージング技術の導入により、ノーザンブロットの解析はより精密になりました。これにより、非常に微量なRNAでも検出可能になり、遺伝子発現の微妙な変化も捉えることができるようになりました。しかし、ノーザンブロットは時間がかかり、高価であるため、高スループットな解析が求められる現代の研究では、RT-PCRや次世代シーケンシング(RNA-Seq)などの他の手法に取って代わられつつあります。
ノーザンブロットの発明とその進化は、遺伝子発現の分析技術としての基礎を築き、現代の分子生物学における多くの発展に寄与しました。この技術は今でも特定のアプリケーションで重要な役割を果たしており、その歴史的な重要性と進化の過程は分子生物学の発展を理解する上で非常に示唆に富んでいます。
ノーザンブロットの手順
RNAの抽出と分離
RNAの抽出と分離は、ノーザンブロット実験の最初の重要なステップです。このプロセスは、RNAが正確に量定され、特定されるための基盤を築きます。
● RNAの抽出
RNAを抽出するためには、まずサンプル内の細胞を破壊してRNAを解放する必要があります。この目的のために、通常、研磨剤や超音波破砕などの物理的手法、または界面活性剤を含むリソーム溶解剤を使用します。破壊された細胞からRNAを分離する一般的な方法には、酸性グアニジニウムチオシアン酸フェノールクロロホルム抽出(AGPC法)があります。
● 分離のための電気泳動
RNAの抽出後、RNAのサイズと純度を評価するために電気泳動が行われます。RNAサンプルをデンプンゲルやアガロースゲル上で電気泳動させ、RNAの分子量に基づいて分離します。この際、通常、RNAの二次構造を解消するために尿素やホルムアルデヒドなどの変性剤がゲルに添加されます。RNAはゲル上でその大きさに応じて異なる距離を移動し、この移動距離からRNAの大きさを推定することができます。
● ゲルの染色と可視化
電気泳動後、RNAを含むゲルはエチジウムブロマイドや他の核酸染色剤で染色され、紫外線下で観察されます。染色によってRNAバンドが可視化され、特定のRNAの存在とその量が確認されます。このステップは、ハイブリダイゼーションに適したRNAが得られたかを確認するために重要です。
このRNAの抽出と分離プロセスを適切に行うことで、ノーザンブロットにおいて高品質なデータを得ることが可能となります。正確な抽出と分離が、信頼性の高い実験結果を保証する鍵となります。
ゲルへの転写と固定化
ノーザンブロットにおけるゲルから膜へのRNAの転写と固定化は、RNAの検出と分析において重要なステップです。このプロセスにより、RNAが膜に安定して固定され、プローブとのハイブリダイゼーションが可能になります。
● 転写プロセス
RNAが電気泳動によって分離された後、次のステップはゲルから膜への転写です。一般的に使用される膜にはナイロンまたはニトロセルロースがあります。転写の方法としては、キャピラリー転写、バキューム転写、または電気転写があります。これらの方法は、RNAをゲルから膜に物理的に移動させることを目的としています。キャピラリー転写は重力を利用し、水分がゲルを通過する際にRNAを膜に引き寄せます。電気転写は電場を使用して、より迅速にRNAをゲルから膜へ移動させる方法です。
● 固定化
転写が完了した後、RNAは膜上で固定化されます。固定化は、RNAが洗浄やハイブリダイゼーションのプロセス中に膜から洗い流されないようにするために必要です。固定化の一般的な方法にはUVクロスリンキングと加熱があります。UVクロスリンキングでは、膜をUV光にさらすことでRNAと膜の間に共有結合を形成させます。これにより、RNAが膜上で安定に固定されます。加熱方法では、膜を特定の温度で加熱することでRNAを膜に固定します。ニトロセルロース膜の場合は焼成が一般的ですが、ナイロン膜ではUVクロスリンキングが推奨されることが多いです。
これらの転写と固定化の適切な実行は、RNAが膜上で正確に固定され、後続のハイブリダイゼーションと検出が成功するために不可欠です。プロセスの正確性は、最終的な実験結果の信頼性と再現性に直接影響します。
ハイブリダイゼーションと検出
プローブの設計と標識
ノーザンブロットにおけるプローブの設計と標識は、特定のRNAを正確に検出するために極めて重要です。このプロセスは、ターゲットRNAと特異的にハイブリダイズするプローブを作成することから始まります。
● プローブの設計
プローブは、ターゲットRNAと補完的な核酸配列を持つ短いDNAまたはRNAの断片です。プローブの設計には、ターゲットとするRNAの配列を正確に知る必要があります。通常、プローブはターゲットRNAの一部に完全に一致するように設計され、20-30塩基のオリゴヌクレオチドが使用されることが一般的です。プローブは、高い特異性と感度を確保するために、ターゲットRNAの非常に保存された領域または独特な領域をターゲットにすることが推奨されます。
● プローブの標識
プローブの標識には、主に放射性標識と非放射性(蛍光や化学発光)標識の二つの方法があります。放射性標識では、通常、^32Pが使用され、プローブに高い感度をもたらしますが、扱いが難しく、安全対策が必要です。一方、非放射性標識は、蛍光標識や発光基を結合させることによって行われ、取り扱いが容易で、安全であるため、より広く利用されるようになっています。
● 標識の適用方法
プローブの標識は、合成段階で直接行われることが多いです。放射性標識の場合、放射性リン酸を用いたキネース反応によってオリゴヌクレオチドの5’末端を標識します。非放射性標識の場合、蛍光マーカーや発光基を化学的にオリゴヌクレオチドに結合させます。これにより、特定のRNAを標的とするプローブを通じて、ハイブリダイゼーション後の洗浄プロセスを経ても、特定のシグナルを確実に検出することができます。
これらのプローブの設計と標識技術の進歩により、ノーザンブロットの精度と効率が大きく向上し、遺伝子の発現分析における信頼性が高まっています。
ハイブリダイゼーションとシグナルの検出
ノーザンブロットにおけるハイブリダイゼーションとシグナルの検出は、特定のRNA分子を同定し、その量を測定するための核心プロセスです。このステップは高い特異性と感度を必要とします。
● ハイブリダイゼーションのプロセス
ハイブリダイゼーションは、特定のRNAに対応する標識付きプローブを使用して行われます。固定化されたRNAが含まれる膜は、まずプリハイブリダイゼーション処理を受けることがあります。これは、非特異的な結合を防ぎ、背景ノイズを減少させるために重要です。プリハイブリダイゼーションの後、膜は標識付きプローブとともにインキュベートされ、プローブがターゲットRNAと特異的に結合するのを待ちます。ハイブリダイゼーションの条件、特に温度と塩濃度は、プローブの特異性と結合効率に大きく影響します【181†source】。
● シグナルの検出
ハイブリダイゼーションが完了した後、膜は余分なプローブを除去するために洗浄されます。洗浄後の膜は、放射性または蛍光標識されたプローブによるシグナルの検出に移ります。放射性プローブの場合、オートラジオグラフィーが用いられ、X線フィルムにシグナルが現れます。一方、蛍光標識の場合は、対応する波長の光源と感度の高いディテクターを使用して直接シグナルを観察します。これにより、特定のRNAの存在とその量が定量化され、遺伝子の発現レベルを正確に評価することができます【181†source】。
これらのハイブリダイゼーションと検出ステップは、ノーザンブロットの成功に不可欠であり、実験の設計と実行の精度が結果の品質に直接影響します。正確なプロトコルと厳密な条件管理により、特定のRNAの検出と定量が可能となり、研究の信頼性が保証されます。
ノーザンブロットの応用
遺伝子発現の分析
### 遺伝子発現の分析
ノーザンブロットは、特定のRNA分子の存在とその量を定量することにより、遺伝子の発現パターンを解析するための強力な手段です。この技術を利用することで、特定の遺伝子がどのように、そしていつ発現されているかを詳細に調べることができます。
● 遺伝子発現の分析手順
1. サンプルの準備: 研究したい細胞や組織からRNAを抽出します。
2. RNAの量と品質の確認: 抽出したRNAの量と品質をスペクトロフォトメトリーやゲル電気泳動で確認します。
3. RNAの分離: RNAを適当なゲル(通常はアガロースゲル)で電気泳動し、分子サイズに基づいて分離します。
4. 転写と固定化: 分離したRNAをニトロセルロースやナイロン膜に転写し、UV光や熱で固定化します。
5. プローブのハイブリダイゼーション: 特定のRNAを検出するための標識付きプローブを膜に適用し、適切な条件下でハイブリダイゼーションを行います。
6. シグナルの検出と定量: プローブが結合したRNAの位置と量を、放射性や蛍光標識を用いて検出します。
● 遺伝子発現パターンの解析
ノーザンブロットにより得られたデータから、遺伝子の発現が組織特異的であるか、あるいは特定の発達段階や外部環境の変化に応じて調節されているかなど、詳細な情報を得ることができます。たとえば、ある遺伝子がストレスやホルモンの影響で発現が上昇するかどうかを調べることが可能です。
このように、ノーザンブロットは生物学的な疑問に対して具体的なデータを提供し、遺伝子の機能や調節メカニズムを理解する上で重要な役割を果たします。この技術により、基礎研究だけでなく、疾患の診断や治療の発展にも寄与する可能性があります。
疾患診断と病理研究
ノーザンブロットは、疾患の診断や病理学的研究において重要なツールとして利用されています。この技術を用いて、特定の疾患に関連する遺伝子の発現パターンを詳細に調べることができます。
● 疾患診断における応用
ノーザンブロットは、特定のRNA分子の発現レベルを測定することで、疾患のバイオマーカーとして機能する遺伝子の同定に寄与します。例えば、特定のがん種では、異常な発現を示す遺伝子が発見されることがあり、これらの遺伝子は診断マーカーとして利用されることがあります。また、遺伝子の発現パターンから、がんの悪性度や薬剤への感受性などを予測することも可能です。
● 病理学的研究での利用
病理学的研究では、ノーザンブロットを用いて疾患の分子メカニズムを解明するための手がかりを得ることができます。例えば、自己免疫疾患や神経変性疾患の研究において、炎症や細胞死に関連する特定のmRNAの発現変化を調べることで、病態の理解を深めることができます。また、疾患の進行過程で発現が変化する遺伝子を特定し、それらが疾患の発症や進行にどのように関与しているかを研究することも可能です。
このように、ノーザンブロットは、単なる実験技術以上の価値を持ち、医学研究や臨床診断の現場で広く利用されています。その高い特異性と感度により、疾患関連遺伝子の発現状況を正確に把握することができ、診断、治療、および病態解明に貢献しています。
ノーザンブロットの限界と現代の代替技術
技術的限界と課題
ノーザンブロットは多くの生物学的研究で利用されていますが、いくつかの技術的限界と課題が存在します。これらの制約は、実験の設計や結果の解釈に影響を与えることがあります。
● 時間と労力の要求
ノーザンブロットは非常に時間がかかるプロセスです。サンプルの準備からRNAの抽出、電気泳動、転写、ハイブリダイゼーション、そしてシグナルの検出まで、多くのステップを要します。各ステップは細心の注意を払って慎重に行う必要があるため、一つのサンプルを処理するのに数日を要することがあります。
● 感度と変動性
ノーザンブロットは他の遺伝子発現分析技術と比較して感度が低い場合があります。特に低発現の遺伝子を検出する場合、十分なシグナルを得ることが困難なことがあります。また、実験条件のわずかな変化が結果に大きな影響を及ぼすため、再現性を確保することが挑戦となることがあります。
● RNAの安定性
RNAは非常に不安定であり、容易に分解されます。このため、RNase(RNAを分解する酵素)の汚染を避けるために、実験中は高い注意が必要です。不適切なサンプル処理は、RNAの分解を引き起こし、実験結果に影響を与える可能性があります。
● コストとリソース
ノーザンブロットは、特に放射性プローブを使用する場合、高額なコストがかかることがあります。また、放射性物質を扱うためには適切な設備と訓練が必要であり、これがさらなるコスト増加を招くことがあります。非放射性標識方法が利用されるようになりましたが、それでもなお、高価な試薬や専門的な機器が必要とされます。
これらの技術的限界と課題により、ノーザンブロットは特定の研究設定や特定の情報を必要とする場合に限られることがあります。また、これらの制約は、より効率的でコスト効果の高い他の手法、例えばリアルタイムPCRやRNAシーケンシングなどが選択される理由となっています。
RT-PCRやRNA-Seqへの移行
ノーザンブロットは長年にわたり遺伝子発現の分析に使用されてきましたが、技術的な限界や効率の問題から、現代の研究者はより高速で高感度な技術であるRT-PCR(リアルタイムPCR)やRNAシーケンシング(RNA-Seq)へと移行しています。これらの技術は、遺伝子発現の分析をより詳細に、迅速に行うための多くの利点を提供します。
● RT-PCRの利点
リアルタイムPCRは、特定のRNAのコピー数を実時間で定量化する技術です。この方法は、非常に高い感度を持ち、ごく少量のRNAからでも遺伝子発現レベルを正確に測定することができます。RT-PCRは迅速で、一つの実験で複数のサンプルを同時に分析できるため、時間とリソースを大幅に節約できます。また、データの再現性が高く、実験間のばらつきが少ないため、研究結果の信頼性が向上します。
● RNA-Seqの利点
RNAシーケンシング(RNA-Seq)は、次世代シーケンシング技術を利用して、細胞内の全RNAトランスクリプトを同時にシーケンスする方法です。この技術は、発現している遺伝子の完全なプロファイルを提供し、未知の遺伝子や代替スプライシングバリアント、非コーディングRNAを含むトランスクリプトの発見にも寄与します。RNA-Seqは非常に高いカバレッジと精度を提供し、微量な遺伝子発現の変化も検出可能です。さらに、定量的なデータも提供するため、遺伝子発現の動態を詳細に理解するのに非常に有効です。
● ノーザンブロットからの移行の影響
これらの進歩した技術は、ノーザンブロットよりも多くの情報を迅速に提供することができ、研究のスケールと範囲を広げています。特に、複雑な生物学的問題や疾患メカニズムの研究において、RT-PCRやRNA-Seqは新しい洞察を提供し、個々の遺伝子発現変動を精密に分析する能力を研究者に与えています。これにより、生物学的サンプルの広範な分析が可能となり、研究の効率と影響が大きく向上しています。
これらの技術は、ノーザンブロットのような従来の手法が抱える多くの課題を克服し、分子生物学および遺伝学研究の新たな標準となっています。