目次
ネオセントロメア
ネオセントロメアは、染色体の非セントロメア領域から時折発生する異所性のセントロメアである。セントロメアは、遺伝情報の適切な分離と継承に不可欠である。ヒトのネオセントロメアは、正常なαセントロメアリピートが全く存在しないにもかかわらず、一次狭窄を形成し、機能的な動原体を組み立てることができる。現在までに60箇所のヒトのネオセントロメアがゲノム上に広く分布していることが報告されている。一般的には、発達障害や先天性異常のある子供に検出されたマーカー染色体上に位置している。また、少なくとも2種類のヒトの癌では、ネオセントロメアが検出されており、ショウジョウバエでは実際にがんが誘発されている。
現在までに得られた知見によると、ネオセントロメアの活性は、DNA配列によってではなく、エピジェネティックに獲得される。ヒトのネオセントロメア形成は一般的に個体にとって有害であるため、その生物学的価値は、核型の進化や種分化など、個体レベルを超えたところにあると考えられている。
ネオセントロメアとセントロメア
セントロメア
セントロメアは、染色体の遺伝にとって非常に重要であり、1つの染色体に1つの機能的なセントロメアが存在することが絶対条件である。そのため、新たなセントロメアの誕生は、染色体だけでなく、細胞、生物、種にも影響を与える可能性のある出来事である。
セントロメアは、細胞遺伝学的には染色体の狭窄部で定義され、一般的には濃く染まったヘテロクロマチンにある。この狭窄部の中心には、微小管に付着して染色体を紡錘体に沿って移動させるのに役立つDNAとタンパク質の複合構造である動原体がある。セントロメアのDNAは、多数の繰り返し配列がタンデムに並んでいる。ヒトの場合、セントロメアには通常2,000-4,000kbの「αサテライト」と呼ばれる171bpの繰り返し配列が存在する。このリピート配列自体は系統的にあまり保存されていないが、セントロメアにサテライトDNAが存在することは、唯一の例外は出芽酵母Saccharomyces cerevisiaeがあるだけの、ほとんどすべての真核生物の特徴である。さらに、αサテライトDNAを培養細胞に導入すると、新たにセントロメアが形成されることから、サテライト配列がセントロメアの形成に基本的な役割を果たしていることが示されている。
ネオセントロメアの発見
このような背景から、1993年にαサテライト配列を全く持たないヒトのネオセントロメアが発見されたことは、驚くべきことであり、まったくの予想外であった。
ヒトで初めてのネオセントロメアは、学習障害のある少年の通常の核型検査の際に、マーカー染色体上に検出された。mardel(10)と名付けられたこのマーカーは、元々のセントロメアが失われた10番染色体の複雑な再配列に由来するものであった。αサテライトDNAが全くないにもかかわらず、ネオセントロメアは一次狭窄を形成し、分裂期に安定した機能的なキネトコアを組み立てることができた。
その後、60の異なる構成のヒトのネオセントロメアが報告されており、それらは通常、同様にセントロメアを失った再配列マーカー染色体上に位置している。ヒトのがんでもネオセントロメアが検出されている。
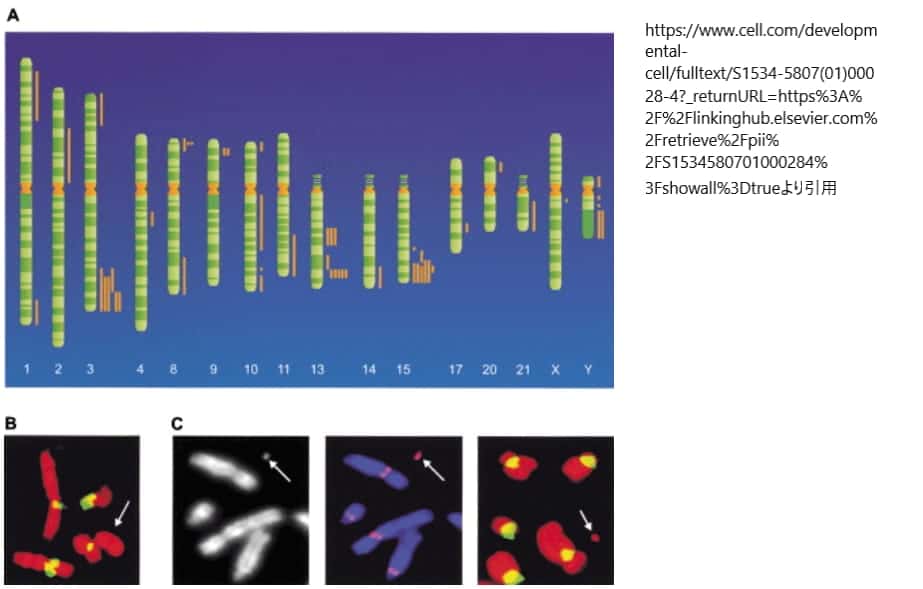
(A) ヒトゲノム上のネオセントロメア部位。通常のセントロメアはα-サテライトDNAで構成されているが、ネオセントロメアは異なるゲノム部位に異所的に形成され、α-サテライトを含まない。最初のヒトのネオセントロメアは、1993年に細胞遺伝学的に報告され、以後、16本の異なる染色体に由来する49例のヒトのネオセントロメアが報告されている。ヒトのネオセントロメア49例のマッピングされた位置は、染色体のイデオグラムの右側に棒で示されている。一部の染色体では、ネオセントロメアが複数の部位に見られ、特定の部位(遠位3q、8p、9p、13q、15q、Yq)では、ネオセントロメアのホットスポットを反映していると思われるクラスタリングが見られる。
(B) 10q25新セントロメアを含むmardel(10)染色体(矢印)は、FISH(Voullaireら、1993年)により、α-サテライト(黄/緑)が存在しないことを示している。
(C) mardel(10)由来のヒト人工ミニクロモゾーム(矢印)(左パネル;DAPI染色)は、CENP-A(赤のダブレットシグナル;中パネル)と結合し、α-サテライト(黄/緑;右パネル)が存在しないことを示す。引用
ネオセントロメアの形成
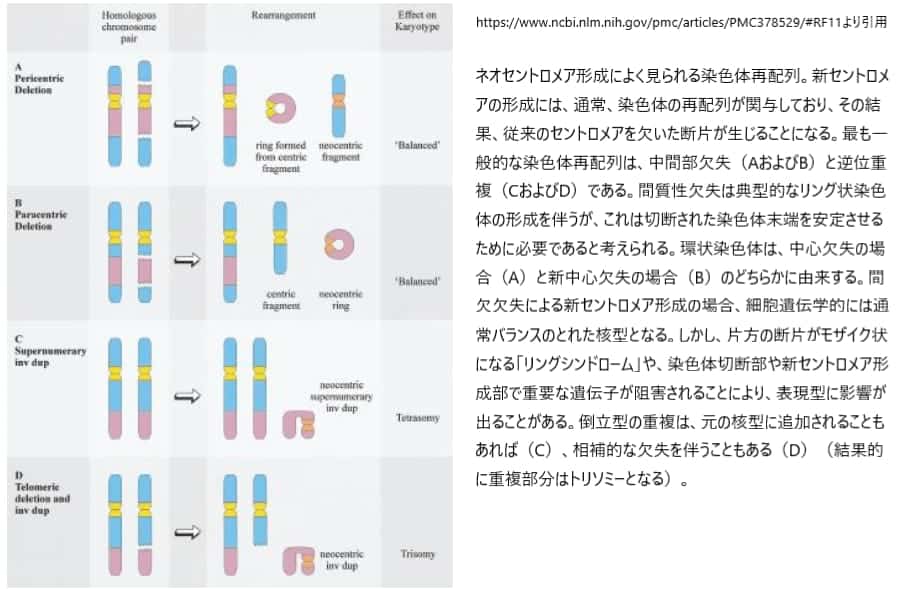
ネオセントロメアの形成には、一般的に「逆位重複」や「中間部欠失」などの染色体再編成が関与しており、従来のセントロメアを欠く染色体断片が生成される。ネオセントロメアマーカー染色体を形成する最も一般的なメカニズムは、染色体遠位部の逆位重複で、報告された60例のうち47例で見つかっている。ネオセントロメアマーカー染色体は、報告された60例のうち47例で染色体の遠位部分が逆に複製されたものである。ネオセントロメアの形成は、切断点とテロメアの間の中間部で起こり、切断点の部位とは明らかに無関係であり、さらなる染色体の再編成を伴わない。注目すべきは、ネオセントロメアの形成は、マーカー染色体1本につき1回しか起こらないことである。これらの逆方向の重複例のうち13例では、マーカーに逆方向の重複部分と相補的な欠失染色体が付随しており、重複部分の部分トリソミーとなっている。残りの34例では、核型は正常であるため、重複部分は部分的に4つの欠失となる(図3)。部分的トリソミーおよびテトラソミーの核型の正確な発生様式は不明であるが、様々なメカニズムが想定されているが、いずれの場合も、ネオセントロメアの形成は明らかに個体に悪影響を及ぼし、染色体断片の保持を引き起こし、その結果、不均衡な核型が形成される。
ネオセントロメアの形成部位はどのようにして決定されるのか?
ヒトのネオセントロメアは、Yq染色体のヘテロクロマチン領域にある少数の例を除いて、典型的にはユークロマチン領域に形成される。しかし、その起源に関わらず、ネオセントロメアはヘテロクロマティクの特徴を持っていることが示唆される。現在までに、22本の常染色体のうち16本、XおよびY染色体でネオセントロメアの形成が報告されているが、報告されているネオセントロメアの分布にはランダム性がなく、3q、13q、15qにあるものが全体の約半分を占めている。さらに、近位の染色体領域に比べて遠位の染色体領域は、ネオセントロメアが形成されやすいように見える。
ネオセントロメアに付着するタンパク
ネオセントロメアには、クロマチンレベルでセントロメアと他の染色体を区別するセントロメア特有のコアヒストンであるCENP-Aや、CENP-C、CENP-Eといったタンパク質が一貫して存在していることが確認されているが、CENP-Bの結合は一貫して見られない。CENP-Bは有糸分裂や減数分裂の際のセントロメアの機能には必須ではないことが示されている。
ネオセントロメアにおけるタンパク質の結合パターンは、CENP-Bが結合していないことを除けば、すべての点で通常のセントロメアと区別がつかない。ネオセントロメアは、α-サテライトが存在しないにもかかわらず、通常のセントロメアと同じように、3層構造のキネトコアを形成し、他の付属タンパク質と相互作用していると考えられる。
ネオセントロメア領域の複製タイミング
哺乳類のセントロメア領域は、S期の後半に異なるタイミングで複製されることが知られている。10q25のネオセントロメアについて詳細な分析が行われ、ネオセントロメアが形成される前のこの染色体部位は、CENP-A結合ドメインを含む約450kbのドメインを除いて、S期中期から後期にかけて複製されることが明らかになった。ネオセントロメア形成後、この450kbの領域の複製タイミングは変わらないが、その周辺の領域ではタイミングがずれている。その結果、1.5Mbの領域がS期の第3四半期にシフトし、コアCENP-A結合ドメインを含むより広い領域が、他のすべてのセントロメアの複製タイミングと一致するようになったのである。この研究は、ネオセントロメアが形成されると、ゲノム領域の複製タイミングが大きく変化することを示唆している。また、「セントロメアに沿った」複製タイミングを持つマイクロゲノムサイトは、ネオセントロメア形成に有利な条件を備えている可能性があることも示唆された。
この記事の著者:仲田洋美医師
医籍登録番号 第371210号
日本内科学会 総合内科専門医 第7900号
日本臨床腫瘍学会 がん薬物療法専門医 第1000001号
臨床遺伝専門医制度委員会認定 臨床遺伝専門医 第755号






