目次
ネオセントロメアは染色体の非セントロメア領域に時折現れる異所性のセントロメアです。これは遺伝情報の正確な分離と継承に必須の部分です。ヒトのネオセントロメアは、通常のαセントロメアリピートが一切含まれていない状態でも、一次狭窄を形成し、動原体を組み立てることが可能です。これまでに60か所以上のネオセントロメアがヒトのゲノム上に存在することが確認されています。これらは主に発達障害や先天性異常を持つ子供のマーカー染色体上に見られます。また、ヒトの少なくとも2種類の癌においてネオセントロメアが確認されており、ショウジョウバエではがんの誘発に関連しています。
ネオセントロメアの活性は、DNAの配列ではなくエピジェネティックな要因によって獲得されます。ヒトにおいてはネオセントロメア形成が通常は有害であるため、その生物学的な価値は、個体のレベルを超えて核型の進化や種の分化などに関連していると考えられています。
ネオセントロメアとセントロメア
セントロメア
セントロメアは染色体の遺伝に欠かせない要素で、各染色体には必ず1つの機能的なセントロメアが存在する必要があります。新たなセントロメアの誕生は、染色体のみならず、細胞や生物、さらには種全体に影響を及ぼす可能性がある重要な現象です。
細胞遺伝学的には、セントロメアは染色体の狭窄部で定義され、一般的には濃く染まるヘテロクロマチンの領域に位置します。この狭窄部の中心には、微小管が付着し、染色体を紡錘体に沿って移動させる役割を持つDNAとタンパク質の複合体、動原体が存在します。セントロメアのDNAは、多数の繰り返し配列がタンデムに並んだ構造をしており、ヒトでは通常、2,000から4,000キロベースの範囲で「αサテライト」と呼ばれる171ベースペアの繰り返し配列があります。このリピート配列は系統的にはあまり保存されていないものの、セントロメアにサテライトDNAが存在するのは真核生物において一般的です。ただし、出芽酵母のSaccharomyces cerevisiaeは例外です。また、αサテライトDNAを培養細胞に導入する実験により、これらの配列がセントロメア形成に基本的な役割を果たしていることが示されています。
ネオセントロメアとは
ネオセントロメアとは、遺伝学的に重要なセントロメア構造が通常ではない染色体の位置に新たに形成される現象です。セントロメアは染色体の適切な分配に必要な部位であり、通常、特定のDNA配列であるα-サテライトによって構成されています。しかし、ネオセントロメアはこのα-サテライト配列を含まず、異所的に形成されるため、従来のセントロメアとは異なる特性を持ちます。
ネオセントロメアは、染色体の異常な再編成後や、特定の遺伝的変異が生じた際に発現することがあります。これにより、染色体の非セントロメア領域に新たなセントロメアが形成され、その結果としてセントロメアの機能を担うようになります。ネオセントロメアは完全に機能的であり、細胞分裂時に染色体を紡錘体に適切に結合させるキネトコアの構成と微小管のアンカーポイントとして機能します。
ネオセントロメアの形成は珍しい現象であるものの、発見される例は増えており、その形成メカニズムや分子生物学的特性の研究が進められています。ネオセントロメアの存在は、セントロメアの生物学的な柔軟性と進化の過程を理解する上で重要な事例とされています。
ネオセントロメアの発見
1993年に、αサテライト配列を一切含まないヒトのネオセントロメアが発見されたことは、科学界にとって大きな驚きであり、全く予想外の出来事でした。ヒトで初めて確認されたネオセントロメアは、学習障害を持つ少年の通常の核型検査中にマーカー染色体上で検出されました。このマーカー染色体は「mardel(10)」と名付けられ、10番染色体の元々のセントロメアが失われた複雑な再配列から発生していました。αサテライトDNAが存在しないにも関わらず、このネオセントロメアは一次狭窄を形成し、分裂期には安定した機能的なキネトコアを組み立てることができました。
その後、60箇所以上の異なる構成のヒトネオセントロメアが報告されており、これらも同様にセントロメアが失われた再配列マーカー染色体上に位置しています。また、ヒトのがんの状態でもネオセントロメアが確認されています。これらの発見は、セントロメア研究において新たな視点を提供しています。
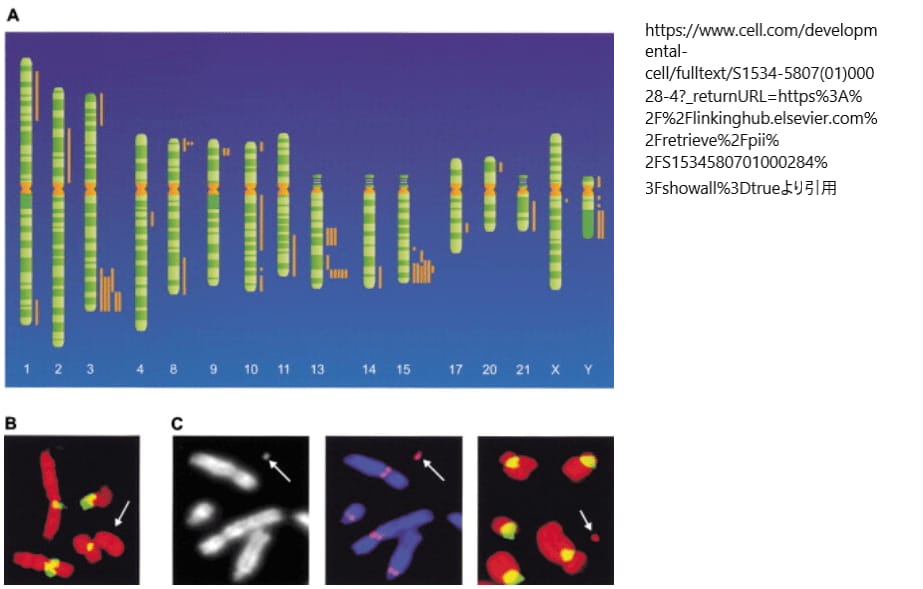
(A) では、ヒトゲノム上におけるネオセントロメアの位置が記述されています。ネオセントロメアは、通常のセントロメアが持つα-サテライトDNAを含まず、異なるゲノム部位に形成されます。1993年に初めて報告されて以来、異なる16本の染色体から49例のヒトネオセントロメアが確認されました。これらのネオセントロメアは染色体イデオグラムの右側に棒で示されており、特定の染色体領域(遠位3q、8p、9p、13q、15q、Yq)では、ネオセントロメアが集中していることが観察されています。これはネオセントロメア形成のホットスポットを反映しているとされます。
(B) では、mardel(10)という10q25に新たなセントロメアを持つ染色体がFISH(フルオレッセンス イン シチュ ハイブリダイゼーション)法により検査されています。この染色体はα-サテライトDNAを持たないことが示されており、通常のセントロメアとは異なる特徴を持っています。
(C) では、mardel(10)由来の人工ミニクロモゾームが示されています。このミニクロモゾームはDAPI染色で視覚化され(左パネル)、CENP-Aタンパク質(中パネル)と結合していることが確認されています。CENP-Aはセントロメア機能の重要なタンパク質で、この結果はネオセントロメアが機能的なセントロメアとして機能していることを示しています。右パネルでは、α-サテライトDNAが存在しないことが再確認されています。これらの観察から、mardel(10)染色体上のネオセントロメアが完全に機能的であることが示されています。引用
ネオセントロメアの形成
ネオセントロメアの形成過程は、複数の段階を経て進行します。この過程は、セントロメアの機能を担う新たな場所が、従来のセントロメア機能を失った染色体上に非典型的に形成されることを特徴としています。以下に、ネオセントロメア形成の一般的なステップを説明します。
1. 染色体の構造変化: ネオセントロメアは、染色体の構造変化、特に逆位重複や中間部欠失などが引き起こす異常な再編成に伴い、通常のセントロメアが欠損した状態で形成されることが多いです。これにより、新たなセントロメアが必要とされる場所が生じます。
2. エピジェネティックな変化: ネオセントロメアの活性化は、エピジェネティックな調整によって支配されます。特定のクロマチン領域が、ヒストンの修飾やDNAメチル化の変化を受け、セントロメアとしての特性を獲得します。これにより、セントロメア特有のタンパク質がその領域に集まり始めます。
3. セントロメア特有のタンパク質の集合: キネトコアの構成要素であるセントロメア特有のタンパク質(例:CENP-Aなど)が新たに形成されたエピジェネティックな環境に集結し、その領域をセントロメアとして機能させる基盤を作ります。
4. キネトコアの形成: CENP-Aを含むセントロメアタンパク質が組み込まれることで、キネトコアと呼ばれる複合体が形成され、これが染色体の適切な分離を助けるために微小管に結合する役割を果たします。
5. 機能的検証と安定化: 新たに形成されたネオセントロメアは、細胞分裂を通じてその機能性が試されます。機能が適切であれば、そのネオセントロメアは遺伝的に安定化し、後代に受け継がれることになります。
このように、ネオセントロメアの形成は複雑な分子メカニズムと遺伝的、エピジェネティックな要因の相互作用によって進行します。これにより、染色体が正常に機能を維持し、遺伝情報の正確な伝達が保証されるのです。
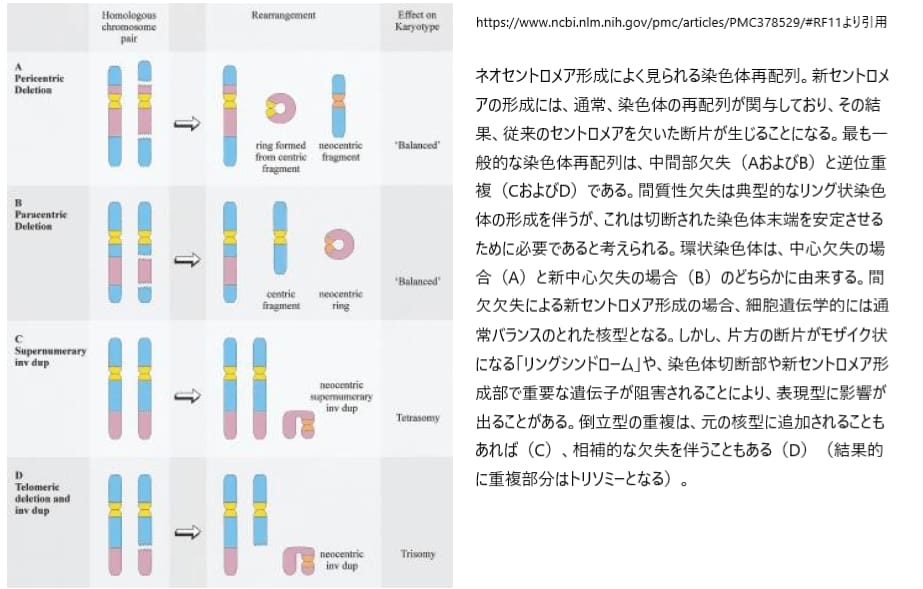
ネオセントロメアの形成には通常、「逆位重複」や「中間部欠失」などの染色体再編成が関わっています。これにより、従来のセントロメアを欠く染色体断片が生成されます。ネオセントロメアマーカー染色体の形成で最も一般的なメカニズムは染色体遠位部の逆位重複であり、報告された60例のうち47例でこのパターンが見られます。このネオセントロメアは、染色体の切断点とテロメアの間の中間部で形成され、切断点の位置とは無関係で、さらなる染色体の再編成を伴いません。特に、マーカー染色体1本につきネオセントロメアの形成は1回しか起こらないとされています。
逆方向の重複が見られる13例では、マーカーに重複部分と相補的な欠失染色体が付随し、重複部分の部分トリソミーが起こっています。残りの34例では、核型は正常とされ、重複部分は部分的に4つの欠失となっています。これらの部分的トリソミーおよびテトラソミーの発生様式はまだ不明であり、さまざまなメカニズムが考えられていますが、いずれにせよ、ネオセントロメアの形成は個体に悪影響を及ぼし、染色体断片の保持を引き起こすことで、不均衡な核型が形成される可能性があります。
ネオセントロメアの形成部位はどのようにして決定されるのか?
ネオセントロメアの形成部位の決定には、いくつかの要因が関与していると考えられています。ネオセントロメアは通常、ユークロマチン領域に形成されることが多く、これはゲノムの中でも特に染色体の構造や機能的特性が変化しやすい場所です。以下に、ネオセントロメアの形成部位がどのようにして決定されるかについての主な要因を挙げます。
1. エピジェネティックな変化: ネオセントロメアの活性は主にエピジェネティックなメカニズムによって制御されます。特定のDNA領域がセントロメアとして機能するか否かは、その領域のヒストンの修飾やクロマチンの構造によって影響を受けることが多いです。
2. 染色体の再編成: 染色体の異常な再編成、特に逆位重複や中間部欠失などがネオセントロメアの形成を促進することがあります。これらの再編成は、通常のセントロメアを欠く染色体断片を生成し、新たなセントロメア形成の必要性を生じさせることがあります。
3. セントロメア構成要素の欠如: 通常のセントロメアに存在するαサテライトDNAが欠如している場合、新たなセントロメア形成部位として他のゲノム領域が活性化されることがあります。
4. 遺伝的要素: ネオセントロメアが特定の染色体領域に偏って形成されることが報告されています(例:3q、13q、15q)。これは遺伝的要素がセントロメア形成の傾向に影響を与えることを示唆しています。
5. 機能的必要性: セントロメアとして機能するには、その領域が微小管に効率的に付着し、染色体の運動に必要な構造を形成できる必要があります。この機能的必要性が特定の領域でのネオセントロメア形成を促進する可能性があります。
これらの要因は相互に作用し、特定のゲノム領域がネオセントロメアとして活性化されるかどうかを決定します。今後の研究により、これらのプロセスの詳細がさらに明らかになることが期待されます。
ヒトのネオセントロメアは、Yq染色体のヘテロクロマチン領域に存在する少数の例を除き、一般的にユークロマチン領域に形成されます。しかし、その起源がどこであれ、ネオセントロメアにはヘテロクロマチンの特徴が見られることが示されています。これまでに、22本の常染色体のうち16本、そしてX染色体およびY染色体でネオセントロメアの形成が報告されています。これらの報告されたネオセントロメアの分布にはランダム性がなく、特に3q、13q、15qの染色体領域に集中しており、全体の約半分を占めています。さらに、染色体の近位領域よりも遠位領域の方がネオセントロメアが形成されやすい傾向にあるとされています。このことは、ネオセントロメアの形成に影響を与える可能性のある特定の染色体領域の特性についてのさらなる研究を促すものです。
ネオセントロメアに付着するタンパク
ネオセントロメアに付着するタンパク質は、通常のセントロメアと同様に、染色体の正しい分離と細胞分裂を支えるために重要な役割を果たします。以下はネオセントロメアに付着する主要なタンパク質の一部です。
1. CENP-A: セントロメア特異的ヒストンH3のバリアントで、ネオセントロメアでも通常のセントロメアと同じようにキープレイヤーとして機能します。CENP-Aはキネトコアの形成に必須であり、染色体の微小管結合部位の形成に関与しています。
2. CENP-C: CENP-Aの組み込みを支援し、キネトコアの構造的整合性を保つ役割を持ちます。このタンパク質はセントロメアの機能的組織に必要であり、CENP-Aと共にネオセントロメアの重要な構成要素です。
3. CENP-T: キネトコアの形成において、セントロメアのDNAと微小管の結合を介して、染色体の運動に直接関与します。CENP-Tもネオセントロメアで見られ、セントロメアの機能維持に寄与します。
4. CENP-E: キネトコアモータータンパク質で、染色体の正確な配列と移動を助けるために必要です。CENP-Eは微小管との相互作用を通じて染色体の移動を促進します。
これらのタンパク質は、ネオセントロメアが通常のセントロメアと同じように機能するための基盤を提供し、細胞分裂の際の染色体の正確な分配を保証します。ネオセントロメアの研究を通じてこれらタンパク質の機能や相互作用の理解が進むことで、細胞分裂のより深いメカニズムが解明されることが期待されています。
ネオセントロメアにおけるタンパク質の結合パターンは、通常のセントロメアと非常に類似しており、CENP-A、CENP-C、CENP-Eなどのセントロメア特有のコアヒストンやタンパク質が一貫して存在しています。これらのタンパク質はセントロメアの機能を支える重要な役割を果たしており、ネオセントロメアの形成と維持に不可欠です。
一方で、CENP-Bの存在については異なる特徴が観察されます。CENP-Bはα-サテライトDNAに特異的に結合することで知られており、通常のセントロメアにおいてはよく見られますが、ネオセントロメアではその結合が確認されません。これは、ネオセントロメアにはα-サテライトDNAが存在しないためと考えられます。興味深いことに、CENP-Bは有糸分裂や減数分裂時のセントロメアの機能には必須ではないことが示されています。これは、セントロメア機能におけるCENP-Bの役割が他のセントロメアタンパク質と比べて相対的に限定的であることを示唆しています。
ネオセントロメアは、α-サテライトが存在しないにもかかわらず、通常のセントロメアと同じように3層構造のキネトコアを形成し、他のセントロメアタンパク質と正常に相互作用することができます。これはネオセントロメアが適切に機能するために必要なタンパク質の結合パターンを備えていることを意味し、セントロメア機能のエピジェネティックな性質を反映しています。このような知見は、セントロメアの分子生物学的基盤とその調節機構の理解を深める上で重要です。
ネオセントロメア領域の複製タイミング
哺乳類のセントロメア領域は、S期の後半に異なるタイミングで複製されることが知られています。10q25のネオセントロメアについて詳細な分析が行われ、ネオセントロメアが形成される前のこの染色体部位は、CENP-A結合ドメインを含む約450kbのドメインを除いて、S期中期から後期にかけて複製されることが明らかになりました。
ネオセントロメア形成後、この450kbの領域の複製タイミングは変わらないが、その周辺の領域ではタイミングがずれています。その結果、1.5Mbの領域がS期の第3四半期にシフトし、コアCENP-A結合ドメインを含むより広い領域が、他のすべてのセントロメアの複製タイミングと一致するようになりました。この研究は、ネオセントロメアが形成されると、ゲノム領域の複製タイミングが大きく変化することを示唆しています。また、「セントロメアに沿った」複製タイミングを持つマイクロゲノムサイトは、ネオセントロメア形成に有利な条件を備えている可能性があることも示唆されました。
ネオセントロメアの形成と遺伝学的基盤
ネオセントロメアの形成メカニズム
ネオセントロメアの形成メカニズムは、伝統的なセントロメアの位置以外で新たにセントロメア機能が獲得される現象です。このプロセスは、特定の染色体領域が失われたり、損傷を受けた場合に観察されることがあります。主にエピジェネティックな変化によって引き起こされ、DNA配列そのものよりも、その配列がどのようにパッケージされ、修飾されるかに依存しています。
● エピジェネティック制御
ネオセントロメアの形成は、DNAのメチル化やヒストンの修飾といったエピジェネティックな要因に強く影響されます。これらの修飾は、特定のDNA領域がセントロメアとしての機能を果たすために必要な構造的な変化を促します。
● セントロメアタンパク質との相互作用
ネオセントロメアの形成には、セントロメア特有のタンパク質、特にCENP-Aの局在が重要です。CENP-Aはセントロメアの形成と維持に不可欠で、新たなネオセントロメアの位置に集まることで、その領域が新しいセントロメアとして機能する基盤を形成します。
● 環境的ストレスと染色体の再構成
環境的ストレスや染色体の損傷がネオセントロメアの形成を促進することがあります。これは、セントロメア領域が破壊されたり、染色体の再構成が行われた結果、新しいセントロメアが必要とされるためです。
ネオセントロメアの形成はまだ完全には解明されていない複雑な現象であり、さらなる研究が進められています。このプロセスを理解することは、染色体異常疾患の治療や遺伝学的な安定性の研究に役立つ可能性があります。
遺伝的およびエピジェネティックなネオセントロメアの形成要因
ネオセントロメアの形成は、遺伝的およびエピジェネティックな要因によって大きく影響を受けます。これらの要因は、染色体の特定の非セントロメア領域にセントロメア機能が発現するための条件を整える役割を果たします。
● 遺伝的要因
ネオセントロメアの形成には、特定のDNA配列や遺伝的背景が関与することがあります。DNA配列中の特定のモチーフや構造がセントロメア機能を支援するための「基盤」となることが示唆されています。たとえば、ある研究では、ネオセントロメアが形成されやすい特定の染色体領域が存在することが報告されています。これらの領域は、通常のセントロメアと比較して特定の遺伝的特徴を持っている可能性があります。
● エピジェネティックな要因
エピジェネティックな要因は、ネオセントロメアの形成において特に重要です。セントロメア特有のヒストンタンパク質であるCENP-Aの存在は、非セントロメア領域でのセントロメア機能の発現に不可欠です。CENP-Aが新たに形成されたネオセントロメア領域に集積することで、その領域はセントロメアとして機能するようになります。
さらに、DNAメチル化やヒストンの修飾など、クロマチンの構造を変化させるエピジェネティックな変更もネオセントロメアの形成に関与しています。これらの修飾は、特定のDNA領域の表現型を変化させ、セントロメアとしての新たな機能を可能にする可能性があります。
ネオセントロメアの形成におけるこれらの遺伝的およびエピジェネティックな要因の理解は、染色体の構造と機能についての洞察を深め、染色体異常に関連する疾患の研究に貢献することが期待されています。
ネオセントロメアの機能的意義
ネオセントロメアの形成は、特定の状況下で染色体の構造的完全性と適切な機能を維持するのに寄与することが示唆されています。ネオセントロメアは、元々のセントロメアが失われたり機能しなくなった場合に、染色体が安定した状態で細胞分裂を続けられるようサポートします。
染色体安定性への寄与
ネオセントロメアは、セントロメアとしての新たな機能を担い、正常な細胞分裂と遺伝情報の正確な伝達を支援することで、染色体の安定性を保ちます。セントロメアは染色体の分離を調節する重要な役割を持っており、ネオセントロメアもまた、この基本的な生物学的プロセスに必要な構造と機能を提供します。これにより、細胞は染色体の不均等分配や無秩序な分裂を避け、遺伝的安定性を維持できるのです。
研究によると、ネオセントロメアの存在は、染色体が不安定になりがちな状況でも、それを安定化させることに貢献することが報告されています。例えば、ネオセントロメアが形成されることで、細胞は失われたまたは機能不全のセントロメアを補い、細胞の生存と適応能力を高めることができるとされています。
このように、ネオセントロメアは自然界での突然の染色体変化に対する一種の「保険」として機能する可能性があり、生物の進化や種の存続において重要な役割を果たしているかもしれません。この現象のさらなる研究は、染色体異常や関連する遺伝性疾患の理解を深めることに寄与するでしょう。
病態生理学における役割
ネオセントロメアと関連する疾患
ネオセントロメアの存在は、特定の遺伝的疾患と関連があることが報告されています。ネオセントロメアが形成されることで、染色体の再配列や不安定性が生じ、これが異常な遺伝子発現や疾患の原因となる場合があります。
モザイクターナー症候群
モザイクターナー症候群は、X染色体に関連する遺伝病で、一部の細胞が通常のX染色体を持ち、他の細胞がX染色体の異常または欠如を示すことが特徴です。ネオセントロメアが関与することで、異常なX染色体の安定性が保たれ、症状の発現に影響を与える場合があります。
モザイクターナー症候群は、女性の一部または全ての細胞がX染色体を欠如する状態で、その結果、さまざまな発達的、身体的特徴が現れます。ネオセントロメアの形成がモザイクターナー症候群の患者において観察されることがあり、特にX染色体にネオセントロメアが形成されるケースが報告されています。
ネオセントロメアがX染色体に形成されることで、異常なX染色体が細胞内で安定し、正常な機能を一部維持することが可能になります。この現象は、ターナー症候群における特異的なケースとして重要な意味を持ちます。ネオセントロメアによるX染色体の安定化は、患者の表現型にどのような影響を与えるか、さらなる研究が必要です。
これらの知見は、ネオセントロメアが持つ可能性の一端を示しており、遺伝的異常に伴う病態の理解を深めるための重要な手掛かりとなります。モザイクターナー症候群とネオセントロメアの関係を解明することは、この症候群のより効果的な診断と治療へとつながる可能性があります。
がんの発生
ネオセントロメアは、がん細胞の染色体においても観察されることがあります。これは、ネオセントロメアが形成される過程で染色体の不安定性が増加し、がん細胞の異常な増殖や遺伝子の再配列を促進するためです。特に、セントロメア領域の異常は、染色体の不安定性を高め、腫瘍の進行や転移に寄与することが知られています。
●ネオセントロメアの存在とがん細胞の染色体不安定性
ネオセントロメアはがん細胞においても観察され、これが染色体の不安定性と関連していることが指摘されています。がん細胞では、セントロメアの異常が頻繁に報告され、これが染色体の不均衡や異常な分裂を引き起こす一因となることがあります。
●ネオセントロメア形成と腫瘍進行
ネオセントロメアの形成は、腫瘍細胞の進化過程で見られることがあり、これによりがん細胞が異常な遺伝情報を持つことで、さらなるがんの進行や転移を促進する可能性があります。具体的には、ネオセントロメアが形成された染色体は、通常のセントロメアと異なる挙動を示し、これが細胞分裂時の異常な染色体の分配につながることが考えられます。
これらの現象は、ネオセントロメアががんの発生や進行において重要な役割を果たす可能性を示唆しています。ネオセントロメアの詳細な研究は、がんの発生メカニズムの解明や新たな治療標的の開発に寄与することが期待されます。
ネオセントロメアの研究と臨床応用
研究の最新動向
ネオセントロメアの研究は近年、顕著な進展を遂げています。特に、遺伝学、細胞生物学、がん研究など、多岐にわたる分野での応用が探求されています。
分子メカニズムの解明: ネオセントロメアの形成に関与する遺伝子やエピジェネティックなメカニズムの解析が進んでいます。特に、セントロメア特有のヒストンタンパク質CENP-Aの動態とその調節機構についての理解が深まっています。
モデル生物を用いた実験研究: ショウジョウバエやイーストなどのモデル生物を使用して、ネオセントロメアの形成条件や機能についての基礎的な研究が行われています。これにより、ネオセントロメアの生物学的な役割とその進化的意義が明らかになりつつあります。
がん研究への応用: ネオセントロメアががん細胞の染色体不安定性に与える影響についての研究が進められています。ネオセントロメアの存在ががんの進行にどのように関与しているかを理解することで、新たな治療標的の同定につながる可能性があります。
遺伝病との関連: ネオセントロメアの異常が特定の遺伝病、例えばモザイクターナー症候群などとの関連が注目されています。これらの症状におけるネオセントロメアの役割を解明することは、疾患の原因を理解し、遺伝子診断や治療に応用する道を開くことに繋がります。
これらの研究の進展は、ネオセントロメアの生物学的な理解を一層深めると同時に、将来的な臨床応用への道を開く重要なステップです。
将来の治療戦略への影響
ネオセントロメアの研究は、将来の治療戦略に大きな影響を与える可能性を秘めています。特に、がん治療や遺伝病の管理において新しいアプローチを提供することが期待されています。
がん治療における新たなターゲット: ネオセントロメアが染色体の不安定性を引き起こすという知見は、がん細胞の生存と増殖に必須な機構を標的とする新しい治療法の開発に繋がります。特に、ネオセントロメアの形成を阻害することで、がん細胞の不安定性をさらに高め、がん細胞を死滅させる戦略が考えられます。
遺伝病の診断と治療: ネオセントロメアが特定の遺伝病と関連していることから、これを早期に識別するバイオマーカーとしての利用や、ネオセントロメア関連の病態を正常化する治療法の開発が進められています。たとえば、モザイクターナー症候群の患者におけるネオセントロメアの特定は、個別化医療において重要な役割を果たす可能性があります。
染色体工学の進展: ネオセントロメアの研究は、染色体工学の分野においても応用されることがあります。例えば、人工染色体の安定性を高めるためにネオセントロメアの機能を利用することが考えられます。これにより、遺伝子療法や細胞治療における効率と安全性が向上する可能性があります。
これらの進展は、ネオセントロメアの生物学的理解を深めるだけでなく、具体的な疾患治療や予防策の開発に直接的な影響を与えることが期待されています。さらなる研究が進むことで、これらの潜在的な応用が現実のものとなる日も遠くないかもしれません。








