目次
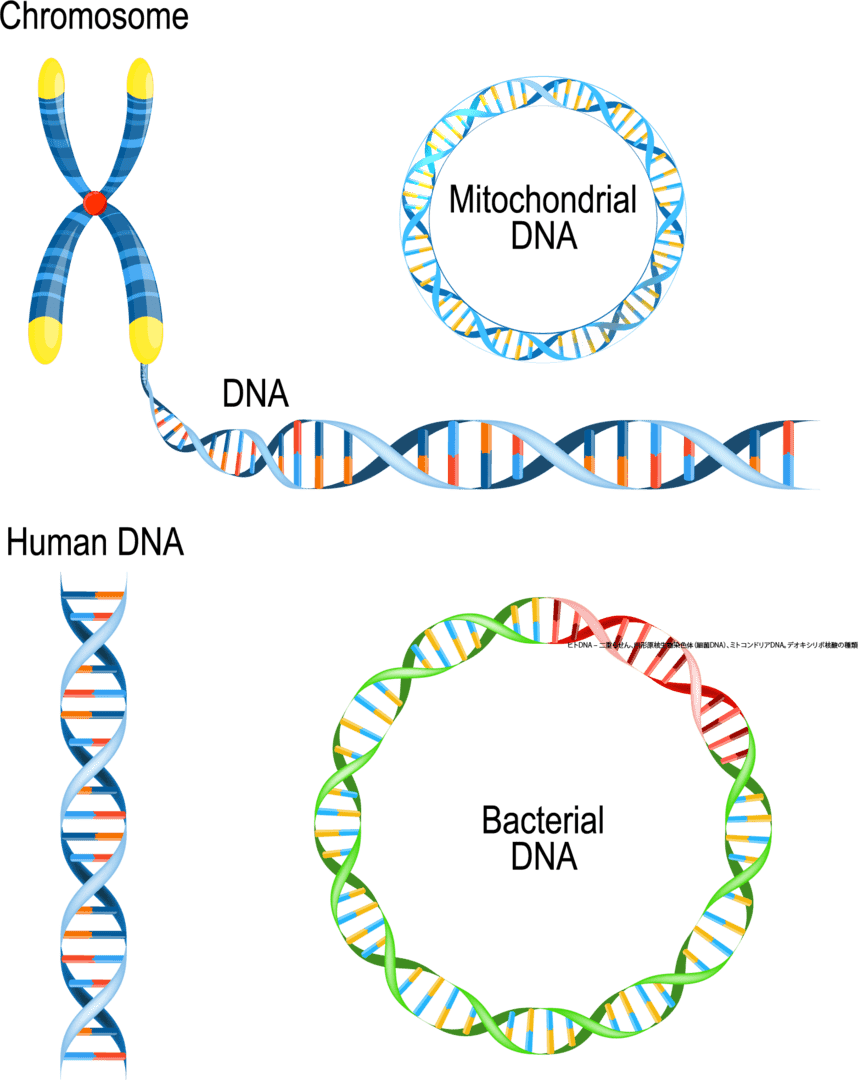
この詳細な記事では、核DNA(nDNA)がどのようにして生物の遺伝的情報をコードし、生命の多様な特性をどのように形成しているかを解説します。さらに、最新の科学技術がどのようにnDNAの研究を進化させているか、そして将来の遺伝学と医療におけるその応用について掘り下げます。
1. nDNAとは何か?
nDNA、または核DNA(nuclear DNA)は、細胞核に存在するDNAで、生物の遺伝情報の大部分を保持しています。このDNAは、生命の基本的な指令と機能をコードしており、生物の発達、生理、および行動を制御する遺伝子の大半を含んでいます。
核DNAの基本的な役割
1. 遺伝情報の保持: nDNAは、遺伝子の形で生物の遺伝情報を保持しています。これらの遺伝子は、タンパク質の合成を含む生命活動のほとんどの指示をコードしており、個体の特徴や機能を決定します。DNAの配列は、タンパク質のアミノ酸配列を決定し、これによって細胞や組織の構造と機能が形成されます。
2. 遺伝情報の伝達: nDNAは、生殖細胞を通じて親から子へと遺伝情報を伝達します。この過程では、DNAの複製が行われ、それぞれの子孫が親と同じ遺伝情報を受け継ぐことが保証されます。また、性的生殖においては、母親と父親の両方から受け継いだ遺伝子が組み合わされることで、遺伝的多様性が生まれます。
3. 細胞機能の調節: nDNAにコードされた遺伝子は、RNAとタンパク質の生産を通じて細胞の様々な機能を調節します。遺伝子発現の制御は、特定の細胞タイプの特性を定めるだけでなく、環境の変化に対する生物の反応を調節するためにも重要です。
4. 遺伝的適応の基盤: nDNAは進化の過程で変異を経験します。これらの変異は、新たな遺伝的特徵をもたらし、生物が変化する環境に適応するための遺伝的な基盤を形成します。自然選択はこれらの変異の中から生存と繁殖に有利なものを選び出し、種の進化を促進します。
nDNAは生物の生命活動の根幹を成す要素であり、その機能と調節は生物学の多くの分野で中心的なテーマです。DNAの構造、遺伝情報の伝達メカニズム、および遺伝子発現の制御の理解は、遺伝学、分子生物学、そして医学研究における基本的な知識となっています。
遺伝情報の保存と伝達
nDNA、すなわち核DNAは、細胞核に存在し、生物の遺伝情報の大部分を保持しているDNAです。このDNAは、生物の発達、適応、および生存に不可欠な遺伝情報を保存し、次世代に伝達する役割を担います。
● 遺伝情報の保存と伝達
1. 遺伝情報の保存: nDNAは染色体という形で整然と配列され、細胞核内に保持されています。各染色体には数千から数万の遺伝子が含まれており、これらの遺伝子が個体の形質や機能を決定するタンパク質の設計図となります。nDNAの二重螺旋構造は遺伝情報を化学的および物理的な損傷から保護し、高い保守性と安定性を保証します。
2. DNA複製: 細胞分裂の過程で、nDNAは厳密に複製されます。この過程はDNAポリメラーゼと呼ばれる酵素によって行われ、一つのDNA分子から二つの娘分子が生成されます。この精確な複製過程によって、遺伝情報が細胞分裂を通じて正確に次世代に伝達されることが保証されます。
3. 遺伝情報の伝達: 性的生殖を行う生物では、nDNAは親から子へと遺伝情報を伝達します。受精時には、母親と父親からそれぞれ半数の染色体が受け継がれ、新たな個体の全体的な遺伝的構成が形成されます。この過程では、遺伝的多様性が確保され、進化的適応の潜在能力が高まります。
4. 遺伝的多様性の確保: メイオーシスと呼ばれる特殊な細胞分裂過程において、染色体の組み換えが起こります。これにより、親から受け継がれた遺伝情報が新しい組み合わせで配置され、個体群内の遺伝的多様性が増します。この多様性は種の生存と進化に重要な役割を果たします。
核DNAの正確な複製と効果的な伝達は、生物の継続的な進化と種の存続にとって不可欠です。これらの過程を理解することは、遺伝学だけでなく、進化生物学や生態学の研究においても重要な意義を持ちます。
2. nDNAの構造と機能
核DNA(nDNA)はその構造と機能において、生物の形態や生理に至るまで幅広い影響を及ぼします。このDNAの遺伝子構造は、遺伝情報のコーディングと表現の基本的な枠組みを提供します。
遺伝子構造の詳細
1. 二重螺旋構造: nDNAの基本的な構造は、ワトソンとクリックによって発見された二重螺旋形状です。この構造によって、遺伝情報が効率的に保持され、複製や修復が容易に行われます。二重螺旋は、互いに相補的な二つのポリヌクレオチド鎖から成り立ち、塩基対によって結合されています。
2. 遺伝子の構成要素: 遺伝子は、コーディング領域(エキソン)と非コーディング領域(イントロン)から構成されています。エキソンはタンパク質の合成に直接関与する情報を含み、イントロンは遺伝子発現を調節する要素やスプライシングに関与するシーケンスを含むことがあります。これらの領域は、RNAスプライシングによって成熟mRNAが生成される過程で、イントロンが除去され、エキソンが結合されることで機能的なRNAが形成されます。
3. プロモーターとエンハンサー: 遺伝子の発現は、プロモーターとエンハンサーと呼ばれる調節領域によって細かくコントロールされています。プロモーターは遺伝子の転写開始点近くに位置し、RNAポリメラーゼとその他の転写因子が結合する場所を提供します。エンハンサーは、距離に関わらず遺伝子の転写を強化する作用を持ち、特定の遺伝子発現パターンの形成に寄与します。
4. 遺伝子調節ネットワーク: 遺伝子は単独で機能するのではなく、複雑な調節ネットワークの一部として機能します。これには転写因子、抑制因子、非コーディングRNA、エピジェネティックな修飾などが関与しており、細胞の状態や環境条件に応じて適切なタンパク質が合成されるように調節されています。
これらの遺伝子構造の詳細は、遺伝子がどのように機能し、生物の特性がどのように決定されるかを理解するための鍵となります。また、これらの知識は遺伝病の診断や治療、遺伝的改良など、多岐にわたる応用に利用されています。
遺伝子発現の調節
核DNA(nDNA)は生物の遺伝情報をコードし、その情報に基づいて細胞機能が調節されます。この過程の中心には、遺伝子発現の調節があります。遺伝子発現の調節は、細胞のタイプ、状態、外部環境に応じてタンパク質の生産を最適化するために不可欠です。
● 遺伝子発現の調節
1. 転写の制御: nDNAからRNAへの情報の転写は、転写因子と呼ばれるタンパク質によって細かくコントロールされます。これらの因子は、特定のプロモーターやエンハンサー領域に結合し、RNAポリメラーゼIIの活動を促進または抑制します。また、エピジェネティックな変化、例えばDNAのメチル化やヒストンの修飾も転写レベルで遺伝子発現を調節します。
2. RNAスプライシング: 前駆体mRNA(pre-mRNA)は、成熟したmRNAになる前に、非コーディング領域であるイントロンが取り除かれ、コーディング領域のエキソンが結合される必要があります。スプライシングは、さまざまなエキソンを異なる方法で組み合わせることにより、一つの遺伝子から複数のタンパク質バリアントを生成する機会を提供します。
3. mRNAの輸送と安定性: 成熟したmRNAは核から細胞質に輸送され、リボソームでタンパク質へと翻訳されます。mRNAの寿命、すなわちその分解までの時間もまた、遺伝子発現の調節に影響を与えます。mRNAの安定性は、特定の調節タンパク質やmiRNA(microRNA)によって変化することがあります。
4. 翻訳後の修正: タンパク質が合成された後、その活性や機能はしばしば翻訳後の修正によって調節されます。これにはリン酸化、グリコシル化、ユビキチン化などが含まれ、タンパク質の安定性、活性、細胞内での位置が調節されます。
これらの遺伝子発現の調節メカニズムは、生物が生存と繁栄を続けるために、適切なタイミングで正確なタンパク質を合成できるようにするために不可欠です。また、これらのプロセスの異常は多くの疾患の原因となりうるため、医学研究においても重要な焦点となっています。
3. nDNAの研究と進歩
核DNA(nDNA)の研究は、遺伝学の分野において絶え間ない進歩を遂げています。特に最新の技術革新は、遺伝情報の解析と操作の方法を根本的に変えており、これにより研究者たちは遺伝病の原因を特定し、新たな治療法を開発することが可能になっています。
● 遺伝学研究における新技術
1. 次世代シーケンシング(NGS): NGS技術は、短時間で大量のDNAシーケンスを同時に読み取ることが可能です。この技術により、完全なゲノムを迅速かつコスト効率良くシーケンシングすることができ、個々の遺伝的差異を詳細に解析することが可能になりました。NGSは、遺伝的多様性、遺伝病の原因、進化の過程を研究する上で貴重なツールとなっています。
2. CRISPR-Cas9: 遺伝子編集技術の中でも特に注目されるCRISPR-Cas9は、特定のDNA領域を正確に編集することができる革命的なツールです。この技術は、遺伝子の機能を研究するためだけでなく、遺伝病の治療法を開発するための新たなアプローチとしても利用されています。CRISPRは、病原遺伝子を無効化するか、または修正することで、遺伝的障害を持つ患者に対する治療可能性を提供します。
3. シングルセルシーケンシング: この技術は、個々の細胞レベルでの遺伝的表現を分析することができます。シングルセルシーケンシングは、細胞群内の微妙な遺伝的差異を明らかにし、特定の病気や条件における細胞の振る舞いを理解するのに役立ちます。これにより、疾患の発症メカニズムや新しいバイオマーカーの同定につながる可能性があります。
これらの技術は、遺伝学の分野において、研究の限界を大きく広げています。特に、遺伝病の診断、治療、予防に関する理解を深め、より効果的で個別化された治療法の開発に寄与しています。これらの進歩は、将来の医学と遺伝学研究における新たな可能性を切り開いています。
遺伝学研究における新技術
核DNA(nDNA)の研究は遺伝病の理解を深めることに大きく貢献しており、この知見は新たな治療法の開発に直接応用されています。進化する科学技術により、遺伝病の原因となる遺伝子の特定や、それらを標的とした治療戦略の策定が可能になりつつあります。
● 遺伝病の理解と治療への応用
1. 疾患の遺伝的基盤の解明: 遺伝病はしばしば特定の遺伝子の突然変異によって引き起こされます。核DNAの詳細な解析により、これらの疾患に関連する遺伝子や遺伝子変異が特定されています。例えば、固有の遺伝子変異がシストロニック病やハンチントン病などの特定の疾患と関連していることが明らかになりました。このような情報は、リスク評価、早期診断、及び予防策の開発に不可欠です。
2. 遺伝子治療の開発: nDNAの研究から得られた知識を活用して、遺伝病を直接治療する新しい方法が開発されています。特に遺伝子治療は、病原性の遺伝子を修正、交換、または無効化することを目指しています。CRISPR-Cas9などの遺伝子編集ツールは、これらの治療法の開発において中心的な役割を果たしており、特定の遺伝子変異を標的として正確に修正する能力を持ちます。
3. 個別化医療への応用: 遺伝学の進歩は、個別化医療の実現にも寄与しています。患者のnDNA情報を基にしたカスタマイズされた治療プランは、より効果的な治療成果をもたらし、副作用のリスクを最小限に抑えることができます。遺伝的スクリーニングによって、特定の薬物や治療法に対する個々の反応を予測し、最適な治療選択を可能にします。
これらの進歩は、遺伝病の治療に革命をもたらし、患者に新たな希望を与えています。遺伝病に対するより効果的で安全な治療法の開発に向けて、nDNAの研究は今後も重要な役割を果たし続けるでしょう。
遺伝病の理解と治療への応用
核DNA(nDNA)の研究は、遺伝病の理解と治療法の開発に大きく貢献しています。特定の遺伝子異常が原因である遺伝病に対して、nDNAの詳細な解析と操作が新たな治療戦略を可能にしています。
● 遺伝病の理解と治療への応用
1. 遺伝病の分子基盤の解明: 現代の遺伝学研究は、多くの遺伝病が特定の遺伝子の突然変異によって引き起こされることを明らかにしています。例えば、システィック・フィブローシスはCFTR遺伝子の変異に関連しており、そのメカニズムの解明は病態理解と治療法の改善に直結しています。nDNAのシーケンス情報から、これらの遺伝的異常を特定し、疾患の発生原因を理解することが可能です。
2. 遺伝子治療の進展: nDNAの知見を活用した遺伝子治療は、遺伝病を根本から治療する可能性を持っています。特に、遺伝子編集技術の進化により、病気に直接関連する遺伝子の変異を修正することが現実的になっています。CRISPR-Cas9などのツールを使用して、患者のDNAを直接編集し、健康な遺伝子配列を回復させる治療が開発されています。
3. 個別化された治療戦略: nDNAの詳細な分析により、個々の患者に最適な治療法を提供する個別化医療が推進されています。遺伝的プロファイリングを通じて、患者特有の遺伝子変異を理解し、その情報を基に最も効果的な薬剤や治療プロトコルを選択することが可能です。これにより、治療の効果を最大化し、不必要な副作用を最小限に抑えることができます。
これらの進歩は、遺伝病に対する治療アプローチを根本的に変え、より効果的で安全な治療オプションを患者に提供する可能性を秘めています。核DNAの研究は、遺伝病の未来を形作る重要な鍵となるでしょう。
4. nDNAの医療における応用
遺伝子療法とパーソナライズドメディシン
nDNAの研究は医療分野において革新的な応用を可能にしており、特に遺伝子療法とパーソナライズドメディシンの領域で顕著な進歩が見られます。これらの技術は、疾患の治療方法を根本から変える可能性を秘めています。
● 遺伝子療法とパーソナライズドメディシン
1. 遺伝子療法の概要: 遺伝子療法は、病気の根本的な原因となる遺伝子の異常を直接的に修正することを目指します。このアプローチでは、病気に関連する遺伝子を正常なものに置換、補修、または修正するために、特定の遺伝子を標的とするベクター(ウイルスまたは非ウイルスベース)を使用します。たとえば、遺伝性網膜疾患や一部の血液疾患に対する遺伝子療法は、臨床試験で有望な結果を示しています。
2. パーソナライズドメディシンの展開: パーソナライズドメディシン、または精密医療は、個々の患者の遺伝的プロファイルに基づいて治療をカスタマイズすることを目指します。nDNAの解析を通じて、患者の遺伝的特性を詳細に理解し、それに最も適した薬物や治療法を選択します。このアプローチは、がん治療や心血管疾患の管理に特に効果的であり、患者にとってより効果的で副作用の少ない治療結果をもたらすことが期待されています。
3. 治療効果の最適化と個別化: nDNAの情報を活用することで、治療の効果を最大化し、不必要な治療から患者を守ることが可能になります。例えば、特定の遺伝子変異を持つ患者にのみ効果的な薬剤を投与することで、治療の成功率を高めるとともに、治療コストを削減することができます。
nDNAのこれらの応用は、患者の生活の質を大幅に向上させると共に、医療システム全体の効率を改善することに貢献しています。遺伝子療法とパーソナライズドメディシンは、現代医療においてますます重要な役割を担うことになるでしょう。
予防医学と診断技術の向上
nDNAの研究進展は、予防医学と診断技術の分野においても重要な役割を果たしています。これにより、疾患の早期発見と予防が可能となり、治療前の段階での介入が現実的になっています。
● 予防医学と診断技術の向上
1. 遺伝的リスクの評価: nDNAの解析を通じて、個々の遺伝的リスクを特定することが可能になりました。特定の疾患に対する遺伝的素因を明らかにすることで、リスクが高い個人に対して早期の予防措置や生活習慣の改善を促すことができます。たとえば、BRCA1やBRCA2遺伝子の変異は乳がんや卵巣がんのリスクを高めることが知られており、これらの情報をもとにリスク管理が行われています。
2. 早期診断の促進: nDNAの分析技術の進化は、疾患の早期診断に寄与しています。高感度の遺伝子解析技術により、発症前に疾患の兆候を検出することが可能になり、より早期からの治療開始が可能になります。例えば、新生児の遺伝的スクリーニングにより、代謝異常や遺伝的障害を早期に発見し、適切な栄養管理や治療を行うことができます。
3. 診断技術の精度向上: 遺伝子チップや次世代シーケンシングなどの技術は、疾患関連遺伝子の詳細なプロファイリングを可能にし、診断の精度を大幅に向上させています。これにより、病状の特定がより正確になり、治療の効果を最大化するための戦略が立てやすくなります。
nDNAのこれらの応用は、医療分野における予防策と診断技術の革新を推進し、より多くの人々に健康で質の高い生活を提供するための重要なステップです。今後も技術の進歩とともに、これらの分野での応用範囲はさらに広がることが期待されます。
5. nDNAの倫理的および法的問題
遺伝情報のプライバシーと利用
nDNAの研究と応用が進む中で、遺伝情報のプライバシーとその利用に関する倫理的および法的な問題が重要な焦点となっています。これらの情報は非常に個人的なものであり、適切な取り扱いが求められます。
● 遺伝情報のプライバシーと利用
1. プライバシーの保護: 個人のnDNA情報は、その人の健康状態、遺伝的リスク、さらには家族歴までを反映する可能性があります。そのため、この情報が不適切に公開または利用されると、個人に対するプライバシーの侵害や差別の原因となる恐れがあります。プライバシー保護のために、厳格なデータ保護法規とプロトコルの整備が必要とされています。
2. 遺伝情報の利用規制: 遺伝情報の利用は、特に保険申請や雇用の際の差別を防ぐために法的に規制されています。例えば、アメリカ合衆国では遺伝情報非差別法(GINA)が制定され、健康保険や雇用において遺伝情報を基にした差別を禁じています。これにより、個人が自分の遺伝的情報を知ることのリスクを軽減し、遺伝子検査を受けやすくなっています。
3. 遺伝情報の倫理的な議論: 遺伝情報の取り扱いには、倫理的な議論が伴います。特に、遺伝的なリスクを持つ子供を持つ可能性に関する情報は、個人やカップルにとって重大な意味を持つため、どのように情報を共有し、どのような選択を提供するかが重要です。また、遺伝子編集技術がもたらす「デザイナーベビー」の問題など、新たな技術の発展は新たな倫理的問題を引き起こしています。
これらの倫理的および法的な課題に対処することは、nDNAの研究と応用を進める上で欠かせない要素です。適切なガイドラインと法律が整備され、守られることが、科学技術の健全な発展を保証し、社会全体の信頼を維持するために不可欠です。
遺伝子編集技術の倫理的な懸念
nDNA研究における最先端技術の一つである遺伝子編集技術は、医療や生物科学に革命をもたらす可能性を持ちますが、同時に深刻な倫理的懸念も引き起こしています。特にCRISPR-Cas9などの遺伝子編集ツールの使用は、遺伝子治療の領域を大きく前進させる一方で、多くの倫理的な問題を提起しています。
● 遺伝子編集技術の倫理的な懸念
1. 遺伝子改変の永続性: 遺伝子編集による変更は、改変された遺伝情報が次世代にも受け継がれる可能性があります。このような永続的な変更は、意図しない遺伝的影響を引き起こす可能性があり、未来の世代に対する倫理的な責任を問います。
2. 人間の遺伝的多様性への影響: 遺伝子編集が広く行われるようになると、人間の遺伝的多様性が減少する恐れがあります。多様性は進化的な適応の重要な要素であり、その減少は未知の長期的影響をもたらす可能性があります。
3. デザイナーベビーへの道: 遺伝子編集技術を使用して、特定の身体的特徴や知能、性格特性を持つ子供を「デザイン」することが技術的に可能になるかもしれません。このような選択的遺伝子操作は、社会的、倫理的な観点から広範な議論を必要とします。
4. 公平性の問題: 遺伝子編集技術へのアクセスが不平等である場合、社会的な不平等をさらに強化する可能性があります。医療資源の配分や治療へのアクセスに既存の格差がある中で、この技術が一部の人々にのみ利用可能となると、遺伝的な「エリート」が生まれる恐れがあります。
これらの倫理的懸念に対処するためには、広範囲にわたる社会的対話が必要です。遺伝子編集技術の開発と応用は、透明性と公共の監視の下で行われるべきであり、国際的な規範やガイドラインの策定が求められています。これにより、技術の利益を最大化し、潜在的なリスクを最小化することが可能になります。








