目次
タンパク質のN末端の基本概念からその生物学的な重要性、医薬品やバイオテクノロジーへの応用まで、N末端が持つ多様な機能とその最新の研究動向を総合的に解説します。
1. タンパク質のN末端とは何か?
基本的な定義
タンパク質のN末端は、ポリペプチド鎖の開始部分に存在するアミノ酸のアミノ基です。タンパク質合成が開始する際に最初に合成される部分であり、タンパク質の構造形成やその生物学的機能の発現において中心的な役割を担っています。このN末端は、タンパク質が適切な細胞内コンパートメントへ運ばれるためのシグナル役割を果たすことがあり、また特定の修飾が加えられることで、タンパク質の活性や安定性が調節されることもあります。このように、N末端はタンパク質の機能を決定づける重要な要素の一つです。
N末端はタンパク質やポリペプチドの構造において非常に重要な部分で、アミノ酸の遊離アミン基(-NH2)が存在するポリペプチドの一端を指します。この端は、タンパク質の合成が始まる場所でもあります。タンパク質の合成はリボソーム内で、メッセンジャーRNAの情報に基づいて行われ、アミノ酸はN末端(アミノ末端)からC末端(カルボキシル末端)へと順に結合していきます。この過程において、N末端のアミノ酸は最初に合成され、そのアミン基はペプチド合成が完了するまで遊離状態になります。この特性により、N末端はタンパク質の機能や局在に関与する重要な修飾を受ける場所でもあります。
タンパク質のN末端は、アミノ末端、NH2末端、アミン末端などとも呼ばれ、これがタンパク質の最初の部分として合成されることは、タンパク質の機能や安定性に大きな影響を与えるため、生物学的に重要です。ペプチドやタンパク質の配列は、翻訳の進行方向と一致してN末端からC末端へと記述されるのが一般的です。これは、タンパク質の合成がこの順序で行われるためです。
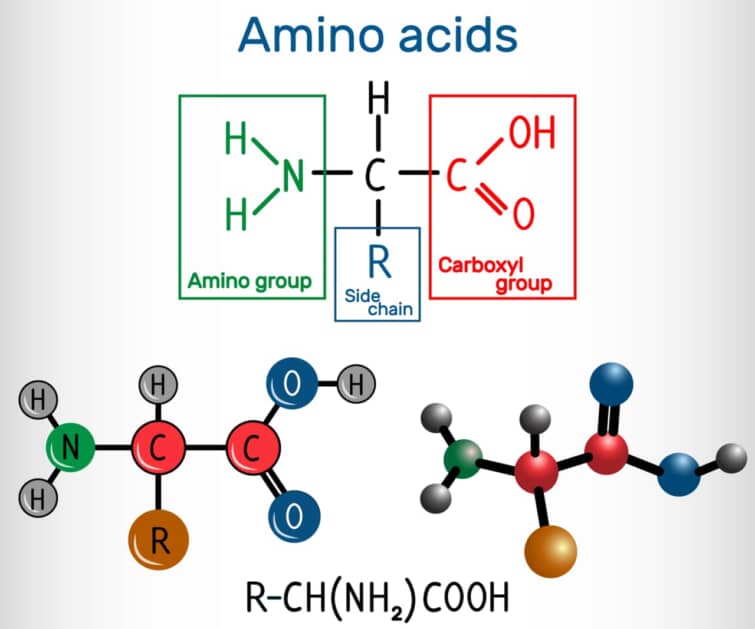
生合成プロセスにおける役割
タンパク質の生合成は、mRNAがリボソームによって読み取られ、アミノ酸が結びつけられてポリペプチド鎖が形成される過程です。この過程は、mRNAの翻訳がN末端(アミノ端)からC末端(カルボキシル端)へと進行することにより進められます。N末端が先に合成されることが重要なのは、タンパク質がその後適切に折りたたまれ、機能的な形へと成熟するためです。
N末端が形成されると、そのシーケンスはしばしば特定の信号を含んでおり、これがタンパク質の運命を決定します。たとえば、シグナル配列が存在すると、それに応じてタンパク質が特定の細胞内コンパートメントへ輸送されるよう誘導されます。また、N末端にはさまざまな化学的修飾が施されることがあり、これがタンパク質の活性化や安定性に直接影響を与えることもあります。したがって、N末端の形成は、タンパク質の正しい折りたたみや後続の修飾反応が適切に行われるための基盤となり、タンパク質の機能発現にとって不可欠な役割を担っています。
2. N末端の生物学的重要性
細胞内輸送の指令
タンパク質のN末端に位置するシグナルペプチドは、新しく合成されたタンパク質が細胞内の正しい位置へ輸送されるための「郵便番号」のような役割を果たします。このシグナルペプチドによって、タンパク質は特定の細胞小器官へ誘導され、そこでその機能を果たすことができます。たとえば、シグナルペプチドが指示することで、タンパク質は細胞膜、リソソーム、ゴルジ体など特定の場所に送られます。この正確な輸送プロセスにより、タンパク質はそれぞれの生物学的役割を効果的に果たすことが可能になります。
分解と寿命の決定
タンパク質のN末端には、その分解速度や細胞内での寿命を決定する重要な役割があります。これは「N-end rule」として知られており、タンパク質の安定性に直接影響を及ぼします。N-end ruleによれば、N末端のアミノ酸が何であるかによって、タンパク質の運命が変わることがあります。例えば、アルギニン、リジン、またはフェニルアラニンなどの特定のアミノ酸がN末端に存在する場合、それによってタンパク質は迅速に分解される可能性が高まります。この規則性により、タンパク質の寿命が短縮され、細胞内のタンパク質レベルの調節がなされます。このメカニズムは、細胞の健康維持や様々な生理的プロセスの正確な制御に寄与しています。
3. N末端の修飾と機能
N末端は、タンパク質の生合成においてリボソームを出る最初の部分であり、多くの場合、特定のシグナルペプチド配列を含んでいます。このシグナルペプチドは「細胞内郵便番号」とも呼ばれ、タンパク質を適切なオルガネラへ正確に送り届ける役割を持っています。タンパク質がその目的の位置に到達すると、シグナルペプチダーゼという酵素によってシグナルペプチドは通常除去されます。
さらに、タンパク質のN末端にあるアミノ酸は、タンパク質の寿命やその半減期にも大きな影響を与えることが知られています。この現象は「N末ルール」と呼ばれ、特定のアミノ酸がN末端に存在するとタンパク質が迅速に分解される可能性が高まるとされています。このルールにより、細胞は不要または損傷したタンパク質を効率的に処理し、細胞内環境のバランスを保つことができます。
これらのメカニズムは、タンパク質の合成、機能発現、そして細胞内での適切な分布を正確に制御するために不可欠であり、生物学的プロセスの正確な調節に寄与しています。
タンパク質のN-末端は、その機能と局在に重要な役割を果たします。この部分は翻訳前または翻訳後に様々な方法で修飾されることがあります。一般的な修飾には以下のものが含まれます:
1. イニシエーターメチオニン(iMet)の除去: タンパク質合成の初期段階で合成されるメチオニンは、特定のアミノペプチダーゼによって除去されることがあります。この過程はタンパク質の成熟と機能の開始に必要です。
2. 小さな化学基の結合: タンパク質のN-末端には、アセチル基、プロピオニル基、メチル基などの小さな修飾が施されることがあります。これらの修飾はタンパク質の構造と機能に影響を与え、その活性や細胞内での相互作用を調節します。
3. 膜アンカーの付加: パルミトイル基やミリストイル基などの脂肪酸系の修飾がN-末端に追加されることもあり、これによってタンパク質は細胞膜に固定されることがあります。これはタンパク質が細胞膜近くで機能する場合に特に重要です。
これらの修飾は、タンパク質が特定の細胞内部位で正しく機能するために不可欠です。また、これらの修飾が適切に行われないと、タンパク質の機能不全や細胞の異常が引き起こされる可能性があります。このように、N-末端修飾はタンパク質の生物学的活性と細胞内での適切な分布を調節するために非常に重要です。
N末ルール
N末端はタンパク質の生合成において非常に重要な役割を果たします。リボソームから最初に出る部分であり、多くの場合、この部分にはシグナルペプチド配列が含まれています。これは「細胞内郵便番号」とも称され、タンパク質を細胞内の適切なオルガネラへ送り届ける役割を担います。シグナルペプチドは、タンパク質が目的の位置に到達した後、シグナルペプチダーゼという酵素によって通常除去されます。
また、タンパク質のN末端に存在するアミノ酸は、そのタンパク質の半減期、つまり分解されやすさを決定する重要な要素です。この現象は「N末ルール」と呼ばれ、特定のアミノ酸がN末端にあると、タンパク質が迅速に分解されることを示します。このメカニズムにより、細胞は不要または損傷したタンパク質を効率的に処理し、細胞の健康を維持します。
これらの機能は、タンパク質の正確な合成、適切な局在、そして迅速なターンオーバーを保証することで、細胞の生理的プロセスを最適化するために重要です。
N-ミリストイル化とその影響
N-ミリストイル化は、タンパク質のN末端にミリスチン酸が結合する共有結合修飾であり、このプロセスは特にシグナルタンパク質や膜タンパク質の機能に不可欠です。この修飾はタンパク質の疎水性を高め、結果として細胞膜に結合しやすくなるため、細胞内での正確な局在と効率的なシグナル伝達が可能になります。N-ミリストイル化されたタンパク質は、細胞膜への固定が必要なシグナリングパスウェイや細胞応答の調整に関与しており、細胞の成長、分化、生存に影響を与えることが知られています。このように、N-ミリストイル化はタンパク質の機能と細胞の挙動に重要な影響を与える修飾です。
その他の翻訳後修飾
タンパク質のN末端では、N-ミリストイル化以外にも様々な翻訳後修飾が起こります。これらの修飾は、タンパク質の活性、安定性、および細胞内での相互作用に大きな影響を与えることがあります。主な修飾としては、アセチル化やリン酸化があります。
アセチル化: タンパク質のN末端のアミノ基にアセチル基が付加されるアセチル化は、タンパク質の活性化やDNA結合の調節に関与しています。この修飾によってタンパク質の電荷が変化し、分子間の相互作用やタンパク質の局在が変わることがあります。
リン酸化: タンパク質のセリン、スレオニン、チロシン残基にリン酸基が結合するリン酸化は、シグナル伝達の調節や酵素の活性制御に重要な役割を果たします。N末端でのリン酸化は、タンパク質の活性を直接変化させることが多く、細胞の応答や動態に影響を与えます。
これらの翻訳後修飾は、タンパク質の機能を微調整し、細胞内での精密な調節機能を提供します。各修飾はタンパク質の特定の機能を促進または抑制し、細胞の生理的な状態や環境変化に適応するための重要な手段となっています。
ミトコンドリアターゲティングペプチド
ミトコンドリアターゲティングペプチド(mtTP)は、タンパク質がミトコンドリアへ正確に取り込まれるための重要な役割を担っています。これらのペプチドは、タンパク質のN末端に存在し、タンパク質がミトコンドリアの膜を通過し、内部に適切に局在するための「郵便番号」のような機能を果たします。mtTPによってタンパク質は特定のミトコンドリア膜輸送システムに認識され、細胞のエネルギー産生に必要なミトコンドリア内に効率的に輸送されることが可能になります。
このプロセスは、タンパク質がミトコンドリア内で特定の機能を果たすために不可欠であり、ミトコンドリアの健康と全体の細胞機能に直接影響を及ぼします。ミトコンドリアターゲティングペプチドの正確な機能とタンパク質の適切な配送は、細胞のエネルギー代謝やアポトーシス制御など、多くの生物学的プロセスにおいて中心的な役割を担っています。
シグナルペプチド
シグナルペプチドは、新たに合成されるほとんどのタンパク質のN末端(または場合によってはC末端)に存在する、通常16〜30アミノ酸の短いペプチドです。これらは、タンパク質が細胞内の特定の小器官(小胞体、ゴルジ体、エンドソーム)へ運ばれるための道しるべとして機能し、細胞外へ分泌されるタンパク質や細胞膜に挿入されるタンパク質の識別に不可欠です。
タイプIの膜結合タンパク質の多くはシグナルペプチドを持っていますが、タイプIIやマルチスパン膜結合タンパク質の多くは、第1膜貫通ドメインによって分泌経路に標的化されます。この膜貫通ドメインはシグナル配列に似ていますが、シグナルペプチドとは異なり、切断されることはありません。
シグナルペプチドは、シグナル認識粒子(SRP)によって認識され、その結果、タンパク質が分泌経路に導かれます。真核細胞ではこのプロセスが粗面小胞体で行われ、原核細胞では細胞膜を介して分泌されます。このようなシグナルペプチドの存在は、タンパク質が適切な場所で適切な機能を果たすために極めて重要です。
4. 医薬品開発への応用
タンパク質の修飾技術
タンパク質のN末端への修飾技術は、タンパク質の機能や安定性を向上させるために利用され、特にバイオ医薬品の開発において重要な役割を果たします。この技術により、タンパク質に特定の化学基を結合させることができ、その結果、タンパク質の活性、安定性、細胞内での分布、体内での半減期が改善されることがあります。
例えば、N末端へのポリエチレングリコール(PEG)の付加は、「PEGylation」として知られ、タンパク質の体内での持続時間を延長し、免疫原性を低減する効果があります。このような修飾は、インスリンや成長ホルモンなどのペプチドホルモンの治療効果を高めるためにも使用されています。
また、N末端に特定のリガンドを結合させることで、タンパク質を特定の細胞や組織に特異的に送達するターゲティングが可能になります。これにより、薬剤の副作用を最小限に抑えつつ、治療効果を最大化することが期待されます。
この技術の発展により、様々な疾患に対するより効果的な治療薬の開発が進められており、将来的には更なる医療の革新が期待されています。
新たな薬剤配送システムへの影響
タンパク質のN末端への修飾は、薬剤配送システムの効率と特異性を大きく改善する可能性を秘めています。これにより、特定の治療が必要な標的細胞に対して、より正確に薬剤を届けることが可能になると考えられています。この技術は、タンパク質のN末端に特定の分子や薬剤を結合させることで、その薬剤の細胞内への導入効率を高め、副作用を減少させつつ治療効果を向上させることが目指されています。
特に、がん治療においては、標的細胞特異的な薬剤配送が重要視されています。N末端修飾を利用したシステムでは、薬剤が正確にがん細胞にのみ作用し、正常な細胞には影響を与えないよう設計されています。このような精密なアプローチにより、薬剤の有効性を最大限に発揮しつつ、治療中の患者の苦痛や治療関連のリスクを最小限に抑えることが可能です。
N末端の修飾技術は、これからの医薬品開発において重要な役割を担うと期待されており、さまざまな疾患に対するより効果的で安全な治療方法の実現に貢献することが予想されます。この技術の進化により、将来的には個別化医療や精密医療のさらなる進展が期待されています。
5. 最新の研究動向と未来の展望
バイオ医薬品への応用例
タンパク質のN末端技術を活用したバイオ医薬品の開発は、特定の疾患に対するターゲット治療薬の形で具体化されています。これらの薬剤は、N末端の修飾を利用することで、薬剤の活性や特異性を高め、副作用のリスクを減少させることが期待されます。たとえば、特定のがんタイプに対して、タンパク質のN末端に特定のリガンドや薬剤を結合させることにより、がん細胞特有の受容体に結合し、正常細胞には少ない影響を与えるように設計された抗体薬剤複合体が開発されています。このようなアプローチは、薬剤の効果を最大化し、治療における精度と安全性を向上させるために重要です。この技術により、患者特有の条件に合わせたカスタマイズされた治療が可能になり、パーソナライズドメディシンの進展に寄与しています。
研究開発における課題と可能性
タンパク質のN末端修飾技術の発展は、バイオ医薬品開発において大きな可能性を秘めていますが、多くの課題も伴います。この技術のさらなる進展には、タンパク質のN末端に施される各種修飾の種類やメカニズムに関する深い理解が必要です。具体的には、どのような修飾がタンパク質の活性や安定性にどのように影響を与えるのか、そしてその修飾が細胞内外でどのように機能するのかの詳細な解析が求められます。
また、新しいN末端修飾方法の開発とその生物学的メカニズムの解明は、治療薬の効果を向上させる上で重要な役割を果たします。新たな修飾技術が発見されれば、それによって特定の疾患に対するターゲット治療が可能となり、より効率的で副作用の少ない治療法を提供することが可能になるかもしれません。これらの技術は、特に慢性病やがんなどの重篤な疾患を対象とした治療に革命をもたらす可能性があります。
したがって、N末端修飾技術の研究開発は、科学的な課題だけでなく、医療への応用という点でも極めて重要です。これらの技術をさらに発展させるためには、学際的な研究が必要であり、化学、生物学、医学の各分野の専門家が協力することが求められます。








