目次
この記事では、メチル化の基本的な概念、生化学的プロセス、および生物学におけるその役割について解説します。DNAメチル化が遺伝子発現にどのように影響するか、タンパク質と小分子のメチル化が生体内でどのように機能するかを詳しく説明し、その医学的および研究上の意義を探ります。
メチル化の基本
メチル化とは何か
メチル化は、さまざまな基質にメチル基(CH3)が結合する化学反応を指します。この用語は化学、生化学、生物科学で一般的に使用されています[18]。特に生体内でのメチル化は、DNAやタンパク質などの生体分子にメチル基が付加されることにより、その機能の発現や調節が行われる重要な生物学的プロセスです[2][9]。
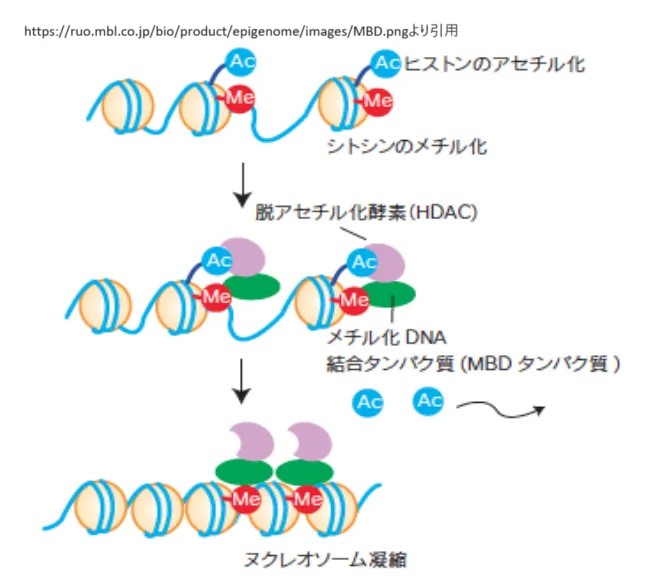
● DNAメチル化
DNAメチル化は、DNA中のシトシン塩基の炭素原子にメチル基が付加されることを指し、主にCpGサイト(シトシンとグアニンが連続する配列)で発生します[3][5][19]。このメチル化は遺伝子の発現を抑制する役割を果たし、転写因子の結合を阻害することで遺伝子のオン・オフを制御します[3][7]。また、DNAメチル化は細胞の分化や発生、疾患の発生においても重要な役割を果たしています[4][14]。
● タンパク質のメチル化
タンパク質のメチル化は、主にリシンやアルギニンの側鎖にメチル基が付加されることを指します。このメチル化はタンパク質の構造や機能に影響を与え、細胞内でのタンパク質の局在や活性の調節に関与しています[9]。
● 生物学的意義
メチル化は、遺伝子の発現調節、タンパク質の活性制御、さらにはエピジェネティックな遺伝情報の維持に不可欠であり、細胞の正常な機能維持や発展、疾患の発生に深く関わっています[14][15][16]。特に、異常なメチル化パターンはがんなどの疾患の原因となることが知られています[15]。
- 参考文献・出典
-
[2] dictionary.goo.ne.jp/word/%E3%83%A1%E3%83%81%E3%83%AB%E5%8C%96/
[3] www.ims.u-tokyo.ac.jp/cancer-cell-biology/hp2018/DNAme_maintenance.html
[4] www.amed.go.jp/news/release_20210420-02.html
[5] www.med.tottori-u.ac.jp/molebio/305/578/1417.html
[6] www.nig.ac.jp/museum/genetic06.html
[7] www.cdb.riken.jp/jp/04_news/articles/071130_epigenetic.html
[8] www.cellsignal.jp/pathways/dna-methylation-pathway
[9] www.weblio.jp/content/%E3%83%A1%E3%83%81%E3%83%AB%E5%8C%96
[10] www.rhelixa.com/knowledgebase/dna-methylation-role/
[11] www.abcam.co.jp/epigenetics/dna-methylation-and-demethylation-4
[12] www.chem-agilent.com/contents.php?id=1000260
[13] www.terumozaidan.or.jp/labo/interview/07/03.html
[14] www.nies.go.jp/kanko/kankyogi/59/column2.html
[15] ruo.mbl.co.jp/bio/product/epigenome/article/DNA-methylation.html
[16] genetics.qlife.jp/tutorials/How-Genes-Work/epigenetics
[17] www.jstage.jst.go.jp/article/jcrsj/63/4/63_257/_pdf
[18] ja.wikipedia.org/wiki/%E3%83%A1%E3%83%81%E3%83%AB%E5%8C%96
[19] ja.wikipedia.org/wiki/DNA%E3%83%A1%E3%83%81%E3%83%AB%E5%8C%96
メチル化の化学的メカニズム
メチル化は、メチル基 (-CH3) がターゲット分子に付加される化学的プロセスです。このプロセスは、特にDNA、RNA、タンパク質、および小分子において重要な役割を果たします。メチル化は、生物学的プロセスにおいて遺伝子の発現調節、タンパク質の機能、および代謝の調整に寄与します。
● DNAメチル化
DNAメチル化は、主にシトシンの5位の炭素にメチル基が付加されることによって発生します。この反応は、DNAメチルトランスフェラーゼ(DNMT)という酵素によって触媒されます。特に、CpGダイヌクレオチド配列がこのメチル化の主な標的です。メチル化されたCpGサイトは、遺伝子のプロモーター領域に多く存在し、メチル化が遺伝子の発現を抑制する重要なメカニズムとなっています[1][5][6][9][10].
● RNAメチル化
RNAメチル化もまた重要で、特にmRNAのアデノシンをN6-メチルアデノシン(m6A)に変換するプロセスがよく研究されています。この反応は、メチル化酵素によって触媒され、RNAの構造と機能に影響を与えることができます。RNAメチル化は、RNAの安定性や翻訳の効率に影響を与えることが示されています[13].
● タンパク質メチル化
タンパク質のメチル化は、主にリシンやアルギニン残基のアミノ基にメチル基が付加されることによって発生します。この修飾はタンパク質の活性、相互作用、および局在を調節することができます。タンパク質メチル化は、シグナル伝達や遺伝子発現の調節においても重要な役割を果たします[15].
● 化学的メチル化剤
メチル化反応には、ヨウ化メチルやジアゾメタンなどのメチル化剤が使用されることがあります。これらの化学物質は、特定の基質にメチル基を効率的に導入することができます[4].
● メチル化の生物学的意義
メチル化は、遺伝子の発現を制御するエピジェネティックなメカニズムとして機能します。DNAメチル化は、細胞の分化、発生、および疾患の状態において、特定の遺伝子の活性を調節するために重要です。また、異常なメチル化パターンはがんを含む多くの疾患の発生に関連しています[1][5][6][9][10].
このように、メチル化は生物学的および化学的プロセスにおいて多様な機能を持ち、細胞の正常な機能と疾患の発生の両方において中心的な役割を果たしています。
- 参考文献・出典
-
[1] www.cdb.riken.jp/jp/04_news/articles/071130_epigenetic.html
[4] japanknowledge.com/contents/nipponica/sample_koumoku.html?entryid=137
[5] www.rhelixa.com/knowledgebase/dna-methylation-role/
[6] www.ims.u-tokyo.ac.jp/cancer-cell-biology/hp2018/DNAme_maintenance.html
[9] ruo.mbl.co.jp/bio/product/epigenome/article/DNA-methylation.html
[10] www.cellsignal.jp/pathways/dna-methylation-pathway
[13] www.ach.ehime-u.ac.jp/seminar/gist/90_1.pdf
[15] ja.wikipedia.org/wiki/%E3%83%A1%E3%83%81%E3%83%AB%E5%8C%96
DNAメチル化と遺伝子調節
遺伝子のオンとオフの切り替え
DNAメチル化は、遺伝子の発現を制御する重要なエピジェネティックなメカニズムの一つです。このプロセスでは、DNAのシトシン塩基にメチル基が付加され、特にCpG配列が対象となります。メチル化されたDNAは、遺伝子の発現を抑制することが一般的ですが、その具体的な影響は、メチル化が発生する遺伝子の領域によって異なります[1][2][3][7].
● 遺伝子の発現抑制
DNAメチル化は主に遺伝子のプロモーター領域で発生し、これにより転写因子のDNAへの結合が阻害されます。プロモーター領域がメチル化されると、その遺伝子の発現は「オフ」の状態になります。このメカニズムは、細胞の分化や発達、さらにはがんの形成においても重要な役割を果たします[1][2].
● 遺伝子の発現活性化
一方で、DNAメチル化が遺伝子の発現を活性化する場合もあります。特定の条件下で、メチル化が遺伝子のエンハンサー領域や他の調節領域に発生すると、遺伝子の発現が「オン」に切り替わることがあります。この現象は、遺伝子の発現調節におけるDNAメチル化の複雑さを示しています[8].
● メチル化の継承と維持
DNAメチル化のパターンは細胞分裂を通じて娘細胞に伝えられます。この過程は「維持メチル化」と呼ばれ、主にDNAメチルトランスフェラーゼ1 (Dnmt1) によって行われます。Dnmt1はヘミメチル化されたDNAを認識し、新生DNA鎖にメチル基を付加することで、メチル化状態を新しい細胞に伝達します[3][7].
● 疾患との関連
異常なDNAメチル化は多くの疾患、特にがんの発生に関連しています。例えば、がん抑制遺伝子が過剰にメチル化されると、その遺伝子の発現が抑制され、細胞の異常増殖が引き起こされる可能性があります。このため、DNAメチル化のパターンを調節することによって、疾患の進行を抑制する新たな治療法の開発が進められています[5].
DNAメチル化は、遺伝子のオンとオフの切り替えを制御する複雑で精密なメカニズムであり、生物学的な多様性と適応の基盤を形成しています。このプロセスの詳細な理解は、遺伝子調節のメカニズムを解明し、エピジェネティック治療の可能性を拓く鍵となります。
- 参考文献・出典
-
[1] www.riken.jp/press/2017/20171214_2/
[2] www.rhelixa.com/knowledgebase/dna-methylation-basic/
[3] www.ims.u-tokyo.ac.jp/cancer-cell-biology/hp2018/DNAme_maintenance.html
[4] www.cellsignal.jp/pathways/dna-methylation-pathway
[5] www.rhelixa.com/knowledgebase/dna-methylation-role/
[6] www.jstage.jst.go.jp/article/biophys/51/3/51_3_124/_pdf
[7] ruo.mbl.co.jp/bio/product/epigenome/article/DNA-methylation.html
[8] www.naro.affrc.go.jp/archive/nias/seika/nias/h20/nias02004.htm
発生生物学における役割
● DNAメチル化と遺伝子調節
DNAメチル化は、遺伝子の発現を調節する重要なエピジェネティックなメカニズムです。このプロセスは、DNAメチル基転移酵素によってシトシン塩基にメチル基が付加されることにより行われ、主にCpGサイトにおいて発生します。DNAメチル化は、遺伝子のプロモーターやエンハンサー領域において転写因子の結合を阻害し、遺伝子の発現を抑制する役割を果たします[8]。
● 発生生物学における役割
発生生物学において、DNAメチル化は細胞の運命決定や分化において中心的な役割を担います。細胞が分化する過程で、特定の遺伝子の発現パターンが変化し、これによって細胞は異なる機能を持つようになります。DNAメチル化は、これらの遺伝子発現パターンの変化を調節することで、細胞のアイデンティティを確立し維持するのに寄与します。
例えば、加熱式タバコの使用によるDNAメチル化および遺伝子発現への影響が研究され、生活習慣や環境化学物質への曝露がDNAメチル化や遺伝子発現パターンを変化させ、疾患の発症に関係することが示されています[1]。また、DNAメチル化は、細胞記憶の継承として機能し、細胞の分化やがん化の抑制に重要な役割を果たすことが示されています[5]。
精子形成におけるDNAメチル化の役割も研究されており、NP95とDNMT1によるDNAメチル化の維持機構が遺伝情報やエピジェネティックな情報を子孫に伝える役割を果たしていることが示唆されています[7]。これは、生殖細胞の発生と分化におけるDNAメチル化の重要性を強調しています。
さらに、DNAメチル化は、細胞の種類ごとにオンになる遺伝子の組み合わせが異なることで、細胞の多様性を生み出すことに寄与しています[4]。これは、一卵性双生児でさえも、寿命や疾患への感受性に大きな違いがあることを説明するのに役立ちます。
DNAメチル化は、胚発生や細胞分化におけるメチル化DNA結合タンパク質の役割と密接に関連しており、正常な発生や細胞分化に必要であることが知られています[11]。DNAメチル化の異常は、胚発生や細胞分化に異常を引き起こし、がん化や神経異常など様々な病気の原因となる可能性があります。
総じて、DNAメチル化は発生生物学において、細胞のアイデンティティの確立、維持、および遺伝情報の継承において不可欠な役割を果たしています。
- 参考文献・出典
-
[1] www.amed.go.jp/news/seika/kenkyu/20211108-02.html
[2] www.activemotif.jp/applications-dna-methylation
[3] www.jstage.jst.go.jp/article/jsbibr/2/1/2_jsbibr.2021.8/_html/-char/ja
[4] www.bri.niigata-u.ac.jp/research/column/002045.html
[5] www.ims.u-tokyo.ac.jp/imsut/jp/about/press/page_00056.html
[6] www.cellsignal.jp/pathways/dna-methylation-pathway
[7] www.amed.go.jp/news/seika/kenkyu/20210603-01.html
[8] www.rhelixa.com/knowledgebase/dna-methylation-role/
[9] ruo.mbl.co.jp/bio/product/epigenome/article/DNA-methylation.html
[10] www.jstage.jst.go.jp/article/biophys/51/3/51_3_124/_pdf
[11] bsw3.naist.jp/bsedge/0003.html
タンパク質のメチル化
タンパク質機能の調節
タンパク質のメチル化は、生体内でのタンパク質の機能調節に重要な役割を果たしています。メチル化は、特定のアミノ酸残基にメチル基が付加される翻訳後修飾の一種であり、タンパク質の活性、相互作用、安定性、局在などを調節することが知られています[1][2][3][4][5][6][7][8][9][10][11][12][13][14].
● メチル化の影響
タンパク質のメチル化は、主にリジンやアルギニン残基に発生し、これによってタンパク質の構造や電荷が変化し、その機能が調節されます。例えば、ヒストンタンパク質のメチル化は遺伝子の発現を制御することが広く知られています。ヒストンのメチル化は、クロマチン構造を変化させ、遺伝子のアクセス可能性を調節することで、遺伝子の転写を促進または抑制します[2][9].
● 疾患との関連
タンパク質のメチル化異常は、がん、神経変性疾患、心血管疾患など多くの疾患の発症に関与していることが示されています。例えば、ヒストンメチル化酵素の異常は特定のがんの発生に直接関連しており、これらの酵素を標的とした治療薬の開発が進められています[13]. また、タンパク質のアルギニンメチル化は、脊髄小脳変性症などの神経変性疾患において重要な役割を果たしていることが報告されています[6].
● 研究と治療への応用
タンパク質メチル化の研究は、疾患の理解を深めるだけでなく、新たな治療法の開発にも寄与しています。メチル化酵素の阻害剤や、メチル化を調節する分子の同定により、特定の疾患に対する治療薬の開発が進められています[3][13]. これにより、エピジェネティックな治療アプローチが可能となり、疾患の治療に新たな道が開かれています。
タンパク質のメチル化は、細胞内での広範な調節機能を持ち、その研究は生命科学だけでなく医学的な応用においても極めて重要です。
- 参考文献・出典
-
[1] www.riken.jp/press/2023/20230829_2/index.html
[2] www.qst.go.jp/site/press/1210.html
[3] www.riken.jp/press/2018/20180806_2/index.html
[4] www.u-tokyo.ac.jp/focus/ja/press/p01_240919.html
[5] www.amed.go.jp/news/release_20210420-02.html
[6] resou.osaka-u.ac.jp/ja/research/2020/20200728_2
[7] www.tsukuba.ac.jp/journal/medicine-health/20230911140000.html
[8] ruo.mbl.co.jp/bio/product/epigenome/article/DNA-methylation.html
[9] ruo.mbl.co.jp/bio/product/epigenome/article/histone-modification.html
[10] www.toyaku.ac.jp/research/advanced/20210317-4345.html
[11] www.thermofisher.com/us/en/home/life-science/protein-biology/protein-biology-learning-center/protein-biology-resource-library/pierce-protein-methods/overview-post-translational-modification.html
[12] bsw3.naist.jp/bsedge/0003.html
[13] www.jstage.jst.go.jp/article/medchem/27/4/27_208/_pdf/-char/ja
[14] www.jstage.jst.go.jp/article/kagakutoseibutsu/51/12/51_785/_pdf/-char/ja
シグナル伝達における影響
タンパク質のメチル化は、シグナル伝達において重要な役割を果たしています。メチル化は、特定のアミノ酸残基にメチル基(CH3)が付加される翻訳後修飾の一種であり、タンパク質の機能、局在化、相互作用、安定性などを調節することにより、シグナル伝達経路を制御します[10][11][12][13][14][16][17]。
シグナル伝達におけるメチル化の影響は、以下のように様々な側面で観察されます:
– シグナル伝達経路の調節:メチル化は、シグナル伝達経路の様々なコンポーネントに影響を与えることができます。例えば、アルギニン残基のメチル化は、シグナル伝達、転写制御、DNA修復などの細胞機能に幅広く関与しています[14]。また、リン酸化とメチル化の相互作用が骨形成タンパク質(BMP)受容体下流のシグナル伝達の理解におけるブレイクスルーとして挙げられています[12]。
– 遺伝子発現の制御:メチル化は、ヒストンタンパク質やDNAメチル化と相互作用し、遺伝子の発現を調節することが知られています。ヒストンメチル化は、クロマチンの構造を変化させ、遺伝子のアクセス可能性を変えることで、転写の活性化または抑制に寄与します[5][8][9]。
– タンパク質の機能と相互作用:メチル化はタンパク質の立体構造や電荷を変化させることができ、これによりタンパク質間の相互作用やタンパク質の活性が変わることがあります。例えば、アルギニンメチル化は、タンパク質の輸送やシグナル伝達に関与することが示されています[6]。
– 細胞応答の調節:メチル化は、細胞が環境刺激に対して応答する際のシグナル伝達経路を調節することで、細胞の適応能力に影響を与えます。例えば、HSP70タンパク質のメチル化ががん細胞の異常増殖及び悪性化に寄与することが示されています[7]。
– 疾患との関連:タンパク質メチル化の異常は、がんを含む多くの疾患の発症と関連しています。例えば、ヒトがん細胞におけるヒストンメチル化異常の解析は、がんの発症や進行におけるエピジェネティックな変化の理解に寄与しています[5]。
これらの点から、タンパク質のメチル化はシグナル伝達において多面的な影響を及ぼし、細胞の正常な機能維持や疾患の発症に深く関わっていることが理解されます。
- 参考文献・出典
-
[1] www.qst.go.jp/site/press/1210.html
[2] www.jstage.jst.go.jp/article/jscc1971b/33/3-4/33_163/_pdf/-char/ja
[3] www.riken.jp/press/2018/20180806_2/index.html
[4] repository.kulib.kyoto-u.ac.jp/dspace/bitstream/2433/110396/1/KJ00004706802.pdf
[5] www.ncc.go.jp/jp/ri/division/molecular_modification_and_cancer_biology/project/010/20170908154407.html
[6] resou.osaka-u.ac.jp/ja/research/2020/20200728_2
[7] www.u-tokyo.ac.jp/focus/ja/press/p01_240919.html
[8] ruo.mbl.co.jp/bio/product/epigenome/article/DNA-methylation.html
[9] www.tsukuba.ac.jp/journal/medicine-health/20230911140000.html
[10] www.cellsignal.jp/services/proteomics-analytical-services/methylscan-methylation-proteomics
[11] www.cosmobio.co.jp/product/detail/ptm-antibodies-rkl.asp?entry_id=16807
[12] www.cosmobio.co.jp/aaas_signal/archive/eg-20140107.asp
[13] www.thermofisher.com/us/en/home/life-science/protein-biology/protein-biology-learning-center/protein-biology-resource-library/pierce-protein-methods/overview-post-translational-modification.html
[14] tokyo-med-imm.jimdofree.com/%E7%A0%94%E7%A9%B6%E6%A6%82%E8%A6%81/b%E7%B4%B0%E8%83%9E%E3%82%B7%E3%82%B0%E3%83%8A%E3%83%AB%E7%A0%94%E7%A9%B6/
[15] www.jstage.jst.go.jp/article/membrane1976/21/3/21_3_184/_pdf/-char/ja
[16] www.natureasia.com/ja-jp/nature/highlights/33021
[17] www.jstage.jst.go.jp/article/faruawpsj/56/1/56_36/_pdf/-char/ja
[18] www.jstage.jst.go.jp/article/kenbikyo/55/2/55_90/_pdf/-char/ja
小分子のメチル化
代謝におけるメチル化の役割
メチル化は生体内で重要な役割を果たす化学修飾の一つであり、特に代謝プロセスにおいて中心的な役割を担っています。メチル化は、遺伝子の発現を調節し、タンパク質の機能を変化させ、代謝経路を制御することにより、生体の健康状態や病態に大きく影響を及ぼします。
● 遺伝子発現の調節
DNAメチル化は、遺伝子のプロモーター領域にメチル基が付加されることにより、遺伝子の発現を抑制する主要なメカニズムです。特に、CpGアイランドと呼ばれるCG配列が集中して存在する領域では、シトシンのメチル化が遺伝子発現を抑制することが知られています[6]。このメカニズムは、正常な細胞分化や発達に必要不可欠であり、異常なメチル化パターンはがんなどの疾患の原因となります。
● タンパク質の機能調節
タンパク質のメチル化もまた、その機能に重要な影響を与えます。例えば、ヒストンタンパク質のメチル化は、クロマチン構造の変化を引き起こし、遺伝子のアクセシビリティを調節します。これにより、遺伝子の発現が促進されたり抑制されたりします[5]。
● 代謝経路の制御
メチル化は、代謝経路の調節にも関与しています。例えば、一部の酵素はメチル化によってその活性が変化し、代謝経路の流れを調節することがあります。また、メチル化は代謝産物自体にも影響を及ぼし、その機能や細胞内での運搬を変化させることがあります[7][8]。
● 疾患との関連
メチル化の異常は、多くの代謝性疾患やがんなどの病態に直接関連しています。例えば、がん細胞では、がん抑制遺伝子が異常にメチル化されることにより、その発現が抑制されることがあります[6]。また、栄養環境によるエピジェネティックな変化も、代謝性疾患の発症に寄与することが示されています[2]。
総じて、メチル化は生体の健康維持において重要な役割を果たし、その調節機構の理解は、疾患治療や予防策の開発に寄与する可能性があります。
- 参考文献・出典
-
[1] www.jst.go.jp/pr/info/info679/index.html
[2] www.jstage.jst.go.jp/article/medchem/21/4/21_31/_pdf
[3] kompas.hosp.keio.ac.jp/sp/contents/medical_info/science/201502.html
[4] www.mm.rcast.u-tokyo.ac.jp/research/research_02.html
[5] bifidus-fund.jp/keyword/kw079.shtml
[6] ruo.mbl.co.jp/bio/product/epigenome/article/DNA-methylation.html
[7] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2016.880397/data/index.html
[8] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2015.870617/data/index.html
薬理学への応用
小分子のメチル化は、遺伝子の発現を調節する重要なエピジェネティックなメカニズムの一つです。このプロセスは、特定のDNA領域(主にCpGアイランド)にメチル基を添加することにより、遺伝子の活性を抑制することができます。このメカニズムは、がんや神経変性疾患など多くの病態の理解と治療において重要な役割を果たしています[5]。
# 薬理学への応用
● がん治療
小分子のメチル化は、特にがん治療において重要な応用があります。がん細胞では、正常な細胞と比較してエピジェネティックな変化が頻繁に観察され、これにはDNAの異常なメチル化が含まれます。例えば、がん抑制遺伝子がメチル化されることにより、その発現が抑制され、がんの進行に寄与することがあります。このため、メチル化を阻害することによって、これらの遺伝子の発現を再活性化し、がん細胞の成長を抑制する治療戦略が開発されています[1][5]。
● 神経変性疾患
アルツハイマー病やパーキンソン病などの神経変性疾患においても、エピジェネティックな変化が病態の一因とされています。これらの疾患においては、特定の遺伝子の異常なメチル化が神経細胞の機能障害を引き起こす可能性があります。したがって、メチル化パターンを正常化することにより、病態の進行を遅らせるか、逆転させる可能性があります[6]。
● 新薬開発
小分子のメチル化を標的とした新薬開発も進められています。これには、DNAメチルトランスフェラーゼ(DNMT)の阻害剤や、メチル化DNAを認識するタンパク質(MBDタンパク質)の機能を阻害する化合物が含まれます。これらの小分子は、エピジェネティックな変化を正常化し、病態の改善を目指すものです[1][5]。
● 研究ツールとしての利用
さらに、小分子のメチル化は研究ツールとしても利用されています。特定の遺伝子の機能を研究するために、意図的にメチル化を誘導または阻害することで、その遺伝子の生物学的役割を解明することが可能です[5]。
このように、小分子のメチル化は薬理学の多様な分野で応用されており、疾患の治療だけでなく、基礎研究においても重要な技術となっています。
メチル化の臨床的意義
がん治療におけるメチル化抑制剤
DNAメチル化は、遺伝子の発現を制御するエピジェネティックな修飾の一つであり、細胞の正常な発達と機能維持に不可欠です。しかし、異常なメチル化パターンはがんを含む多くの疾患の発症に関与しています。がん細胞では、がん抑制遺伝子のプロモーター領域におけるCpGアイランドの異常なメチル化により、これらの遺伝子の発現が抑制されることが知られています[10]。
● がん治療におけるメチル化抑制剤
がん治療において、メチル化抑制剤は、異常にメチル化された遺伝子の発現を回復させることにより、がん細胞の増殖を抑制する新しい治療法として注目されています。これらの薬剤は、DNAメチル化酵素を阻害することで、がん抑制遺伝子のスイッチをオンに戻し、がん細胞の成長を抑えることができます[6][8][12]。
メチル化抑制剤の一例として「アザシチジン」があり、これはDNAのメチル化を阻害することで、がん抑制遺伝子の発現を回復させる効果があります。アザシチジンは、骨髄異形成症候群などの血液がんの治療に用いられており、日本でも承認されています[8][12]。
また、最近では、新しいエピゲノム治療薬バレメトスタットが開発され、血液がんに対して高い治療効果を示すことが証明されました。この薬剤は、メチル化ヒストンに対する阻害薬として作用し、がん抑制遺伝子の発現を誘導することで、持続的な臨床的効果をもたらします[4]。
さらに、DNAメチル化阻害剤は、がんの免疫状態を変えることにより、免疫チェックポイント阻害剤(例えばオブジーボ)が効かないがんに対しても効果を発揮する可能性があることが示されています[7]。
新規抗がん剤「INAQOVI®錠」は、急性骨髄性白血病の治療において欧州で承認されました。この経口DNAメチル化阻害剤は、静注製剤に比べて患者の通院負担を軽減する可能性があります[16]。
これらの進展は、メチル化抑制剤ががん治療における新たな治療選択肢としての臨床的意義を強調しています。DNAメチル化の研究は、がんの予後や治療応答の予測、さらには個別化医療への応用に向けた層別化への有用性を示しており、がん治療におけるメチル化抑制剤の役割は今後も拡大していくことが期待されます[11][12][14].
- 参考文献・出典
-
[4] www.k.u-tokyo.ac.jp/information/category/press/10804.html
[5] www.ncc.go.jp/jp/ri/division/molecular_modification_and_cancer_biology/project/010/20170908154407.html
[6] www.nhk.or.jp/kenko/atc_974.html
[7] naisikyou.com/hongo/news/2022/setdb1.html
[8] crest-ihec.jp/public/epigenome_medicine.html
[9] www.rhelixa.com/knowledgebase/dna-methylation-role/
[10] ruo.mbl.co.jp/bio/product/epigenome/article/DNA-methylation.html
[11] www.jstage.jst.go.jp/article/jspho/59/2/59_124/_article/-char/ja/
[12] www.jstage.jst.go.jp/article/naika/95/2/95_2_362/_pdf
[13] cir.nii.ac.jp/crid/1390001288108190976
[14] medical.nikkeibp.co.jp/leaf/all/cancernavi/news/202309/581242.html
疾患診断におけるメチル化マーカー
DNAメチル化は、遺伝子の発現を調節する主要なエピジェネティックメカニズムの一つであり、特定の疾患の診断、予後評価、さらには治療応答の予測において重要な役割を果たしています。メチル化マーカーは、がんをはじめとする多くの疾患において、非侵襲的なバイオマーカーとしての潜在的な利用が研究されています。
● がん診断におけるメチル化マーカー
がん細胞は、正常細胞と比較してDNAメチル化パターンが異なることが多く、この特性を利用して早期診断や病態のモニタリングが可能です。例えば、大腸がんにおいては、特定の遺伝子のプロモーター領域のハイパーメチル化が観察され、これを検出することでがんの存在を示唆することができます[3][4]。また、胃がんの予後予測マーカーとしてのMutL homolog 1 (MLH1)のメチル化も研究されています[12]。
● 自己免疫疾患におけるメチル化マーカー
自己免疫疾患においても、DNAメチル化は疾患の活動性や予後、治療応答のバイオマーカーとしての可能性が示されています。例えば、リウマチ性疾患におけるDNAメチル化プロファイルの変化は、疾患のサブタイプや進行度、治疗応答を反映する可能性があります[5][7]。
● 精神疾患におけるメチル化マーカー
うつ病やアルツハイマー病などの神経精神疾患においても、特定の遺伝子のメチル化状態が疾患の診断や進行の指標となる可能性が研究されています。うつ病におけるBDNF遺伝子のプロモーター領域のメチル化状態の変化は、疾患のバイオマーカーとしての潜在的な利用が示唆されています[8][16]。また、アルツハイマー病においては、特定の遺伝子プロモーター領域のメチル化レベルの低下が病態の進行と関連していることが報告されています[14][15]。
● メチル化マーカーの臨床応用の課題
DNAメチル化マーカーの臨床応用にはいくつかの課題があります。メチル化状態は疾患の種類や個体差、さらには環境因子によっても影響を受けるため、高い感度と特異性を持つマーカーの同定が必要です。また、メチル化マーカーを用いた診断技術の標準化や、広範な臨床試験を通じてその有効性と安全性を確認する必要があります[1][2]。
これらの研究は、メチル化マーカーが持つ潜在的な価値を示しており、将来的にはより個別化された疾患管理と治療の実現に寄与することが期待されます。
- 参考文献・出典
-
[1] www.nature.com/articles/s41467-023-40389-5
[2] www.ncbi.nlm.nih.gov/pmc/articles/PMC10407555/
[3] clinicalepigeneticsjournal.biomedcentral.com/articles/10.1186/s13148-021-01206-2
[4] www.spandidos-publications.com/10.3892/or.2021.8128
[5] www.nature.com/articles/s41584-020-0470-9
[6] www.amed.go.jp/news/seika/kenkyu/20220523.html
[7] pubmed.ncbi.nlm.nih.gov/32759997/
[8] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2017.890094/data/index.html
[9] www.jsbmg.jp/members/pdf/BG46-3/46-3-7.pdf
[10] www.rhelixa.com/knowledgebase/omics-seminar-ncc2021/
[11] www.rhelixa.com/knowledgebase/dna-methylation-role/
[12] www.jstage.jst.go.jp/article/jsmtmr/34/0/34_43/_article/-char/ja/
[13] fujita-hu.repo.nii.ac.jp/record/360/files/bfms_39_1_21_29.pdf
[14] kaken.nii.ac.jp/ja/grant/KAKENHI-PROJECT-20H03934/
[15] www.jikei.ac.jp/jikei/finance/pdf/drug/JS-246.pdf
[16] mhlw-grants.niph.go.jp/project/24241
メチル化研究の最前線
最新の研究動向
DNAメチル化は遺伝子の発現を制御する重要なエピジェネティックなメカニズムであり、多くの疾患の発症メカニズムや診断、治療において重要な役割を果たしています。最近の研究では、DNAメチル化のプロファイルを利用して疾患のリスク評価や早期発見、個別化医療への応用が進んでいます。
● 1. 疾患診断とリスク評価
DNAメチル化のパターンは、特定の疾患の発症リスクを予測するバイオマーカーとして利用されています。例えば、2型糖尿病のリスクを予測する研究があり、DNAメチル化の変化を用いて高リスク群を特定する方法が開発されています[16]。
● 2. 精神神経疾患の研究
双極性障害患者の前頭葉神経細胞におけるDNAメチル化状態の変化が明らかにされ、これが病態の理解や新たな治療法の開発につながる可能性が示されています[8][9][10]。
● 3. 加齢との関連
DNAメチル化は加齢と密接に関連しており、生物学的年齢の推定に利用されることがあります。最近の研究では、DNAメチル化パターンを用いて体細胞や組織の生物学的年齢を予測するアルゴリズムが開発されています[11]。
● 4. 癌研究
DNAメチル化は癌の発生と進行にも関与しています。特定の遺伝子のメチル化が癌細胞の成長を促進することが知られており、これをターゲットにした治療法が研究されています[19]。
● 5. 心臓疾患との関連
心臓疾患におけるDNAメチル化の研究も進んでおり、心筋細胞のメチル化状態が心機能にどのように影響を与えるかが解明されつつあります[3][4][12]。
これらの研究は、DNAメチル化が持つ広範な臨床応用の可能性を示しており、今後も多くの疾患に対する理解を深め、新たな治療法の開発に寄与することが期待されます。
- 参考文献・出典
-
[3] www.ueharazaidan.or.jp/houkokushu/Vol.32/pdf/report/061_report.pdf
[4] kaken.nii.ac.jp/ja/grant/KAKENHI-PROJECT-20K10569/
[5] www.jstage.jst.go.jp/article/medchem/21/4/21_18/_pdf/-char/ja
[6] www.qiagen.com/ja-jp/applications/next-generation-sequencing/epigenomics
[7] www.bri.niigata-u.ac.jp/research/column/002045.html
[8] www.amed.go.jp/news/release_20210420-02.html
[9] www.kumamoto-u.ac.jp/whatsnew/seimei/20210420
[10] www.eurekalert.org/news-releases/638770?language=japanese
[11] bio.nikkeibp.co.jp/atcl/news/p1/24/03/12/11681/
[12] patents.google.com/patent/JP2019522997A/ja
[13] nanoporetech.com/sites/default/files/s3/literature/Workflows/Japanese%20PDF/Methylation.pdf
[14] www.jstage.jst.go.jp/article/ojjscn/41/6/41_411/_pdf/-char/ja
[15] www.ncc.go.jp/jp/ri/division/molecular_modification_and_cancer_biology/project/010/20170908154407.html
[16] www.natureasia.com/ja-jp/nature/pr-highlights/11520
[17] www.kyoto-u.ac.jp/ja/research-news/2023-12-27-2
[18] dm-rg.net/news/397ad437-69c8-4902-a494-902732f26c7e
[19] www.natureasia.com/ja-jp/reviews/highlight/15242
将来的な研究の方向性
メチル化研究は、遺伝子の発現調節、疾患の発生機序、および治療法の開発において重要な役割を果たしています。以下に、将来的な研究の方向性を概説します。
1. 疾患関連のメチル化パターンの解明
疾患の発生と進行におけるメチル化の役割を解明する研究が進行中です。特にがん、神経変性疾患、自己免疫疾患などの複雑な疾患において、異常なメチル化パターンが疾患の発生や進行にどのように関与しているかを明らかにすることが重要です[1][3][16]。
2. エピジェネティック治療薬の開発
メチル化を標的とした新しい治療薬の開発が進められています。特に、がん治療においては、メチル化異常を正常化することで、がん細胞の増殖を抑制するアプローチが研究されています。UHRF1などのメチル化因子を標的とした阻害剤の開発が進行中であり、これによりがん細胞の異常増殖を抑制する可能性があります[16]。
3. メチル化プロファイリング技術の進化
次世代シーケンシング技術(NGS)やマイクロアレイを用いたメチル化プロファイリング技術の進化が、疾患診断や治療のパーソナライズ化に貢献しています。これらの技術により、個々の患者のメチル化パターンを詳細に解析し、より効果的な治療戦略を立てることが可能になります[11]。
4. 環境因子とメチル化の相互作用
環境因子がメチル化に与える影響についての研究も進んでいます。栄養、ストレス、化学物質などの環境因子がメチル化パターンにどのように影響を与えるかを理解することで、疾患予防や健康維持に役立つ知見が得られることが期待されます[3][9]。
5. トランスポゾンとメチル化
トランスポゾンの活動を制御するメチル化機構の研究も注目されています。特に、植物などのモデル生物を用いた研究から、トランスポゾンの活動を抑制するメチル化の機構が明らかになりつつあります。これにより、遺伝的安定性の維持や進化の過程での役割が理解されることが期待されます[10]。
これらの研究方向性は、メチル化が生物学的プロセスおよび疾患の理解において中心的な役割を果たすことを示しており、今後の生命科学の発展に大きく寄与することが期待されます。
- 参考文献・出典
-
[1] www.amed.go.jp/news/seika/kenkyu/20220523.html
[2] www.riken.jp/press/2023/20230829_2/index.html
[3] www.jstage.jst.go.jp/article/jsbibr/2/1/2_jsbibr.2021.8/_html/-char/ja
[4] www.mhlw.go.jp/stf/newpage_34429.html
[5] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2020.920431/data/index.html
[6] www.riken.jp/press/2022/20220621_1/index.html
[7] www.hsrc.hiroshima-u.ac.jp/research/result/42.html
[8] www.activemotif.jp/blog-rna-rloops
[9] www.jstage.jst.go.jp/article/arerugi/69/10/69_968/_pdf
[10] www.hokudai.ac.jp/news/2022/12/rnadna.html
[11] jp.illumina.com/techniques/multiomics/epigenetics/dna-methylation-analysis.html
[12] www.titech.ac.jp/news/2017/038440
[13] www.mie-u.ac.jp/R-navi/release/cat775/post-75.html
[14] www.kyoto-u.ac.jp/ja/research-news/2022-11-10
[15] www.jst.go.jp/pr/announce/20210528-2/index.html
[16] www.jstage.jst.go.jp/article/jcrsj/63/4/63_257/_pdf