目次
免疫沈降法 immunoprecipitationとは?
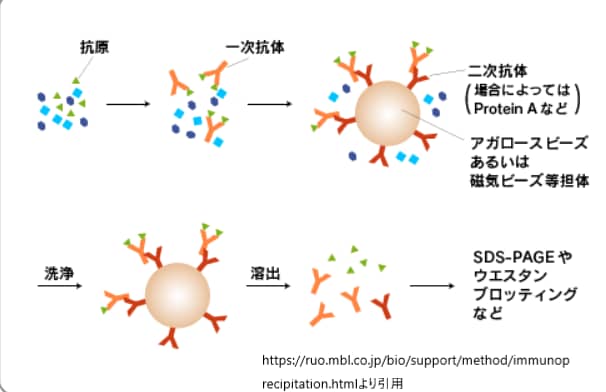
免疫沈降法は、抗原に抗体がくっつくという性質(親和性といいます)を利用して、試料溶液から特定の抗原だけを特異的に取り出す方法です。
このため、抗体を選ぶときには以下の条件に気を付ける必要があります。
- 当該抗原への特異性が高い、つまりほかの抗原に対してくっつかない
- 当該抗原に対して結合する力が強い、つまり結合してから取り出す過程で外れない
合成してペプチドなどの人工的に作成した抗体は結合する力が弱かったり結合しない場合がありますので、理論的にはうまくいくはずなのにも天然化合物とくっつかないということがあります。
免疫沈降法(Immunoprecipitation, IP)は、特定の抗原を認識する抗体を用いて、標的抗原や抗原に親和性を示す分子を混合物中から選択的に分離し、分析する免疫化学的手法です[2]. この技術は、タンパク質の発現、翻訳後修飾、タンパク質間相互作用などを検出するプロテオミクスのワークフローで広く利用されています[5].
IPは、伝統的なカラムアフィニティクロマトグラフィーを適応させた方法で開発されましたが、カラムを使用する代わりに、微量のレジン(通常はビーズ状のアガロース)をマイクロ遠心チューブ内で使用し、バッチ処理方式でインキュベーションを行います[1]. 各ステップでは、ビーズに溶液を加えて混合し、インキュベートした後、遠心分離または磁気を用いてビーズを回収し、溶液を除去します[1].
IPには直接法と間接法の2つのアプローチがあります。直接法では、ビーズに抗体を予め結合させ、その後ターゲットを含む溶液を加えて抗体とターゲットの複合体を形成させます[2]. 間接法では、自由な抗体を溶液中でターゲットと反応させた後、ビーズを用いて複合体を回収します[2].
溶出には変性条件と非変性条件があり、変性条件ではタンパク質の立体構造を破壊して溶出させるのに対し、非変性条件ではタンパク質の立体構造を保ったまま溶出させます[2]. また、タグ付きタンパク質を用いることで、利用可能な抗体がない場合でも免疫沈降を行うことができます[1].
共免疫沈降法(Co-IP)は、IPを応用した技術で、タンパク質間相互作用の研究に用いられます。Co-IPでは、タンパク質複合体を回収し、その相互作用を分析します[3][8].
IP実験を成功させるためには、適切な抗体の選択、ライセートの調製、非特異結合の低減など、いくつかの重要なポイントがあります[4][5]. また、免疫沈降後の解析には、SDS-PAGEやウェスタンブロッティングなどの方法が一般的に用いられます[6][7].
- 参照・引用
-
[1] www.thermofisher.com/us/en/home/life-science/protein-biology/protein-biology-learning-center/protein-biology-resource-library/pierce-protein-methods/immunoprecipitation-ip.html
[2] www.veritastk.co.jp/sciencelibrary/learning/dynabeads-ip-learning.html
[3] www.veritastk.co.jp/sciencelibrary/learning/co-ip-protocol.html
[4] www.ptglab.co.jp/news/blog/8-top-tips-for-immunoprecipitation/
[5] www.thermofisher.com/blog/learning-at-the-bench/immunoprecipitation/
[6] ruo.mbl.co.jp/bio/support/method/immunoprecipitation.html
[7] www.rikelab.jp/post/5389.html
[8] ruo.mbl.co.jp/bio/support/method/co-immunoprecipitation.html
免疫沈降法(Immunoprecipitation, IP)の原理とは?
免疫沈降法(Immunoprecipitation, IP)は、特定の抗原を認識する抗体を用いて、その抗原を含む複合体を試料から選択的に分離し、精製する生化学的手法です。この方法は、抗原と抗体が特異的に結合する性質を利用しています[8].
● 免疫沈降法の基本的な原理
1. 抗原-抗体の結合: 最初に、目的の抗原を含む溶液に特異的な抗体を添加します。この抗体は、特定の抗原に対して高い親和性を持ち、抗原と結合して抗原-抗体複合体を形成します[2].
2. 複合体の固定化: 形成された抗原-抗体複合体は、通常、プロテインAやプロテインGなどが固定化されたビーズによって捕捉されます。これらのプロテインは、多くの哺乳類の抗体のFc領域に結合する能力を持っており、複合体をビーズに固定化します[2].
3. 洗浄: 固定化された複合体は、非特異的に結合した他のタンパク質や不純物を除去するために洗浄されます。これにより、特異的な抗原-抗体複合体のみがビーズ上に残ります[2].
4. 抗原の溶出: 最後に、特定の条件下(例えば、酸性条件やSDSを用いた条件)で抗原をビーズから溶出します。溶出された抗原は、さらにSDS-PAGEやウェスタンブロットなどの方法で分析されます[2][6].
● 免疫沈降法の応用
免疫沈降法は、タンパク質の発現、修飾、タンパク質間相互作用の研究など、多岐にわたる生物学的研究に利用されます。また、直接法と間接法の二つのアプローチがあり、直接法では抗体が先にビーズに結合され、その後に抗原含有サンプルが加えられるのに対し、間接法では抗原と抗体が先に反応させた後でビーズが加えられます[1].
このように、免疫沈降法はその特異性と柔軟性から、生化学研究において非常に重要な技術となっています[1][2].
- 参照・引用
-
[1] www.veritastk.co.jp/sciencelibrary/learning/dynabeads-ip-learning.html
[2] ruo.mbl.co.jp/bio/support/method/immunoprecipitation.html
[6] www.thermofisher.com/us/en/home/life-science/protein-biology/protein-biology-learning-center/protein-biology-resource-library/pierce-protein-methods/immunoprecipitation-ip.html
免疫沈降法(Immunoprecipitation, IP)の利点
免疫沈降法(Immunoprecipitation, IP)の利点は、特定の抗原を選択的に分離し、精製することができる点にあります。この技術は、タンパク質の発現、翻訳後修飾、タンパク質間相互作用の検討、細胞や組織中における抗原の相対的存在量や化学量論的分布の測定など、多岐にわたる生物学的研究に応用されています.
また、免疫沈降法には直接法と間接法の2つのアプローチがあり、それぞれの方法によって異なる利点があります。直接法では、一次抗体の抗体価が高く、標的抗原が豊富である場合や、一次抗体を結合済みのビーズをストックできる場合に適しています。一方、間接法は一次抗体の抗体価が低い場合や、標的抗原が少ない場合に適しています[1].
さらに、Dynabeadsなどの磁性ビーズを使用することで、非特異的結合が少なく、ブロッキングや事前精製が不要であり、洗浄中の取扱いが簡単で、チューブ内のビーズが見えるという利点があります[2]. また、磁気ビーズはセファロースやアガロースよりも抗体の使用量を大幅に削減しつつ、収量はより高く、非特異的バックグラウンドを下げることができるとされています[8].
免疫沈降法は、SDS-PAGEやウェスタンブロットなどと組み合わせた形で実験を行うことができ、目的タンパク質のみに焦点をあてて、その機能を容易に解析することができるという利点もあります[7].
免疫沈降法の欠点
免疫沈降法(Immunoprecipitation, IP)は多くの生物学的研究で用いられる有用な技術ですが、いくつかの欠点も存在します。これらの欠点を理解することは、実験の設計やトラブルシューティングにおいて重要です。
● 免疫沈降法の主な欠点
1. 非特異的結合:
免疫沈降法では、目的の抗原-抗体複合体以外にも、非特異的なタンパク質が抗体やビーズに結合することがあります。これにより、背景ノイズが高くなり、データの解釈が困難になることがあります[8].
2. 抗体の品質と特異性:
高品質で特異的な抗体の選択は、成功する免疫沈降実験には不可欠です。不適切な抗体を使用すると、目的のタンパク質を正確に捕捉できないか、または非特異的なタンパク質が多く結合してしまう可能性があります[8].
3. 抗体の重鎖と軽鎖の干渉:
免疫沈降後の解析段階(特にウェスタンブロット)で、抗体の重鎖や軽鎖がタンパク質のバンドと重なることがあり、解析を複雑にします[7].
4. サンプルの損失:
免疫沈降プロセス中にタンパク質が失われることがあり、特に低濃度のタンパク質ではその影響が顕著です。これは、特に希少なサンプルや低発現のタンパク質を扱う場合に問題となります[8].
5. 時間とリソースの要求:
免疫沈降法は比較的時間がかかるプロセスであり、特に複数の洗浄ステップやインキュベーションが必要です。また、高品質の抗体や特定の試薬が必要であり、コストがかかる場合があります[8].
これらの欠点に対処するために、非特異的結合を減少させる洗浄条件の最適化、高品質で特異的な抗体の選定、抗体の重鎖や軽鎖の影響を避けるための特別な試薬の使用などが推奨されます[7][8].
免疫沈降法 immunoprecipitationの手順
1.抗原を含む溶液に抗体を添加する
2.溶液中で抗原抗体複合物ができる
3.ビーズにこの抗原抗体複合物を吸着させる。
4.ビーズ洗浄し、Sodium Dodecyl Sulfateなどで処理してビーズから抗原を分離する
免疫沈降法とウエスタンブロット
免疫沈降法(Immunoprecipitation, IP)においてウェスタンブロット(Western Blot, WB)は、IPで分離したタンパク質の同定や量的分析を行うための重要な手法です。IPによって特定の抗原タンパク質を抗体と共に沈降させた後、SDS-PAGEを用いてタンパク質を分離し、その後にウェスタンブロットを行ってタンパク質を検出します[1][7].
ウェスタンブロットにおいては、IPで回収したサンプルに含まれるタンパク質をゲル上で分離し、その後に転写してメンブレンに移すことで、特定のタンパク質を検出することができます。しかし、このプロセスにはいくつかの注意点があります。特に、IPで使用した抗体(IP抗体)がウェスタンブロットでの検出に干渉することがあります。IP抗体の重鎖(H鎖)と軽鎖(L鎖)がメンブレン上で検出されると、これらが目的タンパク質のバンドと重なってしまい、正確な検出を困難にすることがあります[4][5].
この問題を解決するために、特定の製品が開発されています。例えば、Clean-Blot IP Detection Reagentは変性していない抗体とは反応しますが、変性した抗体とは反応しないため、IP抗体のバンドを検出せずに目的タンパク質のみを特異的に検出することができます[4]. また、VeriBlot for IPやL鎖特異的二次抗体などは、還元されていないイムノグロブリンとのみ反応し、H鎖やL鎖単独の分子とは反応しないため、目的タンパク質のバンドのみを明確に検出することが可能です[5].
ウェスタンブロットにおいては、適切なコントロールの使用や抗体との親和性の確認(プロテインA/Gの選択)、さらには検出試薬の選択など、実験計画において考慮すべき多くの要素があります[6]. これらの注意点を適切に管理することで、免疫沈降法によって分離したタンパク質のウェスタンブロットによる検出が成功し、正確なデータを得ることができます。
- 参照・引用
-
[4] www.thermofisher.com/blog/learning-at-the-bench/clean-blot-ip-detection-reagent/
[5] www.abcam.co.jp/secondary-antibodies/secondary-antibodies-optimized-for-co-immunoprecipitation-western-blotting-1
[6] pdbu-support.bio-rad.co.jp/techbrief/bulletins202008.html
[7] www.cellsignal.jp/learn-and-support/protocols/protocol-ip-western
免疫沈降法と共免疫沈降法の違いは何ですか?
免疫沈降法(Immunoprecipitation, IP)と共免疫沈降法(Co-immunoprecipitation, Co-IP)は、両者ともに特定のタンパク質やタンパク質複合体を試料から分離するために抗体を利用する技術ですが、その目的と応用において異なります。
● 免疫沈降法 (IP)
免疫沈降法は、特定の抗原(タンパク質)を標的とする抗体を使用して、その抗原を細胞溶解液やその他の複雑な生物学的混合物から選択的に分離する技術です。この方法は、特定のタンパク質の存在、量、状態(例えば、修飾後の状態)を分析するのに用いられます。抗体がその抗原に特異的に結合し、その複合体をビーズや他の固相サポートに結合させて分離します[3].
● 共免疫沈降法 (Co-IP)
共免疫沈降法は、免疫沈降法を基にしており、タンパク質間の相互作用や複合体を研究するために使用されます。この技術では、ターゲットタンパク質だけでなく、それが自然に結合している相方のタンパク質も一緒に沈降させます。つまり、あるタンパク質に対する抗体を使用してそのタンパク質だけでなく、そのタンパク質が結合している他のタンパク質も同時に捕捉し、タンパク質間の相互作用を解析することができます[1][4].
● 主な違い
– 目的: IPは単一のタンパク質の研究に焦点を当てていますが、Co-IPはタンパク質間の相互作用や複合体の研究に利用されます。
– 複合体の捕捉: IPでは特定のタンパク質のみが対象ですが、Co-IPではターゲットタンパク質とそれに結合する他のタンパク質も一緒に捕捉されます。
共免疫沈降法は、タンパク質の相互作用や生物学的なネットワークを理解する上で非常に有用な手法であり、タンパク質の機能や細胞内での役割を解明するのに役立ちます[1][4].








