目次
開始コドンとは?
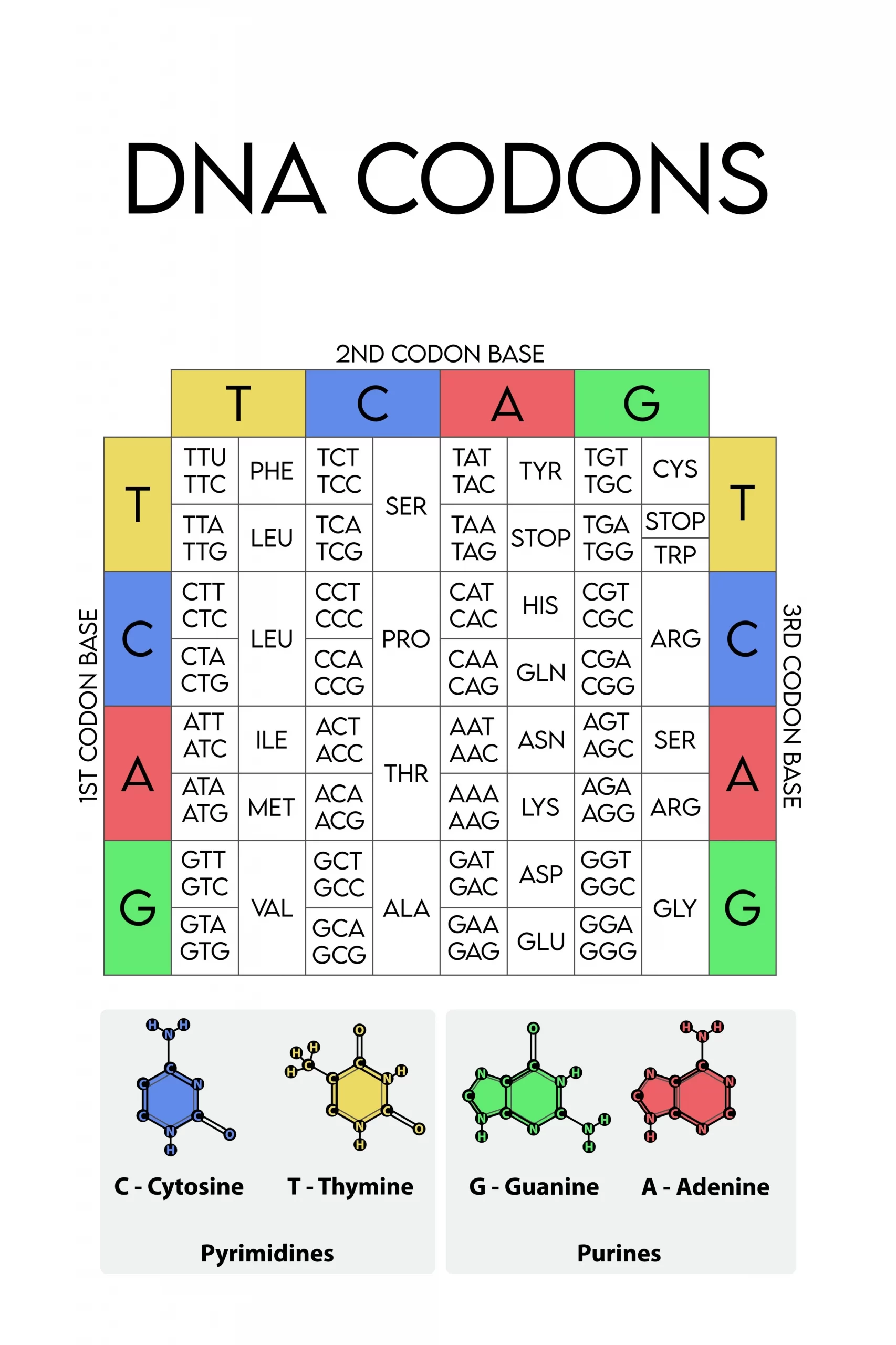
開始コドンは、mRNA上でタンパク質合成(翻訳)が開始される信号として機能する特定の塩基配列です。このコドンは、リボソームがmRNAを読み始める場所を示し、正確な位置で翻訳プロセスを開始させます。一方、タンパク質合成を終了させる停止コドンは3種類(UAA, UAG, UGA)が存在します。
覚え方:8月から始まる Aug 開始
うわーうあぐうがーで終わる UAA UAG UGA 終止
● 主要な特徴
– 一般的な開始コドン: ほとんどの真核生物と原核生物では、開始コドンは「AUG」という配列です。このコドンはメチオニン(真核生物)またはN-ホルミルメチオニン(多くの原核生物)のアミノ酸に対応します。
– 役割: 開始コドンは、リボソームがタンパク質合成を始めるための正確な場所を指定します。また、翻訳の方向性も確立します。
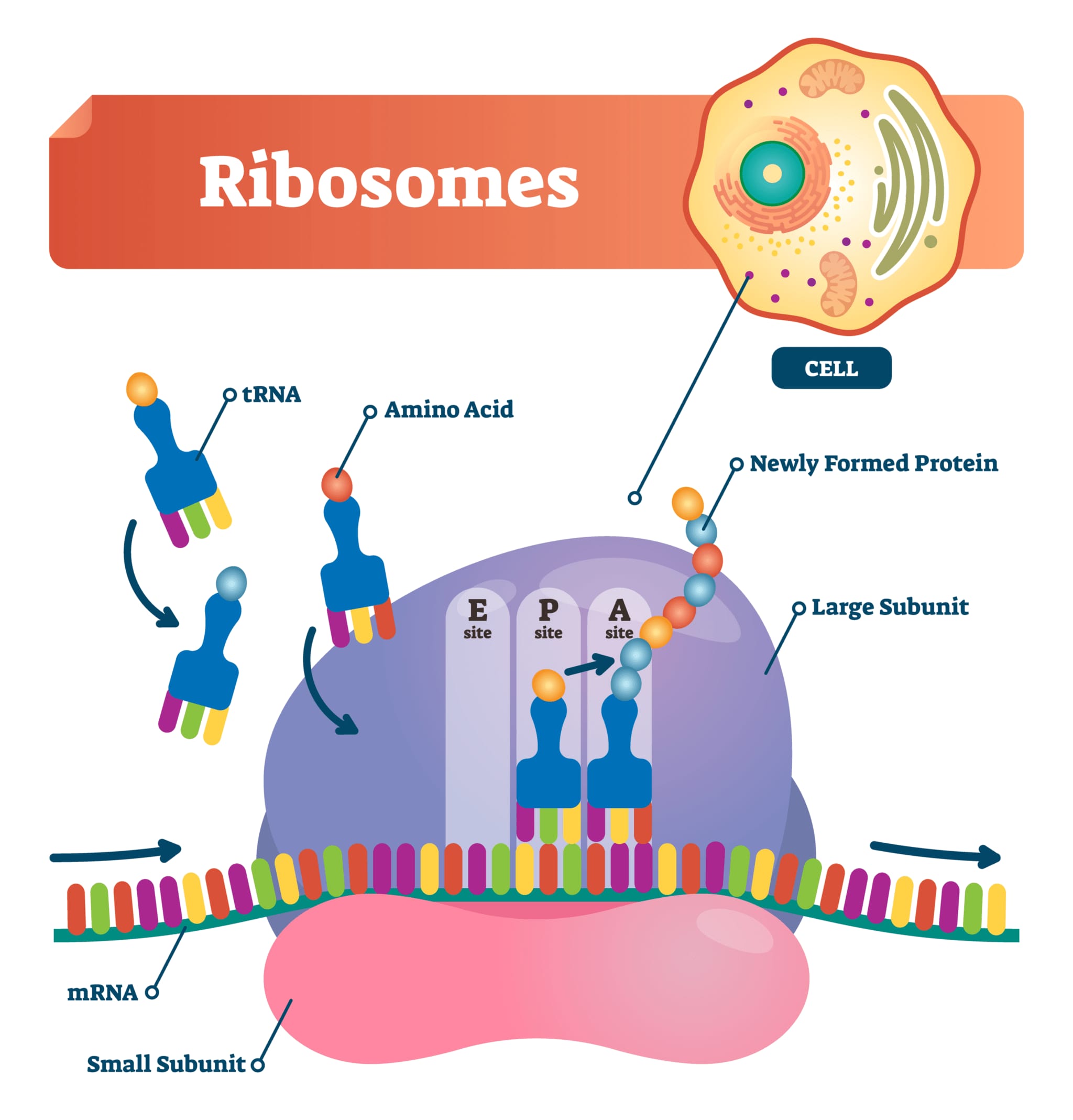
– 翻訳開始過程: 翻訳の開始には、開始コドンを認識する特別なtRNAが関与します。真核生物では、このtRNAはメチオニンを運び、原核生物ではN-ホルミルメチオニンを運びます。リボソームの小サブユニットがまずmRNAと結合し、開始コドンを見つけた後、大サブユニットと結合してタンパク質合成が始まります。
● 開始コドンのバリエーション
真核生物のゲノムでは、AUGが標準的な開始コドンですが、特定の状況下や特定の遺伝子で非標準コドン(例えばCTGやGTGなど)が開始コドンとして機能することも知られています。これらの例外は一般的ではありませんが、遺伝的制御の多様性を示しています。
コドンは、mRNAの三つの連続する塩基で構成され、特定のアミノ酸を指示します。遺伝暗号表には、64個の異なるコドンが存在し、これらは4つの核酸塩基(アデニン[A]、シトシン[C]、グアニン[G]、ウラシル[U])のすべての可能な三重組み合わせから成ります。
● 翻訳開始の制御
開始コドンのコンテキスト(隣接する塩基配列)は、翻訳の効率にも影響を与えることが知られています。特定の5’非翻訳領域(5′ UTR)の構造が複雑である場合や、特定の塩基配列が上流または下流に存在する場合、リボソームの結合や翻訳開始の効率が変化することがあります。
総じて、開始コドンはタンパク質の合成を始めるための基本的な要素であり、遺伝子の表現調節において中心的な役割を担っています。このプロセスの理解は、分子生物学や遺伝学、生物工学などの分野において非常に重要です。
開始コドンはどうやって認識されるのですか
開始コドンがどのように認識されるかは、生物の細胞内でのタンパク質合成(翻訳)の初期段階で非常に重要です。主に真核生物と原核生物でプロセスが異なることがありますが、基本的な概念は似ています。ここでは主に真核生物のプロセスを説明します。
● 真核生物での開始コドンの認識
1. リボソームの小サブユニットとメチオニンtRNAの結合:
真核生物では、まずリボソームの40S小サブユニットが特殊なメチオニンを運ぶtRNA(Met-tRNA)と結合します。このtRNAは翻訳開始時にのみ使われ、メチオニンを運ぶために用いられます。
2. スキャンニングプロセス:
リボソームの小サブユニットとMet-tRNA、さらには複数の翻訳開始因子(eIFs)が結合した複合体が、mRNAの5’末端からスタートし、3’方向へとスキャンを開始します。このスキャンは、適切なAUGコドン(開始コドン)を見つけるまで続けられます。
3. 開始コドンの認識:
スキャン中にリボソームがAUGコドンに到達すると、翻訳開始因子とMet-tRNAのアンチコドンがAUGコドンと塩基対を形成し、認識します。この瞬間、翻訳の開始が決定されます。
4. リボソームの大サブユニットの結合:
開始コドンが認識された後、リボソームの60S大サブユニットが結合し、小サブユニットと合体します。これによって完全な80Sリボソームが形成され、アミノ酸の連鎖反応が始まります。
● 原核生物での開始コドンの認識
原核生物では、リボソームが直接開始コドンを認識するわけではなく、mRNA上のシャイン・ダルガルノ配列(リボソーム結合部位)とリボソームRNAの特定の領域との相補的な塩基対形成により、開始コドンの位置が認識されます。このプロセスにより、リボソームは正確にAUG開始コドンの位置を特定し、翻訳を開始します。
これらのプロセスは、タンパク質の正確な合成を保証し、生命活動の基本的なメカニズムとして機能します。
転写開始点と開始コドンの違い
転写開始点と開始コドンは遺伝子発現のプロセスにおいて重要な役割を果たしますが、それぞれの機能と位置が異なります。以下に、これら二つの用語の違いを明確に説明します。
● 転写開始点(Transcription Start Site, TSS)
転写開始点は、DNA上でRNAポリメラーゼがRNAの合成を開始する特定の位置を指します。この点は、遺伝子のプロモーター領域に位置しており、RNAポリメラーゼがDNAをRNAに転写を開始する場所です。転写開始点は、遺伝子の調節において中心的な役割を果たし、転写の効率やタイミングを決定する要因の一つとなります。
● 開始コドン(Start Codon)
開始コドンは、mRNA上でタンパク質合成(翻訳)が開始する特定のコドンを指します。ほとんどの真核生物や原核生物で、開始コドンは「AUG」という塩基配列であり、このコドンはアミノ酸メチオニンをコードします。開始コドンは、リボソームがmRNAを認識し、タンパク質合成を開始するための信号として機能します。
● 違いの要点
– 位置と関連性:転写開始点はDNA上にあり、RNAの転写が開始される場所です。一方、開始コドンはmRNA上にあり、タンパク質の翻訳が開始される場所です。
– 機能:転写開始点は転写を制御するために重要であり、遺伝子の発現を開始する役割を持ちます。開始コドンは翻訳の開始点であり、タンパク質合成の初期段階を指示します。
– 生化学的プロセス:転写開始点は転写のプロセスに関与し、RNAポリメラーゼが活動する部位です。開始コドンは翻訳のプロセスに関与し、リボソームがタンパク質合成を始める信号です。
このように、転写開始点と開始コドンは、遺伝子の発現における異なる段階を代表し、その機能と位置がそれぞれ異なります。これらを正確に理解することが、遺伝学や分子生物学の基本的な知識となります。
開始コドンとプロモーターの違い
開始コドンとプロモーターは遺伝子発現において非常に重要な役割を果たしますが、それぞれの機能と位置が異なります。ここでは、これら二つの用語の基本的な違いを明確に説明します。
● 開始コドン(Start Codon)
開始コドンは、mRNAの特定の塩基配列(通常はAUG)であり、タンパク質の合成が開始される場所を指示します。このコドンは、リボソームがタンパク質合成を開始する信号として機能し、最初に翻訳されるアミノ酸(通常はメチオニン)を指定します。開始コドンは、mRNA上で直接的にタンパク質合成の開始を指示する役割を持っています。
● プロモーター(Promoter)
プロモーターは、DNA上に位置する特定の領域で、遺伝子の転写を開始するための主要な調節領域です。プロモーターはRNAポリメラーゼやその他の転写因子が結合する場所を提供し、これによって遺伝子の転写が始まります。プロモーターの位置や構造は遺伝子の転写がどの程度活性化されるかを決定する重要な要因です。
● 違いの要点
– 位置と関連性:プロモーターはDNA上にあり、遺伝子の転写を開始するための調節領域です。開始コドンはmRNA上にあり、タンパク質の翻訳が開始される場所です。
– 機能:プロモーターは遺伝子の転写の開始と調節を担当し、RNAポリメラーゼの結合と活動を促します。開始コドンはタンパク質合成(翻訳)の開始点として機能し、リボソームがその位置でタンパク質の合成を始めることを指示します。
– 生化学的プロセス:プロモーターは転写のプロセスに関与し、遺伝子からmRNAが合成される過程で中心的な役割を果たします。開始コドンは翻訳のプロセスに関与し、mRNAからタンパク質が合成される過程で中心的な役割を果たします。
このように、プロモーターと開始コドンは、遺伝子発現の異なる段階において特有の機能を持ち、それぞれが遺伝子の転写と翻訳の調節に不可欠です。それぞれの理解は遺伝学や分子生物学の基本的な知識となります。
開始コドン(通常はAUG)で指示されるメチオニンの除去
開始コドン(通常はAUG)で指示されるメチオニンの除去は、タンパク質合成の後段階で発生するプロセスです。このメチオニンは、タンパク質の最初のアミノ酸として翻訳されますが、多くの場合、タンパク質が成熟する過程で除去されます。この除去プロセスは、特に真核生物において重要であり、次のように行われます。
● メチオニンの除去のプロセス
1. タンパク質合成: mRNA上のAUGコドンにより、タンパク質合成が開始され、最初のアミノ酸としてメチオニンが組み込まれます。原核生物では、このメチオニンはフォルミルメチオニン(fMet)として修飾されることがあります。
2. メチオニンアミノペプチダーゼの作用: 翻訳されたポリペプチドチェーンからメチオニンを切り離すために、メチオニンアミノペプチダーゼ(MAP)という酵素が働きます。この酵素は、N末端に位置するメチオニンが特定の条件を満たす場合(例えば、次のアミノ酸が小さい側鎖を持つ場合など)に活性化され、メチオニンを除去します。
3. タンパク質の成熟と機能化: メチオニンが除去されると、タンパク質はさらに折りたたみや他の修飾を受けることがあります。これにより、タンパク質はその最終的な形状と機能を獲得します。
● なぜメチオニンが除去されるのか?
メチオニンの除去は、タンパク質の機能にとってしばしば重要です。タンパク質のN末端のアミノ酸は、タンパク質の安定性、局在、活性に影響を与えることが知られています。また、特定のシグナル配列やタグがN末端に存在する場合、その機能を発揮する前に除去する必要があります。
このように、メチオニンの除去はタンパク質の正確な成熟と機能発現のために必要なステップであり、細胞内での正確なタンパク質処理の一環として行われます。
開始コドンがメチオニンな理由とは?
メチオニンが開始コドン(AUG)によってコードされる理由は、生物学的進化の過程で確立されたコンベンションに基づいています。開始コドンとしてのAUGがメチオニンをコードすることには、いくつかの具体的な理由が考えられます。
1. 統一性と単純さ
遺伝子の翻訳は、AUGコドンで始まることが一般的です。この単純で一貫したシステムは、生物がタンパク質合成を効率的に開始できるようにするための進化的適応と考えられます。AUGがメチオニンをコードすることにより、リボソームとその関連因子は翻訳開始のプロセスを容易に識別し、適切に調整することができます。
2. メチオニンの特性
メチオニンは硫黄を含むアミノ酸であり、比較的小さな側鎖を持ちますが、疎水性があります。この性質により、タンパク質の成熟と折りたたみにおいて重要な役割を果たします。また、タンパク質の生合成が開始された後、特定の条件下ではメチオニンが切り離されることもありますが、これはタンパク質が最終的な機能的形態を取るための必要な過程です。
3. 翻訳開始のシグナル
メチオニンは、特に真核生物では翻訳開始の信号として機能します。翻訳を開始するためには、特定のメチオニルtRNAが開始コドンAUGとペアリングし、リボソームのPサイトに配置されます。このプロセスは、翻訳の効率性と正確性を確保するための重要なステップです。
4. 進化的背景
AUGがメチオニンをコードするようになった具体的な進化的理由は完全には解明されていませんが、初期の生物におけるタンパク質合成のメカニズムが、より複雑な生命形態への進化において効率的であった可能性があります。つまり、生物学的プロセスの効率化とエネルギーコストの最適化が、メチオニンの使用を推進した可能性があります。
メチオニンがタンパク質の翻訳開始のためのアミノ酸として選ばれたのは、その独特な化学的性質と、生物の進化において形成された翻訳機構の要求に最適だったからであると考えられます。
原核生物の開始コドン
原核生物の開始コドンに関しても、真核生物と同様に、最も一般的な開始コドンはAUGです。しかし、原核生物においてAUGコドンがコードするアミノ酸は、真核生物での通常のメチオニンとは異なり、N-ホルミルメチオニン(fMet)と呼ばれる特別な形態のメチオニンです。この違いは原核生物と真核生物のタンパク質合成プロセスにおける独特の適応を反映しています。
● N-ホルミルメチオニン(fMet)の役割
1. 転写開始信号: N-ホルミルメチオニンは原核生物のタンパク質合成の初期段階で使用される特殊なアミノ酸であり、タンパク質合成の効率を高めるために使用されます。タンパク質合成が開始されると、N-ホルミル基が付加されたメチオニンが最初のアミノ酸として取り込まれます。
2. 翻訳開始の特異性: N-ホルミルメチオニンは特定のtRNA、すなわちtRNA^fMetによって運ばれ、これが直接リボソームのPサイトに配置されることで翻訳が開始されます。この特異性は、正確な翻訳開始位置の識別と効率的なタンパク質合成を保証する重要な要素です。
3. 微生物の生存戦略: 微生物は環境条件が厳しい場所で生存するために、効率的なタンパク質合成メカニズムを進化させました。N-ホルミルメチオニンの使用は、このような厳しい環境下での迅速なタンパク質合成を可能にし、微生物が環境ストレスに迅速に対応できるように支援します。
● 原核生物における他の開始コドン
原核生物ではAUGが最も一般的な開始コドンであるものの、GUGやUUGなどの他のコドンが開始コドンとして機能することもあります。これらのコドンは、特定の遺伝子や特定の環境条件下で、効率的なタンパク質合成のために利用されることがあります。
原核生物における開始コドンとそのアミノ酸の特性を理解することは、微生物の生理学と遺伝子発現の制御機構を解明する上で非常に重要です。また、この知識は抗生物質の開発や微生物由来のバイオテクノロジー製品の設計にも応用されています。








