可逆反応とは
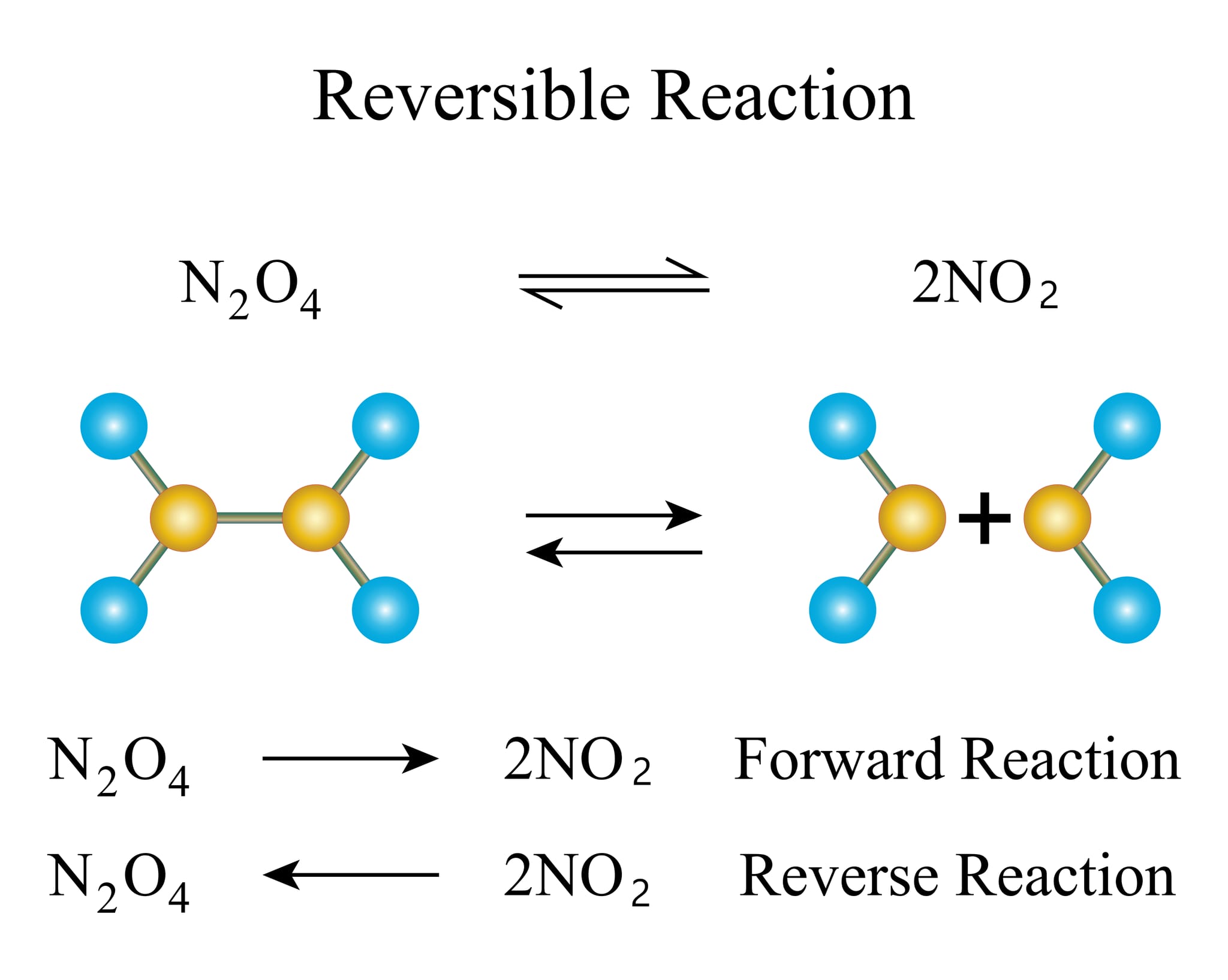
可逆反応とは、反応物が生成物に変化し、その生成物がまた反応物に戻ることができる化学反応のことを指します。このタイプの反応では、反応が前進する(反応物から生成物へ)だけでなく、逆反応も同時に進行するため、ある条件下では化学平衡に達します。化学平衡とは、反応物と生成物の変換速度が等しくなり、その濃度が時間とともに変わらなくなる状態を指します。
●可逆反応の特徴
1.両方向性:
可逆反応は、前進反応と逆反応の両方が可能です。これは反応が進むにつれて、生成物が再び反応物に変わることがあることを意味します。
2.動的平衡:
可逆反応では、一定の条件下で反応物と生成物の変換速度が等しくなるため、化学平衡に達します。この状態では、マクロな観点から見ると反応の変化が停止して見えますが、ミクロな観点では両方の反応が絶えず進行しています。
3.条件依存性:
可逆反応の進行度は温度、圧力、濃度などの条件によって変わります。ルシャトリエの原理によれば、これらの条件を変えることで化学平衡の位置が変わり、反応物や生成物の比率が変動します。
4.エネルギー変化:
可逆反応では、エネルギーが放出される反応(発熱反応)とエネルギーを必要とする反応(吸熱反応)が同時に進行します。
可逆反応の例
可逆反応の一例は、水の電離です。
H2O ⇌ H+ + OH−
この反応では、水がプロトン(H+)と水酸化物イオン(OH–)に分離し、これらが再び水を形成することができます。
可逆反応は化学だけでなく、生物学や工業プロセスにおいても非常に重要です。例えば、生体内での多くの代謝反応や、化学工業における合成プロセスなど、様々な現象が可逆反応の原理に基づいています。
可逆反応と不可逆反応の見分け方
可逆反応と不可逆反応を見分けるためには、反応の性質や進行の仕方を理解することが重要です。ここでは、可逆反応と不可逆反応を見分ける方法についていくつかのポイントを挙げます。
● 1. 反応の平衡状態
– 可逆反応:
– 可逆反応は化学平衡に達する可能性があります。つまり、反応が進行すると同時に逆反応も進行し、一定の条件下で反応物と生成物の濃度が一定になる点が存在します。
– 平衡定数 \(K\) の値が有限の値(0より大きく、無限大ではない)を持ちます。
– 不可逆反応:
– 不可逆反応は一方向に進行し、完成すると逆反応は起こりません。
– 平衡定数 \(K\) が実質的に無限大である場合、その反応は事実上不可逆です。
● 2. 反応速度と反応完了
– 可逆反応:
– 可逆反応は比較的遅いことがあり、時間をかけて平衡状態に達することが一般的です。
– 平衡に達した後も、ミクロなレベルでは前進反応と逆反応が継続して発生しています。
– 不可逆反応:
– 不可逆反応は通常、速く進行し、一度生成物が形成されると、もとの反応物に戻ることはありません。
– 反応が完了すると、生成物のみが系に残ります。
● 3. 熱力学的特徴
– 可逆反応:
– エンタルピー変化(ΔH)やギブズ自由エネルギー変化(ΔG)が比較的小さい値を示します。
– 不可逆反応:
– エンタルピー変化やギブズ自由エネルギー変化が大きく、反応が進むときに大量のエネルギーが放出されることが多いです。
● 4. 実験的観察
– 可逆反応:
– 実験中に反応物と生成物が同時に存在することを観察できる場合、反応は可逆である可能性が高いです。
– 不可逆反応:
– 生成物のみが明確に検出され、反応物が完全に消費される場合、反応は不可逆です。
これらの特徴を理解することで、実験データや理論的な情報から反応が可逆か不可逆かを見分けることができます。実際の判断では、これらの指標を総合的に考慮することが重要です。
可逆反応が平衡状態に達するとは、反応が前進(反応物から生成物への変換)と逆反応(生成物から反応物への変換)の間で動的なバランスを達成した状態を指します。この状態では、反応物と生成物の変換速度が等しくなり、それぞれの濃度が一定に保たれるようになります。
● 平衡の特徴
1. 動的な状態:
平衡は静的な状態ではなく、動的なバランスです。反応物が生成物に変換され続け、同時に生成物も反応物に戻され続けるプロセスが進行しています。マクロスケールで見ると変化がないように見えますが、ミクロスケールでは両方の反応が絶え間なく進行しています。
2. 平衡定数:
平衡に達したとき、反応の平衡定数 (K) は特定の温度で一定です。この定数は、生成物の活性(通常は濃度や圧力)の積を反応物の活性の積で割った値です。
K = 生成物の活性/反応物の活性
平衡定数の値は、反応が生成物の形成をどの程度好むかを示します。Kが大きいほど、生成物が優勢な平衡状態を示し、小さい値では反応物が多く残ることを意味します。
3. ルシャトリエの原理:
外部からの影響(温度、圧力の変化や反応物・生成物の濃度の変化)に対して、平衡はその影響を打ち消す方向にシフトします。たとえば、生成物の一部を取り除くと、反応は生成物を生成する方向にシフトしてその減少を補います。
● 平衡状態の例
– 酢酸とエタノールのエステル化:
CH3COOH + CH3CH2OH ⇌ CH3COOCH2CH3 +H2O
この反応はエステル(エチルアセテート)と水を生成しますが、条件によってはエステルと水から元の酢酸とエタノールが再形成されるため、可逆です。
– アンモニアの合成:
N2(g)+ 3H2(g)⇌ 2NH3
この反応は高圧と高温の下で進行し、ハーバー法で工業的に重要です。生成したアンモニアの一部が反応物に戻るため、平衡状態が重要です。
可逆反応と平衡状態の理解は、化学だけでなく、生物学や工業プロセスの最適化にも非常に重要です。
平衡定数の計算式
可逆反応における平衡定数(K)を求める方法は、化学反応の基本的な理解に基づいています。平衡定数は、反応が平衡に達したときの反応物と生成物の濃度(または圧力)の比率から計算され、反応の進行度を数値的に表します。
● 平衡定数の計算式
平衡定数は以下の一般式で表されます。この式で、反応物と生成物はそれぞれの化学種の濃度を指し、反応の係数はそれぞれの化学種の反応式での係数を使います。

● 平衡定数を求めるステップ
1. 反応式の確認:
可逆反応の化学式を書き出し、各反応物と生成物の化学式と係数を確認します。
2. 平衡時の濃度の特定:
実験から、または問題から与えられた平衡時の各反応物と生成物の濃度(モル濃度)を特定します。
3. 平衡定数の式の設定:
反応式に基づき、平衡定数の計算式を設定します。たとえば、一般的な反応 aA + bB ⇌ cC + dD の場合、平衡定数 K は以下のように表されます:
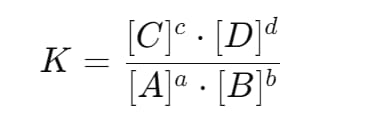
ここで、[A\], [B], [C], および [D] はそれぞれの化学種の平衡濃度を表し、a, b, c, d は化学方程式の係数です。
4. 値の代入と計算:
平衡時の濃度を式に代入し、計算を行います。この値が大きければ大きいほど、反応は生成物の形成を好むことを意味します。
● 例
反応 H2(g)+ I2(g)⇌2HI(g) について平衡定数を求める場合、平衡時にH2、I2およびHIの濃度がそれぞれ 0.2 M、0.2 M、1.2 M だとすると、平衡定数は次のように計算されます:
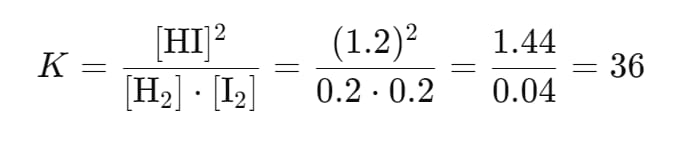
この値は、反応が生成物であるHIを形成する傾向が強いことを示しています。平衡定数の計算は、反応の化学的自然を理解し、予測するための強力なツールです。








