目次
グルタミンリッチドメイン グルタミンリッチ領域 Qドメインとは?
グルタミンリッチ領域(グルタミンリッチドメイン、Qドメイン)は、グルタミン残基を25%以上含んでいる領域のことをいい、代表的な転写活性化ドメインであり、また、転写因子同士の相互作用に必要な部位であるとされている。
ヒトのさまざまなタンパク質において、グルタミン(Q)リッチリピートが過剰に拡大すると、ハンチントン病やいくつかの失調症などの重篤な神経変性疾患を引き起こすことが知られている。しかし、これらのリピートの生理的な役割や、より緩やかなリピートの変化がもたらす結果については、まだ分かっていない。
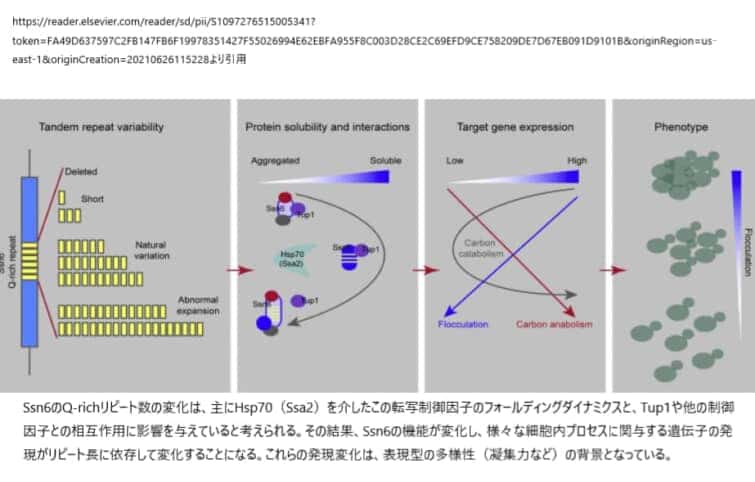
Q-richドメインは真核生物の転写因子に非常に豊富に存在し、機能調節因子として機能していることが明らかとなっている(文献)。酵母の転写制御因子であるSsn6(Cyc8)のリピート数を増加させると、リピート長に依存した標的遺伝子の発現変動が生じ、表現型が直接的に変化する。Ssn6の機能は、リピート数に応じて増加するが、ある閾値を超えると、さらに拡大して凝集する。プロテオミクス解析の結果、Ssn6のリピートは、その溶解性やTup1や他の制御因子との相互作用に影響を与えることが明らかになった。このように、Q-rich repeatは、調節因子の本来の機能を調節するダイナミックな機能ドメインであるが、その一方で、病原性のある繰り返しの拡大というリスクを内在している。
Q-richリピートの役割
タンデムリピートTRはヒトゲノム上の約20%の遺伝子に存在しているが、その機能的意義はまだ完全には解明されていない。
Q-richリピートの数と機能の関係
転写制御因子であるSSN6(CYC8)のリピート数のみが異なるS. cerevisiae株を作成して、自然のリピート変異および自然の範囲外の変異を模倣した研究結果から、SSN6のリピート数の中程度の変動でも、検出可能な機能的変化が生じることがわかった。これらの変化は、Ssn6の溶解性の変化や、主要パートナーであるTup1を含む他のタンパク質との相互作用に起因すると考えられ、Q-richリピートの変異により、TFの安定性や相互作用が変化し、その結果、標的遺伝子の発現やそれらが制御する表現型が変化することが明らかになった。
Q-rich repeatsは、酵母からヒトまでの真核生物のゲノムにおいて、転写調節因子に豊富に含まれている。
興味深いことに、一部のSsn6標的の発現はTR2の長さと直接相関しているが、他の標的の発現は逆の傾向を示している。これは、Ssn6とTup1の複合体が、ある標的に対しては転写抑制因子として働き(Smith and Johnson, 2000)、他の標的に対しては共活性化因子として働くことに起因すると考えられる(Papamichos-Chronakis et al.
これらの観察結果と一致するように、発現がSSN6 TR2数と正の相関を示す37個の遺伝子(グループ1)のうち、22個(約60%)のプロモーターにCat8および/またはAdr1の結合部位があることがわかった(Tachibana et al)。 これらは、低グルコースでの転写に必要な炭素応答性の転写活性化因子である。
一方、SSN6 TR2の増加に伴って発現が逆の傾向をたどる29個の遺伝子(グループ2)のうち17個(約60%)は、プロモーターにPhd1(またはそのホモログであるCin5)および/またはNrg1の部位を含んでいた。
このネットワーク解析により、SSN6が、SSN6自身の直接の標的(タンパク質-DNA相互作用)であると同時にSSN6のパートナー(タンパク質-タンパク質相互作用)でもあるこれらの重要なTFの発現を制御するマスターレギュレーターとして機能していることがさらに明らかになった。
SSN6同様、別の転写制御因子であるSnf5のQ-rich repeatを欠損させると、その標的遺伝子の発現が同様に変化したことから、リピートの数が変わると発現が変化するという現象に関する観察結果は一般的と考えられる。
このように、SSN6のリピートが変化すると、多様な標的がほぼ同じ反応を示すことから、共通のメカニズムが存在すると考えられる。
Q-richリピートの数で機能が変化する理由とは
SSN6の溶解性とTup1との相互作用はTR2の長さに依存し、TR2のらせん構造がSSN6の機能に必須である。このリピート領域は、ハンチンチンのポリQドメインのように、Ssn6の溶解性を高め、さらにその周辺のドメインを空間的に近接させる柔軟な親水性路として機能する可能性がある(Caron et al)。
リピートの短縮や拡大は、この親水性路の柔軟性を損ない、結果としてSSn6のコンフォメーション・ダイナミクスを損なう可能性がある。さらに、Ssn6のリピートを欠失または拡張させた変異体は、共通の相互作用タンパクを獲得しており、この相互作用タンパクが機能的変化にさらに貢献している可能性がある。Hsp70のシャペロンであるSsa2は、Ssn6の繰り返しの長さに依存する本質的な凝集傾向を打ち消していると考えられる。
ポリグルタミンリピート拡大がなぜ病因性があるのか
調節因子のリピートの変化が下流の標的の発現の変化につながり、ある閾値を超えてリピートが拡大すると、グローバルな転写調節異常が生じることが示されている。これは複数のポリQ拡張疾患に共通する観察結果である(Gatchel and Zoghbi, 2005)。さらに、拡張したSsn6がプライベートな相互作用者を獲得していることも示している。これらの相互作用者は、主に転写/翻訳、クロマチン修飾、タンパク質フォールディングに関与していることが明らかになっている(Friedmanら、2007年、Lamら、2006年、Parkら、2013年、Schaffarら、2004年)。また、異常な相互作用によって主要な細胞制御因子が失われることも病因性につながるものである。
プロテオスタシスは、PolyQの病因に寄与するもう一つの因子である。PolyQの凝集体は、病因に直接関与しているのではなく、プロテアソームシステムが過剰になったことによる結果である可能性がある(Douglas and Dillin, 2010)。この「プロテアソームハイジャック」メカニズムは、PolyQ凝集体の発病に直結している(Parkら、2013年、Tsvetkovら、2013年)。Hsp70シャペロンであるSsa2が、Ssn6-Tup1複合体の重要な機能的相互作用者であることが明らかとなっている。Ssa2が存在しない場合、膨張したSsn6(TR2-105)の凝集が増加することが観察された。これらの知見は、ポリQ拡張の病因に対抗するための分子シャペロンの重要性を明らかにするとともに、プロテオスタシスシステムを強化することが神経変性疾患の治療標的になりうる事を示している(Tsvetkov et al)。






