目次
CAGリピートとは?
関連記事:アミノ酸略号の全知識|基礎から覚え方まで
CAGリピートは、多くの生物、ヒトを含む、の遺伝子配列に存在する特定のDNAモチーフです。このリピートは、塩基シトシン(C)、アデニン(A)、グアニン(G)からなり、遺伝子配列内で繰り返し出現します。特に、これらのリピートはタンパク質をコードする遺伝子領域でよく見られ、CAGリピートがコードするアミノ酸はグルタミンです。そのため、CAGリピートの長さが増加すると、「ポリグルタミン」と呼ばれるアミノ酸連鎖の長さも増加します。
異常に多いCAGリピート数は特定の神経変性疾患を引き起こす原因として知られています。これらの疾患には、ハンチントン病やスピノセレベラーアタキシアなどが含まれ、これらの疾患では異常な拡大したCAGリピートが異常なタンパク蓄積を引き起こし、細胞機能障害や細胞死を誘発します。そのため、CAGリピート長はこれらの疾患の診断や研究において重要な指標として利用されています。
ポリグルタミンリピートはなぜ存在するのか?
ポリグルタミンリピートは、DNA配列内に特定の塩基が繰り返し出現することで、それによってタンパク質の構造に連続したグルタミン残基が現れる現象です。このようなリピート配列の存在理由や生物学的な意味は完全に解明されていませんが、いくつかの理論や研究がその存在を説明しようとしています。以下では、それらの主要な理論を紹介します。
●機能的役割:
ポリグルタミンリピートを含むタンパク質はしばしば特定の生物学的機能を持ちます。例えば、これらのリピートはタンパク質間やDNA間で相互作用する可能性が示唆されています。リピートの存在によってタンパク質の構造や機能に影響を与え、その結果特定の役割を果たす可能性があります。
●進化的適応:
進化過程で、ポリグルタミンリピートを含む遺伝子はある程度利益をもたらした可能性があります。これらのリピートが新しい機能獲得や細胞内で多岐にわたる役割遂行へ促進するために、可塑性や調節性向上させていたかもしれません。
●遺伝的ドリフト:
ポリグルタミンリピートは、必ずしも明確な機能意義があるわけではなく、無作為に蓄積された結果かもしれません。この理論によれば、中立的変異として残存した可能性も考えられます。
●病理学的関連:
ポリグルタミンリピートの拡大は、神経変性疾患であるハンチントン病や脊髄小脳変性症などと関連しています。これらの障害では、異常な増加や減少が障害を引き起こす原因として知られています。
CAGリピートが原因の疾患
CAGリピート数とその増加が原因となる疾患は、以下のとおりです。遺伝形式はすべて常染色体優性です。
| 疾患 | 疾患略号 | 遺伝子座 | リピート場所 | 遺伝子 | 正常回数 | 病的回数 |
|---|---|---|---|---|---|---|
| ハンチントン病 | HD | 4p16.3 | エクソン | HTT | 6-34 | 36-121 |
| 球脊髄性筋萎縮症 | SBMA | Xq12 | エクソン | AR | 9-36 | 38-62 |
| 脊髄小脳失調症1型 | SCA1 | 6p22.3 | エクソン | ATXN1 | 19-38 | 39-82 |
| 脊髄小脳失調症2型 | SCA2 | 12q24.12 | エクソン | ATXN2 | 13-31 | 35-500 |
| 脊髄小脳失調症3型 | SCA3 | 14q32.12 | エクソン | ATXN3 | 14-40 | 61-84 |
| 脊髄小脳失調症6型 | SCA6 | 19p13.2 | エクソン | CACNA1A | 4月19日 | 19-33 |
| 脊髄小脳失調症7型 | SCA7 | 3p14.1 | エクソン | ATXN7 | 4-35 | 37-306 |
| 脊髄小脳失調症17型 | SCA17 | 6q27 | エクソン | TBP | 25-42 | 47-63 |
| 歯状核赤核淡蒼球ルイ体変性症 | DRPLA | 12p13.31 | エクソン | ATN1 | 7-34 | 49-88 |
ハンチントンタンパク質とプリオンタンパク質の事例は、アミノ酸リピートの拡張がどのようにタンパク質の機能と病理に影響を与えるかを示す興味深い例です。
●ハンチントンタンパク質におけるグルタミンリピートの役割:
ハンチントンタンパク質には通常、6〜35個のグルタミンリピートが含まれています。これが正常な範囲内であるとき、タンパク質は正常に機能します。しかし、このリピート数が36個以上になると、ハンチントン病を引き起こす可能性があります。リピート数が増えると、タンパク質は不溶性の凝集体を形成しやすくなり、これが神経細胞の死につながると考えられています。この状態は、タンパク質の構造と機能の両方に深刻な影響を及ぼし、特に脳の特定の領域で細胞死を誘発します。
●プリオンタンパク質のQ/N-richドメインの影響:
プリオンタンパク質とは、感染性のタンパク質粒子であり、異常な形状への変化が特徴的です。これらのタンパク質は主に神経組織に存在し、正常な形(PrP^C)と異常な形(PrP^Sc)の二つの異なる立体構造をとることができます。通常のプリオンタンパク質(PrP^C)は細胞膜に結合し、多くの哺乳類の脳に自然に存在していて、神経保護や信号伝達などの正常な生理機能を担っていると考えられていますが、その完全な生物学的役割はまだ完全には明らかにされていません。
異常型プリオン(PrP^Sc)は、プリオン病の原因となります。この異常型は通常型から誘導されるが、異常型が蓄積すると神経細胞が損傷し、最終的には脳組織が海綿状に変性します。この過程は、正常なプリオンタンパク質を異常な形状に変換する能力を持つため、「感染」のように広がります。この変換過程は可逆的ではなく、異常型プリオンは熱や放射線に対しても非常に耐性があります。
プリオンタンパク質には、グルタミンとアスパラギン(Q/N)に富んだドメインが存在し、これがタンパク質の異常な折りたたみや凝集を促進することが知られています。正常なプリオンタンパク質は細胞内で重要な機能を果たしていますが、異常な折りたたみが起こると感染性のプリオン病原体が形成され、これがクロイツフェルト・ヤコブ病や牛海綿状脳症(BSE)などの病気を引き起こします。これらの疾患は、感染したタンパク質が脳内で蓄積し、組織が海綿状に変化することで特徴づけられます。
これらの例から、アミノ酸リピートの特定の展開や特性が、タンパク質の物理的および機能的性質に重大な変化をもたらし、結果として重篤な健康問題を引き起こす可能性があることが分かります。このため、グルタミンリピートや他のアミノ酸リピートの研究は、これらの病気の理解と治療の進展に不可欠です。
トリプレットリピート病の語呂合わせ覚え方
ルイちゃんサッカーろくに見ないでケネディーと踊るの緊張しちゃう
ルイちゃん→DRPLA
サッカーろくに見ないで→SCAの6,2,3,7,1
ケネディーと→球脊髄性筋萎縮症
踊るの→ハンチントン
緊張→筋強直性ジス
しちゃう→フリードリヒ運動失調
筋強直性ジストロフィーは非翻訳領域のCTG反復
フリードリヒ運動失調症は非翻訳領域のGAA反復
これら以外はポリグルタミン病で、翻訳領域のCAG反復
フリードリヒ運動失調症のみ表現促進現象なし
CAGリピートがなぜ病原性を持つようになるのか
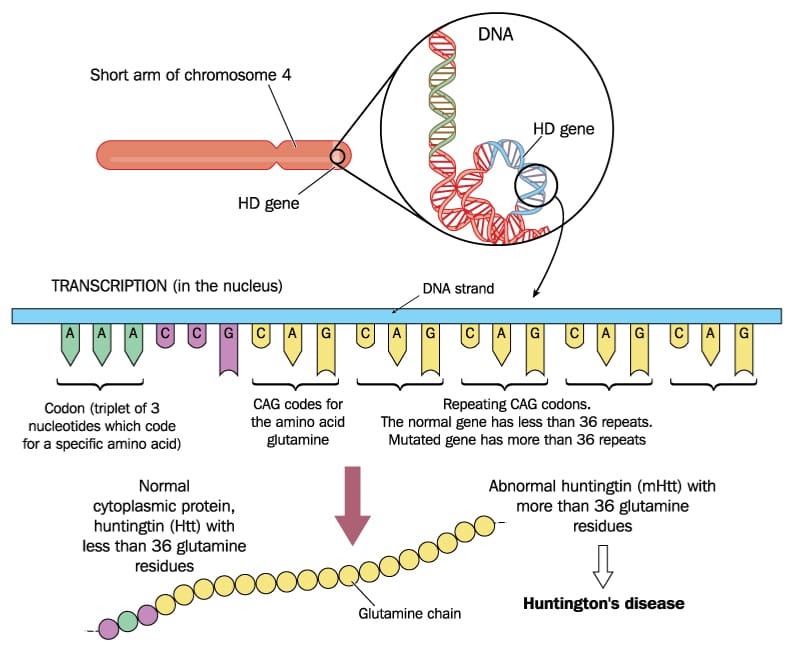
グルタミンリピート、特にポリグルタミン(polyQ)リピートが病原性を持つ理由は、その異常な伸長がタンパク質の構造と機能に重大な影響を与えるためです。正常な範囲内でのリピート数はタンパク質の正常な機能に寄与しますが、リピート数が一定の閾値を超えると、タンパク質が異常に凝集しやすくなり、神経細胞内での毒性を引き起こします[1][2][5][6][12].
● ポリグルタミンリピートの伸長と神経変性
ポリグルタミンリピートの伸長は、タンパク質が不溶性の凝集体を形成する原因となります。これらの凝集体は神経細胞内に蓄積し、細胞の正常な機能を妨げ、最終的には細胞死を引き起こします。例えば、ハンチントン病(HD)では、ハンチントンタンパク質(Htt)におけるCAGリピートの異常伸長が、タンパク質の凝集と神経細胞の損傷を引き起こします[1][2][5].
● 分子メカニズム
ポリグルタミンリピートの伸長がタンパク質の凝集を促進する具体的なメカニズムには、以下のようなものがあります:
1. タンパク質のミスフォールディング:伸長したポリグルタミンリピートは、タンパク質が正常に折りたたまれるのを妨げ、異常な構造を取るようになります。このミスフォールディングは、タンパク質の凝集を促進します[1][2][5].
2. 細胞内処理の障害:伸長したポリグルタミンを含むタンパク質は、細胞のプロテアソームやオートファジーといった分解システムによって効率的に処理されにくくなります。これにより、これらのタンパク質が細胞内に蓄積し、毒性を発揮するようになります[1][2][5][6].
3. 細胞機能への干渉:凝集体は、細胞内のさまざまな機能的なタンパク質やオルガネラと相互作用し、その機能を阻害する可能性があります。これにより、細胞の生存に必要な多くの生物学的プロセスが妨げられます[1][2][5].
● 病態の進行
ポリグルタミン病の進行は、リピート数の増加に伴い、症状の発現が早くなり、病態が重くなる傾向があります。これは、リピートの長さがタンパク質の凝集性と毒性に直接的な影響を与えるためです[1][2][5][12]。
このように、ポリグルタミンリピートの異常な伸長は、タンパク質の構造的な変化を引き起こし、細胞内での凝集と毒性の増大をもたらし、神経変性疾患の発症につながります。
グルタミンリッチドメインやQ/Nリッチドメインは、タンパク質の二次構造、特にα-ヘリックスやコイルドコイルの形成に寄与し、その結果としてタンパク質の凝集を促進するメカニズムと考えられています。これらのドメインは、特定の病理的状態でタンパク質の物理的性質を変化させ、凝集や不溶性のファイバーの形成を促します。その結果、細胞内の正常な機能が妨げられ、神経細胞の死に至ることがあります。
グルタミンリッチドメインの役割:
1. 凝集の促進: グルタミンリッチドメインやQ/Nリッチドメインが豊富なタンパク質は、特にストレスや変化する細胞環境下で、凝集しやすい傾向があります。これは、これらのドメインが相互作用しやすく、非特異的なタンパク質間相互作用を引き起こすからです。
2. 神経変性疾患との関連: アルツハイマー病のβアミロイドペプチドやタウタンパク質のように、グルタミンリッチドメインを持たないタンパク質でも凝集が観察されますが、これらは異なる機序で凝集が促進されることが示唆されています。しかし、グルタミンリッチドメインを持つタンパク質の場合、その凝集傾向が直接的に細胞の機能障害を引き起こしやすいと考えられます。
3. 「自然な役割」の可能性: グルタミンリッチタンパク質が持つ凝集促進能力は、ある状況下では細胞のプログラムされた死(アポトーシス)を誘導するなど、生物学的に重要な役割を果たしている可能性があります。しかし、神経変性疾患の状況では、このプロセスの調節が失われ、過度の細胞死や組織の損傷を引き起こす原因となる可能性があります。
このように、グルタミンリッチドメインは、タンパク質の物理的性質に大きく影響を与え、正常な細胞機能の維持や神経変性疾患の発症において重要な役割を果たしています。これらの知見は、神経変性疾患の治療や予防に向けた新たなアプローチの開発に貢献する可能性があります。
- 参照・引用
-
[1] en.wikipedia.org/wiki/Polyglutamine_tract
[2] molecularneurodegeneration.biomedcentral.com/articles/10.1186/1750-1326-9-45
[3] academic.oup.com/hmg/article/16/R2/R115/2357150
[4] www.frontiersin.org/journals/neuroscience/articles/10.3389/fnins.2021.621996/full
[5] www.ncbi.nlm.nih.gov/pmc/articles/PMC3474664/
[6] www.ncbi.nlm.nih.gov/pmc/articles/PMC2658037/
[7] www.frontiersin.org/articles/10.3389/fncel.2014.00431/full
[8] www.med.nagoya-u.ac.jp/medical_J/research/pdf/Mole_The_N_A_210216.pdf
[9] www.riken.jp/press/2009/20090422/index.html
[10] www.intechopen.com/chapters/74067
[11] bsd.neuroinf.jp/wiki/%E3%83%88%E3%83%AA%E3%83%97%E3%83%AC%E3%83%83%E3%83%88%E7%97%85
[12] www.bri.niigata-u.ac.jp/research/result/001330.html
[13] www.med.kindai.ac.jp/cgi-bin/neuro/research/list.cgi
[14] pubmed.ncbi.nlm.nih.gov/19650870/
[15] www.sciencedirect.com/science/article/pii/S0896627302008723
[16] www.jstage.jst.go.jp/article/naika1913/91/8/91_8_2263/_pdf/-char/en
[17] www.sciencedirect.com/science/article/pii/S0021925820324558
[18] www.jst.go.jp/pr/announce/20101020/
[19] onlinelibrary.wiley.com/doi/10.1111/j.1471-4159.2009.06302.x
[20] bsi.riken.jp/jp/asset/img/about/timeline/pdf/027.pdf
CAGリピート病と表現促進現象
CAGリピート病における表現促進現象は、世代を経るごとに症状が早期発症し、重篤化する現象を指します。この現象は、特にトリプレットリピート病において顕著であり、CAGリピートの数が親から子へと受け継がれる際に増加することが一般的です[1][4][5][6].
● CAGリピート病の特徴
CAGリピート病は、特定の遺伝子内のCAGトリプレットリピートが異常に伸長することによって引き起こされる遺伝性の神経変性疾患群です。これにはハンチントン病、脊髄小脳変性症、球脊髄性筋萎縮症などが含まれます。リピートの伸長は、タンパク質の異常な蓄積を引き起こし、神経細胞の機能障害や細胞死を招きます[1][2][3].
● 表現促進現象のメカニズム
表現促進現象は、リピート数の伸長が主な原因とされています。リピートの数が増えると、疾患の症状がより早く、また重く現れるようになります。このリピート数の増加は、特に精子形成時に不安定になりやすく、父親から子への遺伝時に顕著に見られることが多いです[2][6]. また、リピートの伸長は、DNAの複製や修復の過程でのエラーによって引き起こされると考えられています。
※母親からの伝達で表現促進現象が起こるトリプレットリピート病には、フラジャイルX症候群(Fragile X syndrome)があります。
● 疾患の進行と表現促進
表現促進現象により、CAGリピート病は世代を重ねるごとに症状の発症年齢が若返り、症状が重篤化する傾向があります。これは、リピート数の増加が疾患の重症度と直接的に関連しているためです。この現象は、ハンチントン病や脊髄小脳変性症など、多くのCAGリピート病で報告されています[1][4][5][6].
このように、表現促進現象はCAGリピート病の理解と診断、治療戦略の策定において重要な要素であり、疾患の遺伝的な側面と臨床的な進行の両方を考慮する必要があります。
- 参照・引用
-
[1] bsd.neuroinf.jp/wiki/%E3%83%88%E3%83%AA%E3%83%97%E3%83%AC%E3%83%83%E3%83%88%E7%97%85
[2] grj.umin.jp/grj/huntington.htm
[3] www.nanbyou.or.jp/entry/318
[4] neurology-jp.org/Journal/public_pdf/048110823.pdf
[5] shindan.co.jp/view/2277/pageindices/index12.html
[6] genetics.qlife.jp/tutorials/Inheriting-Genetic-Conditions/anticipation
[7] www.jstage.jst.go.jp/article/jsnt/38/4/38_583/_pdf/-char/ja
[8] kaken.nii.ac.jp/ja/grant/KAKENHI-PROJECT-09670666/
CAGリピート病の診断
CAGリピート病は、特定の遺伝子内のCAGトリプレットリピートの異常伸長によって引き起こされる一群の遺伝性神経変性疾患です。これらの疾患にはハンチントン病、脊髄小脳変性症、球脊髄性筋萎縮症などが含まれます。以下に、これらの病気の症状と診断方法について説明します。
● 症状
1. ハンチントン病:
– 不随意運動、特に舞踏運動(クレア舞踏病)
– 認知障害
– 精神症状、例えばうつ病や性格変化[1][5][10].
2. 脊髄小脳変性症:
– 小脳失調、つまり協調運動障害
– 眼球運動障害
– 認知機能障害や精神症状が伴うこともある[7][8][9].
3. 球脊髄性筋萎縮症:
– 四肢の筋力低下及び筋萎縮
– 球麻痺:脳幹の下部に位置する延髄(球部)にある運動神経細胞が影響を受けることによって生じます。球麻痺によって、話す、飲み込む、呼吸するなどの機能が障害されることがあります。これは、これらの機能を制御する神経の出発点が延髄にあるためです.
– 女性化乳房などのアンドロゲン不全症状[12].
● 診断方法
1. 遺伝子診断:
– CAGリピートの長さを測定するPCR法や他の分子遺伝学的手法を用いて、特定の遺伝子(例えばHTT遺伝子、ATXN1遺伝子など)内のCAGリピート数を解析します[10][11].
2. 臨床診断:
– 症状の観察と家族歴の評価に基づく。特にハンチントン病では、舞踏運動や認知・精神症状の有無が重要です[1][5].
3. 画像診断:
– MRIやCTスキャンを使用して、脳の特定の領域(例えば尾状核)の萎縮を確認することがあります[5].
4. 新技術の利用:
– 最近では、ロングリードシーケンス技術などが開発され、リピート伸長病の迅速かつ正確な遺伝子診断が可能になっています[4].ロングリードシーケンス技術は、数千塩基以上の長いDNA断片のシーケンスを可能にする技術であり、特に10キロベース(kb)以上のリード長を持つことができます. これに対して、ショートリードシーケンス技術は、おおよそ数百塩基(bp)程度の短いDNA断片のシーケンスに限られています. この長さの違いにより、ロングリード技術はゲノムの繰り返し領域や複雑な構造をより正確に解析することができる一方で、ショートリード技術はより高い精度で配列を読むことができ、低コストで高品質のデータを提供します.ロングリードシーケンス技術が普及する前は、リピート回数の検出には主にショートリードシーケンス技術やペアエンドリード技術が使用されていました。ショートリード技術では、DNAの短い断片(通常は数百塩基)が読み取られ、これらの短いリードをゲノムの参照配列にマッピングすることでリピート領域を推定していました。しかし、リピート領域がリード長よりも長い場合、複数箇所にマッピングされてしまい、正確なリピート数の検出が困難でした.
ペアエンドリード技術では、DNAの両端から短いリードを読み取り、それらがどのようにゲノム上で位置するかを分析することで、リピート領域の検出を試みていました。この方法もリピート領域の正確な数を特定するのには限界があり、特に長いリピート領域の解析には適していませんでした.
これらの技術によるリピート検出の限界から、ロングリードシーケンス技術が開発され、長いDNA断片を一度に読み取ることが可能となりました。これにより、以前は検出が困難だった長大なリピート領域も正確に解析できるようになりました.
これらの診断方法は、症状の評価から遺伝子解析に至るまで、総合的なアプローチを必要とします。特に遺伝性の神経変性疾患では、正確な遺伝子診断が治療選択や家族計画において重要な役割を果たします。
- 参照・引用
-
[1] www.mhlw.go.jp/file/06-Seisakujouhou-10900000-Kenkoukyoku/0000064432.pdf
[2] bsd.neuroinf.jp/wiki/%E3%83%88%E3%83%AA%E3%83%97%E3%83%AC%E3%83%83%E3%83%88%E7%97%85
[3] www.sanken.osaka-u.ac.jp/labs/rbc/research/02.html
[4] www.yokohama-cu.ac.jp/amedrc/news/202210miyatake.html
[5] www.nanbyou.or.jp/entry/318
[6] www.jst.go.jp/pr/info/info176/index.html
[7] agmc.hyogo.jp/nanbyo/ncurable_disease/disease03.html
[8] grj.umin.jp/grj/sca6.htm
[9] www.nanbyou.or.jp/entry/4880
[10] test-guide.srl.info/hachioji/test/detail/020396301
[11] data.medience.co.jp/guide/guide-08160008.html
[12] www.nanbyou.or.jp/entry/234/1000
[13] bsi.riken.jp/jp/asset/img/about/timeline/pdf/027.pdf
[14] www.jstage.jst.go.jp/article/naika1913/91/8/91_8_2263/_pdf/-char/en
CAGリピート病の治療
CAGリピート病の治療に関しては、現在いくつかのアプローチが研究されています。これらの疾患は、特定の遺伝子内のCAGトリプレットリピートの異常伸長によって引き起こされる神経変性疾患であり、ハンチントン病や遺伝性脊髄小脳変性症、球脊髄性筋萎縮症などが含まれます[1].
大阪大学の研究グループは、CAGリピートが形成する特徴的なDNA構造に結合する核酸標的低分子ナフチリジンアザキノロン(NA)によって、異常に伸長したCAGリピートを短縮させる作用があることを見出しました。この治療法は、ハンチントン病の原因となる伸長したCAGリピートを短縮して正常化することを目指しており、脊髄小脳失調症など他の神経疾患への応用も期待されています[2].これまでに、トリプレットリピート病モデルマウスにおいて、CAGリピート特異的核酸標的低分子ナフチリジンアザキノロン(NA)の脳室内持続的投与による伸長リピート短縮を実証しています。また、リピート長依存的にマウス脳組織で発現が変動した遺伝子群も同定しており、siRNAを用いてこれら遺伝子を個別に長期間knock downした上で、リピート長変動を検証し、リピート短縮に関与する遺伝子を同定しています.
大阪大学の研究グループは、異常伸長したCAGリピートに結合する低分子化合物を創製し、モデル細胞・動物において伸長リピートを短縮(修復)する効果を確認しています. これらの研究は、CAGリピート病の根本的治療法開発に向けた重要なステップであり、未来の治療法に対する期待を高めています。
また、熊本大学の研究グループは、ピロール・イミダゾール(PI)ポリアミドがリピート伸長病の新しい創薬基盤になることを発見しました。PIポリアミドの一種である「CWG-cPIP」は、病態原因となる伸長したCAG/CTGリピートDNAに優先的に結合し、病原性因子の産生を阻害することで、ハンチントン病や筋強直性ジストロフィー1型患者由来細胞及びモデルマウスにおける神経機能の低下を抑制しました[3].
これらの研究は、CAGリピート病に対する治療法の開発に向けた重要なステップであり、未来の治療法に対する期待を高めています。現在、これらの治療法は研究段階にあり、臨床応用にはさらなる研究と試験が必要です。








